Эндоскопическая диагностика и лечение нейроэндокринных опухолей двенадцатиперстной кишки: опыт МНИОИ им. П.А. Герцена
Автор: Рябцева В.И., Пирогов С.С., Перфильев И.Б., Сухин Д.Г., Паронян М.А., Минибаева Г.Ф., Гоева Н.С., Волченко Н.Н.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Опыт работы онкологических учреждений
Статья в выпуске: 2 т.24, 2025 года.
Бесплатный доступ
Цель исследования - продемонстрировать результаты анализа клинических наблюдений эндоскопической диагностики и лечения пациентов с нейроэндокринными опухолями двенадцатиперстной кишки, выявленными в условиях отделения эндоскопии МНИОИ им. П.А. Герцена. Материал и методы. В нашем институте за период 2012-24 гг проходили обследование, а часть из них и лечение, 20 пациентов с установленным диагнозом нейроэндокринной опухоли двенадцатиперстной кишки, средний возраст больных - 61 год. Новообразования оценивались по ряду параметров: локализация, размер, ямочный и сосудистый рисунок, наличие субэпителиальных сосудов, эндосонографическая структура, глубина инвазии, степень дифференцировки и тип проведенного лечения. Результаты. В анализируемой нами выборке пациентов определен средний размер новообразований, составивший 8 ± 5,6 мм [95 % ДИ: 5,4-10,6]. Наиболее часто (87 % случаев) НЭО локализовались в луковице двенадцатиперстной кишки [95 % ДИ: 69-100 %] и лишь в 13 % - в восходящей ее части [95 % ДИ: 0-30 %]. В луковице образования чаще определялись по ее передней стенке (70 % случаев) [95 % ДИ: 49-90 %], в 18 % случаев - по медиальной стенке [95 % ДИ: 2-37 %] и еще реже, в 12 %, - по задней [95 % ДИ: 0-23 %]. При детальном осмотре исследуемых образований в узкоспектральном режиме установлено, что 45 % из них имели нерегулярный рисунок крипт и капиллярный паттерн [95 % ДИ: 23-66 %], и в 30 % всех случаев определено наличие расширенных извитых субэпителиальных сосудов [95 % ДИ: 9-50 %]. Глубину инвазии выявленных опухолей мы определяли с помощью эндосонографического исследования - в большинстве случаев они локализовались в пределах второго эхослоя, соответствующего мышечной пластинке слизистой оболочки. Ряду пациентов было проведено эндоскопическое лечение (EMR и ESD), во всех случаях признанное радикальным. Заключение. Мы выявили некоторые тенденции, совпадающие с данными ряда более крупных исследований. При соблюдении критериев отбора пациентов для эндоскопического лечения (отсутствие признаков инвазии мышечного слоя, а также данных за наличие регионарных и отдаленных метастазов) нейроэндокринные новообразования двенадцатиперстной кишки возможно радикально и безопасно удалять с использованием эндоскопических технологий.
Нейроэндокринные опухоли, двенадцатиперстная кишка, луковица двенадцати' перстной кишки, эзофагогастродуоденоскопия, эндосонография, эндоскопическое лечение
Короткий адрес: https://sciup.org/140309144
IDR: 140309144 | УДК: 616.342-006-072.1-08 | DOI: 10.21294/1814-4861-2025-24-2-93-100
Текст научной статьи Эндоскопическая диагностика и лечение нейроэндокринных опухолей двенадцатиперстной кишки: опыт МНИОИ им. П.А. Герцена
Нейроэндокринные опухоли (НЭО) двенадцатиперстной кишки – редкие опухоли, составляющие около 4 % всех нейроэндокринных новообразований желудочно-кишечного тракта (ЖКТ) [1, 2]. Заболеваемость ими значительно возросла – с 0,027 на 100 000 населения в 1983 г. до 1,1 на 100 000 человек в 2010 г. Однако такая динамика не является истинным отражением роста заболеваемости и, по данным ряда авторов, может быть связана с улучшением качества эндоскопической диагностики верхних отделов ЖКТ и повышением ее доступности для населения [3, 4].
В 2019 г. Всемирной организацией здравоохранения была утверждена классификация (табл. 1), отражающая разделение всех НЭО желудочнокишечного тракта на группы в зависимости от количества митозов и значения индекса Ki67, определенного при иммуногистохимическом исследовании. Так, различают опухоли низкой степени злокачественности (G1), промежуточной (G2) и высокой (G3) [5]. При этом 50–70 % случаев НЭО двенадцатиперстной кишки (ДПК) имеют низкий потенциал злокачественности (G1), в то время как опухоли, обладающие высокими рисками регионарного и отдаленного метастазирования (G3), встречаются менее чем в 3 % случаев [6].
В литературе описаны факторы, увеличивающие вероятность возникновения метастазов при нейроэндокринных новообразованиях ДПК. Так, к ним относят не только степень дифференцировки (G2 и G3), но и периампулярное расположение опухоли, ее размер более 10 мм, наличие лимфоваскулярной инвазии, а также вовлечение в патологический процесс мышечного слоя стенки. Вместе с тем, известно, что возраст и пол больного, макроскопическая форма НЭО и количество новообразований не являются предикторами регионарного метастазирования [7, 8].
Кроме того, Европейским обществом по изучению нейроэндокринных опухолей (ENETS) в 2023 г. была предложена клинико-патоморфологическая классификация, в которой все новообразования подразделяются на функционирующие и нефункционирующие в зависимости от продукции ими биологически активных веществ. Более 90 % НЭО ДПК относятся к нефункционирующим, и лишь малая часть приходится на редкие формы: комби-
Òàблицà 1/Table 1
Êлàññифиêàция и ñиñтåмà гðàдàции нåéðîэндîêðинныõ нîвîîбðàзîвàниé îðгàнîв жåлóдîчнî-êишåчнîгî тðàêтà (ÂÎЗ, 2019)
Classification and grading system for gastrointestinal neuroendocrine neoplasms (WHO, 2019)
|
Grade |
Степень злокачественности/ Grade status |
Индекс Ki67/ Ki67 proliferation index |
Митозы/2 мм2/ Mitotic rate, rer 2 mm2 |
|
G1 |
Низкая/Low |
<3 % |
< 2 |
|
G2 |
Промежуточная/Intermediate |
3–20 % |
2–20 |
|
G3 |
Высокая/High |
>20 % |
> 20 |
Примечание: таблица составлена авторами.
Note: created by the authors.
нированную ганглиоцитому (ранее известную как ганглиоцитарная параганглиома), дуоденальную гастриному, которая может возникать как спорадически, так и при синдроме множественной эндокринной неоплазии 1-го типа (МЭН-1), а также соматостатиному [9, 10]. Среди функционирующих новообразований наиболее часто диагностируются гастриномы, которые в совокупности составляют от 50 до 60 % случаев [7, 10].
Согласно данным ряда исследований, НЭО двенадцатиперстной кишки чаще локализуются в ее луковице (58 % случаев), реже – в верхнегоризонтальном и нисходящем отделах (33 % случаев). Как правило, эти новообразования одиночные и небольшие [6, 11]. Однако в некоторых случаях (например, при синдроме МЭН-1) в ДПК может локализоваться сразу несколько синхронных опухолей [12]. Как правило, нефункционирующие нейроэндокринные опухоли ДПК являются случайной находкой при эзофагогастродуоденоскопии [11]. В то время как функционирующие НЭО, в зависимости от типа продуцируемого биологически активного вещества, могут сопровождаться проявлениями карциноидного синдрома, синдрома Золингера–Эллисона, а при больших размерах новообразований – дуоденальной непроходимостью, желтухой, кровотечением и сопутствующей анемией [2, 11].
Ведущее место в диагностике данного типа неоплазий отводится эндоскопическому исследованию верхних отделов ЖКТ, при котором можно оценить размер опухоли, ее локализацию, и даже предположить ее степень злокачественности. Кроме эзофагогастродуоденоскопии, рационально и проведение эндосонографии с целью определения глубины инвазии и оценки возможности дальнейшего эндоскопического лечения [11]. Несмотря на возможности современных эндоскопических методов визуализации, проведение дифференциальной диагностики нейроэндокринных опухолей ДПК может вызывать трудности. Этот тип неоплазии необходимо дифференцировать от бруннеромы, желудочной метаплазии эпителия, в ряде случаев – от аденомы, лимфоидной гиперплазии, а также злокачественных опухолей – аденокарциномы, гастроинтестинальной стромальной опухоли и метастатического поражения [13].
Согласно мировым и отечественным рекомендациям, нейроэндокринные опухоли двенадцатиперстной кишки могут быть удалены эндоскопическими методами. Однако Европейское общество по изучению нейроэндокринных опухолей (ENETS) допускает вариант наблюдения за новообразованиями размерами до 0,5 см, при наличии у пациента высоких рисков интраоперационных осложнений. Большинству пациентов показано эндоскопическое лечение в объеме резекции слизистой оболочки (EMR) или ее резекции с диссекцией в подслизистом слое (ESD). И лишь в ряде случаев рекомендовано расширенное хирургическое лечение при наличии определенных показаний, таких как размер опухоли более 1 см, глубина ее инвазии в пределах мышечного слоя при степени дифференцировки G2, высокая степень злокачественности образования (G3), наличие регионарных метастазов [10]. Возможны следующие варианты хирургического лечения НЭО двенадцатиперстной кишки: сегментарная резекция двенадцатиперстной кишки и панкреатодуоденальная (или гастропанкреатодуоденальная) резекция с лимфодиссекцией [14].
Цель исследования – продемонстрировать результаты анализа клинических наблюдений эндоскопической диагностики и лечения пациентов с нейроэндокринными опухолями двенадцатиперстной кишки, выявленными в условиях отделения эндоскопии МНИОИ им. П.А. Герцена.
Материал и методы
Произведен ретроспективный анализ 20 клинических случаев нейроэндокринных опухолей ДПК за период 2012–24 гг. Более половины обследований проведены с использованием оборудования экспертного класса – видеоэндоскопической системы Olympus EVIS Exera III и видеоэндоскопа Olympus GIF-HQ190 с технологией близкофокусной эндоскопии (Near Focus). Новообразования оценивались по ряду параметров: локализация, размер, ямочный и сосудистый рисунок, наличие субэпителиальных сосудов, эндосонографическая структура, глубина инвазии, степень дифференцировки и тип проведенного лечения.
Результаты
В анализ были включены клинические наблюдения 20 пациентов, из них 60 % – женщины, 40 % – мужчины. Возраст пациентов варьировал от 27 до 76 лет, средний возраст – 61 год.
Эндоскопическая семиотика нейроэндокринных опухолей двенадцатиперстной кишки отличается рядом специфических характеристик – как правило, эти новообразования расцениваются как субэпителиальные и имеют полушаровидную или полуовоидную форму, не отличаются по цвету от окружающей слизистой оболочки, однако в ряде случаев могут приобретать желтоватый оттенок и небольшое углубление (рис. 1) [15]. Кроме того, к патогномоничным признакам можно отнести расширенные субэпителиальные сосуды, которые можно четко визуализировать при осмотре образования в узкоспектральном режиме с увеличением (рис. 2, 3). Как правило, архитектоника ворсинок и сосудистый рисунок слизистой оболочки ДПК над поверхностью образования не изменены, но они могут приобретать нерегулярность при высокой степени злокачественности опухоли и значительной глубине ее инвазии в стенку органа (рис. 4, 5).
Чтобы достоверно определить этот параметр, а также оценить возможность эндоскопического внутрипросветного удаления новообразования,
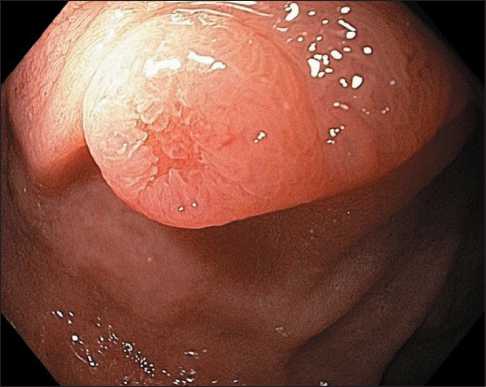
Рис. 1. Эндофото. Нейроэндокринная опухоль двенадцатиперстной кишки. Осмотр в белом свете (WLI).
Примечание: рисунок выполнен авторами
Fig. 1. Endophoto. Neuroendocrine tumour of the duodenum. White light imaging (WLI). Note: created by the authors
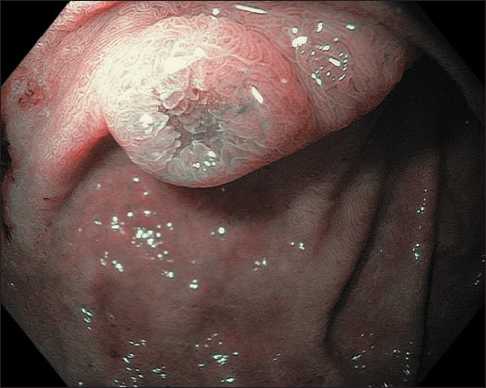
Рис. 2. Эндофото. Нейроэндокринная опухоль двенадцатиперстной кишки. Осмотр в узкоспектральном режиме (NBI). Примечание: рисунок выполнен авторами
Fig. 2. Endophoto. Neuroendocrine tumour of the duodenum. Narrow-Band Imaging (NBI). Note: created by the authors
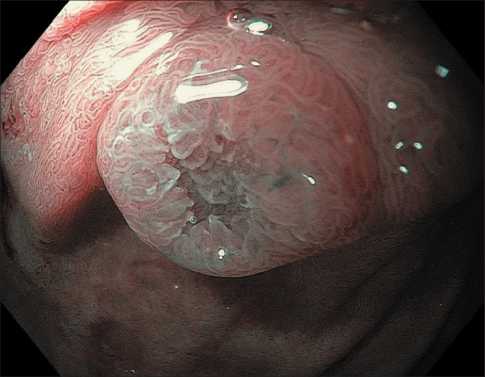
Рис. 3. Эндофото. Нейроэндокринная опухоль двенадцатиперстной кишки. Осмотр в узкоспектральном режиме с увеличением (NBI Near Focus).
Примечание: рисунок выполнен авторами
Fig. 3. Endophoto. Neuroendocrine tumour of the duodenum. Narrow-Band Imaging Near Focus (NBI Near Focus).
Note: created by the authors
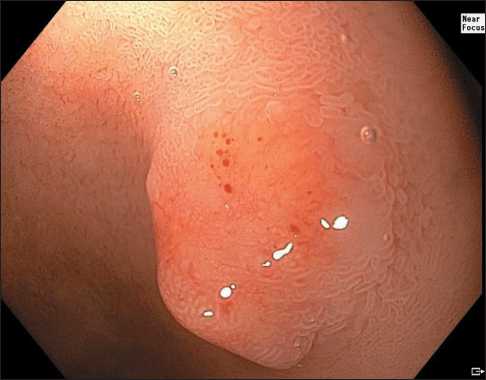
Рис. 4. Эндофото. Нейроэндокринная опухоль двенадцатиперстной кишки. Осмотр в белом свете с увеличением (WLI Near Focus). Примечание: рисунок выполнен авторами Fig. 4. Endophoto. Neuroendocrine tumour of the duodenum. White light imaging Near Focus (WLI Near Focus). Note: created by the authors
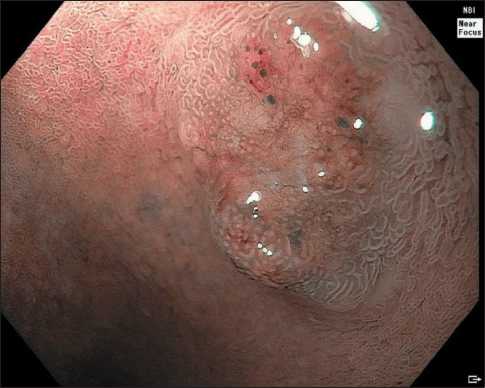
Рис. 5. Эндофото. Нейроэндокринная опухоль двенадцатиперстной кишки. Осмотр в узкоспектральном режиме с увеличением (NBI Near Focus). Примечание: рисунок выполнен авторами
Fig. 5. Endophoto. Neuroendocrine tumour of the duodenum. Narrow-Band Imaging Near Focus (NBI Near Focus).
Note: created by the authors
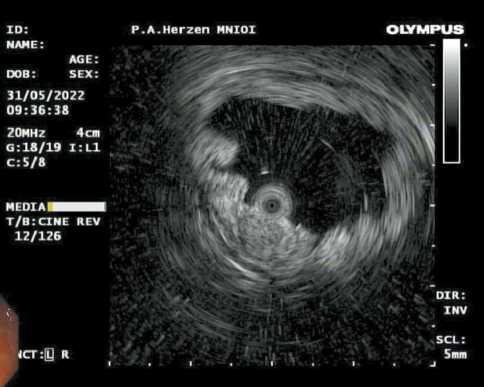
Рис. 6. Эндофото. Эндосонография мини-датчиком 20 МГц нейроэндокринной опухоли двенадцатиперстной кишки.
Примечание: рисунок выполнен авторами
Fig. 6. Endophoto. Endosonography of a 20 MHz miniprobe neuroendocrine tumor of the duodenum.
Note: created by the authors
часто прибегают к выполнению эндосонографии. В большинстве случаев НЭО представляет собой гипоэхогенное образование с четкими контурами, как правило, исходящее из слизистой оболочки и локализующейся на уровне ее мышечной пластинки (рис. 6).
При детальном осмотре исследуемых образований в узкоспектральном режиме было установлено, что 45 % из них имели нерегулярный рисунок крипт и капиллярный паттерн [95 % ДИ: 23–66 %], и в 30 % всех случаев определено наличие расширенных извитых субэпителиальных сосудов [95 % ДИ: 9–50 %]. Эндосонография мини-датчиком с частотой сканирования 20 МГц, как уточняющий метод диагностики, показала, что 67 % всех НЭО локализовались в пределах мышечной пластинки слизистой оболочки [95 % ДИ: 44–85 %], реже они определялись непосредственно в слизистой оболочке (20 %) [95 % ДИ: 2–37 %], и лишь часть опухолей распространялась на мышечный слой
(13 %) [95 % ДИ: 0–30 %]. При этом во всех случаях опухоли имели гипоэхогенную структуру.
В большинстве наших наблюдений выполнялась биопсия новообразований, но из-за их субэпителиального расположения патоморфологи-ческое подтверждение диагноза и оценка степени дифференцировки опухолей были получены лишь у трети пациентов. При этом иммуногистохимическое (ИГХ) исследование в 86 % случаев правильно определило степень злокачественности (G1) на предоперационном этапе [95 % ДИ: 69–100 %].
При планировании эндоскопического лечения мы учитывали ряд факторов, влияющих на радикальность выполняемой нами манипуляции и дальнейший прогноз: размер, глубину инвазии нейроэндокринной опухоли, наличие, по результатам лучевых методов диагностики, регионарных или отдаленных метастазов, а также заключение ИГХ-исследования. Ряду пациентов было реализовано эндоскопическое лечение. Так, 7 больным проведена резекция слизистой (EMR) и 2 – резекция слизистой с диссекцией в подслизистом слое (ESD). Одному пациенту с новообразованием размером более 2 см, с признаками инвазии в мышечный слой выполнена резекция двенадцатиперстной кишки. Все проведенные вмешательства по результатам патоморфологического исследования удаленного материала были признаны радикальными.
Заключение
Нейроэндокринные опухоли ДПК – гетерогенная группа высокодифференцированных злокачественных новообразований, имеющая в большинстве случаев благоприятный прогноз при правильно выбранной лечебной тактике. В ходе анализа клинических наблюдений пациентов с ней-
Òàблицà 2/Table 2
Пàтîгнîмîничныå пðизнàêи нåéðîэндîêðинныõ îпóõîлåé двåнàдцàтипåðñтнîé êишêи (дàнныå àнàлизà êлиничåñêиõ нàблюдåниé îтдåлà эндîñêîпии MÍИÎИ им. П.À. Гåðцåнà (2012–24))
Characteristics of neuroendocrine tumors of the duodenum based on the data of the analysis of clinical cases of the Endoscopy Department of the P.A. Herzen Medical Research Institute (2012–24)
|
Критерий/Criterion |
Наиболее распространенный признак/ The most common hallmark |
Частота/ Frequency |
|
Локализация в двенадцатиперстной кишке/ Localization in the duodenum |
Луковица/Bulb |
87 % |
|
Локализация по стенке луковицы двенадцатиперстной кишки/Localization of the wall in the duodenum |
Передняя стенка/Anterior wall |
70 % |
|
Количество в двенадцатиперстной кишке/ Number of tumors in the duodenum |
Одиночное/Solitary |
79% |
|
Осмотр НЭО двенадцатиперстной кишrи в белом свете (WLI)/ Examination of duodenal NETs in white light imaging (WLI) |
||
|
Размер/Size Форма/Form |
до 1 см/to 1 cm Полушаровидная/Hemispherical |
85 % 55 % |
|
Осмотр НЭО двенадцатиперстной кишки в узкоспектральном режиме (NBI)/ Examination of duodenal NETs in narrow-band imaging (NBI ) |
||
|
Архитектоника крипт/Pit pattern |
Регулярная/Regular |
65 % |
|
Капиллярный рисунок/Vascular pattern |
Регулярный/Regular |
55 % |
|
Субэпителиальные сосуды/Subepithelial vessels |
Визуализируемые/Visualized |
30 % |
|
Эндосонография НЭО двенадцатиперстной кишки мини-датчиком 20 МГц/ Endosonography of duodenum NETs with a 20 MHz mini-probe |
||
|
Эхослой/Echo layer |
Мышечная пластинка слизистой оболочки/ Muscularis mucosae |
67 % |
|
Эхогенность/Echogenicity |
Гипоэхогенные/Hypoechoic |
100 % |
Примечание: таблица составлена авторами.
Note: created by the authors.
роэндокринными опухолями ДПК мы выявили некоторые тенденции, совпадающие с данными ряда более крупных исследований (табл. 2) [11, 15]. Так, наиболее распространенной локализацией НЭО в двенадцатиперстной кишке являлась луковица, а именно ее передняя стенка. Глубину инвазии опухоли можно определить с помощью эндосо-нографического исследования – в большинстве случаев они располагались в пределах мышечной пластинки слизистой оболочки. Части пациентов было проведено эндоскопическое лечение (EMR и


