Эндоскопически ассистированная пункционная гастростомия у взрослых и детей. Опыт клиники
Автор: Выборный М.И., Пахомова А.Ю., Куликов Д.В., Щапов Н.Ф., Садиков И.С.
Журнал: Московский хирургический журнал @mossj
Рубрика: Абдоминальная хирургия
Статья в выпуске: 4 (82), 2022 года.
Бесплатный доступ
Введение. Пероральное поступление питательных веществ является физиологичным. Однако, некоторые пациенты не могут принимать пищу peros. В связи с этим возникает необходимость в поиске альтернативных вариантов введения питания. При наличии показаний к длительному энтеральному питанию наиболее предпочтительно выполнение гастростомии.Целью данной работы является показать опыт гастростомий у взрослых и детей в нашей клинике, а также относительную простоту и преимущества использования эндоскопически ассистированной гастростомии с оценкой показаний и возможных осложнений.Материалы и методы. С июля 2019 г. по октябрь 2022 г. в АО «Ильинская больница» было выполнено 50 эндоскопически ассистированных пункционных гастростомий, из них пять у детей.Результаты лечения. У 97 % пациентов гастростомические трубки в послеоперационном периоде сохраняли свою герметичность, нарушение проходимости канала не отмечено в 100 % случаях. Малые по степени тяжести осложнения зафиксированы в 8 % случая; большие - 6 %.Заключение. Необходимо отдавать предпочтение эндоскопически ассистированной пункционной гастростомии по Push-методу с использованием низкопрофильных балонных гастростомических трубок, что обусловлено малой инвазивностью, безопасностью, небольшой длительностью вмешательства и относительной простотой его выполнения.
Гастростома, эндоскопия, дисфагия, энтеральное питание, нутритивная поддержка
Короткий адрес: https://sciup.org/142236587
IDR: 142236587 | УДК: 006.617-089 | DOI: 10.17238/2072-3180-2022-4-31-40
Текст научной статьи Эндоскопически ассистированная пункционная гастростомия у взрослых и детей. Опыт клиники
Нутритивная поддержка имеет важное значение для пациентов и применяется, в случаях, когда невозможно естественным путем обеспечить полноценное питание, восполняющее суточную потребность в микро- и макроэлементах, белках, жирах и углеводах.
Пероральное поступление питательных веществ является физиологичным [1]. Дотация через рот специализированных смесей (сиппингов) является основным подходом для восполнения потребностей организма в энергетическом и пластическом обеспечении у пациентов [2]. Однако, у некоторых пациентов прием пищи естественным путем может быть затруднен или невозможен, а в определенных случаях может быть опасен, например, у пациентов с неврологическими заболеваниями или обструкцией на различных уровнях желудочно-кишечного тракта [1].
В связи с этим возникает необходимость в поиске альтернативных вариантов введения питания. Разработан целый ряд альтернативных методов: введение внутривенной нутритивной поддержки, установка назогастрального или назоинтестинального зондов, формирование прямого доступа в просвет желудка или тонкой кишки с помощью чрескожной гастро- и еюностомии [3]. Два последних способа позволяют поддерживать нормальную физиологическую активность желудочно-кишечного тракта и тем самым избегать нарушений его функций и отдаленных осложнений, связанных с парентеральным питанием [4, 5].
Парентеральное питание – это один из видов нутритивной заместительной терапии, которая осуществляется путем внутривенного введения питательных веществ, таких как глюкоза, электролиты, аминокислоты, липиды и витамины, минуя пищеварительный тракт. Однако, длительное парентеральное питание применяется крайне редко из-за высокой частоты развития инфекций, а также плохой переносимости у пациентов с сердечной недостаточностью, почечной недостаточностью и сахарным диабетом [6, 7]. По этим причинам в рекомендациях Европейского общества клинического питания и обмена веществ (European Society for Clinical Nutrition and Metabolism guidelines) рекомендуется назначать тотальное парентеральное питание только в том случае, если пациенты не могут компенсировать суточный калораж с помощью перорального питания или энтерального питания [6], либо пациентам с низкой толерантностью к энтеральному питанию.
Выбор между оральной или назальной установкой зонда и выполнением чрескожной гастростомии или еюностомии, должен определяться в каждом конкретном случае междисциплинарной командой, учитывая показания, противопоказания, клиническую картину, риски возникновения осложнений, прогностические критерии заболевания, а также дальнейшее качество жизни пациента.
В опубликованных рекомендациях Европейского общества гастроинтестинальной эндоскопии (ESGE – European Society of Gastrointestinal Endoscopy) рассматривают выполнение чрескожной гастростомии и еюностомии в каждом конкретном случае, чаще всего если нутритивная поддержка необходима более 4 недель [3]. Четырехнедельный порог является произвольным и выбран по результатам анализа возможных осложнений при длительном использовании зондов для питания. Ограничения по срокам стояния гастростом и еюностом нет.
При наличии показаний к длительному энтеральному питанию (табл. 1) [8], выполнение чрескожной эндоскопической гастростомии (ЧЭГ) предпочтительней, чем еюностомии. Обусловлено ориентированностью на безопасность, переносимость и простоту выполнения процедуры [9]. В случае измененной анатомии верхний отделов желудочно-кишечного тракта, замедленной эвакуации содержимого из желудка, обструкции выходного отдела желудка, обструкции двенадцатиперстной кишки, тяжелого гастроэзофагеального рефлюкса рекомендовано рассмотреть возможность установки эндоскопической еюностомии [9].
Таблица 1
Показания для выполнения чрескожной эндоскопической гастростомии
Indications for percutaneous endoscopic gastrostomy
Table 1
|
Доброкачественные заболевания Benign diseases |
Злокачественные заболевания Malignant diseases |
Педиатрические показания Pediatric indications |
Другие Other |
|
Неврологические заболевания и задержка психомоторного развития. Neurological diseases and psychomotor retardation. Цереброваскулярная болезнь. Cerebrovascular disease. Заболевание двигательных нейронов (боковой амиотрофический склероз). Motor neuron disease (amyotrophic lateral sclerosis). Рассеянный склероз. Multiple sclerosis. Болезнь Паркинсона. Parkinson’s disease. Деменция. Dementia. Психомоторная заторможенность. Psychomotor retardation. Низкий уровень сознания. Low level of consciousness. Черепно-мозговая травма. Traumatic brain injury. Пациенты интенсивной терапии. Intensive care patients. Длительная кома. Prolonged coma. Ожоги, контрактуры шеи. Burns, neck contractures. Синдром короткой кишки. Short bowel syndrome. Челюстно-лицевая хирургия. Maxillofacial Surgery. Политравма. Polytrauma. Доброкачественные стриктуры пищевода. Benign strictures of the esophagus. Другие причины недоедания (анорексия). Other causes of malnutrition (anorexia). |
Опухоль центральной нервной системы. Tumor of the central nervous system. Опухоль головы и шеи. Tumor of the head and neck. Опухоль пищевода. Tumor of the esophagus. |
Детский церебральный паралич. Cerebral palsy. Врожденная аномалия (например, трахеопищеводный свищ). Congenital anomaly (for example, tracheoesophageal fistula). Муковисцидоз. Cystic fibrosis. Синдром короткой кишки. Short bowel syndrome. Буллезный эпидермолиз. Bullous epidermolysis. |
Декомпрессия желудка, при невозможности устранения обструкции выходного отдела желудка, кишки. Decompression of the stomach, if it is impossible to eliminate the obstruction of the outlet section of the stomach, intestines. Обеспечение доступа для выполнения комбинированной антеградной и ретроградной дила-тации/стентирования стриктур пищевода. Providing access for performing combined antegrade and retrograde dilatation/stenting of esophageal strictures. |
Перед выполнением ЧЭГ все пациенты должны быть тщательно обследованы. Уточняется анамнез, история заболевания, текущее лечение и проводится физикальный осмотр пациента [10], определяются относительные или абсолютные противо- показания для установки ЧЭГ. Наиболее распространенные противопоказания представлены в таблице 2 [8]. Научные исследования показали, что именно мультидисциплинарная команда отбирает пациентов для возможной установки ЧЭГ [11].
Таблица 2
Противопоказания для выполнения чрескожной эндоскопической гастростомии
Table 2
Contraindications for percutaneous endoscopic gastrostomy
|
Относительные противопоказания Relative contraindications |
Абсолютные противопоказания Absolute contraindications |
|
Кровотечение из пептической язвы с высоким риском повторного кровотечения. Bleeding from a peptic ulcer with a high risk of rebleeding. Асцит. Ascites. Вентрикулоперитонеальные шунты. Ventriculoperitoneal shunts. Абдоминальные операции. Abdominal operations. Большая грыжа пищеводного отверстия диафрагмы. Large hiatal hernia. |
Нарушения свертывания крови (МНО > 1,5, АЧТВ > 50 с). Blood coagulation disorders (INR > 1.5, APTT > 50 s). Тромбоцитопения < 50*109/л. Thrombocytopenia < 50*109/l. Признаки сепсиса. Signs of sepsis. Перитонит. Peritonitis. Перитонеальный карциноматоз. Peritoneal carcinomatosis. Отсутствие безопасного пути для чрескожной установки. Lack of a safe route for percutaneous insertion. Состояние после тотальной гастрэктомии. Total gastrectomy. |
Первая ЧЭГ была осуществлена в 1979 году у 4,5-месячного ребёнка детским хирургом M.W. Gauderer и эндоскопистом J.L. Ponsky в Кливленде [12]. Методика предлагалась в качестве альтернативы гастростомии из лапаротомного доступа и получила название pull-метод (метод «протягивания»). Впоследствии была разработан push-метод (метод «проталкивания»).
Цель
Целью данной работы является показать опыт гастростомий у взрослых и детей в нашей клинике, а также относительную простоту и преимущества использования ЧЭГ с оценкой показаний и возможных осложнений.
Материалы и методы
Гастростомия может быть выполнена тремя различными методами: эндоскопическим, рентгенологическим и хирургическим [13]. В нашей клинике мы выполняем ЧЭГ. Данный метод является малоинвазивным и имеет наименьший процент осложнений.
С июля 2019 г. по октябрь 2022 г. в нашей клинике было выполнено 50 эндоскопически ассистированных пункционных гастростомий, 1 УЗИ- и рентгенологически асситированная пункционная гастростомия. Из них у детей: 5 эндоскопически ассистированных пункционных гастростомий. Возраст пациентов был от 6 до 14 лет, вес – от 13,6 до 52,5 кг. У 1 ребенка гастростомия выполнена по Pull-методу и у 4 детей – по Push-методу. Показанием для гастростомии в этой группе было невозможность кормления через рот в связи с неврологическими нарушениями у 4 пациентов и в связи с тяжелой белково-энергетической недостаточностью у 1 пациента на фоне основного нейро-мышечного заболевания.
У взрослых выполнено 45 эндоскопически ассистированных пункционных гастростомий и 1 ультразвуковая и рентгенологически асситированная пункционная гастростомия. Постановка гастростомы у 17 пациентов была по Pull-методу и 28 – по Push-методу. В основном показание к установке гастростом стали неврологические заболевания у 38 пациентов, которые нарушали функции жевания и глотания, приводящие к рецидивирующим аспирационным пневмониям. Опухоли головы, шеи и пищевода стали показанием к гастростомии у 3 пациентов; заболевания, связанные с нарушением обмена веществ, отказ от приема пищи у 2 пациентов. Двум онкологическим пациентам пункционная гастростомия была выполнена с целью декомпрессии желудка, из-за невозможности устранения многоуровневых обструкций тонкой кишки.
Все операции проводились под общей анестезией в операционной командой, состоящей из врача-хирурга (выполняющий перкутанный этап), врача эндоскописта (обеспечивающий эндоскопический доступ), анестезиолога, анестезиологической медсестры, операционной медсестры. Все пациенты получали предоперационную дозу антибиотиков (обычно, цефалосприны 1 поколения) непосредственно перед ЧЭГ.
Рассмотрим две техники, применяемые в клинике: Pull-метод (метод «протягивания») и Push-метод (метод «проталкивания»).
Pull-метод (метод «протягивания»): гастростомическая трубка доставляется в желудок через рот и вытягивается из полости желудка через прокол на передней брюшной стенке в проекции желудка (рис. 1).
Выполняется эзофагогастродуоденоскопия, эндоскоп подводится к передней стенке нижней трети тела желудка, в желудок инсуффлируется СО2, выбирается наименее васкуляризованный и измененный участок слизистой. При максимальном нагнетании СО2 в желудок в проекции трансиллюминации на передней брюшной стенке, чаще всего в левом мезогастрии, определяется место формирования будущей гастростомы путем надавливания на переднюю брюшную стенку. При этом эндоскопист должен четко видеть место пролабирования передней брюшной стенки при пальпации «отмеченной» точки.
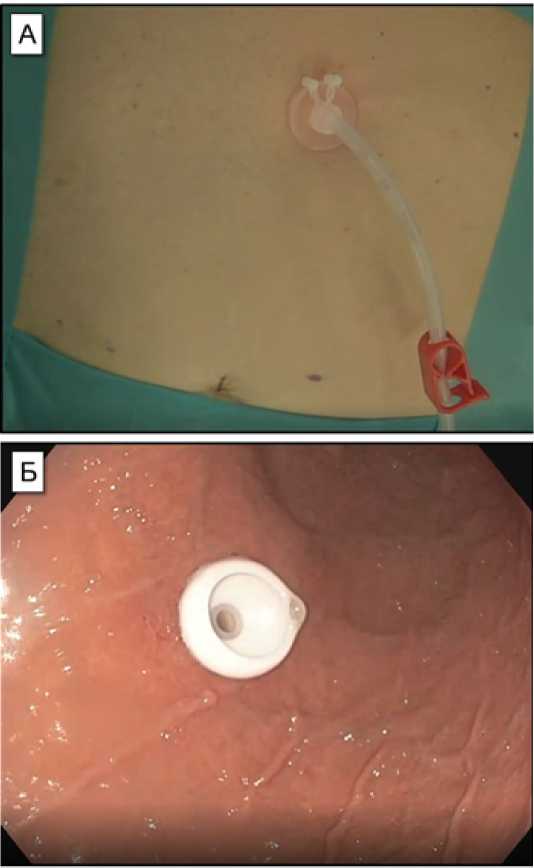
Рис. 1. “Бамперная” гастростома, устанавливаемая Pull-методом. А – вид снаружи; Б – вид изнутри Fig. 1. “Bumper” gastrostomy, installed by the Pull method. A – outside view; B – view from the inside
После определения места пункции проводят местную анестезию и выполняется разрез кожи скальпелем до 3–5 мм.
Под визуальным эндоскопическим контролем через выполненный разрез выполняется пункция просвета желудка специальной иглой со стилетом (интродьюсер). Стилет извлекается. Через иглу в просвет желудка вводится проксимальная часть петли-проводника, которая с помощью эндоскопического зажима под контролем эндоскопа захватывается и выводится через рот, эндоскоп извлекается. На выведенную петлю фиксируется трубка гастростомы необходимого диаметра. Выполняется подтягивание гастростомической трубки за дистальную часть петли-проводника. Под контролем эндоскопа гастростома вводится в просвет желудка, далее вытягивается наружу, а со стороны желудка подтягивается к передней стенке, до упора внутренней фиксирующей пластинки. Со стороны передней брюшной стенке гастростома также зафиксируется специальным фиксатором с умеренным натяжением.
Push-метод (метод «проталкивания»): гастростомическая трубка погружается в желудок снаружи через прокол (расширяется с помощью набора бужей) на передней брюшной стенке в проекции желудка (рис. 2).
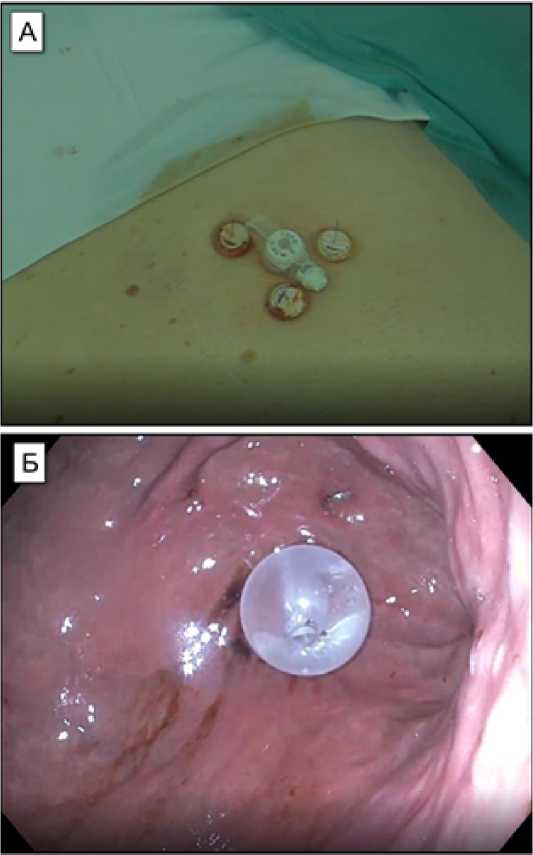
Рис. 2. Низкопрофильная гастростома, устанавливаемая
Push-методом. А – вид снаружи; Б – вид изнутри
Fig. 2. Low profile gastrostomy, installed by the Push method. A – outside view; B – view from the inside
Выполняется эзофагогастродуоденоскопия, эндоскоп подводится к передней стенке нижней трети тела желудка, в желудок инсуффлируется СО2, выбирается наименее васкуляризован- ный и измененный участок слизистой. При максимальном нагнетании СО2 в желудок в проекции транслюменации на передней брюшной стенке, чаще всего в левом мезогастрии, определяется место формирования будущей гастростомы путем надавливания на переднюю брюшную стенку. При этом эндоскопист должен четко видеть место пролабирования передней брюшной стенки.
Под визуальным контролем размечается и пунктируется полость желудка через переднюю стенку с использованием 3-х Т-образных швов с защелкивающимися блокираторами («якорные» держатели) таким образом, чтобы они формировали вершины углов равнобедренного треугольника. Расстояние между держателями должно составлять около 2,0 см. С помощью держателей осуществляется гастропексия: передняя стенка желудка подтягивается и фиксируется к передней брюшной стенке, блокираторы защелкиваются с помощью хирургического зажима. В центре треугольника выполняется разрез кожи и апоневроза около 5 мм, через центр разреза выполняется пункция полости желудка специальной иглой. Через просвет пункционной иглы в желудок водится струна-проводник с J-образным концом, игла удаляется. По проводнику выполняется бужирование пункционного канала передней брюшной стенки системой телескопических бужей до необходимого диаметра. Одновременно осуществляется эндоскопический визуальный контроль прохождения бужей в полость желудка для исключения повреждения задней стенки желудка дистальным концом бужа.
После проведенного бужирования выполняется измерение длины сформированного канала, с помощью измерительного устройства, для определения размера гастростомической трубки. После определения подходящего размера трубки осуществляется окончательное расширение канала. После завершения бужирования струна-проводник и бужи удаляются, в канале остается трубчатая пластиковая наружная часть бужей, по просвету которой заводится гастростомическая низкопрофильная трубка. Последняя фиксируется в полости желудка путем введения воды для инъекций в баллон типа Фолея, находящийся на дистальном конце трубки. Проводится эндоскопическая оценка стояния гастростомической трубки и проверка ее проходимости.
Результаты
Интраопреационных осложнений в нашей серии не отмечалось. Продолжительность самой процедуры составила от 15 до 24 минут.
Первое введение жидкости в гастростому мы начинали не менее чем через 12 часов после операции с постепенным увеличением объема. Кормление начинали с введения питательной смеси через 1,5–2 суток после операции.
Наличие гастростомы позволило осуществлять кормление пациентов в физиологическом объеме с полным контролем белково-энергетической потребности как обычной пищей, так и специализированными нормо- или гиперкалорийными смесями. Также гастростомическая трубка позволила вводить лекарственные препараты непосредственно в полость желудка. После постановки гастростомы у всех пациентов отмечена прибавка в весе.
У 97 % пациентов гастростомические трубки в послеоперационном периоде сохраняли свою герметичность, нарушение проходимости канала не отмечено в 100 % случаях. Малые по степени тяжести осложнения зафиксированы в 8% случая; большие – 6 %.
У детей ранних и больших осложнений не было. Отмечено два поздних малых осложнения у 2 детей, которым была выполнена гастростомия по Push-методу. У одного пациента на 10 сутки отмечалась местная гиперемия, инфильтрация в области стояния «якорных» фиксаторов. После удаления фиксаторов и проведения местного лечения, воспалительные изменения были купированы. У второго ребенка через 3 месяца после гастростомии отмечено появление гипергрануляций области стояния гастростомической трубки, проведено местное лечение с использованием мази с антибактериальным и гормональным компонентом, достигнуто выздоровление.
У взрослых пациентов поздние малые осложнения наблюдались в 2 случаях. У одного в виде местной гиперемии, инфильтрации в области стояния «якорных» фиксаторов. После проведения местного лечения, воспалительные изменения были купированы. У второго отмечено подтекание желудочного содержимого помимо гастростомической трубки. Данное осложнение возникало из-за временного гастропареза. Для устранения данной патологии проводилось усиление перистальтики верхних отделов желудочно-кишечного тракта с помощью лекарственных препаратов – прокинетиков.
Большие (по тяжести) осложнения были зафиксированы у 3-х пациентов. У 2-х пациентов – кровотечения из области гастростомии. У одного из них кровотечение удалось остановить с помощью компрессии – подтягивания гастростомического баллона вплотную к стенке желудка, сроком на 24 часа. У второго пациента было выполнено эндоскопическое клипирование сосуда, продолжена консервативная гемостатическая терапия, так как кровотечение было гипокоагуляционным. У третьего пациента было выявлено тяжелое осложнение: внутренний бампер гастростомы, установленной по Pull-методу, образовал полностенный пролежень с миграцией бампера в свободную брюшную полость. Осложнение возникло через 3 месяца после выполненной пункционной эндоскопической гастростомии, в результате прогрессии онкологического заболевания (канцероматоз).
Обсуждение
Недавние исследования показали, что метод ЧЭГ безопасен и может применяться у детей до 1 года и с массой тела всего 2,6 кг [14].
Осложнения операций по установке эндоскопически ассистированных гастростом по времени возникновения разделяют на ранние (до 24 ч) и поздние (после 24 часов) [15]. По литературным данным при исследовании самой большой серии пациентов (760 человек) частота ранних осложнений составила 4 %, поздних – 20 %. [16]. По тяжести осложнения разделяют на большие и малые. Большие осложнения возникают в 0,4–8,7 % случаев, малые – в 13–43 % [17]. Большие осложнения, такие как кровотечение, бампер-синдром, преждевременное самопроизвольное удаление гастростомической трубки, перитонит, желудочно-толстокишечный свищ, большой пневмоперитонеум, повреждение соседних внутренних органов требуют дополнительного хирургического лечения, удлиняют сроки госпитализации. Малые осложнения, такие как местная гиперемия, гипергрануляции, инфицирование области стояния гастростомической трубки, подтекание содержимого желудка помимо гастростомической трубки, обычно требуют проведение только местного консервативного лечения. По данным литературы послеоперационная летальность после эндоскопически ассистированной гастростомии варьирует от 0 до 2 %, что связывают с наличием тяжелой сопутствующей патологией [17, 18]
У пациентов с гастростомией по Pull-методу первые 24 часа внешний бампер должен быть зафиксирован на коже, чтобы обеспечить плотное прилегание брюшной стенки и стенки желудка. Через 24 ч наружный бампер можно расслабить на 0,5–1 см во избежание излишнего сдавливания кожи, слизистой желудка. При длительном сдавлении увеличивается риск развития парастомальной инфекции, может привести к местной ишемии тканей. В дальнейшем к некрозу.
Низкопрофильная гастростомическая трубка удобна в использовании как для медперсонала, так и для пациента, родственников. Находясь на передней брюшной стенке, она легко прикрывается одеждой и не привлекает к себе внимания. Еще на дооперационном этапе пациент, родственники, родители детей получают всю необходимую информацию по кормлению и уходу за гастростомической трубкой. С первых-вторых суток после гастростомии медицинский персонал обучает пациента, родственников, родителей детей непосредственной работе с гастростомической трубкой. Первая замена низкопрофильной гастростомической трубки осуществляется через 6–8 мес. в условиях медицинского учреждения, последующие замены также проводятся через 6–8 мес. и могут быть выполнены самостоятельно в домашних условиях. Необходимо отметить, что для замены данной трубки не требуется проведение седации.
Только через 4 недели после выполненной операции гастро-стомичесий канал считается полностью сформированным. У пациентов с кахексией это может занять больше времени. Кожу вокруг гастростомического отверстия следует ежедневно обрабатывать антисептическим раствором. Оставлять гастро-стомическую область без повязки можно через 48 часов, это снижает риск появления мацерации кожи.
При необходимости проведения длительного энтерального кормления низкопрофильная гастростомическая трубка обладает рядом существенных преимуществ перед использованием питательных зондов. Использование гастростомичен-ской трубки в отличие от питательных зондов не приводит к формированию воспалительных изменений в носовых ходах, ротоглотке, пищеводе, желудке, существенно снижается риск гастроэзофагеального рефлюкса и аспирации.
К сожалению, не всегда можно выполнить эндоскопически ассистированную гастростомию, например, в случае нарушения проходимости ротоглотки и пищевода, ввиду их стеноза или опухолевого поражения, а также после перенесенных ранее открытых хирургических вмешательствах на органах брюшной полости, ввиду формирования выраженного спаечного процесса. В таких случаях используются альтернативные рентгенологические, видеоассистированые или открытые хирургические методы постановки гастростом.
Выводы
Проводя анализ литературы, можно сделать вывод о том, что в настоящее время имеется тенденция отказа от использования открытых операций по постановке гастростом у детей в пользу выполнения эндоскопически или видеоассистированных пункционных гастростомий.
При всех равных условиях мы отдаем предпочтение эндоскопически ассистированной пункционной гастростомии по Push-методу с использованием низкопрофильных баллонных гастростомических трубок. Аргументами для выполнения такой операции являются малая инвазивность, безопасность, небольшая длительность вмешательства и относительная простота его выполнения. Большие серьезные осложнения наблюдаются редко. Использование низкопрофильных баллонных гастростомических трубок считаем оптимальным для осуществления длительного энтерального кормления у взрослых и детей, которые не могут питаться перорально. Наличие пункционной гастростомии позволяет пациентам восстановить белково-энергетический баланс и достигнуть оптимальных показателей массы тела, что несомненно приведет к улучшению клинической картины и повысит качество жизни.
Список литературы Эндоскопически ассистированная пункционная гастростомия у взрослых и детей. Опыт клиники
- Kurien M., Penny H. and Sanders D.S. Impact of direct drug delivery via gastric access devices. Expert opinion on drug delivery, 2015, Vol. 12, № 3, pp. 455-463. https://doi.org/10.1517/17425247.2015.966683
- Welbank T. and Kurien M. To PEG or not to PEG that is the question. The Proceedings of the Nutrition Society, 2021, Vol. 80, № 1, pp. 1-8. https://doi.org/10.1017/S002966512000703X
- Arvanitakis M., Gkolfakis P., Despott E. J., Ballarin A., Beyna T., Boeykens K., Elbe P., Gisbertz I., Hoyois A., Mosteanu O., Sanders D.S., Schmidt P.T., Schneider S.M. and van Hooft J.E. Endoscopic managementof enteral tubes in adult patients - Part 1: Definitions and indications. European Society of Gastrointestinal Endoscopy (ESGE) Guideline. Endoscopy, 2021, Vol. 53, № 1, pp. 81-92. https://doi.org/10.1055/a-1303-7449
- Buchman A.L., Moukarzel A.A., Bhuta S., Belle M., Ament M.E., Eckhert C.D., Hollander D., Gornbein J., Kopple J.D. and Vijayaroghavan S.R. Parenteral nutrition is associated with intestinal morphologic and functional changes in humans. JPEN. Journal of parenteral and enteral nutrition, 1995, Vol. 19, № 6, pp. 453-460. https://doi.org/10.1177/0148607195019006453
- Braunschweig C.L., Levy P., Sheean P. M. and Wang X. Enteral compared with parenteral nutrition: a meta-analysis. The American journal of clinical nutrition, 2001, Vol. 74, № 4, pp. 534-542. https://doi.org/10.1093/ajcn/74.4.534
- Pironi L., Boeykens K., Bozzetti F., Joly F., Klek S., Lal S., Lichota M., Mühlebach S., Van Gossum A., Wanten G., Wheatley C. and Bischoff S.C. ESPEN guideline on home parenteral nutrition. Clinical nutrition (Edinburgh, Scotland), 2020, Vol. 39, № 6, pp. 1645-1666. https://doi.org/10.1016/j.clnu.2020.03.005
- Chow R., Bruera E., Chiu L., Chow S., Chiu N., Lam H., McDonald R., DeAngelis C., Vuong S., Ganesh V. and Chow E. Enteral and parenteral nutrition in cancer patients: a systematic review and meta-analysis. Annals of palliative medicine, 2016, Vol. 5, № 1, pp. 30-41. https://doi.org/10.3978/j.issn.2224-5820.2016.01.01
- Fugazza A., Capogreco A., Cappello A., Nicoletti R., Da Rio L., Galtieri P.A., Maselli R., Carrara S., Pellegatta G., Spadaccini M., Vespa E., Colombo M., Khalaf K., Repici A. and Anderloni A. Percutaneous endoscopic gastrostomy and jejunostomy: Indications and techniques. World journal of gastrointestinal endoscopy, 2022, Vol. 14, № 5, pp. 250-266. https://doi.org/10.4253/wjge.v14.i5.250
- McClave S.A., DiBaise J.K., Mullin G.E. and Martindale R.G. ACG Clinical Guideline: Nutrition Therapy in the Adult Hospitalized Patient. The American journal of gastroenterology, 2016, Vol. 111, № 3, pp. 315-335. https://doi.org/10.1038/ajg.2016.28
- Heaney A. and Tham T.C. Percutaneous endoscopic gastrostomies: attitudes of general practitioners and how management may be improved. The British journal of general practice: the journal of the Royal College of General Practitioners, 2001, Vol. 51, № 463, pp. 128-129. PMID:11217626
- Abuksis G., Mor M., Plaut S., Fraser G. and Niv Y. Outcome of percutaneous endoscopic gastrostomy (PEG): comparison of two policies in a 4-year experience. Clinical nutrition (Edinburgh, Scotland), 2004, Vol. 23, № 3, pp. 341-346. https://doi.org/10.1016/j.clnu.2003.08.001
- Gauderer M.W., Ponsky J. L. and Izant R. J., Jr. Gastrostomy without laparotomy: a percutaneous endoscopic technique. Journal of pediatric surgery, 1980, Vol. 15, № 6, pp. 872-875. https://doi.org/10.1016/s0022-3468(80)80296-x
- Yuan Y., Zhao Y., Xie T. and Hu Y. Percutaneous endoscopic gastrostomy versus percutaneous radiological gastrostomy for swallowing disturbances. The Cochrane database of systematic reviews, 2016, Vol. 2, № 2, CD009198. https://doi.org/10.1002/14651858.CD009198.pub2
- Backman T., Arnbjörnsson E., Berglund Y. and Larsson L.T. Video-assisted gastrostomy in infants less than 1 year. Pediatric surgery international, 2006, Vol. 22, № 3, pp. 243-246. https://doi.org/10.1007/s00383-005-1628-x
- Retes F.A., Kawaguti F.S., de Lima M.S., da Costa Martins B., Uemura R.S., de Paulo G.A., Pennacchi C.M., Gusmon C., Ribeiro A.V., Baba E.R., Geiger S.N., Sorbello M.P., Kulcsar M.A., Ribeiro U., Jr. and Maluf-Filho F. Comparison of the pull and introducer percutaneous endoscopic gastrostomy techniques in patients with head and neck cancer. United European gastroenterology journal, 2017, Vol. 5, № 3, pp. 365-373. https://doi.org/10.1177/2050640616662160
- Fortunato J.E., Troy A.L., Cuffari C., Davis J.E., Loza M.J., Oliva-Hemker M. and Schwarz K.B. Outcome after percutaneous endoscopic gastrostomy in children and young adults. Journal of pediatric gastroenterology and nutrition, 2010, Vol. 50, № 4, pp. 390-393. https://doi.org/10.1097/MPG.0b013e3181aed6f1
- Бондаренко С.Б., Котловский А.М., Шароев Т.А. и Иванова Н.М. Применение пункционной гастростомии у детей. Российский вестник детской хирургии, анестезиологии и реаниматологии, 2015, Т. 5. № 1. С. 93-97.
- Di Leo G., Pascolo P., Hamadeh K., Trombetta A., Ghirardo S., Schleef J., Barbi E. and Codrich D. Gastrostomy Placement and Management in Children: A Single-Center Experience. Nutrients, 2019, Vol. 11, № 7, p. 1555. https://doi.org/10.3390/nu11071555


