Эндоскопические цитопротективные технологии в лечении синдрома Меллори - Вейсса
Автор: Чередников Е.Ф., Юзефович И.С., Баранников С.В., Банин И.Н., Черных А.В., Ростиашвили Г.Г., Болховитинов А.Е., Шкурина И.А.
Журнал: Волгоградский научно-медицинский журнал @bulletin-volgmed
Статья в выпуске: 1 т.21, 2024 года.
Бесплатный доступ
Цель исследования разработать и применить в клинической практике метод эндоскопического лечения кровоточащих разрывов с использованием гемостатика «Альгистаб» у пациентов с синдромом Меллори Вейсса (СМВ). Материал и методы. В клиническое исследование вошел 121 пациент с СМВ, 65 пациентов составили основную группу (ОГ). Им применяли для лечения кровоточащих разрывов эндоскопические инсуффляции порошкообразного гемостатика «Альгистаб». В контрольной группе (КГ) у 56 пациентов эндогемостаз проводили инъекционными методами, диатермокоагуляцией, аргоноплазменной коагуляцией (АПК) и др. без гемостатика.
Синдром меллори - вейсса, эндоскопический гемостаз, цитопротективное лечение
Короткий адрес: https://sciup.org/142242047
IDR: 142242047 | УДК: 616-002.151-072.1-08
Текст научной статьи Эндоскопические цитопротективные технологии в лечении синдрома Меллори - Вейсса
Синдром Меллори – Вейсса (СМВ) в течение последних лет занимает ведущее место в структуре кровотечений неязвенной этиологии. Значительное количество повторных кровотечений, проведение оперативных вмешательств, общая летальность у больных с СМВ вызывают тревогу у хирургов [1, 2].
В вопросах лечения СМВ большое значение занимают методы эндогемостаза. Следует отметить, что при использовании даже комбинированных методов эндоскопического гемостаза рецидивы геморрагии возникают в 5,7–13,3 % случаев [3, 4].
Важно указать, что больные с разрывногеморрагическим синдромом являются пациентами трудоспособного возраста, что свидетельствует о социально-экономической значимости этого недуга. В этой связи совершенствование и поиск эффективных методов эндоскопического лечения СМВ является актуальным [5–6].
ЦЕЛЬ РАБОТЫ
Разработать метод эндоскопического лечения СМВ, который позволит обеспечить надежный гемостаз, снизит частоту повторных кровотечений, улучшит заживление дефектов.
МЕТОДИКА ИССЛЕДОВАНИЯ
В клиническое исследование вошел 121 пациент с СМВ. Исследование проведено при разрешении Этического комитета ВГМУ им. Н. Н. Бурденко (протокол 2, от 24.03.2023 г.).
Клинические исследования проведены на базе Специализированного Центра БУЗ ВО «ВГКБ СМП №1». Среди пациентов мужчин было 99 (81,8 %), женщин – 22 (18,2 %). Возраст составил 48,18 ± 15,08 (M ± Ϭ) лет.
Факторы, способствующие появлению СМВ: злоупотребление алкоголем – 99 (81,8 %), физическое перенапряжение – 8 (6,6 %), рвота – 12 (9,9 %), кашель – 2 (1,7 %).
По локализации кровоточащие дефекты распределились в следующем порядке: пищеводно-желудочный переход – у 111 (91,7 %), пищеводные – у 3 (2,5 %), кардиальные – у 7 (5,8 %) пациентов.
Расположение дефектов по стенкам было следующим: на задней стенке – у 44 (36,4 %) больных, на правой стенке – у 40 (33,1 %) больных, на левой стенке – у 21 (17,4 %) и на передней – у 16 (13,1 %) пациентов.
Длина кровоточащих дефектов была от 0,3 до 2,9 см. Различали большие (от 2,5 и больше), средние (1,0–2,5 см) и малые (до 1,0 см) разрывы. Малые размеры в нашей работе были выявлены у 56 (46,3 %) пациентов, средние – у 61 (50,4 %) и большие дефекты – у 4 (3,3 %) пациентов.
По глубине дефекты встречались в пределах слизистой оболочки (I стадия) – у 34 (28,1 %) пациентов, слизисто-подслизистой основы (II стадия) – у 71 (58,7 %) пациентов и доходили до мышечной оболочки (III стадия) – у 16 (13,2 %) больных. IV стадия разрывно-геморрагического синдрома в нашем исследовании не встречалась.
В большинстве случаев разрывы были единичными – у 85 (70,2 %), множественные дефекты встречались у 36 (29,8 %) пациентов.
Активность кровотечения при СМВ определяли по J. Forrest (1974). Пациенты распределились так: тип геморрагии FIA-FIB отмечен у 12 (9,9 %) пациентов, тип FIIA-FIIB – у 68 (56,2 %) пациентов и тип FIIC – у 41 (33,9 %) пациентов.
По классификации А. И. Горбашко (1985) у 15 (12,4 %) пациентов отмечалась тяжелая степень кровопотери, средняя – у 48 (39,7 %) и легкая – у 58 (47,9 %) пациентов.
Все пациенты распределены были на две группы случайной выборкой: основную группы (ОГ), 65 человек, и контрольную группу (КГ), 56 человек. Пациенты обеих групп сопоставимы.
В табл. 1 представлена характеристика групп проведенного исследования.
Пациентам ОГ с кровотечением FIA-FIB (6 человек) использовали комбинированный эндогемостаз: в начале производили обкалывание аминокапроновой кислотой (АКК), затем на дефект воздейтсвовали аргоно-плазменной коагуляцией (АПК) и после этого на область разрыва инсуффлировали полимерный «Альги-стаб» (рис. 1).
Таблица 1
Характеристика групп проведенного исследования
|
Показатель |
ОГ ( n = 65) |
КГ ( n = 56) |
P |
Всего |
|
Мужчины |
54 (83,1 %) |
45 (80,4 %) |
p > 0,05 |
99 (81,8 %) |
|
Женщины |
11 (16,9 %) |
11(19,6 %) |
p > 0,05 |
22 (18,2 %) |
|
Возраст |
40,7 ± 1,1 |
44,7 ± 1,2 |
p > 0,05 |
|
|
Характер кровотечения по J. Forrest, 1974 |
||||
|
FIA-FIB |
6 (9,2 %) |
6 (10,7 %) |
p > 0,05 |
12(9,9 %) |
|
FIIA-FIIB |
38 (58,5 %) |
30 (53,6 %) |
p > 0,05 |
68 (56,2 %) |
|
FIIC |
21 (32,3 %) |
20 (35,7 %) |
p > 0,05 |
41 (33,9 %) |
|
Степень тяжести кровопотери по А. И. Горбашко, 1982 |
||||
|
Легкая |
30 (46,2 %) |
28 (50,0 %) |
p > 0,05 |
58 (47,9 %) |
|
Средняя |
27 (41,5 %) |
21 (37,5 %) |
p > 0,05 |
48 (39,7 %) |
|
Тяжелая |
8 (12,3 %) |
7 (12,5 %) |
p > 0,05 |
15 (12,4 %) |
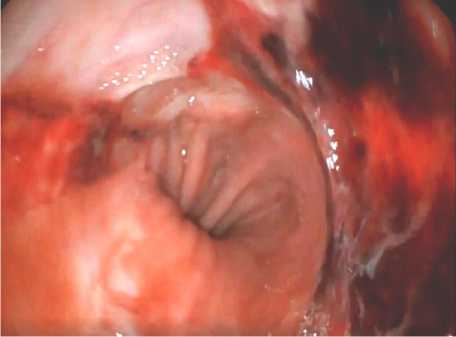
Рис. 1. Больной П. 32 лет. Синдром Меллори – Вейсса. Два разрыва области пищеводно-желудочного перехода: по правой и левым стенкам с признаками продолжающегося кровотечения
У больных ОГ с кровотечением FIIA-FIIB (38 человек) применяли способ эндоскопического лечения путем нанесения на тромбированный сосуд или сгусток гемостатика «Альги-стаб» (Патент РФ № 2762121) по разработанной методике для предупреждения повторного кровотечения. Больным с угрозой рецидива геморрагии (FIA-FIB и FIIA-FIIB) проводился эндо- скопический мониторинг с интервалом 12–24 часа. У пациентов с типом FIIС (21 человек) на дефект производили нанесение порошкообразного альгстаба по разработанной методике (Патент РФ № 2762121).
Всем больным ОГ повторную лечебную эндоскопию с нанесением на дефект альгиста-ба осуществляли через 4–5 суток (рис. 2).
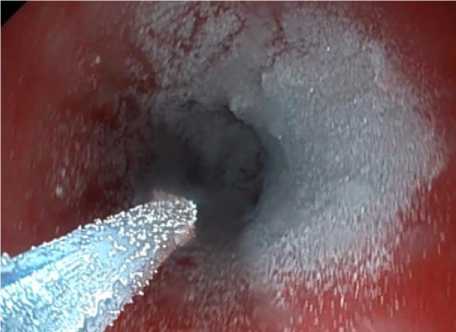
Рис. 2. Больной П. 32 лет. Синдром Меллори – Вейсса. 4-е сутки стационарного лечения. Дополнительно производится эндоскопическое лечение альгистабом
В КГ (56 человек) использовали обкалывание АКК, АПК, диатермокоагуляция и другое без применения гемостатических средств.
В комплексном лечении все пациенты получали ингибиторы протонной помпы (ИПП), общую гемостатическую и симптоматическую терапии.
Эффективность лечения пациентов с СМВ оценивали по основным критериям: гемостаз окончательный, частота повторных кровотечений, сроки и качество заживления разрывов (рубцевание, эпителизация), смертность.
Обработку данных статистическими методами проводили в программе MSExcel. Рассчитывали стандартные показатели: среднее (М), медиану (Ме), верхний и нижний квартили. Значимость различий по количественным показателям определяли с помощью критерия Манна – Уитни. По качественным признакам значимость различий оценивали тестом Фишера и Z-критерием с поправкой Йетса.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Проведенный анализ лечения пациентов с СМВ с типом кровотечения FIIC показал, что в ОГ (21 человек) сразу после нанесения гемостатика на кровоточащий дефект порошкообразный альгистаб превращался в гидрогелевый слой, который плотно фиксировался к краям и дну дефекта, удерживаясь на их поверхности до 4–5 суток. При этом гидрогелевый слой закрывал дефект, сгусток и тромбированный сосуд от соляной кислоты и пепсина, предотвращая повторные кровотечения. Одновременно с этим было отмечено, что альгстаб оказывал цитопротективный эффект, способствуя благоприятному течению репаративного процесса. У всех пациентов ОГ улучшалось общее состояние, гемодинамика стабилизировалась, приближались к норме гематологические анализы. У пациентов с типом FIIC ОГ операций, повторных геморрагий и летальных исходов не наблюдалось. В КГ (20 человек) с типом FIIC у пациентов с СМВ операций, повторных геморрагий и летальных исходов также не было.
Пациентов с FIIA-FIIB было 68 человек. В ОГ (38 человек) применяли эндоскопический гемостаз альгистабом с профилактической целью. В КГ (30 человек) проводили эндоскопическую профилактику возобновления кровотече- ния путем АПК разрыва без нанесения гемостатика. В ОГ с FIIA-FIIB повторное кровотечение было отмечено у 2 из 38 человек с глубоким разрывом в области эзофагокардиального перехода справа. У них возобновившееся кровотечение остановлено в результате повторного использования разработанного способа.
Осложнений в данной группе не было. В КГ с FIIA-FIIB возобновление кровотечения было у 6 из 30 пациентов. 5 пациентам не потребовалось проведение операции и кровотечение у них было остановлено эндоскопически. 1 пациент с массивным рецидивным кровотечением взят в операционную, где умер на операционном столе. Кроме этого, в этой группе умер еще 1 пациент от основного соматического заболевания.
В группе пациентов с FIA-FIB было 12 человек. В ОГ 6 пациентам проводили комбинированный эндогемостаз с гемостатиком «Аль-гистаб».
Отмечено, что у всех 6 пациентов ОГ с FIA-FIB гемостаз был достигнут в 100 % случаев, повторных кровотечений, операций и летальных исходов не было. В КГ с FIA-FIB первичный эндогемостаз был успешен у всех 6 пациентов (100 %), но кровотечение возобновилось у 2 пациентов. У этих пациентов кровотечение при повторной эндоскопии было остановлено успешно. Иных осложнений у данных больных не наблюдалось.
Подводя анализ клиническим исследованиям по применению порошкообразного гемостатика «Альгистаб» в комплексном лечении пациентов с синдромом Меллори – Вейсса, следует отметить, что процесс заживления дефектов в ОГ при местном цитопротективном лечении по сравнению с КГ протекал качественнее и быстрее. Так, средний срок заживления дефектов в ОГ был 5,0 (4,0–6,0) дня ( р < 0,0001), а в КГ дефекты зажили в срок 10,0 (7,5–12,0) дня ( р < 0,0001). Причем, при местном лечении альгистабом в ОГ дефекты зажили у 60 (92,3 %) пациентов путем эпителизации, и лишь у 5 (7,7 %) пациентов разрывы зажили с образованием нежного рубца. В КГ заживление дефектов происходило путем рубцевания у 22 (39,3 %), а у 34 (60,7 %) пациентов зажили дефекты путем эпителизации.
Результаты лечения пациентов в сравниваемых группах показаны в табл. 2.
Таблица 2
|
Показатель |
ОГ ( n = 65) |
КГ ( n = 56) |
P |
|
Гемостаз окончательный |
63 (96,9 %) |
48 (85,7 %) |
р = 0,043 |
|
Рецидивные кровотечения |
2 (3,1 %) |
8 (14,3 %) |
р = 0,043 |
|
Летальность |
- |
2 (3,6 %) |
- |
|
Сроки заживления |
5,0 (4,0–6,0) |
10,0 (7,5–12,0) |
р = 0,0001 |
|
Эпителизация дефектов |
60 (92,3 %) |
34 (60,7 %) |
р = 0,0001 |
Показатели эффективности лечения в сравниваемых группах (абс/%)
Из данных, отраженных в таблице, видно, что разработанный способ эндоскопического гемостаза с применением альгистаба усиливает гемостатический эффект, уменьшает число рецидивных геморрагий, способствует быстрому и качественному заживлению дефектов.
ЗАКЛЮЧЕНИЕ
Разработанный метод местного лечения СМВ с использованием гемостатика «Альги-стаб» позволил получить окончательный гемостаз в 96,9 % случаев и уменьшить частоту повторных геморрагий с 14,3 до 3,1 % ( р = 0,043). Инсуффляция альгистаба при местном лечении СМВ способствует образованию цитопротек-торной гидрогелевой пленки на кровоточащих дефектах, создает условия для качественной репаративной регенерации путем эпителизации дефектов до 92,3 % ( р = 0,0001) и уменьшения сроков заживления с 10,0 (7,5–12,0) до 5,0 (4,0– 6,0) ( р = 0,0001) дней.
Список литературы Эндоскопические цитопротективные технологии в лечении синдрома Меллори - Вейсса
- Князева Н. А., Фоменко К. А., Стяжкина С. Н. Желудочно-кишечные кровотечения при синдроме Меллори - Вейсса в клинической практике. Modern Science. 2020;5(1):228-232.
- Wilkins T., Wheeler B., Carpenter M. Upper Gastrointestinal Bleeding in Adults: Evaluation and Management. Am Fam Physician. 2020;101(5):294-300. EDN: MIQSGI
- Валеев М. В., Тимербулатов Ш. В. Гастродуоденальные кровотечения. Анализ результатов лечения в условиях районной больницы. Вестник Национального медико-хирургического центра им. Н. И. Пирогова. 2020;15(1):39-42. 10.25881/BPNMSC. 2020.61. 63.007. DOI: 10.25881/BPNMSC.2020.61.63.007 EDN: TLRNBV
- Тимербулатов Ш. В., Валеев М. В. Обострение язвенной болезни как причина развития синдрома Меллори - Вейсса. Описание серии случаев. Пермский медицинский журнал. 2019;36(4):97-103. DOI: 10.17816/pmj36497-103 EDN: QLGFKY
- Cherednikov E. F., Yuzefovich I. S., Maleev Yu. V. et al. The Use of the Hemostatic Agent Zhelplastan in Combination with a Granulated Sorbent in the Treatment of Patients with MalloryWeiss Syndrome. International Journal of Biomedicine. 2021;11(2):160-163. DOI: 10.21103/Article11(2)_OA7 EDN: ESKGCN
- Юзефович И. С., Баранников С. В., Чередников Е. Ф. Профилактическое цитопротективное лечение синдрома Меллори - Вейсса в условиях специализированного центра. Профилактическая медицина. 2021;24:5-7:91.


