Эндоскопические признаки, ассоциированные с высоким риском развития рака желудка, у пациентов с хроническим гастритом
Автор: Коржева И.Ю., Лактюнькина Е.Н., Алиев А.М., Айдиев А.М., Шилов А.В., Козырь Л.В., Валиулин И.Р., Сызранцев А.Ю., Абдуллаева Э.Н.
Журнал: Московский хирургический журнал @mossj
Рубрика: Абдоминальная хирургия
Статья в выпуске: 3 (93), 2025 года.
Бесплатный доступ
Введение. Изменения слизистой оболочки желудка, связанные с инфекцией Helicobacter pylori и определяемые при эндоскопическом исследовании, могут служить индикаторами повышения риска развития рака желудка. Цель исследования. Выявление значимых эндоскопических предикторов рака желудка у пациентов с хроническим гастритом. Материалы и методы исследования. Ретроспективное пилотное исследование «случай — контроль» включило 32 пациента с аденокарциномой желудка. Группа сравнения включила 80 пациентов с хроническим H. pylori-ассоциированным гастритом. В исследование были включены пациенты с ранними и локализованными формами рака желудка. Исследование проводилось на базе ФГБОУ ДПО РМАНПО. Пациенты проходили обследование и лечение с сентября 2020 года по январь 2025 года в КБ «Медси в Отрадном», КДЦ «МЕДСИ на Красной Пресне» АО ГК «МЕДСИ», в ГКБ им. В.В. Вересаева, эндоскопическом центре ММНКЦ им. С.П. Боткина. Результаты. Статистически значимые различия получены для следующих предикторов: тяжёлой атрофии ОШ = 2,833 (95 % ДИ: 1,193–6,724); кишечной метаплазии ОШ = 11,400 (95 % ДИ: 3,318–39,164), гиперплазии складок желудка ОШ = 2,833 95 % (ДИ: 1,193–6,724), ксантомы желудка ОШ = 6,333 (95 % ДИ: 1,752–22,892). Модель определения вероятности новообразования в зависимости от кишечной метаплазии, гиперплазии складок тела желудка и ксантомы имеет чувствительность и специфичность 80,6 % и 67,5 %, соответственно, PPV 71,3 % и NPV 77,7 %. Заключение. По результатам исследования определены дополнительные предикторы рака желудка: гиперплазия складок тела желудка и ксантома, — кроме традиционно используемых атрофии и кишечной метаплазии.
Рак желудка, Helicobacter pylori, гастрит, кишечная метаплазия, атрофия, зернистость, гиперплазия складок, ксантома
Короткий адрес: https://sciup.org/142245625
IDR: 142245625 | УДК: 006.617-089 | DOI: 10.17238/2072-3180-2025-3-12-19
Текст научной статьи Эндоскопические признаки, ассоциированные с высоким риском развития рака желудка, у пациентов с хроническим гастритом
Материалы и методы
Пациенты. В исследование было включено 112 пациентов: 53 женщины, что составило 47,3 %, и 59 мужчин, что составило 52,7 %. Медиана возраста пациентов составила 63 года (Q1 – Q3 52–71,75), минимальный возраст – 24 года, максимальный возраст – 85 лет.
Пациенты проходили обследование и лечение в период с сентября 2020 года по декабрь 2022 года в КБ МЕДСИ в Отрадном, с апреля 2022 года по январь 2025 года – в ГКБ им. В.В. Вересаева, в мае 2024 года – в КДЦ «МЕДСИ на Красной Пресне», в 2022–2023 годах – в эндоскопическом центре ММНКЦ им. С. П. Боткина.
Критерии включения пациентов в исследование.
Наличие информированного согласия пациента на гастроскопию и биопсию.
Критерии исключения пациентов из исследования.
Отсутствие согласия пациента на эндоскопическое исследование с выполнением биопсии.
Методика эндоскопического исследования и эндоскопические предикторы.
Эндоскопические исследования выполнялись на видеосистеме Olympus EVIS Exera III видеоэндоскопами GIF-H190, после подготовки слизистой оболочки к осмотру приёмом симетикона, разведённого в 50–100 мл воды, и отмывания при помощи водоструйной эндоскопической помпы. Эндоскопическое исследование выполнялось в условиях местной или общей анестезии.
Исследование одобрено Локальным этическим комитетом ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Министерства здравоохранения Российской Федерации 15 мая 2023 года.
Описание методов статистического анализа.
Статистический анализ проводился с использованием программы StatTech v. 4.7.1 (разработчик – ООО «Статтех», Российская Федерация).
При помощи критерия Шапиро-Уилка было определено отличающееся от нормального распределение количественных данных. Количественные данные описывались с помощью медианы (Me) и нижнего и верхнего квартилей (Q1–Q3). Категориальные данные описывались с указанием абсолютных значений и процентных долей. 95 %-е доверительные интервалы для процентных долей рассчитывались по методу Клоппера-Пирсона.
Сравнение двух групп по количественному показателю, распределение которого отличалось от нормального, выполнялось с помощью U-критерия Манна-Уитни. Сравнение процентных долей при анализе четырёхпольных таблиц сопряжённости выполнялось с помощью точного критерия Фишера в связи со значениями ожидаемого явления менее 10.
При сравнении относительных показателей рассчитывалось отношение шансов с 95 %-м доверительным интервалом (ОШ; 95 % ДИ). В случае нулевых значений числа наблюдений в ячейках таблицы сопряжённости расчёт отношения шансов выполнялся с поправкой Холдейн-Энскомб.
Сравнение процентных долей при анализе многопольных таблиц сопряжённости выполнялось с помощью критерия хи-квадрат Пирсона.
Построение прогностической модели вероятности определённого исхода выполнялось при помощи метода логистической регрессии. Мерой определённости, указывающей на ту часть дисперсии, которая может быть объяснена с помощью логистической регрессии, служил коэффициент R² Найджелкерка.
Для оценки дискриминационной способности количественных признаков при прогнозировании определённого исхода применялся метод анализа ROC-кривых. Разделяющее значение количественного признака в точке «cut-off» определялось по наивысшему значению индекса Юдена.
Различия считались статистически значимыми при p < 0,05.
Результаты
Также для ксантомы была установлена статистически значимая разница при анализе группы пациентов с наличием Н. pylori на момент выявления новообразования (p = 0,039, используемый метод: Точный критерий Фишера, ОШ = 6,357 (95 % ДИ: 1,303–31,023)). Методом бинарной логистической регрессии рассчитаны чувствительность и специфичность признака, которые составили 33,3 % и 92,7 %, соответственно.
зависимость описывается уравнением: P = 1 / (1 + e-z) × 100 %
z
-2,239
+
2,845X
1,539XНаличие
широких складок
Наличие
+
кишечной метаплазии
1,828XНаличие
+
ксантомы.
(где P – оценка вероятности Наличия новообразования, z –
значение логистической функции)
Полученная регрессионная модель, с точки зрения соответствия прогнозируемых значений, наблюдаемых при включении предикторов, по сравнению с моделью без предикторов является статистически значимой (p < 0,001). Псевдо-R² Найджелкерка
составил 36,9 %.
|
Гиперплазия складок Enlarged folds |
Гиперплазия складок отсутствует Enlarged folds absent |
61 (76,2) |
17 (53,1) |
0,023* |
|
Наличие гиперплазии складок Enlarged folds is present |
19 (23,8) |
15 (46,9) |
||
|
Ксантома Xanthoma |
Ксантома отсутствует Xanthoma absent |
76 (95,0) |
24 (75,0) |
0,004* |
|
Наличие ксантомы Xanthoma is present |
4 (5,0) |
8 (25,0) |
* – различия показателей статистически значимы (p < 0,05)
Таблица 1
Table 1
Predictors of Increased Risk of Stomach Cancer
|
Показатель Predictor |
Категории Category |
Новообразование Lesion |
p |
|
|
Новообразование отсутствует Lesion absent |
Наличие новооб-разова-ния Lesion is present |
|||
|
Тяжёлая атрофия Severe atrophy |
Тяжёлая атрофия отсутствует Severe atrophy absent |
61 (76,2) |
17 (53,1) |
0,023* |
|
Наличие тяжёлой атрофии Severe atrophy is present |
19 (23,8) |
15 (46,9) |
||
|
Кишечная метаплазия Intestinal metaplasia |
Кишечная мета плазия отсутствует Intestinal metaplasia absent |
76 (95,0) |
20 (62,5) |
< 0,001* |
|
Ниличие кишечной метаплазии Intestinal metaplasia is present |
4 (5,0) |
12 (37,5) |
||
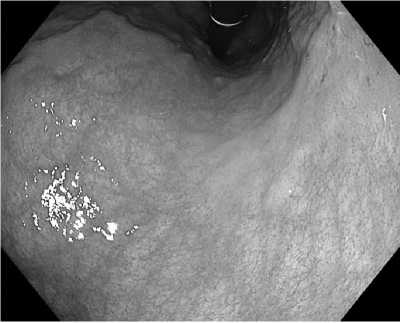

Fig. 2. Intestinal metaplasia in a patient with gastric adenocarcinoma
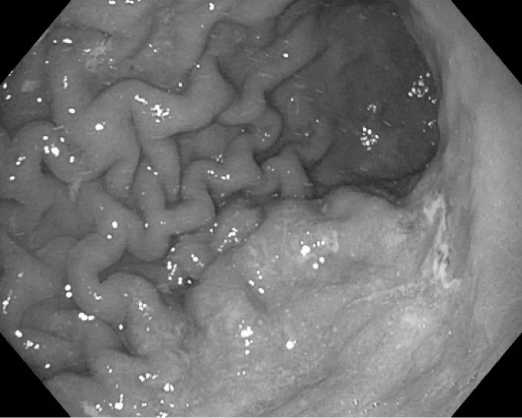
Fig. 4. Xanthoma in a patient with gastric adenocarcinoma
Photos 2–4 by Laktyunkina E.N.
Оценка вероятности P является статистически значимым предиктором новообразования (AUC = 0,799; 95 % ДИ: 0,698– 0,900, p < 0,001).
Пороговое значение оценок вероятности P в точке «cut-off» с высшим значением индекса Юдена составило 0,332. Наличие новообразования прогнозировалось при значении P выше данной величины или равном ей. Чувствительность и специфичность полученной прогностической модели составили 80,6 % и 67,5 %, соответственно (табл. 3).
Таблица 2
Характеристики связи предикторов модели с шансами выявления новообразования
Table 2
Characteristics of the Association between Model Predictors and the Odds of Detecting a Neoplasm
|
Предиктор Predictor |
Нескорректированное ОШ Unadjusted |
Скорректированное ОШ Adjusted |
||
|
COR; 95 % ДИ |
p |
AOR; 95 % ДИ |
p |
|
|
Наличие кишечной метаплазии Intestinal metaplasia is present |
12,000; 3,480 – 41,388 |
< 0,001* |
17,198; 4,276 – 69,131 |
< 0,001* |
|
Наличие широких складок Enlarged folds is present |
2,644; 1,102 – 6,341 |
0,029* |
4,662; 1,602 – 13,558 |
0,005* |
|
Наличие ксантомы Xanthoma is present |
6,609; 1,824 – 23,951 |
0,004* |
6,223; 1,385 – 27,938 |
0,017* |
* – влияние предиктора статистически значимо (p < 0,05)
При оценке дискриминационной способности регрессионной модели с помощью ROC-анализа была получена следующая
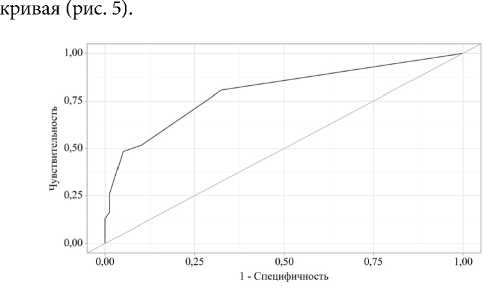
Рис. 5. ROC-кривая, характеризующая дискриминационную способность регрессионной модели при прогнозировании новообразования
Fig. 5. ROC-curve characterising the discriminatory ability of the regression model in predicting neoplasm
Таблица 3
Анализ дискриминационной способности оценок вероятности P
Table 3
Analysis of Discriminatory Capacity of Probability Estimates P
|
Порог P value in cut-off point |
Чув-стви-тель-ность (Se), % |
Спец-ифич-ность (Sp), % |
Положительно прогностическая ценность (PPV) |
Отрицательно прогностическая ценность NPV |
|
0,399 |
51,6 |
90,0 |
83,8 |
65,0 |
|
0,332 |
80,6 |
67,5 |
71,3 |
77,7 |
Обсуждение
По данным когортного исследования, которое включило 1755 пациентов с медианой срока наблюдения в 5 лет, риск эпителиальной неоплазии был нулевым у пациентов со стадией атрофии OLGA 0, I и II (95 % ДИ от 0 до 0,4), в то время как у пациентов со стадией гастрита OLGA III он составил 36,5 на 1000 человеко-лет (95 % ДИ от 13,7 до 97,4) и 63,1 на 1000 человеко-лет со стадией OLGA IV (95 % ДИ от 20,3 до 195,6) [10].
Заключение


