Эндоваскулярные технологии в лечении пациентов с окклюзионно-стенотическими поражениями илио-кавального сегмента
Автор: Стойко Ю.М., Масленников М.А., Яшкин М.Н., Марчак Д.И., Литвинов А.А.
Журнал: Вестник Национального медико-хирургического центра им. Н.И. Пирогова @vestnik-pirogov-center
Рубрика: Оригинальные статьи
Статья в выпуске: 1 т.17, 2022 года.
Бесплатный доступ
В статье представлены результаты эндоваскулярного стентирования илио-кавального венозного сегмента у двух групп пациентов - с посттромботической болезнью и неопухолевой нетромботической экстравазальной компрессией подвздошных вен. Полученные результаты подтверждают эффективность и относительную безопасность стентирования подвздошных вен в лечении пациентов с хроническими заболеваниями вен нижних конечностей.
Хронические заболевания вен, венозное стентирование, посттромботическая болезнь, синдром мей-тернер
Короткий адрес: https://sciup.org/140293512
IDR: 140293512
Текст научной статьи Эндоваскулярные технологии в лечении пациентов с окклюзионно-стенотическими поражениями илио-кавального сегмента
ской болезнью себе на вооружение. Имея успешный опыт реканализации, ангиопластики и стентирования артерий, эндоваскулярные хирурги все чаще стали применять этот метод для лечения пациентов с посттромботической обструкцией подвздошных вен и нижней полой вены. Так как венозное стентирование являлось малоизученным направлением эндоваскулярной хирургии вен, то P. Neglen и соавт. [3] в 2007 г. начали развивать это направление, оперируя пациентов с трофическими язвами, и доказали его эффективность в заживлении трофических язв и улучшении качества жизни пациентов. Позднее, S. Raju и соавт. [4] в 2010 г. подтвердили ранее полученные результаты, а венозное стентирование заняло ведущую роль, как операция выбора для ликвидации илио-кавальных поражений различной этиологии. В 2016 г. M.J. Seager и соавт. [5] представили систематический обзор по результатам стентирования подвздошных вен. В обзор включены 14 рандомизированных исследований со всего мира со сроком наблюдения за пациентами от 6 месяцев до 4 лет. В анализ включены результаты 2373 операций по поводу посттромботической обструкции и 2586 операций по поводу экстравазальной компрессии подвздошных вен (синдром Мей-Тернер). Обобщенные результаты анализа показали, что частота заживления трофических язв после операции увеличилась с 56% до 100% (по сравнению с консервативной терапией), первичная проходимость стентов составила 32–98,7%, вторичная проходимость стентов — 66–96%. Послеоперационные

осложнения отмечены в 8,7% случаев. Мировой опыт стентирования нижней полой вены не так велик, как при стентировании подвздошных вен. Тем не менее, в 2017 г. O. Grotta и соавт. [6] представили опыт успешного стентирования подвздошных вен и нижней полой вены при посттромботической болезни. У 19 пациентов выполнена эндоваскулярная операция, за 2 года вторичная проходимость стентов составила 83%. Но уже за период наблюдения до 42 месяцев — у 15 из 19 пациентов стенты сохранили свою проходимость. Если первые свои наблюдения хирурги сосредоточили на лечение пациентов с посттромботической болезнью, то позже появилась необходимость лечения пациентов с нетромботическим нарушением венозного оттока по подвздошным венам. Так, в 2017 г. R. Goldman и соавт. [7] доказали, что эндоваскулярное стентирование служит безальтернативным способом устранения нарушений венозного оттока при синдроме Мей-Тернер. Эффективность венозного стентирования определяется не только правильной техникой выполнения операции, адекватной антитромботической терапией, но и выбором стента, характеристики которых улучшаются их года в год [8]. В 2018 г. S. Raju и соавт. [9] предложен оптимальный диаметр стента в зависимости от пораженного венозного сегмента.
Целью нашего исследования послужил анализ клинических результатов лечения пациентов с посттромботической болезнью и экстравазальной неопухолевой компрессией илио-кавального сегмента с использованием эндоваскулярных методов лечения.
Материал и методы
Проведен анализ результатов эндоваскулярного лечения 90 пациентов в клинике грудной и сердечно-сосудистой хирургии им. Св. Георгия НМХЦ им. Н.И. Пирогова в период с 01.2015 по 09.2021 гг.
В первую группу включено 55 пациентов, которым выполняли эндоваскулярную операцию по поводу экс-травазальной компрессии левой общей подвздошной вены (синдром Мей-Тернер). По половому признаку пациенты разделились практически поровну: 26 мужчин, 29 женщин. Средний возраст составил 32 года у мужчин и 30 лет у женщин. У пациентов с экстравазальной компрессией отмечался клинический класс С2,3,S (симптоматический) по классификации СЕАР.
Вторую группу составили 44 пациента с посттромботической болезнью и обструкцией илио-кавального сегмента. По половому признаку пациенты разделились следующим образом: 11 мужчин и 27 женщин. Средний возраст составил 31 год у мужчин, 39 лет у женщин. У пациентов с посттромботической болезнью диагностирован клинический класс С3-С6,S (симптоматический) по классификации СЕАР.
На контрольных осмотрах и перед операцией в обеих группах оценивали клинический класс по международной классификации хронических заболеваний вен СЕАР, тяжесть хронического заболевания вен по шкале VCSS,
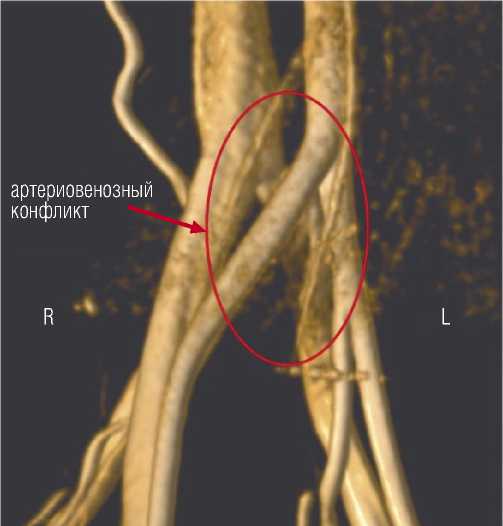
Рис. 1. Результат МР-флебографии — экстравазальная компрессия левой общей подвздошной вены.
качество жизни по опроснику CIVIQ-20. У пациентов с посттромботической болезнью оценивали тяжесть заболевания по шкале VILLALTA.
Показанием к операции являлись нарушение венозного оттока в зоне подвздошных вен и кавального сегмента с клиническими проявлениями хронической венозной недостаточности (С3-С6 по СЕАР).
В предоперационном периоде для подтверждения диагноза выполняли бесконтрастную магнитно-резонансную флебографию (МР-флебография) (Рис. 1) или контрастную компьютерно-томографическую флебографию (КТ-флебография) (Рис. 2). МР-флебографию выполняли в проекциях TRA, COR, SAG, в последовательности BH FIESTA, 3D Inhance PC, обработка MIP и 3D изображений. КТ-флебографию выполняли с внутривенным введением контрастного вещества (Оптирей-350) в проекциях TRA, COR, SAG, с обработкой MIP и 3D изображений.
Техника выполнения операции
В большинстве случаев пункционный доступ под УЗ-наведением выполнялся через подколенную вену, в связи с чем оптимальным положением пациента являлось лежа на животе. Далее с использованием проводников различной жесткости выполнялась реканализация окклюзированного участка вены (Рис. 3). В связи с обилием развитых венозных коллатералей, обязательным было ангиографическое подтверждение нахождения проводника в просвете нижней полой вены (Рис. 4). Перед имплантацией стент-системы во всех случаях выполнялась предилатация (баллонная ангиопластика) пораженных венозных сегментов баллонным катетером с диаметром

окклюзия нижней полой вены ниже почечных вен
Рис. 2. Результат КТ-флебографии — посттромботическая окклюзия нижней полой вены.
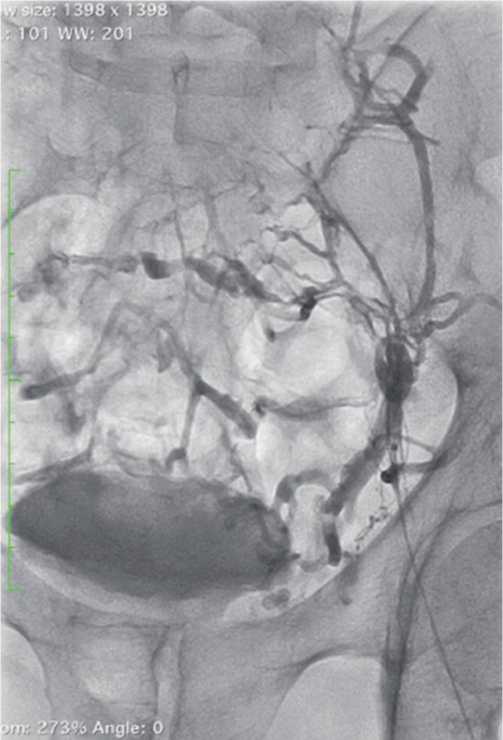
Рис. 3. Этап выполнения проводниковой реканализации при посттромботической обструкции.
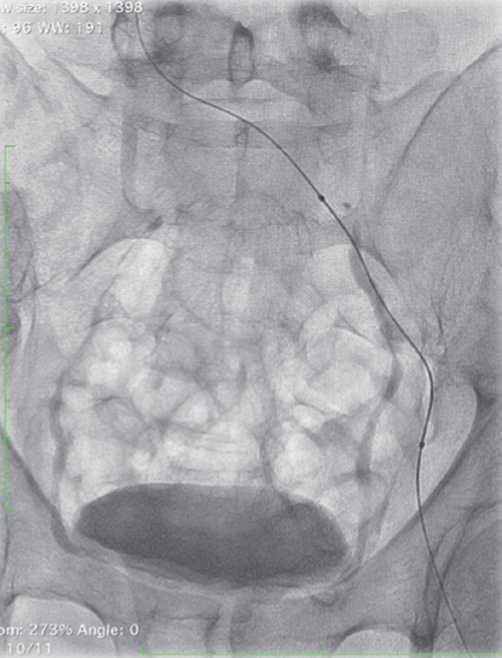
Рис. 4. Успешная проводниковая реканализация подвздошных вен при посттромботической обструкции.
от 7 до 16 мм (Рис. 5). Вслед за баллонной ангиопластикой производилось позиционирование стент-системы так, чтобы проксимальный и дистальный края стента располагались в тромботически или стенотически неизмененных участках венозного русла (Рис. 6). Этап имплантации стента всегда завершался баллонной постдилатацией стентированного участка с целью его полного расправления. Диаметр баллонных катетеров составил от 12 до 22 мм (Рис. 7). При выполнении операции по поводу экстравазальной компрессии левой общей подвздошной вены пациент располагался на операционном столе лежа на спине, под УЗ-наведением проводилась пункция общей бедренной вены.
После операции пациентам рекомендовалась ранняя активизация, а до полного восстановления после сочетанной анестезии — перемежающаяся пневмокомпрессия (Рис. 8).
В послеоперационном периоде назначалась компрессионная терапия — пациентам с посттромботической болезнью — гольфы 34–46 мм рт. ст. на период до 1 года, пациентам с экстравазальной компрессией — чулки 23–32 мм рт. ст. до 2 месяцев.
С целью контроля проходимости стентированного участка проводилось ультразвуковое ангиосканирование вен нижних конечностей в 1–3 сутки после операции, через 1 месяц, далее 1 раз в год. КТ-флебография прово-
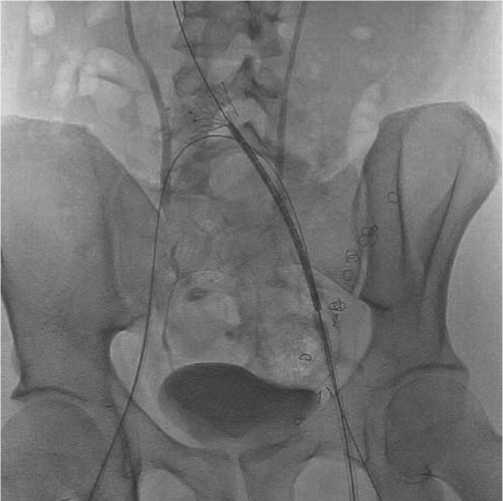
Рис. 6. Заведение стент-системы, позиционирование и начало установки стента.
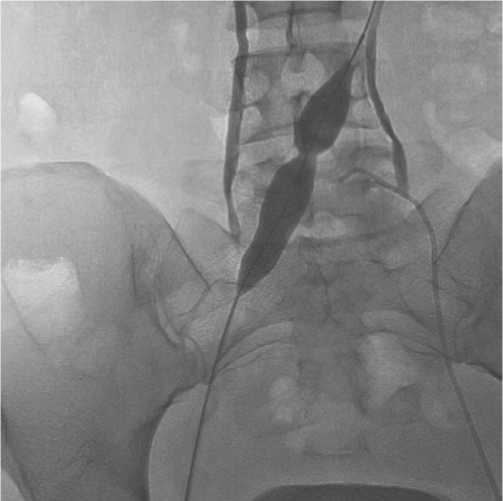
Рис. 5. Баллонная ангиопластика (предилатация) правой общей подвздошной вены при посттромботической обструкции.
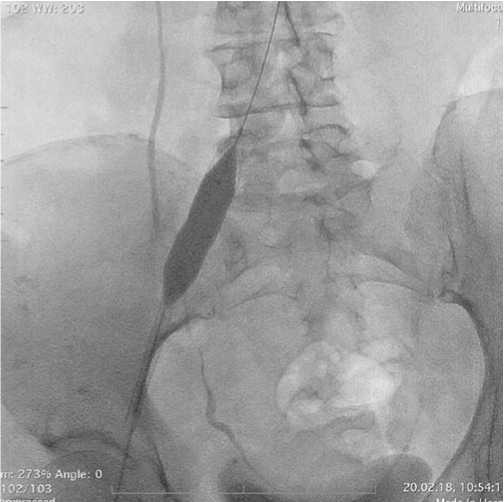
Рис. 7. Постдилатация правой общей подвздошной вены.
дилась через 6 месяцев для определения проходимости стентов, исключения деформации их конструкции.
Одним из самых обсуждаемых вопросов эндоваскулярного стентирования подвздошных вен и нижней полой вены является выбор антитромботической терапии в послеоперационном периоде. В 2018 г. вышел международный консенсус по антитромботической терапии после венозного стентирования (K. Milinis, A. Thapar,

Рис. 8. Перемежающаяся пневмокомпрессия до активизации пациента (режим В, 60–70 мм рт.ст.).
J. Shalhoub, 2018). Консенсус опирается на исследование по типу Делфи, то есть не имеет высокой степени доказательности, тем не менее, во всем мире достигнуты определенные закономерности. Во-первых, антикоагулянтная терапия должна проводиться в сроки не менее 6–12 месяцев, наиболее часто используемая терапия — низкомолекулярные гепарины в сроки от 2 до 6 недель после операции. Пожизненная антикоагулянтная терапия показана при рецидивирующем тромбозе глубоких вен. У пациентов с первичным тромбозом терапия может быть отменена через 12 месяцев. А вот объем и длительность дезагрегантной терапии полностью не определены.
В начале освоения методики мы назначали антикоагулянтную терапию в объеме ривароксабана 20 мг в сутки (либо другие ПАОК) в сочетании с дезагрегантной терапией клопидогрела 75 мг в сутки на 6 месяцев. С 2018 г. используется созданный внутренний протокол, по которому антитромботическая терапия была изменена. Пациентам с посттромботической болезнью назначали варфарин (МНО 2–3) с клопидогрелом 75 мг в сутки, при

нетромботическом поражении вен — ривароксабан 20 мг и клопидогрел 75 мг в сутки не менее 12 месяцев.
Результаты
После эндоваскулярных операций у 44 пациентов по поводу посттромботической болезни положительный результат достигнут у 30, у 6-ти в сроки от 1 до 6 месяцев выявлен тромбоз стентов наружной или общей подвздошных вен (Рис. 9). У 6 пациентов выявлено сужение проксимальной части стента «тепперинг», которое не потребовало повторных вмешательств. Данная особенность оказалась характерной для плетеных стентов (Рис. 10). У 2 пациентов отмечена деформация стента в сегменте общей бедренной вены, осложнившаяся тромбозом данного участка, что потребовало рестентирования (Рис. 11).
При стентировании подвздошных вен при посттромботической обструкции у подавляющего числа пациентов получены обнадеживающие клинические результаты операции. Уменьшились общеклинические проявления венозного заболевания по VCSS 14±6 баллов (до операции) и 6±3 баллов (после операции). Улучшилось качество жизни пациентов по опроснику CIVIQ 61±27 баллов (до операции), 40±6 баллов (после операции).
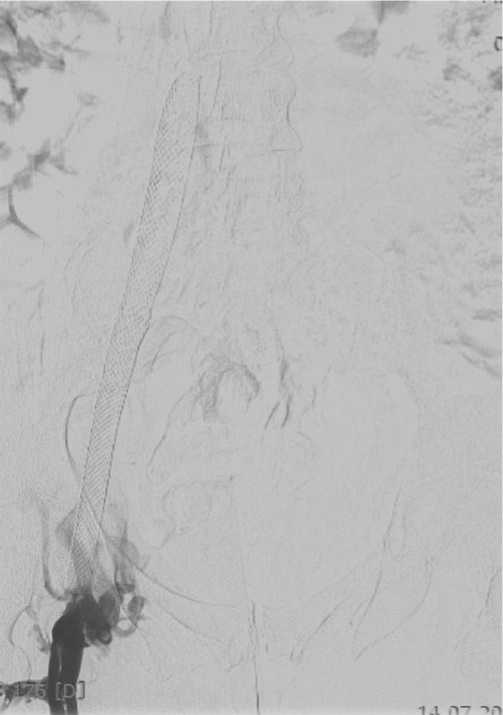
Рис. 9. Тромбоз наружной и общей подвздошных вен — отсутствие контра- стирования.
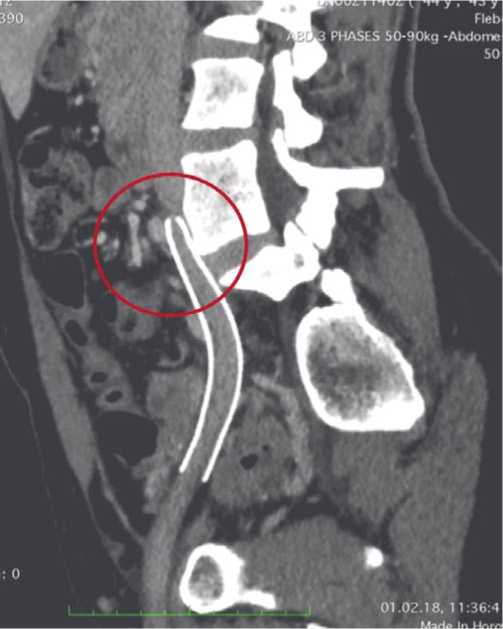
Рис. 10. Сужение проксимальной или верхней части стента в отдаленном периоде после операции.
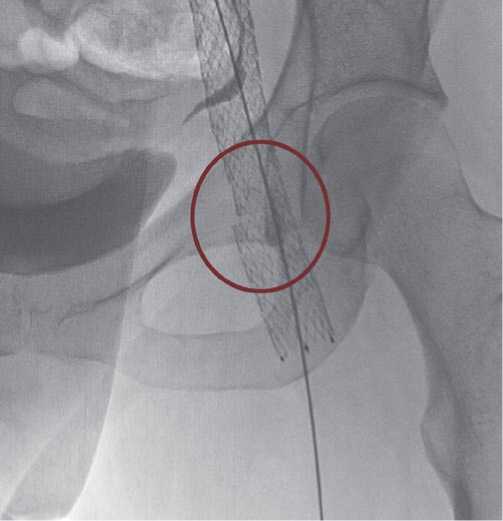
Рис. 11. Надлом стента в области бедренного сгиба.
Снизилась тяжесть клинических проявлений посттромботической болезни по шкале VILLALTA 13±9 баллов (до операции), 6±3 баллов (после операции).
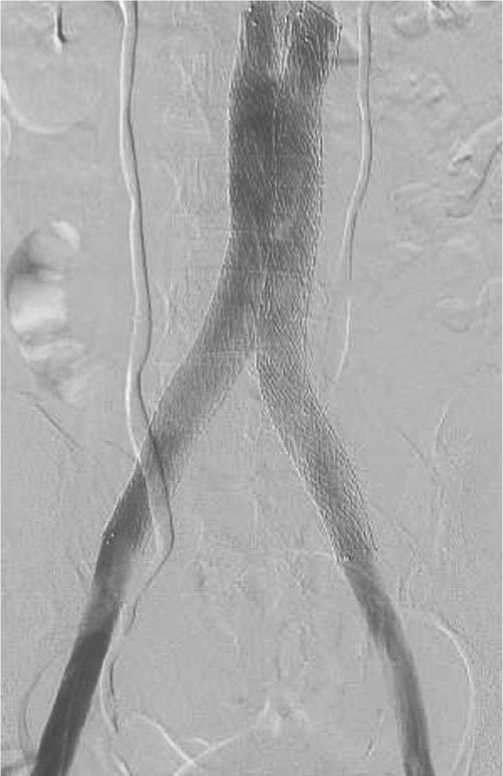
Рис. 12. Полное восстановление венозного оттока крови при тяжелой двусторонней посттромботической обструкции подвздошных вен и нижней полой вены.

После стентирования подвздошных вен при экстра-вазальной компрессии отдаленные результаты изучены в сроки от 3 до 46 месяцев.
После операций у 55 пациентов по поводу экстра-вазальной компрессии проходимость стентов составила 100%. У 7 пациентов выполнено дополнительное вмешательство на поверхностных венах после стентирования (ЭВЛО, РЧА, стриппинг). При клинической оценке результатов вмешательства получены следующие результаты: снижение тяжести заболевания по шкале VCSS 6±3 баллов (до операции) и 3,6±1,6 балла (после операции). Улучшилось качество жизни пациентов: CIVIQ 43±7 балла (до операции) и 26±3 баллов (после операции).
Операции завершались ангиографическим контролем, по данным которого подтверждалось полное восстановление венозного оттока по пораженному сегменту (Рис. 12, 13).
Помимо прямого ангиографического результата проведен анализ лучевой нагрузки во время операции.
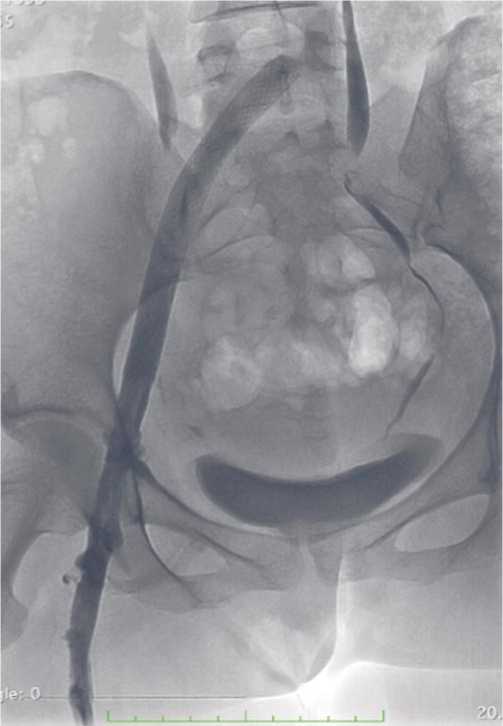
Рис. 13. Полное восстановление венозного оттока крови при экстравазаль-ной компрессии подвздошной вены.
Среднее время рентгеноскопии при операции по поводу посттромботической болезни составило — 29,7 мин., при экстравазальной неопухолевой компрессии подвздошной вены (синдром Мей-Тернер) — 10,1 мин. Среднее количество контрастного вещества (Йогексол/Йопро-мид) при операции по поводу посттромботической болезни — 187,5 мл, при синдроме Мей-Тернер — 160 мл. Таким образом указанные показатели не превышают таковые при вмешательствах на артериальном русле аналогичного сегмента.
Выводы
-
1. Показанием к эндоваскулярному стентированию являются клинически значимые нарушения венозного оттока в илио-феморальном сегменте вследствие окклюзионных поражений или экстравазальной компрессии.
-
2. Эндоваскулярное стентирование подвздошных вен является эффективным и относительно безопасным методом ликвидации окклюзионно-стенотических поражений глубоких вен нижних конечностей, улучшающий клинический результат комплексного лечения пациентов.
-
3. Выполнение данных вмешательств прерогатива специалистов с опытом эндоваскулярных операций в условиях высокотехнологичного оснащения лечебного учреждения и возможностью лечения интраоперационных и послеоперационных осложнений.
Авторы заявляют об отсутствии конфликта интересов (The authors declare no conflict of interest).
Список литературы Эндоваскулярные технологии в лечении пациентов с окклюзионно-стенотическими поражениями илио-кавального сегмента
- Wright KC, Wallace S, Charnsangavej C, Carrasco CH, Gianturco C. Percutaneous endovascular stents: an experimental evaluation. Radiology. 1985; 156(1): 69-72.
- DOI: 10.1148/radiology.156.1.4001423
- Zollikofer CL, Largiader I, Bruhlmann WF, Uhlschmid GK, Marty AH. Endovascular stenting of veins and grafts: preliminary clinical experience. Radiology. 1988; 167(3): 707-12.
- DOI: 10.1148/radiology.167.3.2966417
- Neglen P. Chronic venous obstruction: diagnostic consideration and therapeutic role of percutaneous iliac stenting. Vascular. 2007; 15(5): 273-80.
- DOI: 10.2310/6670.2007.00071
- Raju S, Darcey R, Neglen P. Unexpected major role for venous stenting in deep reflux disease. J. Vasc. Surg. 2010; 51 (2): 401-8.
- DOI: 10.1016/j.jvs.2009.08.032
- Seager MJ, Busuttil A, Dharmarajah B, Davies AH. A Systematic Review of Endovenous Stenting in Chronic Venous Disease Secondary to Iliac Vein Obstruction. Eur. J. Endovasc. Surg. 2016; 51(1): 100-20.
- DOI: 10.1016/j.ejvs.2015.09.002
- Grotta O, Enden T, Sandbaek G, Gjerdalen GF, Slagsvold CE, Bay D, Klow NE, Rosales A. Patency and Clinical Outcome After Stent Placement for Chronic Obstruction of the Inferior Vena Cava. Eur. J. Endovasc. Surg. 2017; 54(5): 620-628.
- DOI: 10.1016/j.ejvs.2017.07.003
- Goldman RE, Arendt VA, Kothary N, Kuo WT, Sze DY, Hofmann LV, Lungren MP. Endovascular Management of May-Thurner Syndrome in Adolescents: A Single-Center Experience. J. Vasc.Interv. Radiol. 2017; 28(1): 71-77.
- DOI: 10.1016/j.jvir.2016.09.005
- Литвинов А.А. Сравнительная характеристика венозных стентов. Вестник Национального медико-хирургического Центра им. Н.И. Пирогова. - 2021. - Т.16. - №2. - С.98-104.
- DOI: 10.25881/20728255_2021_16_2_98 EDN: RTSKHF
- Raju S, Buck WJ, Crim W, Jayaraj A. Optimal sizing of iliac vein stents. Phlebology. 2018; 33(7): 451-457.
- DOI: 10.1177/0268355517718763


