Энтальпия гидратации халькогенидов
Автор: Рябухин Александр Григорьевич, Груба Оксана Николаевна, Германюк Нина Васильевна
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Физическая химия
Статья в выпуске: 4 т.6, 2014 года.
Бесплатный доступ
В работе показана возможность применения модифицированной модели для расчета стандартной энтальпии образования анионов халькогенов в газовой фазе и в водном растворе, стандартной энтальпии гидратации халькогенид-ионов. Сделаны предсказательные расчеты термохимических характеристик для аниона полония. Полученные величины энтальпий образования газообразных анионов позволили рассчитать для атомов халькогенов первые и вторые значения сродства к электрону.
Анион, халькогены, энтальпия образования, энтальпиягидратации, радиус "водного" аниона, сродство к электрону
Короткий адрес: https://sciup.org/147160299
IDR: 147160299 | УДК: 544.31.031
Текст научной статьи Энтальпия гидратации халькогенидов
Халькогенидам в природе принадлежит важная роль: это кислородсодержащие горные породы, составляющие большинство, это кислород- и серосодержащие руды – основные источники металлов и халькогенидов.
Разнообразным технологиям переработки руд требуются данные по различным свойствам веществ в разных фазовых состояниях: газы, расплавы, растворы и другие.
В работе [1] на примере галид-ионов (для которых приведены надежные справочные сведения) показано, что модифицированное уравнение расчета энтальпии кристаллической решетки позволяет вычислить энтальпию образования газообразного и гидратированного аниона. Сущность модификации заключается в замене в расчетном уравнении межструктурного расстояния в кристалле на радиус иона.
В расчетах используются следующие единицы измерения: для энтальпии – кДж∙моль-1, для расстояний – ангстремы (10-8 см).
Уравнение для расчета энтальпии образования газообразных ионов имеет одинаковую форму для катионов и для анионов.
A fH ° = A H 0 + A H вз = 83,581728 ■ z 2 ■ f 1 - 103,19053 ■ A M ■ кч ■ z ■ f 2 • ( r ° ) - 1 . (1)
Здесь кч = 6 и АМ = 1,747565 (NaCl).
Для полных электронных аналогов двухзарядных катионов и анионов, имеющих электронное строение ( n - 1 ) s 2 p 6 ns 2 p 6 :
A fH ° = 83,581728 ■ z 2 ■ f + 103,19053 ■ 1,747565 ■ 6 ■ z ■ f 2 ■ ( r ° ) — 1 =
= 83,581728 ■ 4 ■ f 1 + 1081,99295 ■ 2 ■ f 2 ■ ( r ° ) — 1 ;
A fH ° =- 334,3269 ■ f 1 + 2163,9859 ■ f 2 ■ ( r ° ) — 1 . (2)
В работе [2] из расчетов по уравнениям модели энтальпий кристаллических решеток халькогенидов металлов подгруппы цинка вычислены A f H ° ( Хг2 - ,г ) для S2 - , Se2 - , Te2 - , Po2 - .
В случае полных электронных аналогов ( Se2 - - Po2 - )
- 1
f 1 = f ГЦК ■ f ОЦК = 2 [ 1 + 2 J 3V3 = 4,156922 ;
f 2 = f ГЦК - f ОЦК = 2 | 1 + тЬ- | 1 + -I = 1,68750 .
V 2 ) 8 V 9 )
После подстановки значений f 1 и f 2 в уравнение (2) получим
A fH ° ( Хг2 - ,г ) = - 1389,771 1 + 3651,7262 ( r ° ) - 1 . (3)
Исходные (справочные) данные и результаты расчетов по уравнению (3) приведены в табл. 1.
Таблица 1
Энтальпия образования газообразных анионов халькогенов
|
№ п/п |
Хг2 - |
r ° ( Хг2 -) , [2] |
A f H ° ( Хг2 - ,г ) , [2] |
A H вз , ур. (3) |
A f H ° ( Хг2 - ,г ) , ур. (3) |
|
1 |
2 |
3 |
4 |
5 |
|
|
1 |
S2 - |
1,78064 |
619,315±0,167 |
2050,187 |
660,416 |
|
2 |
Se2 - |
1,89371 |
537,935±0,430 |
1927,774 |
538,003 |
|
3 |
Te2 - |
2,06104 |
381,555±0,667 |
1771,263 |
381,492 |
|
4 |
Po2 - |
2,13724 |
318,174±0,753 |
1708,111 |
318,340 |
Из сравнения величин в колонках 3 и 5 следует хорошее согласие для ионов полных электронных аналогов - Se2 - , Te2 - и Po2 - . Для иона связующего элемента ( S2 - ) согласия нет (расхождение составляет 41,1). Для иона начального элемента ( О2 - ) расхождение между рассчитанной и экспериментальной величинами составило 188,3 ( A f H ° ( О2 - , г ) = 1069,218 [2]).
В работе [2] показано, что в таблицах ионных радиусов [3, 4] приводятся «водные» радиусы анионов. В основе расчетов ионных радиусов создатели таблиц использовали радиус иона кислорода O2 - в интервале от 1,32 до 1,46 А (10-8 см). В 1923 г. индийский ученый Вазашерна из рефрактометрических измерений растворов солей вычислил радиус иона кислорода, составивший 1,32∙10-8 см. Поэтому нельзя считать радиусы, приведенные в [3, 4], «кристаллическими».
Водные радиусы r в можно вычислить по уравнению модели эффективных ионных радиусов, используя свойства воды.
rK • rD • r A = 1,383 - 83,933735 - r A = 118,846356 - r A rK - r D - ( r A ) 2 1,383 - 83,933735 - ( r A ) 2 118,846356 - ( r A ) 2
Здесь rK = 1,383 – радиус молекулы воды, которая положительным концом диполя ориентирована к аниону (радиус rA), то есть выступает в роли катиона; rD - дебаевский радиус экранирования rD = rD (NaCl) - fz = 31,45393 - (1 + Jz2 -1) = 85,933735.
«Водные» радиусы ионов халькогенов приведены в табл. 2 и 3.
Таблица 2 Энтальпия образования анионов халькогенов в водном растворе
|
№ п/п |
Хг2 - |
r в, ур. (4) |
A f H ° ( Хг2 - ,р-р ) , [5] |
-A H вз , ур. (5) |
A fH ° ( Хг2 ,р-р ) , ур.(5) |
|
1 |
2 |
3 |
4 |
5 |
|
|
1 |
S2 - |
1,82945 |
36,40±1,26 |
522,223 |
93,428 |
|
2 |
Se2 - |
1,95263 |
126,575±2,092 |
489,280 |
126,372 |
|
3 |
Te2 - |
2,13744 |
168,91±2,092 |
446,975 |
168,677 |
|
4 |
Po2 - |
2,22267 |
отс. |
429,835 |
185,817 |
Таблица 3
Энтальпия гидратации анионов халькогенов
|
№ п/п |
Хг2 — , r в , ур. (4) |
A f H ° ( Хг2 — ,г ) , (табл. 1) |
A f H ° ( Хг2 — ,р-р ) , (табл. 2) |
—Ar H ° ( Хг2 —) , ур. (6) |
—A H вз , ур. (7) |
—Ar H ° ( Хг2 —) , ур. (7) |
|
1 |
2 |
3 |
4 |
5 |
6 |
|
|
1 |
S2 — 1,82945 |
619,315±0,167 |
93,428±1,26 |
525,887±1,427 |
2441,657 |
565,888 |
|
2 |
Se2 — 1,95263 |
537,935±0,430 |
126,372±0,430 |
411,631±2,522 |
2290,959 |
411,272 |
|
3 |
Te2 — 2,13744 |
381,555±0,667 |
168,677±0,667 |
212,815±2,751 |
2092,397 |
213,230 |
|
4 |
Po2 — 2,22267 |
318,174±0,753 |
185,817±0,753 |
132,523 |
2015,865 |
132,995 |
В модели гидратации катионов [2] показано, что в любых растворах, для которых принимается A f H ° ( Н + , р-р ) = 0, необходимо знать его действительное значение. Там же вычислено A f H ° ( Н + , р-р ) = 406,025 ± 0,008 .
Уравнение для расчета энтальпии образования анионов в водном растворе в нашем случае
A fH ° ( Хг2 — , p - p ) = 406,025 " z + A H 0 + A H вз ,
A f H ° ( Хг2 — , p - p ) = 406,025 " 2 — 83,581728 • 4 • f1 — 103,19053 • 1,747565 • 6 • 2 • г в — 1 =
= 812,050 — 196,398 — 955,3820 • г в — 1 ,
A fH ° ( Хг2
, p - p ) = 615,652 — 955,3 825 • r B — 1
.
(5)
( 8 f . = f ОЦК " f ГЦК = к 3^3
—
1 ) 42^2 = 0,587443 ;
7 з4з
f 2 = f ОЦК " f ГЦК = 3/3 "
1 +
к 3 7
— 1
= 0,441492 .
Исходные данные и результаты вычислений помещены в табл. 2.
. —
Из данных строк 2 и 3 ( Se2
и Te2 ) следует их хорошее согласие, что подтверждает
адекватность модели и позволяет произвести предсказательный расчет для A f H ° ( Ро2 ,р-р ) . У аниона связующего элемента ( S2 — ) согласия не наблюдается, как и в случае с расчетами A f H ° ( Хг2 — ,г ) . Здесь расхождение расчетных и справочных данных составило 57,0.
Согласно определению, энтальпия гидратации аниона
A г H ( A z —) = A f H ° ( A z — ,р-р ) — A f H ° ( A z — ,г ) . (6)
Ранее были вычислены хорошо согласующиеся значения A f H ° ( Хг2 — ,г ) и A f H ° ( Хг2 — ,р-р ) для анионов Se2 — и Te2 — . Это позволяет использовать расчеты по уравнению (6) с применением полученных термических характеристик в качестве контрольных.
Модифицированное уравнение для расчета энтальпии гидратации анионов халькогенов аналогично уравнению расчета энтальпии образования простых анионов халькогенов в водном растворе.
А г Н ( Хг2 - ) = 2 A fН ° ( Н + , р-р ) + А Н 0 + А Н вз;
А г Н ( Хг2 -) = 2 ■ 406,025 + 83,587128 ■ 2 2 ■ f - 103,19053 ■ 1,747565 ■ 6 ■ 2 ■ f 2 ■ r - =
= 812,050 + 1067,117 - 4472,3772 ■ r - 1; в
А г Н ( Хг2 -) = 1879,167 - 4472,3772 ■ г в - 1 .
f 1 = f ОЦК ■ f ГЦК = 3 f 1 + 9
1 L 4V2 )
1 +
2 ( 373 J
- 1
= 3,191836 ;
f 2 = f ОЦК ■ f ГЦК =
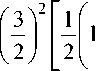
4\2 )
+ 343 J
- 1
= 2,066757 .
Исходные данные и результаты вычислений по уравнениям (6) и (7) приведены в табл. 3.
Из сравнения величин в колонках 4 и 6 следует хорошее согласие у элементов полных электронных аналогов. У сульфид-иона, являющегося ионом связующего элемента, расхождение между справочной и расчетной величинами составляет 39,6.
Согласие результатов расчетов энтальпии гидратации для иона полония ( Po2 - ) со справочным значением носит принципиальный характер, так как в вычислениях А г Н ° ( Ро2 -) была использована прогнозная величина А f H ° ( Ро2 - ,р-р ) (табл. 2).
Важнейшими характеристиками атомов являются потенциалы ионизации и сродство к электрону. Технология определения потенциалов ионизации хорошо отработана, чего нельзя сказать об определении сродства к электрону. Присоединение к атомам электрона с образованием устойчивого однозарядного аниона наблюдается у галогенов. Присоединение второго электрона с образованием двухзарядного аниона неизвестно, так как пока отсутствует метод измерения энтальпии присоединения второго электрона.
Численные величины А f H ° ( Хг2
,г ) , полученные из энтальпий кристаллических решеток
-
[2] (табл. 1), позволяют впервые рассчитать £ А и А 2 по уравнению
А fН ° ( Хг2 - ,г ) = А fH ° ( Хг0,г ) - F £ А - 2 ■ 6,1965, (8)
где F – постоянная Фарадея, 96484,56 Кл∙моль-1; 6,1965 – энтальпия 1 моль электронного газа.
Исходные данные и результаты расчетов по уравнению (8) приведены в табл. 4.
Таблица 4
Сродство атомов халькогенов к электрону
|
№ п/п |
Хг2 - |
А fH • ( Хг0,г ) , [6] |
А fH • ( Хг2 - ,г ) , (табл. 1) |
F £ А - 12,393, ур. (8) |
£ А , эВ, ур. (8) |
А 1 , эВ [6] |
А 2 , эВ |
|
1 |
2 |
2 |
4 |
5 |
6 |
7 |
|
|
1 |
S2 - |
276,980±1,046 |
619,315±0,167 |
342,335±1,826 |
3,61470± ±0,00169 |
2,0772± ±0,0005 |
1,4709± ±0,0194 |
|
2 |
Se2 - |
227,610±2,092 |
537,935±0,430 |
310,325±2,932 |
3,36508± ±0,00337 |
2,0201± ±0,0003 |
1,1962± ±0,0307 |
|
3 |
Te2 - |
168,615±1,255 |
381,555±0,667 |
212,940±1,935 |
3,06371± ±0,00226 |
(1,5213) |
(0,6857) |
|
4 |
Po2 - |
144,346±2,092 |
318,174±0,753 |
173,828±2,845 |
2,89839± ±0,02818 |
1,32 |
0,4816± ±0,0217 |
В колонке 5 помещены впервые полученные суммы величин сродства электронов к атомам халькогенов. К сожалению, для теллура экспериментальные данные о величине первого сродства электрона отсутствуют. Однако такие сведения имеются для селена и полония. Так как зависимость энтальпии образования газообразных халькогенид-ионов является линейной от обратного радиуса, то можно принять такой же вид зависимости и для первого сродства электрона.
А1 ( Te ) = а + А А 1 - 1 ( r Te )- 1 = - 4,1240 + 11,36517 ( r Te )- 1.
а( r °)
r Te = 2,06104; А 1 ( Te ) = 1,5213. Эта величина существенно отличается от примерной оценки [6]. Величина второго сродства к электрону для теллура А 2 ( Te ) , определенная по разности ^ А - A 1, составит (2,2070 - 1,5213) = 0,6857.
-
1. Подтверждена адекватность модифицированной модели энтальпии кристаллической решетки.
-
2. Хорошее согласие справочных и расчетных величин позволило произвести предсказательные вычисления энтальпии образования ионов полония в водном растворе.
-
3. Показано, что анионы связующего и тем более начального элементов обладают данными, не согласующимися с моделью.
-
4. Впервые рассчитана сумма сродства электронов к халькогенидам, что позволило вычислить вторые сродства и предсказать для теллура обе величины сродства.
-
1. Рябухин, А.Г. Энтальпия гидратации простых анионов галогенов / А.Г. Рябухин // Вестник ЮУрГУ. Серия «Химия». – 2014. – Т. 6, № 3. – С. 29-33.
-
2. Рябухин, А.Г. Эффективные ионные радиусы. Энтальпия кристаллической решетки. Энтальпия гидратации ионов: монография / А.Г. Рябухин. - Челябинск: Изд. ЮУрГУ, 2000. -115 с.
-
3. Справочник химика / под ред. Б.П. Никольского. - Л.: Химия, 1971. - Т. 1. – 1071 с.
-
4. Краткий справочник физико-химических величин / под ред. А.А. Равделя и А.М. Пономарева. – Л.: Химия, 1983. – 232 с.
-
5. Латимер, В.М. Окислительные состояния элементов и их потенциалы в водных растворах: пер. с англ. / под ред. проф. К.В. Астахова. - М.: Изд. иностр. лит., 1954. - 400 с.
-
6. Энергия разрыва химических связей. Потенциалы ионизации и сродство к электрону: спр. изд. / под ред. В.Н. Кондратьева. - М.: Наука, 1974. - 351 с.
Список литературы Энтальпия гидратации халькогенидов
- Рябухин, А.Г. Энтальпия гидратации простых анионов галогенов/А.Г. Рябухин//Вестник ЮУрГУ. Серия «Химия». -2014. -Т. 6, № 3. -С. 29-33.
- Рябухин, А.Г. Эффективные ионные радиусы. Энтальпия кристаллической решетки. Энтальпия гидратации ионов: монография/А.Г. Рябухин. -Челябинск: Изд. ЮУрГУ, 2000. -115 с.
- Справочник химика/под ред. Б.П. Никольского. -Л.: Химия, 1971. -Т. 1. -1071 с.
- Краткий справочник физико-химических величин/под ред. А.А. Равделя и А.М. Пономарева. -Л.: Химия, 1983. -232 с.
- Латимер, В.М. Окислительные состояния элементов и их потенциалы в водных растворах: пер. с англ./под ред. проф. К.В. Астахова. -М.: Изд. иностр. лит., 1954. -400 с.
- Энергия разрыва химических связей. Потенциалы ионизации и сродство к электрону: спр. изд./под ред. В.Н. Кондратьева. -М.: Наука, 1974. -351 с.


