Энтальпия гидратации простых анионов галогенов
Автор: Рябухин Александр Григорьевич
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Физическая химия
Статья в выпуске: 3 т.6, 2014 года.
Бесплатный доступ
В работе предложены модели расчета стандартной энтальпии образования простых анионов в газовой фазе и в водном растворе, стандартной энтальпии гидратации анионов. Возможности моделей проиллюстрированы на примере галид-ионов. Сделаны прогнозные вычисления термохимических характеристик для астатид-иона. Полученные величины энтальпий образования газообразных анионов позволили рассчитать для атомов галогенов корректные значения сродства к электрону.
Анион, галиды, энтальпия образования иона, энтальпия гидратации, радиус "водного" аниона, сродство к электрону
Короткий адрес: https://sciup.org/147160291
IDR: 147160291 | УДК: 544.31.031
Текст научной статьи Энтальпия гидратации простых анионов галогенов
В работе [1] предложено информативное деление элементов с учетом внешнего и предвнеш-него электронного строения простых ионов в системе «период-группа»
Второй период - начальные элементы Энач ( Li + .. F - ; 1 s 2 .1 s 2 2 s 2 p 6 ) характеризуют группу в общем: щелочные, щелочноземельные, …, халькогены, галогены.
Третий период - связующие Эсв ( Na + . Cl - ; 2 s 2 p 6 .2s 2 p 6 3s 2 p 6 ) объединяют свойства подгрупп А и В ( S6 + 2 s 2 p 6 3s 2 p 6 - Cr6 + 2 s 2 p 6 3s 2 p 6 ).
Периоды 4—7 - полные электронные аналоги Эпан в подгруппах (1А: K + . Fr + ;
2 s 2 р 6 3s 2 р 6 .5s 2 р 6 6s 2 р 6 7A: Br - . At - ; 2 s 2 p 6 3s 2 p 6 4s 2 p 6 .4s 2 p 6 5s 2 p 6 6s 2 p 6).
Такое деление позволяет предположить, что Эсв (тем более Энач ) не должны образовывать монотонных зависимостей, основанных на свойствах Э . Это количественно показано в той же пан работе на примере вычисления энтальпии образования газообразных катионов щелочных металлов. Для этого было использовано уравнение, аналогичное уравнению для расчета энтальпии кристаллической решетки путем замены межструктурного расстояния на радиус иона.
Полученные результаты открывают путь для решения более сложной задачи: зависимости некоторых свойств простых анионов от их радиусов.
В расчетах энтальпия – в кДж∙моль-1, расстояние – в ангстремах (10-8 см).
Стандартная энтальпия образования газообразных галид-ионов
В работе [1] для расчетов использовано модифицированное уравнение расчета энтальпии кристаллической решетки. Для галид-ионов используем r ° ( г -) .
A fH ° ( г - ,г ) =А Н 0 + A H вз = 83,581728 - z 2 - f 1 - 103,19053 - A M ■ кч - z ■ f 2 - ( r ° ) — 1 =
= 83,581728 - 1 - 0,7320508 - 103,19053 - 1,747565 - 6 - 1 - 0,4714045 - ( r ° ) — 1 =
= 61,186 - 510 , 0564 - ( r ° ) — 1 . (1)
Здесь z = 1; внешней структуре иона s 2 p 6 соответствует кч = 6 и АМ = 1,747565 (NaCl).
f - = f оцк - f гцк = 2 ( V3 - 1 ) 1 = 0,7320508 .
f 2 = f оцк - f гцк = 3V2 = 0,4714045 .
Исходные (справочные) данные и результаты вычислений приведены в табл. 1.
Таблица 1
Энтальпия образования газообразных галид-ионов
|
Г - |
r ° ( Г - ) , [2] |
-А f H 0( Г - ,г ) , [3, 4] |
-А Н вз , ур.(1) |
-А fH ° ( Г - ,г ) , ур.(1) |
|
|
1 |
2 |
3 |
4 |
5 |
|
|
1 |
Cl - |
1,69182 |
233,670±0,155 |
301,484 |
240,298 |
|
2 |
Br - |
1,81898 |
219,037±0,199 |
280,408 |
219,222 |
|
3 |
I - |
1,98995 |
195,035±0,176 |
256,316 |
195,130 |
|
4 |
At - |
2,05844 |
187,00±2,51 |
247,788 |
(186,602) |
Стандартная энтальпия образования галид-ионов в водном растворе
В 1923 г. индийский ученый Вазашерна из рефрактометрических измерений растворов солей щелочных и щелочноземельных металлов вычислил радиусы ионов. В 1926 г. Гольдшмидт использовал эти «водные» радиусы F- и O2- как кристаллические и составил первую систему ионных радиусов. Его многочисленные последователи, создававшие подобные системы использовали в качестве достоверно известного радиус O2- от 1,32 до 1,46. В результате в разных сис- темах приводятся разные радиусы анионов.
Любые частицы, имеющие заряд, взаимодействуют с полярными молекулами воды. В электромагнитном поле аниона они ориентируются положительным концом диполя, т. е. выступают в роли катиона с радиусом 1,383 [2]. Водные радиусы анионов можно рассчитать по уравнению [2]
rA =
rK • rD • r A r K - r D -( r A )
Простые анионы имеют внешнее электронное строение s 2 p 6, формирующее вокруг себя окта-
эдрическое окружение, которому соответствует дебаевский радиус
rD = rD (NaCl)*(1 + 7^)- fD.
Для галид-ионов rD = 31,45393 , r D ( NaCl ) = 18,159935; fD = V3 .
Например, водный радиус Cl
43,500785 - 1,69182
43,500785 - 2,862255
= 1,81098.
1,383 - 31,45393 - 1,69182 r ,- =-------------------------------т
Ci ,р-р 1,383 . 31,45393 - ( 1,69182 ) 2
Водные радиусы галид-ионов приведены в табл. 2 (колонка 3). Теперь можно вывести в аналитической форме уравнение для расчета энтальпии образования галид-ионов в водном растворе. В работе [2] получено А f H ° ( н + ,р-р, 298 ) = 406,025 ± 0,008 .
А fH 0 ( г - , p - p ) = 406,025 + А Н 0 + А Н вз =
= 406,025 + 83,581728 - 1 - 1,325825 - 103,19053 - 1,747565 - 6 - 1 - 1,160941 - r - 1 =
в
= 406,025 + 110 , 815 - 1256 , 130 - г в - 1 = 516,840 - 1256 , 130 - г в - 1 . (4)
-
f . = f гцк - f оцк = -4- I 1 + 4 I = 1,325825 ;
|
Ыз I |
"1 |
ГзТ2 I |
г1 |
|
|
f 2 = f ОЦК - f ГЦК = 4 |
- 1 |
— 2 |
+ 1 |
= 1,160941 |
|
V V |
L |
V У. |
Результаты расчетов по уравнению (4) помещены в табл. 2.
Таблица 2
Энтальпия образования галид-ионов в водном растворе
|
Г - |
r • (Г А [2] |
r в , ур. (2) |
-А f H 0 ( Г - ,р-р ) , [5] |
-А Н вз , ур. (4) |
-А f H 0 ( Г - ,р-р ) , ур. (4) |
|
|
1 |
2 |
3 |
4 |
5 |
6 |
|
|
1 |
Cl - |
1,69182 |
1,81098 |
167,080±0,088 |
693,619 |
176,779 |
|
2 |
Br - |
1,81898 |
1,96822 |
121,50±0,15 |
638,206 |
121,366 |
|
3 |
I - |
1,98995 |
2,18924 |
56,90±0,10 |
573,775 |
56,935 |
|
4 |
At - |
2,05844 |
2,28058 |
отс. |
550,794 |
33,954 |
Сравнение величин в колонках 4 и 6 показывает, что данные для полных электронных аналогов хорошо согласуются, для иона связующего элемента - отсутствие согласия ( А = +9,699). Хорошее согласие данных для Br - и I - позволило сделать предсказательное вычисление А f H ° ( At - ,р-р ) =- 33,954 .
Стандартная энтальпия гидратации галид-ионов
По определению энтальпия гидратации простого аниона
А г Н ( A2 -) =А fH ° ( A2 - ,р-р ) -А fH ° ( A z - ,г ) .
Это уравнение является проверочным для любой модели гидратации на ее адекватность. К сожалению, в справочной литературе имеется мало данных по АfH°(Az-,р -р) и полное отсутствие по АfH°(Az-,г) при z > 1, так как нет способов измерения второго и более сродства к элек- трону. Этот факт не снижает значимость уравнения (5) и аналогичных ему уравнений, например, для сложных анионов.
Уравнение для расчета энтальпии гидратации простых анионов по форме является таким же же, как для расчета энтальпии образования простых анионов в водном растворе (уравнение (4)), отличаясь только структурными коэффициентами.
А г Н ° ( г - ) = 406,025 + 83 , 581728 - 1 2 - f 1 - 103 , 19053 - 1 , 747565 - 6 - 1 - f 2 - г в - 1 =
= 406,025 + 83,581728 - 1,125 - 103 , 19053 - 1 , 747565 - 6 - 1 - 0 , 7320508 - г в - 1 ;
А г Н ° ( г -) = 500,054 - 792,0738 - г в - 1 .
f . = f ОЦК - f ЦК =
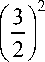
- 2 = 1,125 ;
f 2 = f ОЦК - f ГЦК = 2 ( V3 - 1 ) 2 = 0,7320508 .
Результаты вычислений и исходные данные приведены в табл. 3.
Таблица 3
Энтальпия гидратации галид-ионов
|
Г - , r ° ( Г -) , [2] |
Г в , ур. (2) |
-А f H 0 ( Г - ,р-р ) , [5] |
-А fH °(Г - ,г ) , [3, 4] |
А г Н ° ( Г -) , ур. (5) |
-А H вз , ур. (6) |
А г Н ° ( Г -) , ур. (6) |
|
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
|
1 |
Cl - 1,69182 |
1,81098 |
167,080±0,088 |
233,670±0,155 |
66,590± ±0,243 |
437,373 |
62,681 |
|
2 |
Br - 1,81898 |
1,96822 |
121,50±0,15 |
219,037±0,199 |
97,537± ±0,349 |
402,431 |
97,623 |
|
3 |
I - 1,98995 |
2,18924 |
56,90±0,10 |
195,035±0,176 |
138,135± ±0,276 |
361,803 |
138,251 |
|
4 |
At - 2,05844 |
2,28058 |
(33,954) |
187,00±2,510 |
153,046± ±2,510 |
347,312 |
152,742 |
Из сравнения величин в колонках 5 и 7 следует, что для ионов элементов полных аналогов наблюдается хорошее согласие. Согласие для At - подтверждает адекватность расчетов по уравнению (4). Для связующего элемента ( Cl - ) согласие отсутствует ( А = -3,909). Еще большая несогласованность наблюдается для иона начального элемента ( F - ), для которого А f H ° ( f - ,г ) =- 255,148 и -А f H ° ( f - ,р-р ) =- 335,35 ± 0,65 , то есть по уравнению (5) А г Н° ( f -) =- 80,202 ± 0,65. По уравнению (6) ( г в ( f -) = 1,34086) А г Н° ( f -) =- 90,667 ( А = |10,465| ). К тому же энтальпия гидратации имеет отрицательное значение в отличие от ионов остальных галогенов.
Сродство к электрону
Важнейшими характеристиками для катионов являются потенциалы ионизации, для анионов – сродство к электрону. Для измерения сродства к электрону А используются методы поверхностной ионизации и фотоотрыва. Из расчетных методов наиболее важным является использование теоретического уравнения
А fH 0 ( г - ,г ) =А fH 0 ( г0, г ) - FA - 6 , 1965 . (7)
Здесь F – постоянная Фарадея, 96485,56 Кл∙моль-1; 6,1965 – энтальпия 1 моль электронов.
Так как энтальпия образования практически для всех элементов известна из анализа температурной зависимости давления пара [4], то расчет сродства к электрону определяется только величиной энтальпии образования аниона.
Для вычисления энтальпии образования газообразных анионов галогенов было успешно использовано модифицированное уравнение кристаллической решетки (уравнение (1) и табл. 1). Исходные данные и результаты расчетов по уравнению (7) приведены в табл. 4.
Таблица 4 Сродство атомов галогенов к электрону
|
Г |
А f H ° ( Г,г ) , [4] |
-А f H 0 ( Г - ,г ) , (табл. 1) |
- ( FA + 6 , 1965 ) , ур. (7) |
А , эВ, ур. (7) |
А , эВ [4] |
|
|
1 |
2 |
3 |
4 |
5 |
6 |
|
|
1 |
Cl |
121,290±0,008 |
233,670±0,155 |
354,960±0,163 |
3,61470±0,00169 |
3,614±0,0001 |
|
2 |
Br |
111,838±0,126 |
219,037±0,199 |
330,875±0,325 |
3,36508±0,00337 |
3,37 |
|
3 |
I |
106,763±0,042 |
195,035±0,176 |
301,798±0,218 |
3,06371±0,00226 |
3,0±0,12 |
|
4 |
At |
98,847±0,209 |
187,00±2,510 |
285,847±2,719 |
2,89839±0,02818 |
(2,8±0,2) |
Сравнение величин в колонках 5 и 6 показывает их хорошее согласие, тем более что для брома это сопоставление различных данных, а для астата – полуэмпирический расчет. Это позволяет вычислять достаточно точные величины сродства к электрону.
Заключение
Установлено, что стандартная энтальпия образования простого аниона в газовой фазе и водном растворе, а также стандартная энтальпия гидратации аниона могут быть найдены по уравнениям модели расчета стандартной энтальпии образования (разрушения) кристаллической решетки. Как и в базовой модели, термохимические характеристики (энтальпия образования иона, энтальпия гидратации) являются функциями структуры, а именно – радиуса иона и структурных коэффициентов. Результаты расчетов по уравнениям моделей представлены на примере галид-ионов. Для ионов полных электронных аналогов – элементов, расположенных в 4–7 периодах Периодической системы, наблюдается практически абсолютное совпадение рассчитанных величин с известными справочными данными, что позволило предсказать термохимические характеристики для астатид-иона.
Показано, что использование уравнения модифицированной модели для расчета энтальпии образования газообразных анионов позволяет вычислить корректные величины сродства к электрону и уточнить их для полных электронных аналогов галогенов.
Список литературы Энтальпия гидратации простых анионов галогенов
- Gruba, O.N. Enthalpy of formation of the ion in the gas phase/O.N. Gruba, A.G. Ryabukhin//Abstracts of the XIX International Conference on Chemical Thermodynamics in Russia (RCCT-2013). Moscow: D. Mendeleyev UCTR, 2013. -P. 118-119.
- Рябухин, А.Г. Эффективные ионные радиусы. Энтальпия кристаллической решетки. Энтальпия гидратации ионов: монография/А.Г. Рябухин. -Челябинск: Изд. ЮУрГУ, 2000. -115 с.
- Термодинамические свойства индивидуальных веществ: справ. изд. в 4 т./под ред. В.П. Глушко. -М.:АН СССР, ВИНИТИ. -1978. -Т. I, кн. 2. -326 с.
- Энергия разрыва химических связей. Потенциалы ионизации и сродство к электрону. Спр. изд./Под ред. В.Н. Кондратьева. -М.: Наука, 1974. -351 с.
- Термодинамические свойства индивидуальных веществ: Справочное издание в 4 т./под ред. В.П. Глушко. -М.: АН СССР, ВИНИТИ. -1981. -Т. III, кн. 2. -423 с.


