Энтропия пространственно-энергетических взаимодействий
Автор: Кораблев Григорий Андреевич, Петрова Наталья Григорьевна, Кораблев Роман Григорьевич, Заиков Геннадий Ефремович
Журнал: НБИ технологии @nbi-technologies
Рубрика: Социально-экономические инновации
Статья в выпуске: 2 (9), 2013 года.
Бесплатный доступ
Аналогично представлениям термодинамики о статистической энтропии используется понятие энтропии пространственно-энергетических взаимодействий. Обсуждается многоплановость проявлений энтропии.
Термодинамическая вероятность, энтропия, статистическая термодинамика, пространственно-энергетический параметр
Короткий адрес: https://sciup.org/14968288
IDR: 14968288 | УДК: 536.7-631.152
Текст научной статьи Энтропия пространственно-энергетических взаимодействий
Понятие энтропии возникло на основе второго закона термодинамики и представлений о приведенном количестве теплоты.
В статистической термодинамике энтропия изолированной и находящейся в равновесии системы равна логарифму вероятности нахождения ее в определенном макросостоянии:
S = k lnW , (1)
где W – число доступных состояний системы или степень вырождения микросостояний; k – постоянная Больцмана.
Или:
W = e S/k,
Эти соотношения являются общими утверждениями, имеющими макроскопический харак- тер, не содержат никаких ссылок на элементы структур рассматриваемых систем и полностью не зависят от микроскопических моделей [1].
Поэтому применение и рассмотрение этих законов могут иметь большое число следствий, которые наиболее плодотворно используются статистической термодинамикой.
При любых самопроизвольных изменениях в изолированной системе энтропия всегда возрастает: D S > 0.
Смысл второго закона термодинамики сводится к следующему:
Природа стремится от состояний менее вероятных к состояниям более вероятным. Так, наиболее вероятным является равномерное распределение молекул по всему объему. С макрофизической точки зрения эти процессы заключаются в выравнивании плотности, температуры, давления и химических потенциалов, а основной характеристикой процесса является термодинамическая вероятность – W .
В реальных процессах в изолированной системе рост энтропии неизбежен – в системе нарастает беспорядок, хаос, идет понижение качества внутренней энергии.
Термодинамическая вероятность равна числу микросостояний, отвечающих данному макросостоянию.
Поскольку степень вырождения системы никак не связана с физическими особенностями систем, статистическое понятие энтропии может иметь и другие применения и проявления (кроме статистической термодинамики).
«Ясно, что из двух совершенно разных по своему физическому содержанию систем энтропия может быть одинаковой, если у них число возможных микросостояний, отвечающих одному макропараметру (неважно, какой это параметр) совпадают. Именно поэтому понятие энтропии можно использовать в самых разнообразных областях. Возрастающая самоорганизация человеческого общества ... приводит к возрастанию энтропии и беспорядка в окружающей среде, что выражается в частности к появлению громадного числа рассеянных по Земле свалок» [1].
В данном исследовании делается попытка применения понятия энтропии ко ценке степени пространственно-энергетических взаимодействий.
Пространственно-энергетический параметр
Сопоставление многочисленных закономерностей физических, химических и биологических процессов позволяет предположить, что во многих случаях выполняется принцип сложения обратных величин, объемных энергий или кинетических параметров взаимодействующих структур.
Уравнение Лагранжа для относительного движения системы двух взаимодействующих материальных точек с массами m 1 и m 2 в координате х имеет вид:
,, д U 111
mX = —, где — = —+ — (2),(2а), дx mr m 1 m 2
где U – взаимная потенциальная энергия материальных точек; m пр – приведенная масса.
Это уравнение можно привести к виду:
A U ~ A U 1 + A U 2 ’ (3)
в котором результирующая энергетическая характеристика системы взаимодействия двух материальных точек находится по принципу сложения обратных величин исходных энергий взаимодействующих подсистем.
«Электрон с массой m, движущийся около протона с массой М, эквивалентен части- це с массой: mr =
mM m + M
» [3, с. 12].
Поэтому, модифицируя уравнение (3), можно предположить, что энергия валентных орбиталей атома (ответственная за межатомные взаимодействия) может быть рассчитана [4] по принципу сложения обратных величин некоторых исходных энергетических составляющих, согласно уравнениям:
—;— + = — или — +---- (4Y5)
q 2/ r, W i n, P e P o ( WrnV )(5)
PE = P 0 , (6)
где Wi – орбитальная энергия электронов [5]; ri– орбитальный радиус i-ной орбитали [6]; q = Z*/n* – по [7, 8], ni – число электронов данной орбитали, Z*и n* – эффективный заряд ядра и эффективное главное квантовое число, r – размерные характеристики связи.
Величина РО названа пространственноэнергетическим параметром (далее – ПЭП), а величина РЭ – эффективным Р -параметром (эффективный ПЭП). Эффективный ПЭП имеет физический смысл некоторой усредненной энергии валентных электронов в атоме и является прямой характеристикой электронной плотности в атоме на данном расстоянии от ядра ( ri ).
При образовании твердого раствора и в других структурных равновесно-обменных взаимодействиях в местах соприкосновения атомов-компонентов должна устанавливаться единая электронная плотность. Этот процесс сопровождается перераспределением электронной плотности между валентными зонами обеих частиц и переходом части электронов из одних внешних сфер в соседние.
Очевидно, что при близости электронных плотностей в свободных атомах-компонентах процессы переноса между граничными атомами частиц окажутся минимальными, что будет благоприятствовать образованию новой структуры. Таким образом, задача оценки степени таких структурных взаимодействий во многих случаях сводится к сравнительной оценке электронной плотности валентных электронов в свободных атомах (на усредненных орбиталях), участвующих в процессе по уравнениям:
a =
P o / r i - PJ r'i ( p0/ r i +p ; / r i )/2
X 100%
или
Ре-Ре a = pTPS x 200%, (8)
PS + PS где Рс– структурный параметр, находится по уравнению:
11 1
--- — ----- Г +-- V + ... ,
P N P' N P"
S 1 E 2 E
где N 1 и N 2 – число однородных атомов в подсистемах.
По всем полученным данным была построена номограмма зависимости степени структурного взаимодействия ( r ) от коэффициента a , единая для широкого класса структур (см. рисунок).
Данный подход дал возможность оценить степень и направление структурных взаимодействий процессов фазообразования, изоморфизма и растворимости в многочисленных системах, в том числе в молекулярных.
Такая номограмма может быть представлена и в виде линейной логарифмической зависимости:
a — P In ( p -1) , (10)
где коэффициент b – постоянная величина для данного класса структур. От среднего значения величина b структурно может изменяться в основном только в пределах ± 5 %.
Таким образом, коэффициент a обратно пропорционален логарифму степени структур-
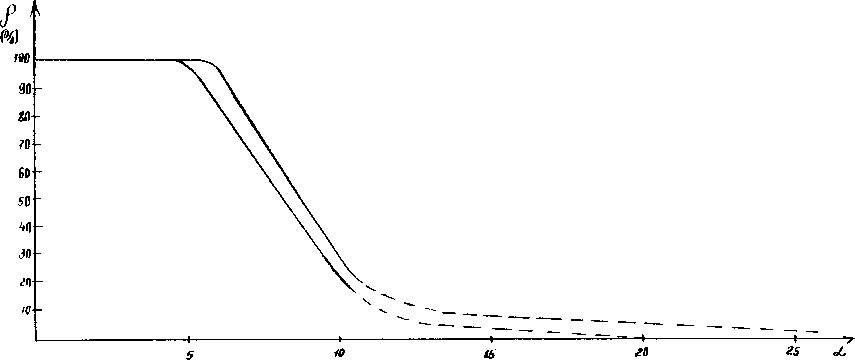
Номограмма зависимости степени структурных взаимодействий ( r ) от коэффициента a
ных взаимодействий и поэтому может характеризоваться как энтропия пространственноэнергетических взаимодействий атомно-молекулярных структур.
Действительно, чем больше r , тем более вероятно образование стабильных упорядоченных структур (например, образование твердых растворов), то есть тем меньше энтропия процесса. Но тем меньше и коэффициент a . То есть относительная разность пространственно-энергетических параметров взаимодействующих структур может быть количественной характеристикой энтропии этого процесса:
a = S = в ln ( p - 1) - (10а)
Уравнение (10) не имеет полной аналогии с уравнением (1) Больцмана, так как в данном случае сравниваются не абсолютные, а только относительные значения соответствующих характеристик взаимодействующих структур, которые могут выражаться в процентах. И это касается не только коэффициента a , но и сравнительной оценки степени структурных взаимодействий ( r ), например – процент содержания атомов данного элемента в твердом растворе, относительно общего числа атомов.
Поэтому в уравнении (10) коэффициент k = 1.
Энтропия укрупнения бизнес-структур
Основные свойства бизнес-систем, обеспечивающие их экономические преимущества, это: 1) эффективная конкуренция и 2) максимальная личная заинтересованность каждого сотрудника.
Но на различных уровнях концентрации экономики эти первопричинные особенности функционируют и проявляют себя по-разному. Наибольшая их эффективность соответствует малому бизнесу, когда число членов организации минимально, более четкая личная заинтересованность и активная конкурентная борьба за выживание. По мере укрупнения предприятий и производств, с увеличением численности персонала роль каждого сотрудника постепенно снижается, уменьшается конкурентная борьба, так как появляются новые возможности для согласованных дей- ствий разных бизнес-структур. Идет снижение качества экономических отношений в бизнесе, то есть возрастание энтропии. Более всего такой процесс характерен в моноструктурах на крупнейших предприятиях большого бизнеса (синдикаты и картели).
Понятие термодинамической вероятности как числа микросостояний, отвечающих данному макросостоянию, можно модифицировать применительно к процессам экономических взаимоотношений, которые напрямую зависят от параметров бизнес-структур [9].
За макросостояние системы можно принять данную отдельную бизнес-структуру, а за число микросостояний – число ее сотрудников ( N ), которое есть число доступных наиболее вероятных состояний данной бизнес-структуры. Таким образом, предполагается, что такое число сотрудников бизнес-структу-ры является аналогом термодинамической вероятности применительно к процессам экономических взаимоотношений в бизнесе.
Поэтому можно принять, что общая энтропия качества бизнеса состоит из двух энтропий, характеризующих: 1) уменьшение эффективности конкуренции ( S 1) и 2) уменьшение личной заинтересованности каждого сотрудника ( S 2), то есть: S = S 1 + S 2. Величина S 1 пропорциональна числу работников предприятия: S ~ N , а величина S 2 имеет сложную зависимость не только от числа работников предприятия, но и от эффективности самого управления им. Она обратно пропорциональна персональной заинтересованности каждого сотрудника. Поэтому можно принять, что S 2= 1/ g , где g – коэффициент личной заинтересованности каждого сотрудника.
По аналогии с уравнением Больцмана (1) получаем:
ГО (nA
S = ( S 1 + S 2 )~[ In— + In l — I ]~ln l — I к Y ) I Y )
или
( — )
S = kln l — I , к Y )
где k – коэффициент пропорциональности.
Здесь N показывает во сколько раз данная бизнес-структура больше эталонной структуры малого бизнеса, при которой N = 1, то есть эта величина не имеет наименования.
Для нетермодинамических систем принимаем k = 1. Поэтому:
I N S = In I —
I Y.
В таблице приведены примерные расчеты бизнес-энтропии по уравнению (11) для трех основных уровней бизнеса: малого, среднего и крупного. При этом предполагалось, что число N соответствует некоторому среднему значению из наиболее вероятных величин. Подробнее в работе [10].
При расчете коэффициента личной заинтересованности g учитывалось, что он может меняться от 1 (один сотрудник работает только сам на себя) до ноля (0), если такой работник как бесправный раб, и для наиболее крупных предприятий принималось g = 0,1 – 0,01.
Несмотря на весьма приближенную точность таких усредненных расчетов, можно сделать достаточно достоверный вывод о том, что энтропия бизнеса с укрупнением его структур резко возрастает при переходе именно от среднего к крупному бизнесу, так как снижается качество бизнес-процессов. Применение более точных исходных данных позволит получить конкретные значения энтропии бизнеса, выше которых процесс экономических отношений может выйти на критический уровень.
Сравнение номограммы (см. рисунок) с данными таблицы показывает аддитивность величин энтропии бизнеса ( S ) со значениями коэффициента пространственно-энергетических взаимодействий ( a ).
Более того, значения коэффициента a для высокой степени структурных взаимодей- ствий (до 7 %) совпадают со значениями энтропии для малого и среднего бизнеса. Такая закономерность изменения величин сохраняется и далее: для ограниченной степени структурных взаимодействий по номограмме идет резкое возрастание коэффициента a и аналогично резко возрастает величина S при переходе от среднего к крупному бизнесу.
Все это подтверждает утверждение о том, что понятие энтропии имеет множественное проявление в самых разнообразных областях исследований.
Вывод
Аналогично представлениям термодинамики о статистической энтропии можно использовать понятие энтропии пространственно-энергетических взаимодействий.
Список литературы Энтропия пространственно-энергетических взаимодействий
- Грибов, Л.А. Основы физики/Л.А. Грибов. -М.: Высш. шк., 1992. -430 с.
- Осипов, А.К. Проблемы и пути решения эффективного управления малыми предприятиями общественного питания/А.К. Осипов//Вестник Ижевской государственной сельскохозяйственной академии. -2010. -№ 1. -С. 29-34.
- Рейф, Ф. Статистическая физика/Ф. Рейф. -М.: Наука, 1972. -352 с.
- Семенова, Л.М. Качество управления производством с позиций сенергетики/Л.М. Семенова//Вестник Волгоградского государственного университета. Серия 10, Инновационная деятельность. -2012. -№ 7. -С. 120-126.
- Эйринг, Г. Квантовая химия/Г. Эйринг. -М., 1948. -528 с.
- Clementi, E. Atomic Screening constants from S.C.F. Functions, 1/E. Clementi//J. Chem. Phys. -1963. -Vol. 38, N 11. -Р. 2686-2689.
- Clementi, E. Atomic Screening constants from S.C.F. Functions, 1/E. Clementi//J. Chem. Phys. -1967. -Vol. 47, N 4. -Р. 1300-1307.
- Fischer, C.F. Average-Energy of Configuration Hartree-Fock Results for the Atoms Helium to Radon/C.F. Fischer//Atomic Data. -1972. -N 4. -Р. 301-399.
- Korablev, G.A. Spatial-Energy Principles of Complex Structures Formation/G.A. Korablev//Brill Academic Publishers and VSP. -Netherlands, 2005. -426 p.
- Waber, J.T. Orbital Radii of Atoms and lons/J.T. Waber//J.Chem. Phys. -1965. -Vol. 42, N 12. -Р. 4116 -4123.


