Эпидемиология и профилактика рака пищевода
Автор: Заридзе Д.Г.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Обзоры
Статья в выпуске: 4 т.24, 2025 года.
Бесплатный доступ
Цель исследования – анализ заболеваемости и смертности от рака пищевода (РП) в мире и России; обзор литературы, посвященной этиологии и факторам риска РП. Материал и методы. Использованы базы данных GlOBOCan, «Рак на пяти континентах» и справочники МНИОИ им. П.А. Герцена по заболеваемости и смертности от злокачественных новообразований и состоянию онкологической помощи в России; проведен систематический поиск опубликованных работ в базах данных PubMed и Cochrane library. Результаты. Для РП характерна выраженная географическая вариабельность в заболеваемости. Высокие показатели заболеваемости зарегистрированы в странах Южной и ЮгоВосточной Азии, низкие – в Европе и Северной Америке. В России заболеваемость РП низкая. Однако в некоторых регионах этот показатель в 2 раза превышает общероссийский. В мире 85 % случаев РП имеют гистологическое строение плоскоклеточного рака (ПКР) и 14 % – аденокарциномы (АК). Плоскоклеточный РП встречается чаще в странах Восточной, Южной и Центральной Азии, АК превалирует в странах Северной Америки, Западной и Северной Европы. Заболеваемость от ПКР снижается, а заболеваемость АК растет. Доказанные факторы риска ПКР – курение, потребление алкоголя, горячего чая, опия, экспозиция к дыму горения биомассы (дров) в помещении, недостаток в диете овощей и фруктов. Основной фактор риска АК – избыточная масса тела. Риск АК повышен у лиц с диагнозом гастроэзофагеального рефлюкса (ГЭР) и эзофагита Барретта (ЭБ). идентифицированы соматические мутационные сигнатуры – результат экспозиции к основным факторам риска РП: табачному дыму, потреблению алкоголя, опия. Выявлены мутации, вызванные ферментами семейства aPOBeC. Профилактические меры, направленные на снижение распространенности перечисленных факторов риска ПКР, уже привели к снижению заболеваемости ПКР. Однако сохраняется необходимость продолжения активной профилактической работы, с учетом региональных особенностей. Профилактика АК, которая должна включать контроль избыточного веса, своевременную диагностику и лечение ГЭР и ЭБ, пока не очень эффективна. Заключение. Перечисленные факторы и связанные с ними сигнатуры не объясняют выраженную географическую вариабельность в заболеваемости РП. Для поиска неизвестных канцерогенных факторов с не мутационным, а эпигенетическим механизмом действия рекомендовано проведение дальнейших молекулярно-эпидемиологических исследований.
Плоскоклеточный рак пищевода, аденокарцинома, эпидемиология, профилактика, факторы риска, мутационные сигнатуры
Короткий адрес: https://sciup.org/140312276
IDR: 140312276 | УДК: 616.329-006.6-084-036.2 | DOI: 10.21294/1814-4861-2025-24-4-99-111
Текст научной статьи Эпидемиология и профилактика рака пищевода
Рак пищевода (РП) относится к злокачественным новообразованиям (ЗНО) с неблагоприятным прогнозом. Общая популяционная 5-летняя выживаемость больных РП варьирует в пределах 5–20 %. Показатели выживаемости не претерпели значительных изменений в результате внедрения инновационных методов хирургического лечения, лекарственной и лучевой терапии. Идентифицированы факторы риска РП, однако они не объясняют выраженную географическую вариабельность в заболеваемости РП. Тем не менее научно обоснованная профилактика остается основным направлением для снижения заболеваемости и смертности от РП.
В представленном обзоре проведен анализ статистических данных по заболеваемости и смертности от плоскоклеточного рака (ПКР) и аденокарциномы (АК) пищевода в мире и России, динамики этих показателей, опубликованных литературных источников, посвященных дескриптивной эпидемиологии, факторам риска и их распространенности, особенностям мутационного профиля РП и методам первичной профилактики и скрининга РП.
Дескриптивная эпидемиология
РП занимает 11-е место в структуре заболеваемости и 7-е место в структуре смертности от злокачественных новообразований в мире. В 2022 г. зарегистрировано 511 054 новых случая РП, что составляет 2,6 % от всех диагностированных ЗНО, и
445 391 случай смерти, или 4,6 % от всех умерших от ЗНО. Стандартизованные по возрасту показатели заболеваемости (СПЗ) и смертности (СПС) РП составляют 5,0 и 4,3 на 100 000 населения соответственно. РП чаще встречается у мужчин (365 225), чем у женщин (145 829). Число заболевших и число умерших в 2,5 раза выше у мужчин, чем у женщин [1, 2].
Для РП характерна выраженная географическая вариабельность в заболеваемости и смертности. Самая высокая заболеваемость отмечена в ряде регионов Восточной и Центральной Азии, в частности, в некоторых регионах Китая, Монголии, Ирана и других стран так называемого Каспийского пояса, а именно: в районах Туркменистана и Казахстана, прилегающих к Каспийскому морю, и в Южной Африке. В Азии зарегистрировано 74,9 % всех случаев РП, в Европе – 10,5 %, Африке – 5,9 %, Северной Америке – 4,3 %, Южной Америке – 4 %. Почти половина всех случаев РП диагностирована в Китае – 43,8 % [1, 2].
В некоторых китайских регионах отмечаются самые высокие показатели заболеваемости РП в мире. Первое и второе места среди мужчин с СПЗ – 95,1 и 91,7 занимают два китайских округа – Цысянь и Яньтин; у женщин также китайские канцер-регистры занимают первые 3 места в мире с СПЗ – 58,2 (Яньтин), 55,9 (Цысянь) и 47,0 (Ланчжун). Последующие ранговые места, со значительным отрывом, у индийских, южноафриканских и иранских регистров (рис. 1, 2) [1, 2].
Китай,Цысянь China,Cixian County Китай,Яньтин China,Yanting County Индия,Мегхалая India,Meghalaya Индия,гор.Камруп India,Kamrup District Зимбабве,Хараре,афр. Zimbabwe,Harare:Afr. Япония,преф.Акита Japan,Akita Prefecture Кения, Элдорет Kenya,Eldoret РФ,рес.Коми Russia, Komi Republic РФ,Архангельск Russia,Arkhangelsk Шотландия UK,Scotland Иран,пров.Ардебиль Iran,Ardabil Province РФ,Карелия Russia, Karelia Нидерланды The Netherlands
Франция,г.Лилль France, Lille-Metropole РФ,Мурманск Russia,Murmansk ФРГ,Бремен Germany,Bremen Бразилия,Джад Brazil, Jad РФ,Псков Russia,Pskov Литва Lithuania
Беларусь Belarus РФ,Вологда Russia,Vologda Region Ирландия Ireland Корея,Чеджудо Republic of Korea,Jeju Швейцария,Тичино Switzerland, Ticino РФ,Оренбург Russia,Orenburg Латвия Latvia Бельгия Belgium США,Индиана,белые USA,Indiana:White Эстония Estonia РФ,Самара Russia,Samara РФ,Калининград Russia,Kaliningrad
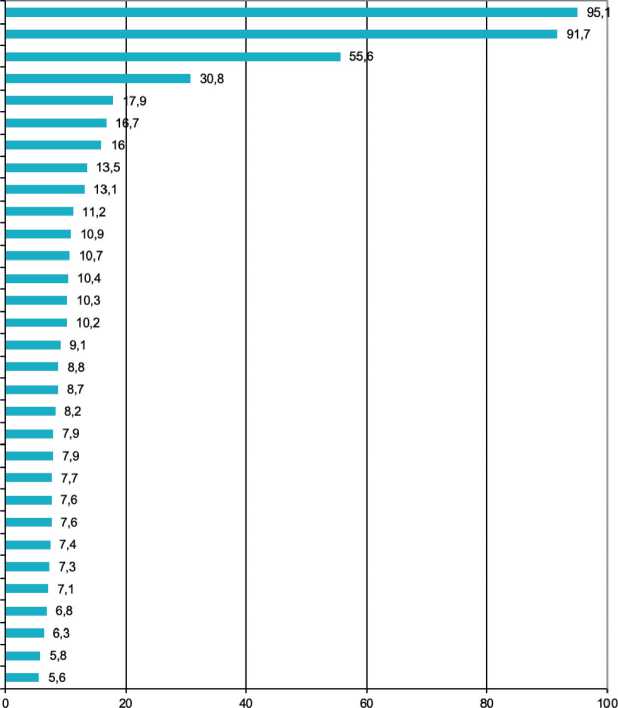
Рис. 1. Регионы мира с наибольшей заболеваемостью раком пищевода у мужчин (стандартизованные по возрасту показатели на 100 000 населения, по данным из Cancer Incidence in Five Continents, Vol. XII, 2023) [2]
Fig. 1. Regions of the world with the highest incidence of esophageal cancer in men (age-standardized (world) incidence (per 100 000).
According to Cancer Incidence in Five Continents, Vol. XII, 2023) [2]
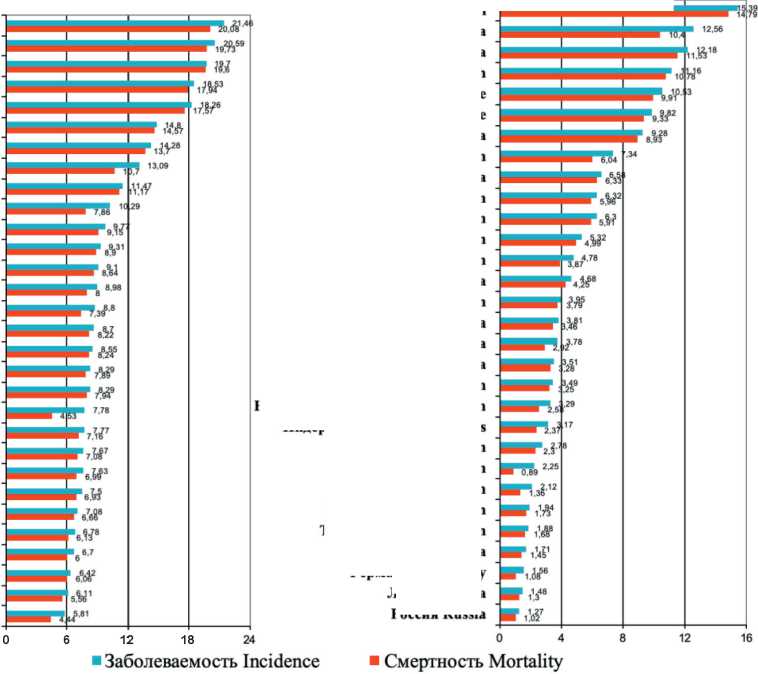
Мировая статистика смертности представлена странами, а не административными регионами внутри стран, как это было показано выше . На рис. 3 представлены заболеваемость и смертность от РП в странах мира. Очень высокие показатели зарегистрированы в Малави, Бангладеш, Монголии, ряде африканских стран и Китае. Показатели заболеваемости и смертности от РП практически одинаковы. Из общей картины выпадает Япония, где заболеваемость РП значительно выше, чем смертность. Этот феномен можно объяснить проведением в Японии скрининга РП, в результате которого растет заболеваемость и снижается смертность.
Гистологическое строение РП в большинстве случаев в мире соответствует ПКР – 85 % случаев и 14 % случаев АК. ПКР встречается чаще в странах Восточной, Южной и Центральной Азии, в то время как АК превалирует в Австралии, Канаде, США, в странах Северной и Западной Европы [3]. Преобладание ПКР над АК наиболее выражено в Китае и других регионах очень высокого риска. Например, в округе Цысянь ПКР составляет 98 %.
Аналогичная картина наблюдается в других регистрах с высокой заболеваемостью. В Индии частота ПКР среди мужчин составляет 96–98 %, в Японии ПКР диагностируется в 91–94 %. ПКР все еще преобладает среди мужского населения в странах Южной Европы: во Франции и Италии ПКР составляет от 65 до 70 %. В Восточной Европе также превалирует ПКР. В Польше он составил 85 %, а АК – 9 %; в Словакии – в 81 % случаев диагностируется ПКР, а АК – в 13 %. В то же время в Северной Европе соотношение этих двух гистологических форм среди мужчин меняется в сторону преобладания АК. Например, в Нидерландах АК составляет 70,4 %, а ПКР – 24 %. В Норвегии АК – 64 % и ПКР – 32 %. В США среди белого населения преобладает АК, а среди афроамериканцев – ПКР. Так, по статистическим данным SEER, которая включает результаты 18 канцер-регистров США, среди белых мужчин частота АК составляет 74 %, а ПКР – 20 %; а у чернокожих мужчин больше ПКР, чем АК, – 79 и 17 % соответственно. Отношение частоты двух наиболее частых гистотипов РП среди
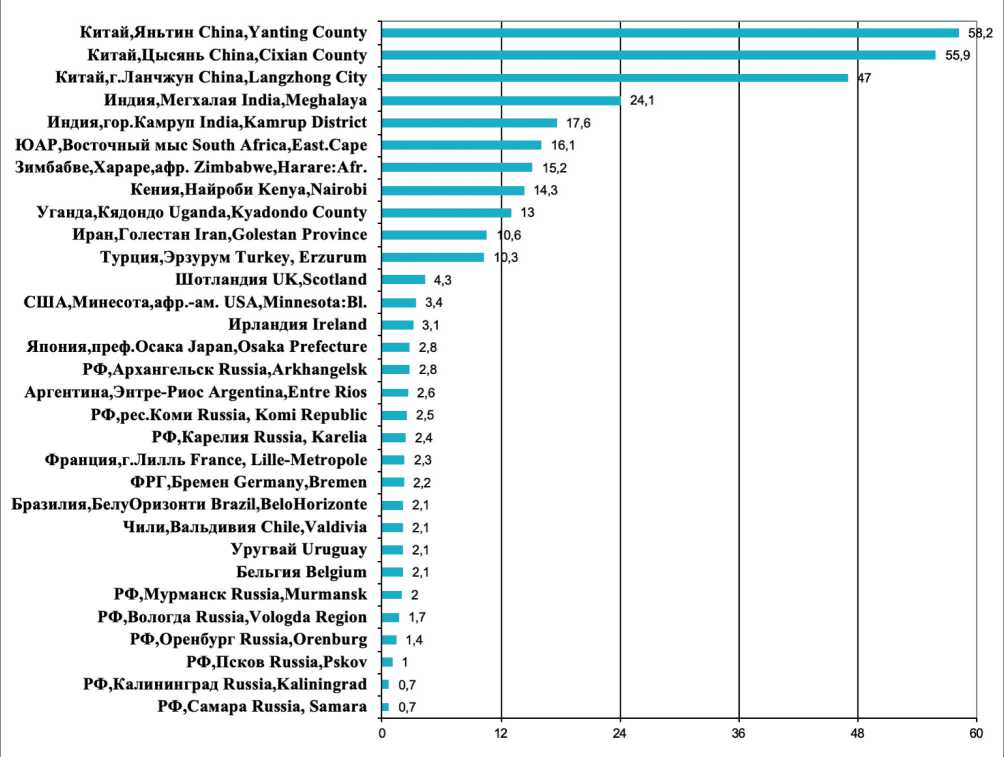
Рис. 2. Регионы мира с наибольшей заболеваемостью раком пищевода у женщин (стандартизованные по возрасту показатели на 100 000 населения, по данным из Cancer Incidence in Five Continents, Vol. XII, 2023) [2]
Fig. 2. Regions of the world with the highest incidence of esophageal cancer in women (age-standardized (world) incidence (per 100 000). According to Cancer Incidence in Five Continents, Vol. XII, 2023) [2]
женщин практически повторяет представленные данные у мужчин [4].
Анализ динамики заболеваемости, основанный не на административном делении мира, а на географических регионах, показал, что с 1990 по 2017 г. суммарный (все регионы) средний годовой процент изменения (СГПИ) СПЗ для обоих полов составил -1,21 %. Заболеваемость снизилась за счет женщин. У мужчин заболеваемость практически не изменилась. Наибольшее снижение отмечается в регионах с высокой заболеваемостью, а именно в Центральной Азии (-3,28 %) и Восточной Азии (-2 %). В Европе СГПИ варьирует от -0,35 % в Западной Европе до -0,89 % в Восточной Европе . Снижение смертности от РП в мире коррелирует с темпами снижения заболеваемости. Так, СГПИ смертности в мире у мужчин составил -1,30 %, а у женщин – -2,23 %. Наиболее высокие темпы снижения смертности отмечены в регионах с высокой заболеваемостью в Центральной Азии (-3,23 %) и Восточной Азии (-2,54 %). Темпы снижения смертности в Европе отражают темпы снижения заболеваемости [4–6].
Заболеваемость и смертность от АК, в отличие от ПКР, растет. Так, например, в США среди мужчин на фоне снижения заболеваемости ПКР растет заболеваемость АК. Причем такой тренд отмечен как у белых, так и темнокожих мужчин. У белых мужчин виден перекрест кривых АК и ПКР в 1990-х гг., что привело к изменению отношения АК к ПКР в пользу первой гистологической формы. Прогнозируется, что к 2040 г. количество диагностируемых в год случаев рака пищевода вырастет до 957 000, из которых АК составит 141 300, а ПКР – 806 000 случаев [4, 6].
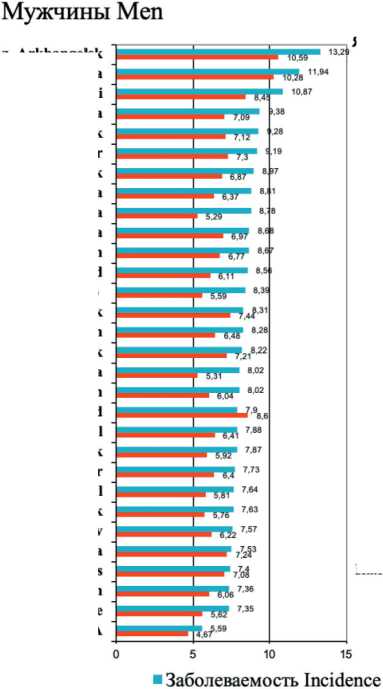
В России в 2023 г. РП заболели 7 979 человек (6 124 мужчины и 1 855 женщин) и умерли 6 606 больных (5 131 мужчина и 1 475 женщин). CП3 составляют 5,6 и 1,1, а СПС – 4,7 и 0,8 для мужчин и женщин соответственно. В некоторых регионах России, например, в Архангельской области (13,3), в республиках Бурятия (11,9), Коми (10,9), Удмуртия (9,4) заболеваемость у мужчин высокая и в 2 раза превышает показатель заболеваемости по России в целом. У женщин самые высокие по-
Мужчины Men
Малави Malawi Бангладеш Bangladesh Монголия Mongolia Уганда Uganda Танзания Tanzania Зимбабве Zimbabwe Кения Kenya Китай China
Мьянма Myanmar Нидерланды The Netherlands Туркменистан Turkmenistan Ангола Angola Замбия Zambia Литва Lithuania Великобритания United Kingdom Азербайджан Azerbaijan
Южная Африка South Africa Мозамбик Mozambique
Северная Корея North Korea Япония Japan
Ирландия Ireland Куба Cuba Беларусь Belarus Шри Ланка Sri Lanka Украина Ukraine Россия Russia Латвия Latvia Индия India
Казахстан Kazakhstan Франция France
Женщи ны Women Малави Malawi
Монголия Mongolia Кения Kenya Бангладеш Bangladesh Зимбабве Zimbabwe Мозамбик Mozambique
Уганда Uganda Азербайджан Azerbaijan Танзания Tanzania Туркменистан Turkmenistan Йемен Yemen
Пакистан Pakistan Узбекистан Uzbekistan Южная Африка South Africa Афганистан Afghanistan Шри Ланка Sri Lanka Китай China Индия India
Иран Iran Великобритания United Kingdom Нидерланды The Netherlands Казахстан Kazakhstan
Япония Japan Бельгия Belgium Киргизстан Kyrgyzstan Таджикистан Tajikistan Аргентина Argentina Германия Germany
Латвия Latvia Россия Russia
Рис. 3. Заболеваемость и смертность от рака пищевода в мире (по данным из GLOBOCAN 2022, IARC) [1] Fig. 3. Incidence and mortality from esophageal cancer in the world (according to GLOBOCAN 2022, IARC) [1]
казатели отмечены в Ямало-Ненецком автономном округе и Архангельской области (рис. 4) [7]. При ранжировании показателей заболеваемости были исключены регионы с количеством заболевших менее 10.
Корреляцию между заболеваемостью и смертностью можно продемонстрировать на примере России, т.к. мы можем сравнить региональную заболеваемость с региональной смертностью (рис. 4) за один и тот же год. В большинстве регионов соотношение заболеваемости к смертности близко к единице. В нескольких регионах регистрируемая заболеваемость ниже смертности. Этот факт указывает на недоучет при жизни больных РП.
На рис. 5 представлена динамика заболеваемости (СПЗ) в России. У мужчин СПЗ снизился с 8,8 в 1993 г. до 5,6 в 2023 г.; у женщин за этот же период заболеваемость снизилась с 1,6 до 0,91 в 2013 г. Однако за период с 2013 до 2023 г. заболе-
Женщины Women
Архангельская обл. Arkhangelsk Рес.Бурятия Buryatia Рес.Коми Komi Рес.Удмуртия Udmurtia Брянская обл. Bryansk Владимирская обл. Vladimir Курская обл. Kursk Рес.Чувашия Chuvashia Рес.Карелия Karelia Костромская обл. Kostroma Рес.Татарстан Tatarstan Нижегородская обл. Nizhnij Novgorod Ивановская обл. Ivanovo Хабаровский кр. Khabarovsk Сахалинская обл. Sakhalin Мурманская обл. Murmansk Рес.Калмыкия Kalmykia
Рес.Башкортостан Bashkortostan Новгородская обл. Novgorod Рес.Марий Эл Mari El Иркутская обл. Irkutsk Амурская обл. Amur Ярославская обл. Yaroslavl Смоленская обл. Smolensk Кировская обл. Kirov Вологодская обл. Vologda Ямало-Ненецкий а.о. Yamal-Nenets Курганская обл. Kurgan Приморский кр. Primorie РОССИЯ RUSSIA
Ямало-Ненецкий а.о. Yamal-Nenets Архангельская обл. Arkhangelsk Рес.Карелия Karelia Рес.Саха(Якутия) Sakha(Yakutia) Хабаровский кр. Khabarovsk Рес.Дагестан Dagestan Астраханская обл. Astrakhan Рес.Коми Komi Новгородская обл. Novgorod Саратовская обл. Saratov Сахалинская обл. Sakhalin Рес.Удмуртия Udmurtia Рес.Бурятия Buryatia Красноярский кр. Krasnoyarsk Пермский кр. Perm Амурская обл. Amur Иркутская обл. Irkutsk Тверская обл. Tver Вологодская обл. Vologda Приморский кр. Primorie Владимирская обл. Vladimir
Рес.Башкортостан Bashkortostan
Рес.Татарстан Tatarstan Оренбургская обл. Orenburg Мурманская обл. Murmansk Свердловская обл. Sverdlovsk Калининградская обл. Kaliningrad Ярославская обл. Yaroslavl Самарская обл. Samara РОССИЯ RUSSIA
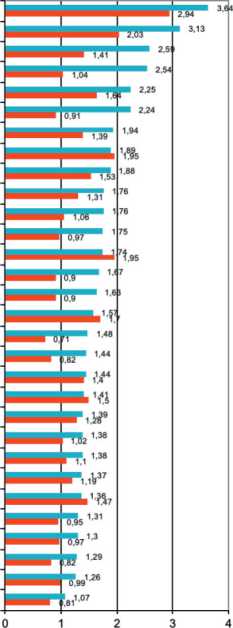
■ Смертность Mortality
Рис. 4. Регионы России с наибольшей заболеваемостью раком пищевода в 2023 г. (стандартизованные по возрасту показатели на 100 000 населения, по данным из: Каприн А.Д. с соавт., 2024 г.) [7]
Fig. 4. Regions of Russia with the highest incidence of esophageal cancer in 2023 (age-standardized (world) incidence (per 100 000). According to Kaprin A.D. et al., 2024) [7]
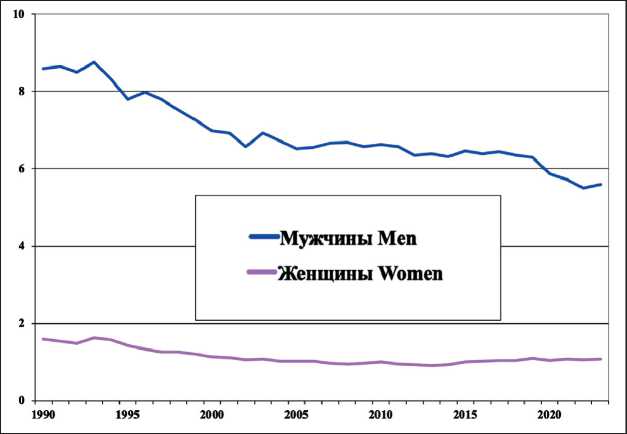
Рис. 5. Динамика заболеваемости раком пищевода в России (стандартизованные по возрасту показатели на 100 000 населения, по данным Национального канцер-регистра МНИОИ им. П.А. Герцена).
Примечание: рисунок выполнен автором Fig. 5. Time-trends in incidence of esophageal cancer in Russia (age-standardized (world) incidence (per 100 000). According to the National cancer registry of the P. Hertsen Moscow Oncology Research Institute).
Note: created by the author ваемость незначительно выросла [9]. Смертность мужчин от РП, достигнув максимального СПС в 1965 г. (13,9), резко снизилась до 7,7 в 1981 г., затем показатель незначительно вырос и достиг в 1993 г. 8,7. Далее мы наблюдаем резкое снижение смертности: СПС в 2023 г. снизился до 4,7. У женщин СПС упал с 5,4 в 1965 г. до 0,8 в 2023 г. Снижение смертности зарегистрировано и в других странах, представленных GloboCan [1], – Франции, Венгрии, Великобритании, Японии (рис. 6).
Пятилетняя выживаемость больных РП остается низкой. В развитых странах в среднем этот показатель составляет 15–20 %. В развивающихся странах, в которых до 80 % случаев РП, – пяти-
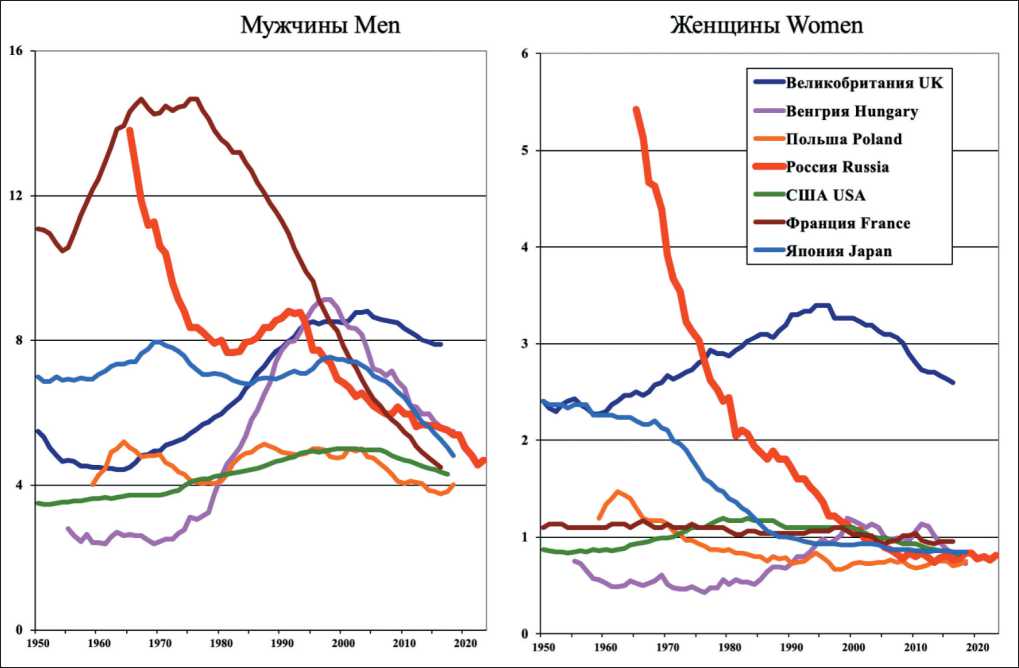
Рис. 6. Динамика смертности от рака пищевода в некоторых странах (стандартизованные по возрасту показатели на 100 000 населения, по данным из GLOBOCAN 2022, IARC) [1]
Fig. 6. Time-trends of esophageal cancer mortality in selected countries. (Age-standardized (world) mortality (per 100 000).
According to GLOBOCAN 2022, IARC) [1]
летняя выживаемость очень низкая, в среднем 5 %. Самая высокая пятилетняя выживаемость больных, диагностированных в 2010–2014 гг., зарегистрирована в Японии – 36 %. Как и при других формах рака, выживаемость больных с ранними стадиями РП достигает 80–90 %. Это в большей степени касается опухолей, выявленных при эндоскопическом скрининге в странах высокого риска РП. В США, по данным SEER, пятилетняя выживаемость больных РП составляет 20 %, с локализованным РП – 46 %, с регионарным распространением – 26 %, с отдаленными метастазами – 5 % [10]. В Англии статистика выживаемости больных РП, диагностированных в 2013–2017 гг., представлена по стадиям: I стадия – 55 % и более, II cтадия – 30 %, III–IV стадии – статистика пятилетней выживаемости отсутствует ввиду того, что количество больных РП, живущих больше 5 лет, незначительное [11].
В России РП диагностируется на I стадии в 9,4 %, II стадии – в 29,0 %, III – в 28 % и IV стадии – в 32,7 % [12]. Пятилетняя выживаемость в 2010–2014 гг. в Северо-Западном регионе составила 9 % [13]. Однолетняя выживаемость в том же регионе России – 31 % [14]. Очень высока летальность на 1-м году жизни после установления диагноза РП, которая по РФ в целом составляет 51,5 %. Однако в некоторых регионах этот показатель превышает 70 %, в Амурской области он равен 71,7 %, в Магаданской области – 75,4 %, в Курганской области – 72,0 % [12].
Факторы риска
Курение и алкоголь
Этиология РП имеет региональные особенности, а также зависит от локализации в пищеводе и гистологического типа опухоли. Основными факторами риска ПКР в развитых странах являются курение табака и потребление алкогольных напитков [15, 16]. Табачный дым содержит десятки канцерогенных веществ, включая полициклические ароматические углеводороды (ПАУ), нитрозо(а) амины, гетероциклические амины и т.д., контакт с которыми вызывает мутации в клеточных генах слизистой оболочки пищевода, а затем и их малиг-низацию [15]. Причинная связь между курением и ПКР показана практически во всех когортных эпидемиологических исследованиях: в когорте британских врачей, американских ветеранов войны, американского противоракового общества. Результаты, подтверждающие канцерогенность курения для пищевода, получены и в исследованиях случай-контроль, проведенных практически на всех континентах. Отмечена достоверная связь между интенсивностью и длительностью курения и риском РП. Отказ от курения приводит к снижению риска РП. Так, у бросивших курить более 10 лет назад относительный риск (ОР) в 3 раза ниже, чем у лиц, которые продолжают курить. У бросивших курить более 20 лет назад ОР практически равен риску никогда не куривших. Кумулятивный риск РП снижается на 60 % у курильщиков, бросивших курить в 30 лет, и на 50 % у курильщиков, отказавшихся от курения в 50 лет. Риск РП повышен не только у курильщиков сигарет, но, в меньшей степени, и у курильщиков сигар и трубки. У курильщиков сигар риск РП повышен в 4 раза, а трубки – в 8–9 раз [17].
Исследования, проведенные в России, а также в других странах Восточной и Центральной Европы, показали, что риск ПКР повышен в 7,5 раз (ОР=7,4; 95 % ДИ 4,0–13,8) у лиц, которые курили к моменту опроса. Риск был ниже у лиц, бросивших курить (ОР=2,4; 95 % ДИ 1,2–4,9). Величина относительного риска зависит от количества сигарет, выкуриваемых в день (р для тренда 0,01), и от длительности курения (р для тренда 0,01). Отказ от курения приводит к снижению риска. Достоверное снижение риска отмечается через 10–19 лет после отказа от курения (ОР=0,3; 95 % ДИ 0,13–0,72). Однако недостоверное снижение риска наблюдается уже через 2–4 года после отказа от курения (ОР=0,3; 95 % ДИ 0,09–1,2) [18].
Потребление алкоголя является канцерогенным для человека и представляет собой доказанный фактор риска ПКР, с выраженным доза-зависимым эффектом [16]. Канцерогенный эффект алкогольных напитков реализуется ацетилальдегидом, метаболитом этанола, который является доказанным канцерогеном для человека (группа 1 по классификации МАИР) [16]. Эффект воздействия курения и потребления алкоголя на риск РП имеет мультипликативный характер (р<0,01). По сравнению с лицами, курившими менее 9 сигарет и выпивавшими в день менее 40 г 40 % спиртного напитка, у мужчин, которые в день выкуривали более 30 сигарет и выпивали более 121 г водки или другого 40 % алкогольного напитка, риск повышен в 150 раз [17].
Эпидемиологическое исследование, проведенное в России и в странах Центральной и Восточной Европы, показало, что риск ПКР достоверно повышен у лиц, выпивавших в неделю 1–139 г этанола в виде водки, пива или вина (ОР=3,1; 95 % ДИ 1,1–8,6). Риск растет с увеличением количества потребляемого этанола (р для тренда <0,01) и достигает 9,8 (95 % ДИ 3,1–31,0) для лиц, выпивающих >420 г этанола в неделю. Тип алкогольного напитка (водка, пиво, вино) не влияет на риск [18].
Избыточный вес
В этиологии АК кардиального отдела пищевода, наряду с курением и алкоголем, доминирующую роль играют избыточный вес и ожирение. Избы- точный вес, особенно центральное (висцеральное) ожирение, является наиболее значительным фактором риска как эзофагита Барретта (ЭБ), так и АК. Ожирение повышает риск гастроэзофагеального рефлюкса (ГЭР) за счет увеличения внутрибрюш-ного давления, являясь в то же время компонентом метаболического синдрома, способствующего развитию ЭБ [19, 20].
Питание
Высокий риск РП связан с дефицитом в структуре питания овощей и фруктов, а соответственно, недостаточностью некоторых витаминов и других микроэлементов. Метаанализы, проведенные двумя группами исследователей, которые включали 32 исследования ПКР и 12 исследований АК, показали достоверное снижение риска ПКР на 45 % и на 25 % АК у людей с повышенным потреблением овощей и фруктов, по сравнению с пониженным их потреблением [21]. В эпидемиологических исследованиях, проведенных в западных странах, показано, что риск АК повышен у лиц с высоким потреблением красного мяса и с недостатком потребления овощей и фруктов [22]. На основании описательных эпидемиологических исследований и наблюдаемых временных тенденций в заболеваемости РП можно заключить, что полноценное питание, с адекватным содержанием всех ингредиентов, особенно овощей и фруктов, приведет, а, точнее, уже привело к снижению распространенности РП практически во всех регионах мира.
Потребление горячего чая
Получены убедительные данные, что потребление очень горячего зеленого чая – причина высокой заболеваемости РП в Иране и Китае. В то же время зеленый чай, скорее, полезен, т.к. в нем содержатся в большом количестве флавоноиды, изоцианиты, фенолы и другие вещества, которые в эксперименте ингибируют развитие РП. Канцерогенный эффект связан с термическим повреждением слизистой оболочки пищевода, приводящим к хроническому воспалению, эзофагиту [23].
Опий
Несколько исследований, проведенных в регионе высокого риска в Иране, доказали связь потребления опия с РП [24]. Это, в первую очередь, крупное проспективное когортное исследование, проведенное совместно с МАИР в Голестане (Иран), которое включало 50 000 здоровых мужчин и женщин в возрасте 40–75 лет. Через 10 лет наблюдения в когорте диагностировано 1 833 случая рака, из них 342 случая – РП. Потребление опия, независимо от типа потребления, было связано со значимым повышением риска развития всех форм рака (ОР=1,40; 95 % ДИ 1,24–1,58), ЗНО дыхательной и пищеварительной системы, в том числе и РП (ОР=1,38; 95 % ДИ 1,06–1,80). Доза-зависимый повышенный риск РП был связан с курением опия (ОР 1,79; 95 % ДИ 1,32–2,86, p=0,0046), но не с приемом его перорально. Дым и пиролизат, который образуется при курении опия, содержат десятки мутагенных и канцерогенных веществ, включая ПАУ, ароматические амины, нитрозо(а) амины и т.д. Эти вещества, поступая в организм через дыхательный или пищеварительный тракт, приводят к мутациям в клеточных генах и малиг-низации клеток. Кроме того, они могут способствовать промоции опухолевого роста, активируя ангиогенез и неоваскуляризацию опухоли.
Загрязнение воздуха помещений
Использование биомассы (дров) для обогрева помещения и приготовления пищи повышает риск РП. Опубликованы результаты эпидемиологического исследования, проведенного МАИР в Голестане (Иран), о влиянии на риск РП дыма от горения биомассы (дров) и керосина. Относительный риск РП был повышен у лиц, проживающих в домах, в которых дрова и керосин использовались как для отопления помещения, так и для приготовления пищи, по сравнению с применением газа для этих же целей. Риск РП был достоверно повышен у лиц, использующих дрова (ОР=1,89; 95 % ДИ 1,02–3,50) и керосин (ОР=1,82; 95 % ДИ 1,10–3,10), по сравнению с газом. Учитывая, что 40 % населения мира в домашних целях все еще используют дрова и керосин и что дым, образующийся в результате их горения, содержит такие канцерогенные вещества, как ПАУ, бензидин, формальдегид, значение этого фактора для профилактики РП трудно переоценить [25].
Вирус папилломы человека (ВПЧ)
Роль ВПЧ в этиологии РП окончательно не доказана. Однако, учитывая то, что ВПЧ – признанный этиологический фактор рака полости рта и глотки, его роль в развитии РП нельзя исключить. Большинство исследований, посвященных этой проблеме, проведено в Китае, в регионах как высокого, так и умеренного риска. Практически все исследования показали значимую связь между инфекцией ВПЧ и риском РП, с 2- и 3-кратным повышенным риском РП [26].
Наследственность
Описаны семейные формы АК, для которых характерно наличие двух и более кровных родственников с диагнозом АК, а также кластеры ГЭР и ЭБ в этих семьях. Подтверждением гипотезы о наследственном характере этих семейных кластеров является ранний возраст пациентов. Причиной развития наследственных форм ЗНО являются герминальные мутации с высокой пенетрацией. Один из наиболее распространенных генетических синдромов связан с мутацией гена APC. Этот синдром характеризуется очень высоким риском развития семейного полипоза и рака толстой кишки. АК крайне редко, но тем не менее бывают компонентом этого генетического синдрома. ГЭР, ЭБ и АК пищевода также описаны у больных с синдромами Гарднера и Линча, которые развиваются в результате мутации генов АPC и MMR. Описаны случаи ГЭР и ЭБ у больных семейным полипозом толстой кишки, а у 3–5 % больных АК отмечены соматические мутации MMR, гена, наследственная мутация которого ассоциирована с синдромом Линча. Для подтверждения наследственного компонента в этиологии АК необходимы новые более убедительные данные как по генам-кандидатам, так и, возможно, новым генам [27].
Мутационные сигнатуры факторов риска РП
Характерной чертой РП является значительная региональная вариабельность в заболеваемости; разница между регионами высокого и низкого риска более чем стократная. Однако этот феномен нельзя полностью объяснить влиянием известных факторов риска, включая факторы образа жизни и окружающей среды. Высказывалось предположение, что причина географической вариабельности РП – неизвестные ныне воздействия, идентификация которых наряду с эпидемиологическими исследованиями требует применения инновационных методов. В частности, определения мутационных отпечатков пальцев (сигнатур) неизвестного генеза. Для идентификации неизвестных мутационных сигнатур и связанных с ними канцерогенных (мутагенных) воздействий, приводящих к развитию РП и ответственных за межрегиональные вариации в заболеваемости РП, в рамках международной программы «Mutograph» изучен мутационный профиль 552 случаев ПКР из 8 стран, с разным уровнем заболеваемости РП. Идентифицированы известные мутации, результат экспозиции к табачному дыму, алкоголю, опию. В частности, сигнатура DBS (double base substitution – замена двух оснований) 2 (p=3,2×10-5) и ID3 (indel delition – инсерция-делеция последовательности ДНK) (p=0,017) ассоциированы с курением у больных ПКР. Выявлена также связь курения с мутацией SBS (single base substitution – замена одного основания) 2 88I и SBS4 (p=9,8×10-6). Потребление алкоголя связано с повышенной частотой сигнатур SBS16 и ID11 (p=1,8×10-3, p=0,036). Эти сигнатуры встречались эксклюзивно у пьющих индивидов и в регионах с низкой заболеваемостью РП, где потребление алкоголя – основной фактор риска. Потребление опия в иранской когорте ассоциировалось с сигнатурой SBS288J (p=9,5×10-5), частота которой зависела от длительности его потребления (trend p=3,6×10-7). Выявлены мутации, связанные с активностью (экспрессией) ферментов семейства APOBEC (аpolipoprotein B mRNA-editing enzyme, catalytic polypeptides). APOBEC – каталитические полипептиды-цитозиндезаминазы, участвующие в регуляции врожденного и адаптивного иммунитета. Однако некоторые члены семейства APOBEC (APOBEC 3) также могут дезаминировать геном хозяина, что приводит к онкогенным мутациям. Возникающие в результате мутации, в первую очередь, сигнатуры 2 и 13 встречаются во многих типах опухолей и являются наиболее распространенными мутационными признаками рака. Мутагенез, опосредованный APOBEC 3, влияет на эволюцию опухоли посредством модуляции иммунного микроокружения и индукции драйверных мутаций. Триггерами экспрессии APOBEC 3 могут быть как экзогенные, так и эндогенные факторы.
Идентифицировать новые мутационные процессы, связанные с экзогенными воздействиями, ответственные за вариабельность в заболеваемости РП, не удалось. Напротив, мутационный профиль исследованных случаев РП практически одинаков. Однако полученные результаты не исключают существование неизвестных канцерогенных факторов в регионах высокого риска РП с не мутационным, а эпигенетическим механизмом действия [28].
Состояние и гигиена полости рта
Недавно опубликованный метаанализ имеющихся литературных данных показал связь риска РП с частотой чистки зубов: риск в 2 раза повышен у людей, которые редко чистят зубы, по сравнению с теми лицами, которые чистят зубы каждый день. Риск РП также связан с потерей зубов и периодонтитом [29].
Микробиом
Несмотря на то, что исследования о влиянии микробиома полости рта и пищевода на риск РП еще на начальной стадии, уже вырисовываются некоторые тенденции. В частности, показано, что бактериальный состав в полости рта (превалирование граммотрицательных бактерий Prevotella ) и пищевода (превалирование Fusobacterium и Clostridia ), снижение бактериального многообразия в полости рта и пищевода могут быть связаны с риском развития дисплазии и ПКР [30, 31].
Предрак
Исследования, проведенные в двух регионах Казахстана с высокой заболеваемостью РП, выявили высокую частоту эзофагита (88 и 68 %) на вскрытиях больных, умерших от других причин. Хронический эзофагит был диагностирован у 608 (60 %) из 1 344 мужчин, проживающих в Нарпайском районе Самаркандской области Узбекистана, которым была проведена эзофагоскопия. Дисплазия была обнаружена у 4 % пациентов, прошедших эндоскопию [34]. Высказаны предположения о возможной роли бездымного табака в этиологии РП. В Каракалпакстане (Узбекистан) в регионе с высокой заболеваемостью РП риск эзофагита был достоверно повышен у мужчин, которые начали употреблять нас (оральная форма табака) в возрасте до 23 лет (ОР=1,48) и делали это к моменту опроса более 40 лет (ОР=1,59), чаще 12 раз в день (ОР=1,46). Риск хронического эзофагита, связанный с курением, был также повышен. Наибольший риск был отмечен у мужчин, которые начали курить в возрасте до 20 лет (ОР=2,12; 95 % ДИ 1,30–3,46), курильщиков со стажем более 30 лет (ОР=2,21; 95 % ДИ 1,28–3,83) и выкуривающих наибольшее количество пачек сигарет в год (ОР=2,47; 95 % ДИ 1,34–4,56) [17]. Эндоскопические обследования населения в регионах высокого риска в Китае также выявили высокую распространенность хронического эзофагита – 85 и 66 % соответственно. Повышению риска хронического эзофагита способствовало курение (ОР=1,48), потребление алкоголя (ОР=1,40), наличие ГЭР (ОР=1,75) [35].
Скрининг
Наибольший опыт эндоскопического скрининга накоплен в Китае. В одном из эндемичных регионов Китая 10-летнее наблюдение показало снижение на 33 % показателя кумулятивной смертности в районах, в которых проводился хромоэндоскопический скрининг с применением раствора Люголя, по сравнению с районами, в которых скрининг не проводился. Аналогичные результаты были получены в других крупных ретроспективных исследованиях, в которых оценивалась эффективность скрининга РП на основании сравнения смертности в группе скрининга и контрольной группе. Кумулятивный показатель смертности в группе, в которой проводилась хромоэндоскопия (3 311 человек), был значимо ниже, чем в контрольной группе (3 514 человек). В первой группе в течение 14 лет наблюдения от РП умерли 108 человек, в контрольной группе – 217 человек [36].
Скрининг АК направлен на раннее выявление ЭБ. Американская ассоциация гастроэнтерологов рекомендует проводить эндоскопический скрининг пациентов с симптомами ГЭР и ЭБ со следующими факторами риска: мужской пол, белый цвет кожи, возраст старше 50 лет, ожирение или избыточный вес, курение, семейный анамнез ГЭР и ЭБ. Дальнейшая тактика скрининга, т.е. частоты эндоскопических исследований, зависит от степени выраженности (grade) дисплазии и длины пораженного участка слизистой оболочки пищевода [37].
Химиопрофилактика
Витамины и металлы
Интервенционные исследования по изучению эффекта приема витаминов и металлов, в частности бета-каротина, ретинола, витамина Е, цинка, в разных комбинациях, проведенные в регионах высокого риска РП, не привели к ожидаемым результатам, т.е. к достоверному снижению заболеваемости РП. Из двух исследований влияния приема витаминов на частоту предшествующего раку хронического эзофагита и дисплазий в Китае и Узбекистане только в последнем отмечено недостоверное снижение частоты эзофагитов у лиц, получавших ретинол и витамин Е [38, 39]. Однако в дальнейшем в рандомизированных клинических исследованиях показан достоверный протектив-ный эффект приема фолиевой кислоты (витамин B9) для профилактики ПКР пищевода [40].
Аспирин и ингибиторыпротонной помпы (ИПП)
В описательных эпидемиологических исследованиях показано, что прием аспирина снижает риск РП. В двух когортных эпидемиологических исследованиях, проведенных в США, выявлено значимое снижение риска РП у лиц, принимавших аспирин. В рандомизированном клиническом исследовании высоких доз аспирина и эзомепразола, которое включало 2 557 больных с ЭБ, выявлено, что высокие дозы этих препаратов улучшают прогноз больных с ЭБ, т.е. снижают риск (увеличивают сроки развития) выраженной дисплазии, РП и смерти от РП. Кроме того, прием больших доз ИПП снижает риск (удлиняет время) общей (от всех причин) смертности. Прием аспирина снижает риск (увеличивает время) развития дисплазии Highgrade. Ингибиторы протонной помпы снижают вероятность развития ГЭР, главной причины ЭБ. В то же время у больных ЭБ ИПП ингибируют экспрессию циклогоксидазы-2 и предупреждают клональную экспансию клеток ЭБ, чем предупреждают развитие рака. В целом, данные литературы указывают на эффективность применения препаратов, снижающих кислотность, для снижения риска прогрессирования ЭБ в РП [41].
Статины
Профилактический эффект статинов против рака связан с их способностью ингибировать пролиферацию клеток и ангиогенез, а также усиливать апоптоз. Наблюдательные эпидемиологические исследования показали, что прием статинов больными с диагнозом ЭБ снижает риск развития АК. Метаанализ исследований, посвященных этой проблеме, выявил, что прием статинов снижает риск развития РП (ОР=0,72; 95 % ДИ 0,60–0,86). Наиболее выраженный протективный эффект приема статинов получен у больных с диагнозом ЭБ. Риск развития АК был снижен на 41 % (ОР=0,59; 95 % ДИ 0,45–0,78) [42].
Заключение
Рак пищевода – заболевание, которое можно предотвратить. В результате эпидемиологических исследований получены убедительные данные о причинах развития как ПКР, так и АК. Профилактические меры, направленные на снижение распространенности факторов риска РП, в частности, контроль курения табака и потребления алкоголя в Европе и Северной Америке и увеличение потребления свежих овощей и фруктов в Китае и других регионах высокого риска, уже привели к снижению заболеваемости ПКР. Однако сохраняется необходимость продолжения активной профилактической работы с учетом региональных особенностей. Несмотря на то, что имеются убедительные данные о факторах риска АК и, соответственно, профилактики АК, заболеваемость этой формой РП растет. В связи с этим необходимы профилактические меры, включающие контроль избыточного веса и ожирения, повышение физической активности, а также своевременную диагностику и лечение ГЭР и ЭБ. Рекомендуется проведение эндоскопического скрининга ПКР в регионах повышенного риска и АК у пациентов с ГЭР и ЭБ. Известные факторы риска и связанные с ними сигнатуры не объясняют выраженную географическую вариабельность заболеваемости РП. В связи с этим для поиска неизвестных канцерогенных факторов с не мутационным, а эпигенетическим механизмом действия рекомендовано проведение дальнейших молекулярно-эпидемиологических исследований.


