Эпидемиология эндокринных иммуноопосредованных нежелательных явлений, предикторы их развития и связь с исходами злокачественных опухолей
Автор: Кожевников А.А., Мкртумян А.М., Жукова Л.Г., Гречухина К.С., Феоктистова П.С., Филоненко Д.А., Польшина Н.И., Волкова Е.И., Рустамова И.И., Коляго Е.М., Пасечнюк О.С., Смолин С.А., Воронцова К.А., Зарьянов Д.А., Ибрагимова Т.М., Сухова М.В., Оганесян Л.В.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Оригинальные исследования
Статья в выпуске: 4 т.15, 2025 года.
Бесплатный доступ
Ингибиторы иммунных контрольных точек (ИИКТ) широко применяются в лечении злокачественных опухолей (ЗО) в виде отдельного варианта терапии, или в комбинации с химиотерапией, или тирозин киназными ингибиторами (ТКИ). Эндокринные иммуноопосредованные нежелательные явления (эИОНЯ) являются перспективным маркером эффективности ИИКТ и выживаемости пациентов благодаря их частоте, раннему развитию, четким критериям диагностики. Цель исследования: Провести эпидемиологический анализ развития эИОНЯ, выявить предикторы их возникновения и оценить их влияние на исходы ЗО. Материалы и методы исследования: В ретроспективное исследование были включены совершеннолетние пациенты с солидными ЗО, получившие первое введение ИИКТ совместно с химиотерапией, или c ТКИ, или без них в ГБУЗ МКНЦ им. А. С. Логинова с 01.06.2016 г. по 31.12.2022 г. Общая выживаемость (ОВ) пациентов была прослежена до 01.02.2024 г. Результаты считались значимыми при p < 0,05. Результаты: В исследование было включено 214 участников. Средний возраст — 62,6 лет (от 32 лет до 91 года). эИОНЯ были зарегистрированы у 45,3 % участников, в том числе у 6,5 % — 2 вида эИОНЯ. В 25,7 % выявлялся первичный гипотиреоз, 7,9 % — тиреотоксикоз, 7,5 % — тиреоидит, 7,5 % — вторичная надпочечниковая недостаточность, 1,4 % — ИИКТ индуцированный сахарный диабет, у 1 пациента — вторичный гипотиреоз. 64,2 % эИОНЯ было выявлено в первые 26 нед. после начала терапии ИИКТ. Развитие эИОНЯ коррелировало с лучшей 1 летней OВ (11,52 мес. против 10,85 мес., log rank p = 0,027), особенно среди пациентов с тиреоидными осложнениями (11,6 мес. против 10,82 мес., log rank p = 0,009). В подгруппах участников, не принимавших ТКИ, был на 44 % выше шанс достижения стабилизации (immune stable disease (iSD), р = 0,04) и на 45 % — клинической пользы (clinical benefit rate (CBR), р = 0,03). эИОНЯ чаще развивались при сопутствующем приеме препаратов инкретинового ряда, блокаторов медленных кальциевых каналов и антигистаминных средств, и реже — при производном отношении нейтрофилов к лейкоцитам (derived neutrophil tolymphocyte ratio, dNLR)) ≥ 3 исходно и перед вторым введением ИИКТ и dNLR - 2,2 перед вторым введением ИИКТ. эИОНЯ ≥ 2 степени в 2,09 раза чаще регистрировались у пациентов ≥ 60 лет. Комбинация ИИКТ и ТКИ повышает риск развития первичного гипотиреоза в 2,3 раза (р = 0,035). Заключение: Результаты исследования свидетельствуют о частой встречаемости эИОНЯ. Определены возможные факторы риска их развития. Требуется подтверждение данных в проспективных исследованиях.
Иммуноопосредованые нежелательные явления, ингибиторы иммунных контрольных точек, эндокринология, гипотиреоз, тиреоидит, тиреотоксикоз, надпочечниковая недостаточность, гипофизит, сахарный диабет, ниволумаб, ипилимумаб, атезолизумаб, пембролизумаб, пролголимаб
Короткий адрес: https://sciup.org/140313472
IDR: 140313472 | DOI: 10.18027/2224-5057-2025-060
Текст научной статьи Эпидемиология эндокринных иммуноопосредованных нежелательных явлений, предикторы их развития и связь с исходами злокачественных опухолей
В России растет использование ингибиторов иммунных контрольных точек (ИИКТ) у пациентов со злокачественными новообразованиями (ЗО). В связи с этим можно ожидать роста и частоты иммуноопосредованных нежелательных явлений (ИОНЯ). В реальной клинической практике они представляют интерес по двум причинам. С одной стороны, ИОНЯ ухудшают качество жизни пациентов, требуют дополнительных диагностических и лечебных вмеша- тельств, и, к сожалению, отмены эффективного, а иногда и просто единственного варианта терапии. С другой стороны — ИОНЯ могут быть индикатором эффективности противоопухолевого иммунного ответа, ассоциируясь с лучшей общей выживаемостью (ОВ) и выживаемостью без прогрессирования (ВБП).
Эндокринные ИОНЯ (эИОНЯ) занимают особое место в структуре осложнений терапии ИИКТ. Во-первых, они обладают хорошей прогностической ценностью в плане определения исхода ЗО согласно данным систематиче- ского обзора с метаанализом [1]. Во-вторых, эИОНЯ возникают одними из первых среди прочих ИОНЯ и занимают второе место по встречаемости (после кожных токсических реакций), что может дать им преимущество в качестве раннего предиктора эффекта иммунотерапии [2,3]. В-третьих, большинство эИОНЯ имеют хроническое, неопределенно долгое течение [4]. Последний пункт важен с точки зрения своевременной заместительной терапии, которая улучшит качество жизни пациента и позволит ему, по возможности, сохранить привычную повседневную активность.
Цель исследования: провести эпидемиологический анализ эИОНЯ, выявить предикторы их развития и оценить их влияние на выживаемость пациентов.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Дизайн исследования и участники
Данная работа представляет собой ретроспективное когортное одноцентровое исследование. В ходе него была проанализирована медицинская документация пациентов, которым первое введение ИИКТ было осуществлено в ГБУЗ МКНЦ имени А.С. Логинова ДЗМ с 1 июня 2016 г. по 31 декабря 2022 г. В анализ были включены пациенты, соответствующие следующим критериям включения:
-
1. Совершеннолетние пациенты обоих полов.
-
2. Введение любого ИИКТ: ингибиторов ассоциированного с цитотоксическими Т-лимфоцитами антигена-4 (анти-CTLA-4) — ипилимумаба; ингибиторов рецептора программируемой смерти — 1 (анти-PD-1) — ниволумаба, пембролизумаба, пролголимаба; ингибиторов лиганда-1 к рецептору программируемой смерти — 1 (анти-PD-L1) — атезолизумаба; комбинации ипилимумаба и ниволумаба.
-
3. ИИКТ был введен участнику впервые в комбинации с другими химиопрепаратами, или тирозин-киназным ингибитором (ТКИ), или без них.
-
4. Назначение ИИКТ по поводу солидного ЗО.
-
5. Наличие хотя бы однократного обследования функции эндокринной системы после 1-го введения ИИКТ, включающее анализ крови на глюкозу, тиреотропный гормон (ТТГ), свободный трийодтиронин (Т3) и свободный тироксин (Т4), а также кортизол и адренокортикотропный гормон (АКТГ) утром.
-
2. Некомпенсированная или медикаментозно компенсированная дисфункция щитовидной железы, гипофиза, надпочечников к моменту первого введения ИИКТ.
-
3. Наличие сахарного диабета (СД) 1 типа, панкреатогенного СД, СД, индуцированного лекарственными или
- химиотерапевтическими средствами, иммунологически опосредованного СД.
-
4. Введение ИИКТ по поводу онкогематологического заболевания.
-
5. Введение ИИКТ ранее до первого назначения ИИКТ в рамках исследования.
Пациент не мог быть включен в исследование, если он соответствовал хотя бы одному критерию невключения: 1. Деструкция эндокринного органа (из-за любой причины, в том числе хирургического вмешательства, лучевой терапии, метастазирования, травмы, кровоизлияния, болезней накопления, агенезии и дисгине-зии) в анамнезе.
Представляющие интерес исходы
В качестве эИОНЯ мы рассматривали развитие необъяснимых иными объективными причинами:
-
1. Дисфункции щитовидной железы: первичного тиреотоксикоза (установленный на основании хотя бы однократного снижения ТТГ с последующей нормализацией его уровня в сочетании со сниженным или нормальным уровнем свободных Т3 и Т4), первичного гипотиреоза (хотя бы однократное повышение ТТГ выше верхней границы референсного интервала с нормальным или сниженным уровнем свободного Т4), тиреоидита (дисфункции щитовидной железы с развитием транзиторной тиреотоксической фазы, переходящей в гипотиреоидную фазу), а также комбинированные исходы — развитие любого из вышеперечисленных тиреоидных осложнений (тиреоидное эИОНЯ) или развитие тиреоидита или гипотиреоза (вероятный тиреоидит). Последнюю конечную точку мы оценивали из-за пациентов, у которых нарушение функции щитовидной железы могло быть обнаружено только в гипотиреоидной фазе тиреоидита, и такие случаи могли ошибочно классифицироваться как первичный гипотиреоз.
-
2. Дисфункции гипофиза (гипофизита): вторичной надпочечниковой недостаточности (2-НН), подтверждающейся снижением уровня кортизола в сочетании с неадекватно низким уровнем АКТГ; вторичного гипотиреоза (характеризующегося снижением уровня свободного Т4 в сочетании со снижением или нахождением по нижней границе нормы уровня ТТГ); пангипопитуитаризма (множественного дефицита гормонов гипофиза).
-
3. Первичную надпочечниковую недостаточность (характеризующуюся снижением уровня кортизола и повышением уровня АКТГ в крови утром).
-
4. ИИКТ-индуцированного сахарного диабета (ИИСД), подтвержденного дважды зафиксированной, впервые выявленной гипергликемией натощак ≥ 7,0 ммоль/л и снижением уровня С-пептида.
Мы также анализировали время от первого введения ИИКТ до развития (первого упоминания/выявления) эИОНЯ и оценивали степень их тяжести по рекоменда циям Американского общества клинической онкологии (ASCO) от 2021 г. [5]. В ходе исследования учитывалось число случаев развития сахарного диабета (СД) 2 типа и предиабета в рамках поиска новых гипотез, но мы не классифицировали их как эИОНЯ.
С целью поиска возможных предикторов возникновения эИОНЯ мы анализировали данные:
-
1) демографические: возраст на момент первого введения ИИКТ, пол;
-
2) анамнеза: длительность течения ЗО, наличие первично-множественного злокачественного образования (ПМЗО), назначение лечения по первично выявленному ЗО или его рецидиву/прогрессированию, стадия ЗО, проведение лучевого и/или хирургического лечения ЗО до первого введения ИИКТ, наличие узлового зоба, нарушений углеводного обмена, прием сопутствующих антигипертензивных, гиполипидемических, сахароснижающих, антигистаминных препаратов, глюкокортикостероидов (ГКС);
-
3) режима проводимой терапии: стартовая доза ИИКТ в расчете на кг массы тела; монотерапия, или комбинация ИИКТ с другими ИИКТ, и/или иными химиопрепаратами или ТКИ; число прерываний лечения ИИКТ; наличие сопутствующей ИИКТ химиотерапии; группа химиотерапевтического препарата или вариант ТКИ, применявшегося за ≤ 12 нед. до начала лечения ИИКТ и при комбинации с ИИКТ;
-
4) физикальных данных: индекс массы тела, наличие ожирения;
-
5) лабораторных данных перед первым и перед вторым введениями ИИКТ: отношения абсолютного числа нейтрофилов к абсолютному числу лимфоцитов (neutrophil-to-lymphocyte ratio, NLR) < 3; производного отношения нейтрофилов к лимфоцитам (derived NLR, dNLR, рассчитанного как отношение абсолютного числа нейтрофилов к разнице между числом лейкоцитов и абсолютным числом нейтрофилов) > 2,2 и ≥ 3; отношения тромбоцитов к абсолютному числу лимфоцитов (platelets-to-lymphocyte ratio, PLR) ≥ 180; уровень эозинофилов < 0,24 тыс./мкл); относительный уровень эозинофилов перед вторым введением ИИКТ > 3,2%. Мы также анализировали эффективность проводимого лечения с ИИКТ в соответствии с классификацией оценок ответов патологического процесса на иммунотерапию iRECIST 2017 г. [6], в том числе по критериям: иммунный полный ответ (immune complete response, iCR), иммунный частичный ответ (immune partial response, iPR), иммунная стабилизация заболевания (immune stable disease, iSD), иммунное неподтвержденное прогрессирование (immune unconfirmed progressive disease, iUPD), иммунное подтвержденное прогрессирование (immune confirmed progressive disease, iCPD), иммунный наилучший ответ за все лечение (immune best overall response, iBOR). Кроме того, мы изучали частоту клинической пользы — clinical benefit rate (CBR), оцененную как долю пациентов, достигших iCR, iPR или ≥ 6 мес. iSD [7].
Статистический анализ
Статистическая обработка данных была завершена 7 февраля 2024 г. Количественные показатели проверялись на предмет соответствия нормальному распределению по критерию Шапиро-Уилка (при менее 50 человек в исследуемых группах) или критерию Колмогорова-Смирнова (при числе исследуемых участников более 50 в группах сравнения), а также по показателям эксцесса и асимметрии. При описании количественных показателей, распределенных равномерно, использовалось среднее арифметическое с границами 95% доверительного интервала (ДИ). Количественные параметры с ненормальным распределением были описаны медианой и межквартильным размахом (МКР), представляющего собой границы 1 и 3 квартилей. Номинальные данные указывались в виде процентов и долей.
Сравнение средних количественных величин, распределенных нормально в группах сравнения, проводилось с помощью критерия Стьюдента (t-тест). При ненормальном распределении количественных величин в сравниваемых группах использовался U-критерий Манна-Уитни. Если рассчитанные t-критерий или U-критерий оказывались равными или были меньше критического значения при заданном уровне значимости, мы признавали различие статистически достоверным.
Сравнение номинальных данных проводилось по методу χ 2 Пирсона. Значение критерия χ 2 сравнивалось с критическими значениями для (r–1) × (c–1) числа степеней свободы. Если χ 2 -критерий превышал критическое значение, мы делали вывод о наличии статистически значимой связи между изучаемым фактором риска и исходом при соответствующем уровне значимости. В тех случаях, когда число ожидаемых наблюдений в любой из ячеек четырехпольной таблицы было менее 5, для оценки статистической значимости использовался точный критерий Фишера (Р). Значение Р менее 0,05 свидетельствовало о наличии статистически значимой связи изучаемого фактора риска и исхода. Расчет относительного риска (ОР) проводился для оценки количественной меры эффекта при сравнении относительных показателей. Для переноса полученного результата на генеральную выборку мы указывали границы 95% ДИ для ОР. Значимость полученной взаимосвязи признавалась статистически значимой в случае нахождения 95% ДИ за пределами границы отсутствия эффекта, принимаемой за 1.
В качестве показателя тесноты связи между нормально распределенными количественными данными мы использовали коэффициент корреляции Пирсона (r). Если же распределение количественных данных отличалось от нормального, для оценки тесноты связи применялся критерий Спирмена (ρ). Оценка статистической значимости корреляции осуществлялась с помощью t-критерия. Если рассчитанное значение t-критерия было больше критического при заданном числе степеней свободы и уровне значимости, то корреляционная связь считалась достоверной. Значения коэффициентов корреляции r и ρ интерпретировались в соответствии со шкалой Чеддока.
Мы также провели анализ выживаемости пациентов по состоянию на 01 февраля 2024 г. по методу Каплана-Мейера. ОВ была определена как временной интервал от даты первого введения ИИКТ до даты смерти участника. Пациенты, которые были живы или их состояние было неизвестно в вышеуказанный день, были зацензурированы. Оценка нулевой гипотезы о равенстве ОВ в интересуемых группах участников осуществлялась с помощью критериев log-rank, Breslow и Tarone-Ware.
Все статистические тесты были двусторонними. Результаты признавались статистически значимыми при уровне значимости р < 0,05. Статистическая обработка данных проводилась при помощи программного обеспечения IBM SPSS Statistics версии 26.0.0.0 (разработчик — IBM Corporation).
РЕЗУЛЬТАТЫ
Данные участников, основного ЗО и лечения
В ходе исследования была изучена медицинская документация 443 пациентов. Из них были отобраны данные 214 участников (46,3% — женщины, 53,7% — мужчины). Причиной невключения большинства пациентов (83%) стало отсутствие хотя бы однократного определения уровня гормонов (ТТГ, свободные Т3 и Т4, кортизола) после первого введения ИИКТ или лишь однократный исходный осмотр. Медиана возраста составила 62,6 лет (от 32 лет до 91 года), при этом пациенты распределились по возрастным группам следующим образом: 7,4% — 32–44 года, 29 % — 45–59 лет, 45,8% — 60–74 года, 17,8 % — старше 75 лет. В среднем, оценка функции эндокринных органов проводилась в течение 47,6 недель.
Большинство пациентов получали терапию ИИКТ по поводу меланомы (36%), немелкоклеточного рака легкого (НМРЛ, 24%), почечно-клеточного рака (ПКР, 20 %), колоректального рака (КРР, 5%), рака молочной железы (РМЖ, 5%), мелкоклеточного рака легких (МРЛ, 3%). У оставшихся 7% были выявлены иные виды злокаче- ственных опухолей. У 16,8% участников было установлено ПМЗО. У 48% пациентов была определена IV-я стадия ЗО, у 21% — III-я, у 19% — II-я, 7% — I-я. У 5% информация о стадии заболевания отсутствовала.
Из ИИКТ 6% пациентов получали пролголимаб, 12% — атезолизумаб, 18% — ниволумаб, 32% — пембролизумаб и еще 32% — комбинацию ипилимумаба и ниволумаба. 26,2 % участникам за ≤ 12 недель до первого введения ИИКТ проводилась терапия иными противоопухолевыми препаратами, 35% получали комбинированную иммунотерапию. ИИКТ в комбинации с ТКИ получали 5,1% участников исследования в том числе 8 пациентов (4,2%) — с акситинибом, 2 (0,9%) — с ленватинибом. Еще 5 (2,34%) пациентам за ≤ 12 нед. до первого введения ИИКТ осуществлялась терапия интерфероном-альфа (ИФН-а).
Характеристика эИОНЯ эИОНЯ были выявлены у 45,3% участников исследования. У 14 пациентов (6,5%) развилось 2 разных эИОНЯ. У большинства эИОНЯ была 2 и 1 степень выраженности (57,03% и 35,94%, соответственно), 3-я или 4-я степень отмечены в единичных случаях (4,69% и 2,34% соответственно). Ни одного летального случая, связанного с эИОНЯ, зарегистрировано не было.
Ожидаемо, риск развития эИОНЯ был ниже в группе пациентов, получавших анти-PD-1/PD-L1 без комбинации с анти-CTLA-4, по сравнению с теми, кому была назначено сочетанное введение данных групп препаратов (ипилиму-
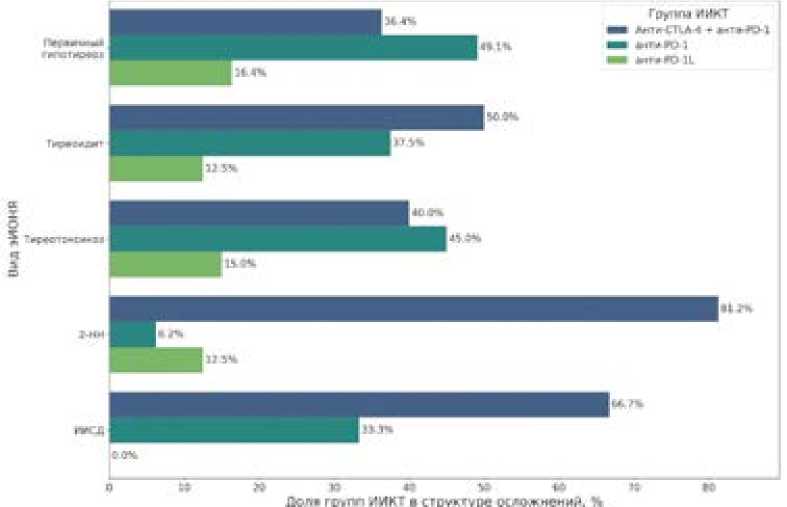
Рисунок 1. Частота развития эндокринных иммуноопосредованных нежелательных явлений в зависимости от варианта иммунотерапии (%)
-
Figure 1. Frequency of endocrine immune-related adverse events depending on the immunotherapy option (%)
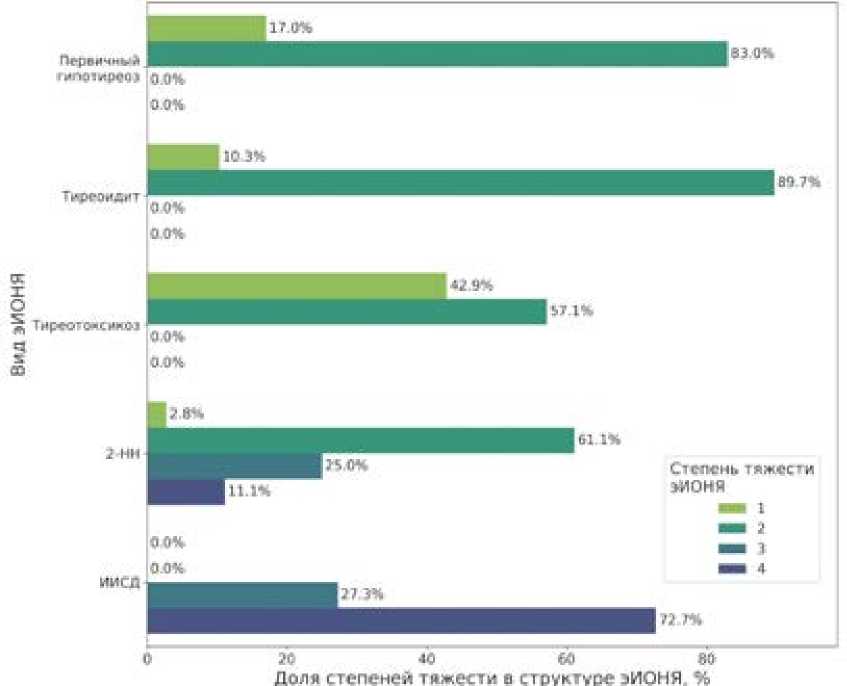
Рисунок 2. Распределение эИОНЯ по степени тяжести
-
Figure 2. Distribution of e-IRAE by severity
маба + ниволумаба): ОР = 0,63; 95% ДИ: 0,48–0,83 (χ 2 = 8,70; р = 0,003).
Наиболее часто у пациентов фиксировалась дисфункция щитовидной железы: гипотиреоз — у каждого четвертого (25,7%), тиреотоксикоз — у 7,9% и тиреоидит — у 7,5%. У 7,5 % участников была выявлена вторичная надпочечниковая недостаточность, еще у 3 участников (1,4%) — ИИСД. У 1 пациента был зафиксирован вторичный гипотиреоз. В ходе лечения ИИКТ у 7 человек (3,3%) развился сахарный диабет (СД) 2 типа, еще у 7 — нарушенная гликемия натощак.
Распределение случаев эИОНЯ при использовании разных режимов терапии ИИКТ приведено на рисунке 1.
Поражение щитовидной железы протекало преимущественно с 1-й и 2-й степенью выраженности (рис. 2). В то же время 2-НН манифестировала чаще всего с 2-й и 3-й степенью выраженности, а ИИСД — с 4-й и 3-ей (рис. 2). Единственный случай вторичного гипотиреоза протекал с 2-й степенью тяжести.
После первой инфузии ИИКТ раньше всего обнаруживались тиреоидит (медиана времени обнаружения 7,3 нед., МКР: 4,6–17,2 нед.) и тиреотоксикоз (медиана 9,4 нед., МКР: 8,0–16,9 нед.). Несколько позже выявлялся первичный гипотиреоз (медиана 20,9 нед., МКР: 13,3–34,6 нед.)
и 2-НН (медиана 21,6 нед., МКР: 15,2–39,5 нед.). ИИСД развился у трех пациентов через 12,3 нед., 54,0 нед., 63,7 нед., вторичный гипотиреоз — через 81,3 нед. Наглядно время обнаружения эндокринных осложнений приведено на рисунке 3.
-
64,2% случаев эИОНЯ были выявлены в первые 26 нед. после первого введения ИИКТ, 87,2% — в первые 48 нед. Медиана обнаружения гипотиреоза не отличалась между пациентами, принимающими ТКИ, и нет (21,71 нед. и 20,0 нед. соответственно, р = 0,53), равно как и вероятного тиреоидита (21,71 нед. против 17 нед. соответственно, р = 0,91).
ОТДАЛЕННЫЕ РЕЗУЛЬТАТЫ ТЕРАПИИ
Медиана ОВ с момента первого введения ИИКТ составила 35,7 мес. (95% ДИ: 24,5–46,8 мес.). 90 участников умерли к 01 февраля 2024 г., 100 участников были живы на дату среза данных, еще 24 пациента — выпали из наблюдения.
Развитие эИОНЯ статистически значимо ассоциировалось с лучшей 1-летней ОВ (11,52 мес. против 10,85 мес., log-rank p = 0,027) (рис. 4)., преимущественно среди пациентов с любым из тиреоидных осложнений (11,6 мес.
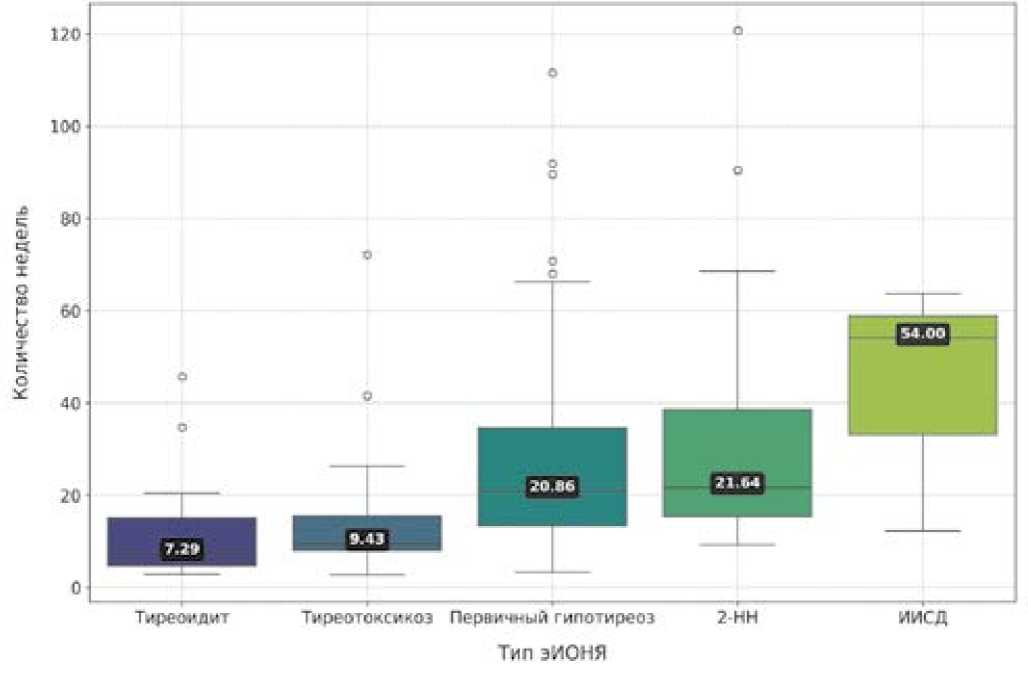
Рисунок 3. Время манифестации основных эИОНЯ в исследовании
Figure 3. Time of manifestation of the main Endocrine immune-related adverse events in the study
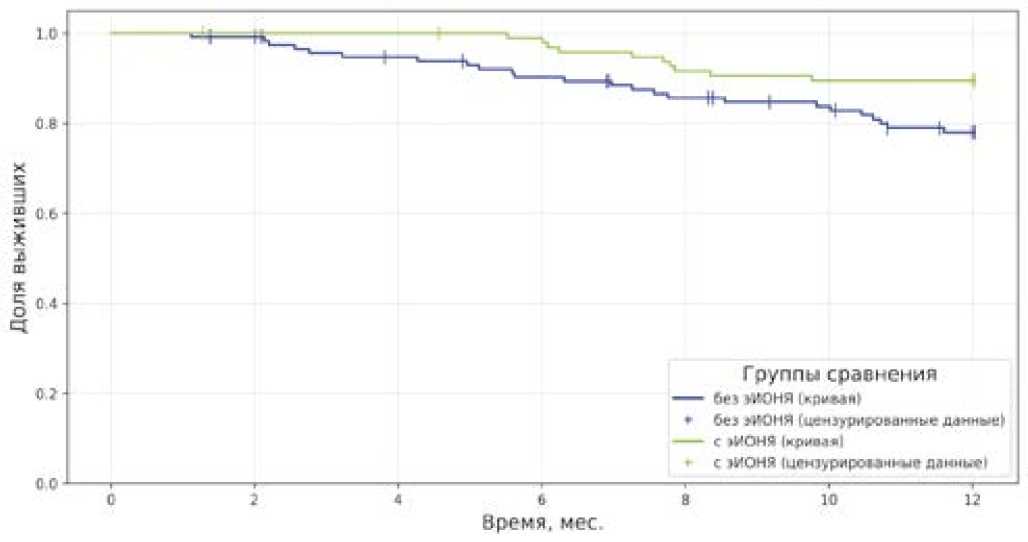
Рисунок 4. Сравнение 1-летней общей выживаемости в группах с наличием и отсутствием эндокринных иммуноопосредованных нежелательных явлений
Figure 4. Comparison of 1-year overall survival in groups with and without endocrine immune-related adverse events
против 10,82 мес., log-rank p = 0,009). Однако 2-летняя ОВ статистически значимо не отличалась у пациентов с эИОНЯ и без них (20,95 мес. против 19,28 мес., log-rank p = 0,226).
Мы не обнаружили связи между 1- и 2-летней ОВ и развитием гипотиреоза, тиреотоксикоза, тиреоидита, 2-НН и ИИСД. Степень эИОНЯ не оказывала влияния на общую выживаемость, за исключением тиреоидных осложнений: у пациентов с тиреоидным эИОНЯ 2-й степени и выше 1-летняя ОВ оказалась нумерически выше, чем при 0–1 степени (11,65 против 10,96 мес., log-rank p = 0,041).
Учитывая, что выживаемость пациентов напрямую зависит от варианта ЗО, мы провели анализ ОВ в подгруппах по видам ЗО. Была отмечена тенденция к увеличению ОВ при НМКР, если у пациента развилось тиреоидное эИОНЯ (39,0 мес., 95% ДИ: 31,1–47,0 против 29,3 мес., 95% ДИ: 21,1–37,5), не достигшая статистической значимости по критерию log-rank (p = 0,144) и Tarone-Ware (p = 0,071). Однако по критерию Breslow (p = 0,039) можно предположить статистически значимое улучшение ОВ при НМКР на ранних этапах лечения ИИКТ при развитии тиреоидного эИОНЯ (рис. 5).
Наличие эИОНЯ не было связано с iCR, iPR, iUPD, iCPD, iBOR. У пациентов с первичным гипотиреозом наблюдалась тенденция к более частому достижению iSD на границе статистической значимости (χ2 = 3,7, р = 0,054, ОР = 1,59, 95% ДИ: 1,01–2,53). При субанализе пациентов в группах с сопутствующим приемом ТКИ и без него, было обнару- жено, что во втором случае были выше шансы достижения iSD при развитии первичного гипотиреоза (χ2 = 4,99, р = 0,026, ОР = 1,77, 95% ДИ: 1,09–2,87), вероятного тиреоидита (χ2 = 5,82, р = 0,016, ОР = 1,67, 95% ДИ: 1,12–2,47) или любого тиреоидного эИОНЯ (χ2 = 4,22, р = 0,04, ОР = 1,44, 95% ДИ: 1,04–2,0). В первой группе статистически значимой связи дисфункции щитовидной железы и iSD выявлено не было.
Развитие тиреоидного эИОНЯ ассоциировалось с более частым достижением CBR (χ 2 = 4,73, р = 0,03, ОР = 1,45, 95% ДИ: 1,033–2,037). Субанализ подгрупп пациентов с сопутствующим приемом TKI и без него показал, что во второй подгруппе чаще достигали CBR при развитии первичного гипотиреоза (χ 2 = 4,31, р = 0,038, ОР = 1,76, 95% ДИ: 1,02– 3,02) и любого тиреоидного эИОНЯ (χ 2 = 5,23, р = 0,022, ОР = 1,49, 95% ДИ: 1,05–2,1), но не вероятного тиреоидита (χ 2 = 3,55, р = 0,059). Среди получающих ТКИ дисфунция щитовидной железы не ассоциировалась с достижением CBR (p > 0,05).
Не было выявлено статистически значимой связи между степенью какого-либо эИОНЯ, и iBOR, и CBR.
ПРЕДИКТОРЫ РАЗВИТИЯ ЭИОНЯ
Демографические предикторы. Средний возраст достоверно не различался у пациентов с выявленными эИОНЯ и без них (62,9 лет против 62,3 лет, соответственно; р = 0,69). Однако у пациентов ≥ 60 лет был повышен риск
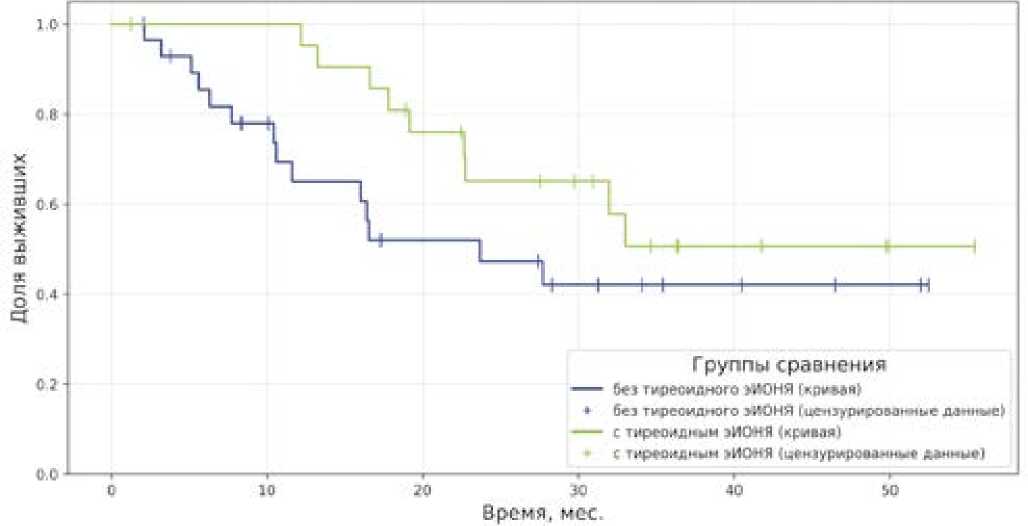
Рисунок 5. Сравнение общей выживаемости среди пациентов с немелкоклеточным раком легкого в группах с наличием и отсутствием тиреоидных иммуноопосредованных нежелательных явлений
Figure 5. Comparison of overall survival among patients with non-small cell lung cancer in groups with and without thyroid immune-related adverse events
выявления эИОНЯ 2-й степени тяжести и выше (χ 2 = 5,17, р = 0,023, ОР = 2,09, 95% ДИ: 1,1–3,96).
Частота эИОНЯ была схожей среди мужчин и женщин (p = 0,11), а также у женщин в пре — и в постменопаузе (р = 0,87).
Анамнестические предикторы. Нам не удалось установить статистически значимую связь развития каких-либо эИОНЯ с длительностью течения ЗО, наличием ПМЗО, назначением лечения по первично выявленному ЗО или при прогрессировании болезни, стадией ЗО, проведением лучевого и/или хирургического лечения до первого введения ИИКТ.
У участников с узловым зобом ОР развития тиреоидита возрастал в 2,91 раза (95% ДИ: 1,03–8,25), хотя данная связь не смогла достичь уровня статистической значимости (Р = 0,067). При наличии узлового зоба был выше риск развития тиреотоксикоза 2-й ст. по сравнению с 0–1 ст. (Р = 0,038, ОР = 4,1, 95% ДИ: 1,51–10,96).
Развитие эИОНЯ не зависело от массы тела, исходного наличия и степени нарушений углеводного обмена.
Частота развития эИОНЯ в зависимости от приема ряда лекарственных препаратов
Увеличение частоты эИОНЯ было выявлено среди пациентов, использовавших препараты инкретинового ряда (ингибиторы дипептидилпептидазы-4 и агонистов глюкагоноподобного пептида-1), назначенных по причине СД 2 типа: ОР = 1,95, 95% ДИ: 1,39–2,78, Р = 0,048 (n = 7). эИОНЯ были выявлены у всех пациентов, принимавших инкретиновые средства. В их число входят 5 пациентов, которые использовали ингибиторы дипептидилпепти-дазы-4 (ДПП-4): ОР = 2,27, 95% ДИ: 1,95–2,65, Р = 0,018; и 2 пациента, которые выполняли инъекции агонистов рецепторов глюкагоноподобного пептида — 1: ОР = 2,22, 95% ДИ: 1,91–2,58, хотя данный результат не достиг статистической значимости (Р = 0,21). Статистически значимой связи эИОНЯ и использования других групп сахароснижающих препаратов (метформина, препаратов сульфонил-мочевины, инсулина, ингибиторов натрий-глюкозного котранспортера — 2) установлено не было.
Обнаружено увеличение риска тиреоидного эИОНЯ при приеме блокаторов медленных кальциевых каналов (БМКК), использовавшихся в качестве антигипертензивных средств: χ 2 = 4,38, р = 0,036, ОР = 1,54, 95% ДИ: 1,09– 2,19. При приеме других препаратов с преимущественно кардиоваскулярным действием (ингибиторов ангиотен-зин-превращающего фермента, блокаторов рецепторов к ангиотензину-2, бета-адреноблокаторов, статинов, анти-агрегантов, антикоагулянтов) повышения вероятности развития эИОНЯ не наблюдалось.
При добавлении в схему химиотерапии антигистаминных препаратов (дифенгидрамина, хлоропирамина) чаще выявлялся первичный гипотиреоз (χ 2 = 4,2, р = 0,04, ОР = 1,68, 95% ДИ: 1,05–2,7).
Сопутствующая терапия ГКС не влияла на риски развития эИОНЯ.
Вариант комбинированной противоопухолевой терапии
При комбинации ипилимумаба и ниволумаба по сравнению с введением отдельных препаратов анти-PD-1/PD-L1 был выше риск развития 2-НН (Р = 0,001, ОР = 7,7, 95% ДИ: 2,2–26,0), а также ИИСД или СД 2 типа (Р = 0,033, ОР = 3,49, 95% ДИ: 1,09–11,21).
Дозы ипилимумаба, ниволумаба, пембролизумаба, атезолизумаба, пролголимаба при первом введении статистически значимо не отличались у пациентов с эИОНЯ и без них. Развитие каких-либо эИОНЯ не зависело от того, вводились ли пациентам какие-либо иные противоопухолевые препараты за ≤ 12 нед. до первой инфузии ИИКТ (в том числе ИФН-а), применялись ли какие-либо химиотерапевтические препараты в режиме комбинированной терапии.
При включении в схемулечения ТКИ более часто развивался первичный гипотиреоз (Р = 0,035, ОР = 2,27, 95% ДИ: 1,25–4,1). При анализе отдельных представителей ТКИ было выявлено повышение риска развития первичного гипотиреоза среди принимающих акситиниб (Р = 0,028, ОР = 2,58, 95% ДИ: 1,43–4,64). При предшествующем приеме ТКИ за ≤ 12 нед. до начала терапии ИИКТ подобного факта не наблюдалось (р = 0,86).
Не было установлено статистически значимой связи между эИОНЯ и сопутствующей терапией препаратами платины (n = 62), таксанами (n = 46), моноклональными антителами (n = 41), аналогами пиримидина (n = 15), фолатами (n = 11), подофиллотоксинами (n = 6), кампотецинами (n = 4), азотистыми ипритами (n = 3), ингибиторами ароматазы (n = 3), блеомицином (n = 1).
Мы также не обнаружили статистически значимой связи между приемом антигистаминных препаратов и ТКИ. Анализ связи приема антигистаминных средств и первичного гипотиреоза не показал статистически значимых результатов в подгруппах пациентов, принимающих ТКИ и нет. У принимающих БМКК и инкретиновые препараты также не было выявлено статистически значимой связи с использованием ТКИ.
Лабораторные предикторы. Абсолютное количество лейкоцитов, нейтрофилов, лимфоцитов, эозинофилов, тромбоцитов, а также NLR, dNLR, PLR исходно не отличались в группах пациентов, кому за ≤ 4 нед. до первого введения ИИКТ назначались препараты, способные повлиять на показатели клинического анализа крови: препараты железа, антигистаминные средства, гранулоцитарный колониестимулирующий фактор, ГКС, химиотерапевтические препараты. Исключение составил более высокий медианный показатель PLR у принимавших антигистаминные препараты за ≤ 4 нед. до первой инфузии ИИКТ (180,5 против 148,4, р = 0,021).
Уровень dNLR ≥ 3 исходно и перед вторым введением ИИКТ ассоциировался с меньшим риском развития эИОНЯ (χ2 = 4,02, р = 0,045 и χ2 = 5,72, р = 0,04, соответственно). При этом dNLR > 2,2 перед вторым введением ИИКТтакже был предиктором более низкой вероятности развития эИОНЯ (χ2 = 5,35, р = 0,021). Оцениваемые исходно и перед вторым введением ИИКТ NLR < 3, PLR ≥ 180, уровень эозинофилов < 0,24 тыс./мкл и уровень эозинофилов перед вторым введением ИИКТ > 3,2% не были связаны с риском развития каких-либо эИОНЯ. Однако наблюдалась тенденция по границе статистической значимости к более высокому медианному уровню эозинофилов перед вторым введением ИИКТ у пациентов с развившимся впоследствии эИОНЯ (0,16 тыс./ мкл против 0,13 тыс. / мкл, р = 0,053). Количество эИОНЯ слабоположительно коррелировало с абсолютным количеством эозинофилов и лимфоцитов перед вторым введением ИИКТ (r = 0,16, p = 0,046 и r = 0,17, p = 0,037, соответственно).
ОБСУЖДЕНИЕ
Насколько нам известно, это самое крупное ретроспективное исследование, посвященное поиску предикторов эИОНЯ и одно из наиболее крупных эпидемиологических исследований эИОНЯ в России. В ходе него мы обнаружили очень высокую частоту развития эИОНЯ (почти у каждого второго участника). В отечественной и зарубежной литературе этот показатель обычно ниже — в пределах 10 – 20 % [8–10], хотя некоторые авторы сообщали о частоте в 50 % [11] и даже 84 % [12]. Обнаруженный феномен вызван более высокой частотой выявления в нашем исследовании первичного гипотиреоза (25% по сравнению с 6,6 % в систематических обзорах [13]) и 2-НН (7,5% по сравнению с 1,3 – 3,2 % в других работах [14,15]) из-за частого назначения пациентам комбинации анти-PD-1 и анти-CTLA-4 препаратов. Исказить данные результаты могла и возможная систематическая ошибка выборки, поскольку из 443 пациентов было включено только 214 (48%) и частота эИОНЯ в исключенной когорте осталась неизвестна.
В ходе исследования было выявлено более частое развитие первичного гипотиреоза у пациентов, получающих комбинацию ИИКТ и ТКИ. Но стоит ли считать данные случаи классическим эИОНЯ или это осложнения, вызванные ТКИ? С одной стороны, медиана времени обнаружения первичного гипотиреоза была сопоставимой у пациентов, получающих ТКИ и без них. С другой — первичный гипотиреоз ассоциировался с более благоприятным результатами (достижение iSD и CBR) только среди тех пациентов, кто ТКИ не принимали. В других исследованиях первичный гипотиреоз, вызванный ИИКТ, уже ассоциировался с улучшением ОВ [16]. В то же время развитие первичного гипотиреоза на фоне приема ТКИ также ассоциируется с улучшением OS и CBR [17,18]. Возможно, ИИКТ и ТКИ имеют разную силу влияния на исходы ЗО при развитии первичного гипотиреоза, поскольку в нашем исследовании включение в анализ пациентов, принимающих ТКИ, привело к исчезновению достоверной связи первичного гипотиреоза с iSD и CBR. Таким образом, высокая встречаемость первичного гипотиреоза как эИОНЯ в нашей работе могла быть искажена частым развитием первичного гипотиреоза в подгруппе пациентов, получающих ТКИ.
Мы обнаружили интересную тенденцию к более частому развитию тиреоидита среди пациентов с узловым зобом в анамнезе. В литературе уже публиковался клинический случай практически полного разрешения токсического многоузлового зоба с последующей атрофией щитовидной железы после назначения 72-летней пациентке с меланомой комбинации ипилимумаба и ниволумаба [19]. Возможно, узловой зоб связан со скрытой аутоиммунной реакцией в щитовидной железе. Нельзя исключать и тот факт, что части участников нашего исследования мог бы по ошибке быть выставлен узловой зоб, а не узловая форма хронического аутоиммунного тиреоидита. В последнем случае наличие аутоиммунного состояния было бы очевидным и объясняло тенденцию к более частой манифестации тиреоидита-эИОНЯ.
Не менее интересной находкой стало более частое обнаружение при использовании ипилимумаба + ниволумаба сахарного диабета в целом: как ИИСД, являющегося явным эИОНЯ, так и СД 2 типа, который нельзя отнести непосредственно к эИОНЯ. ИИСД является редким, но характерным осложнением терапии ИИКТ. Однако в последнее время появляются статьи, в которых рассматривается возможная роль ИИКТ и в развитии СД, протекающего по 2-му типу. Предполагается, что ИИКТ могут усиливать инсулино-резистентность, т. к. они вызывают повышение уровня провоспалительных цитокинов, ухудшающих чувствительность к инсулину [20]. Как результат, анти-PD-1 независимо от возраста, пола и массы тела увеличивают уровень HbA1c у пациентов без сахарного диабета на 0,2–0,25% в абсолютном исчислении за первые 3 месяца лечения [21]. Нельзя исключить и возможность реализации медленно развивающегося ИИСД по типу латентного аутоиммунного диабета взрослых (LADA). Так, исследователи из Японии представили клинический случай СД с нарушением первой фазы секреции инсулина, возникшего через 2 недели после терапии ниволумабом у пациента с исходно положительными антителами к ассоциированному с инсулиномой антигену-2 (IA-2) [22].У описанного пациента секреция инсулина сохранялась более 1 года.
Прием препаратов инкретинового ряда в нашем исследовании ассоциировался с повышением риска эИОНЯ. Большая часть данных средств относилась к ингибиторам ДПП-4. Указанный фермент (известен также как CD26) ограничивает миграцию лимфоцитов в ткани путем посттрансляционного процессинга хемокинов [23]. В мышиной модели карциномы кишечника CT26 добавление ситаглиптина усилило эффект анти-CTLA-4 препарата, а комбинация ситаглиптина с анти-CTLA-4 + анти-PD-1 дало полный ответ у 100% мышей, в то время как терапия анти-CTLA-4 + анти-PD-1 в отдельности — только у 42% [23]. Известно также, что прием ингибиторов ДПП-4 может вызвать некоторые аутоиммунные заболевания: например, буллезный пемфигоид, воспалительные заболевания кишечника [24]. Возможно, усиление иммунного ответа после блокады ДПП-4 и контрольных точек иммунитета затрагивает и органы с подавленной аутоиммунной реакцией. Однако повторимся, что всего 7 пациентов в нашем исследовании принимали препараты инкретино- вого ряда. Поэтому нельзя убедительно исключить фактор случайности в обнаружении связи данных средств и эИОНЯ, хотя ее вероятность довольно мала — 0,4%.
БМКК ассоциировались с более частым развитием тиреоидных эИОНЯ. Судя по всему, это связано со способностью представителей данной группы подавлять экспрессию PD-L1 на клеточной поверхности [25]. Известно, что использование амлодипина приводит к усилению инфильтрации опухоли CD8 + Т-лимфоцитами, и эффект является дозозависимым [26]. Предполагается, что блокада кальциевых каналов ограничивает поступление в цитозоль кальция, необходимого для секреции эндосом и экзосом с PD-L1 [25,26]. Также есть данные, что БМКК ингибируют транскрипционный фактор STAT1, таким образом подавляя транскрипцию PD-L1 гена [27]. В итоге, БМКК, подавляя экспрессию PD-L1 и секрецию экзосомального PD-L1, могут стимулировать развитие аутоиммунной агрессии как против опухоли, так и против здоровых органов и тканей.
Третьей группой препаратов, показавших ассоциацию с развитием эИОНЯ первичного гипотиреоза, стали анги-тистаминные средства. Реализация данного феномена может быть обусловлена усилением иммунного ответа, ведь блокада гистамина значимо улучшала ОВ в исследо- ваниях у пациентов с ЗО [28–30]. Увеличение выживаемости наблюдалось при многих опухолях, и данный эффект усиливался еще больше при совместном использовании антигистаминных препаратов с ИИКТ [29]. Примечательно, что в зонтичном обзоре 23 исследований использование блокаторов H2-рецептора гистамина не влияло на ОВ [31], а в метаанализе результатов терапии 2267 пациентов даже негативно ассоциировалось с ОВ и ВБП [32]. В нашем исследовании был зафиксирован же прием только хлоро-пирамина и дифенгидрамина — блокаторов Н1-рецепторов гистамина. Увеличение ОВ при использовании антигистаминных препаратов может объясняться тем, что в опухолевой области часто повышена концентрация гистамина [28]. Связываясь с H1-рецепторами поверхности макрофагов, он стимулирует их преобразование в иммуносупрессивную форму М2. Последняя экспрессирует иммунную контрольную точку VISTA, подавляющую CD8 + Т- лимфоцитов [28]. Высокая экспрессия H1-гистаминовых рецепторов также ассоциируется со снижением ответа на терапию анти-PD-1/PD-L1, а блокада данных рецепторов фексофенадином в мышиных моделях ассоциировалась с более частым достижением терапевтического эффекта при комбинации с анти-PD-1 + анти- CTLA-4 , по сравнению с использованием фексофенадина или ИИКТ по отдельности [28].
Исследования показывают, что основную роль в развитии ИОНЯ, в том числе и эндокринных, играет активация лимфоцитов с последующей инфильтрацией органа-мишени CD8 + Т-лимфоцитами [33]. При этом известно, что некоторые ЗО способны активировать гранулопоэз и влиять на деятельность нейтрофилов в зависимости от секретируемых в опухолевой области цитокинов [34]. В частности, некоторые исследователи в животных моделях показывали, что при отсутствии трансформирующего фактора роста-бета нейтрофилы ингибировали CD8 + Т-лимфоциты, тем самым стимулируя рост опухоли (подкожной мезотелиомы) [34]. Таким образом, индексы крови (NLR, dNLR, PLR и им подобные) могут быть суррогатными маркерами состояния иммунного ответа до начала лечения и во время его реализации. Наша работа подтвердила, что исходный dNLR ≥ 3 как раз и ассоциируется со сниженным риском эИОНЯ. Данная находка соотносится с результатами других исследований, где dNLR ≥ 3 также ассоциировался со снижением частоты ИОНЯ в целом [35]. При этом сохранение высокого dNLR > 2,2 в конце 1-го цикла терапии ИИКТ свидетельствует о снижении риска эИОНЯ, что может отражать слабое влияние ИИКТ на иммунный ответ пациента.
Мы не нашли различий в частоте эИОНЯ по уровню эозинофилов, хотя ранее в другом ретроспективном исследовании было обнаружено более частое развитие эИОНЯ при исходном уровне эозинофилов < 0,24 тыс./мкл. и относительным числом эозинофилов ≥ 3,2% через 1 мес. после начала терапии ИИКТ [36]. Тем не менее, у пациентов с эИОНЯ наблюдалась тенденция к более высокому уровню эозинофилов перед вторым введением ИИКТ, что свидетельствует в пользу продолжения поиска оптимального уровня эозинофилов для предсказания развития эИОНЯ. Исследования показывают, что ИИКТ могут вызвать эозинофилию через секрецию интерлейкина-5 CD4 + Т- лим фоцитами [37]. В ряде публикаций было подтверждено, что накопление эозинофилов в здоровых, не затронутых опухолью тканей, свидетельствует о развитии ИОНЯ [37].
Нам также не удалось подтвердить связь эИОНЯ с NLR и PLR, хотя в метаанализах при более низких NLR и PLR ИОНЯ развивались чаще [38,39]. Возможно, dNLR имеет более сильную связь с развитием ИОНЯ, чем NLR, т. к. этот показатель более комплексно оценивает соотношение между нейтрофилами и другими лейкоцитами, в том числе лимфоцитами и эозинофилами. Повышение dNLR ассоциируется со уменьшением инфильтрации зоны опухоли иммунными клетками [40]. Это может означать снижение Т-клеточного иммунного ответа и в эндокринных органах со подавленной аутоиммунной реакцией и как следствие, более низкий риск эИОНЯ, как и было показано в нашем исследовании.
Проведенное исследование являлось ретроспективным. В связи с этим оно имеет несколько ограничений. Во-первых, дизайн исследования не исключает публикационные искажения (publication bias). Во-вторых, большая доля пациентов не была включена в исследование, несмотря на достаточно широкие критерии включения, что могло привести к систематической ошибке выборки. В-третьих, оно было проведено на популяции с высокой гетерогенностью по вариантам ЗО и разнообразию режимов терапии с включением ИИКТ.
ЗАКЛЮЧЕНИЕ
эИОНЯ развиваются почти у половины пациентов, начавших лечение ИИКТ. Самым частым эИОНЯ является дисфункция щитовидной железы, реже — гипофи- зит (преимущественно в виде 2-НН) и ИИСД. Две трети эИОНЯ развиваются в первые полгода лечения. Комбинация ипилимумаба и ниволумаба может увеличивать риск сахарного диабета в целом. В исследовании наблюдалась тенденция к более частым положительным исходам пациентов с ЗО и развившимся эИОНЯ (в виде увеличения ОВ у пациентов с НМРЛ, более частым достижением iSD и CBR). К перспективным предикторам развития эИОНЯ относятся возраст ≥ 60 лет, dNLR ≥ 3 исходно и перед 2-м введением
ИИКТ, dNLR > 2,2 перед вторым введением ИИКТ, прием препаратов инкретинового ряда, БМКК, антигистаминных средств. Сопутствующий прием ТКИ повышает риск развития первичного гипотиреоза, однако пока неясно, можно ли трактовать подобные случаи как эИОНЯ. Учитывая ретроспективный дизайн исследования, данные находки представляют ценность в качестве генераторов гипотез и требуют проверки в дальнейших проспективных исследований.


