Эпидемиология внутрибольничных инфекций в онкологическом стационаре, вызванных высокорезистентными (XDR) штаммами А. baumannii
Автор: Григорьевская Злата Валерьевна, Петухова Ирина Николаевна, Дьякова Светлана Андреевна, Дмитриева Наталья Владимировна
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 3 (75), 2016 года.
Бесплатный доступ
Проблема формирования MDR ( multy-drug-resistant ) штаммов Аcinetobacter baumannii и распространения резистентности в клинике чрезвычайно актуальна для онкологических стационаров. Для грамотной организации мероприятий по прерыванию путей передачи инфекции в стационаре и распространения внутрибольничных патогенов важно определение идентичности циркулирующих штаммов микроорганизмов. Оценка истинных филогенетических отношений изучаемых штаммов возможна с помощью проведения кластерного анализа изолятов с последующим построением и анализом MSP Dendrogram в системе MALDI-TOF BIOTYPER.
Аcinetobacter baumannii, пути передачи инфекции, внутрибольничные патогены, идентичность штаммов
Короткий адрес: https://sciup.org/14056687
IDR: 14056687 | УДК: 616-006-036.22-022.3:616.9 | DOI: 10.21294/1814-4861-2016-15-3-62-66
Текст научной статьи Эпидемиология внутрибольничных инфекций в онкологическом стационаре, вызванных высокорезистентными (XDR) штаммами А. baumannii
Проблема формирования устойчивых штаммов микроорганизмов, в частности MDR ( multy-drug-re-sistant ) штаммов Аcinetobacter baumannii , и распространения резистентности в клинике чрезвычайно актуальна для онкологических стационаров [ 1, 3, 6 ] . Пациенты, инфицированные резистентными штаммами, становятся естественным резервуаром, носителями устойчивой флоры. Опасность кроссконтаминации – обсеменения объектов больничной среды и инфицирования других пациентов в такой ситуации очень велика [ 2 ] . Лечение инфекций, вызванных высокорезистентными микроорганизмами, – непростая задача. При таких инфекциях необходима длительная, комбинированная антибактериальная терапия, что затрудняет, а в некоторых случаях делает невозможным, проведение противоопухолевого лечения, ухудшая общий прогноз больного [ 8-10 ] . Резистентность микроорганизмов, вызвавших инфекционный процесс, непосредственно влияет на результаты лечения. В 1,5–1,6 раза увеличивается длительность госпитализации пациентов, стоимость лечения, достоверно возрастают показатели летальности от инфекции [ 1,2,4 ] . Для определения идентичности циркулирующих в клиниках штаммов высокорезистентных бактерий используют ПЦР-диагностику с определением генотипов микроорганизмов, а также при помощи системы MALDI-TOF BIOTYPER проводят кластерный анализ изолятов с последующим построением MSP Dendrogram, который с высокой степенью вероятности отражает истинные филогенетические отношения изучаемых штаммов [ 5, 7 ] .
Целью исследования явился анализ распространенности и идентичности штаммов MDR Аcinetobacter baumannii , выделенных в клинике с объектов внутрибольничной среды и из патологических материалов онкологических больных с инфекциями, вызванными А. baumannii .
Материал и методы
Проанализировано 153 штамма А.baumannii , из них 101 штамм получен от 98 онкологических пациентов. Патологические материалы были представлены отделяемым нижних дыхательных путей, раневым отделяемым и прочими биоматериалами (табл. 1). Также было проанализировано 187 объектов больничной среды (табл. 2).
Далее были определены биотипы исследуемых штаммов бактерий в соответствии с 8-значной экспертной системой обработки данных MicroScan и программным обеспечением системы WаlkАway. Выполнен кластерный анализ и видовая идентификация штаммов А. baumannii путем сопоставления получаемых масс-спектров с имеющимися базами данных. Анализ производили с помощью программного пакета MALDI Biotyper 2,0 (Германия, «Bruker»). Математические модели для классификации масс-спектров, накопленных для разных групп MDR А. baumannii , строили на основании генетического алгоритма кластеризации, являющегося модулем программы ClinProTools 2,1.
Результаты
В результате проведенного исследования среди 101 штамма А.baumannii , которые выделены у
таблица 1
Количество штаммов À. baumannii , выделенных из различных патологических материалов онкологических больных
виды анализируемых объектов больничной среды
онкологических больных, было обнаружено 17 различных биотипов комплекса A. baumannii/ haemolyticus (табл. 3). Из них 5 (29,4 %) биотипов А. baumannii были представлены «дикими» штаммами и имели чувствительность практически ко всем группам антибактериальных препаратов; 12 (70,6 %) биотипов представлены MDR штаммами. Однократно встречались 13 биотипов, двух- и трехкратно – 2 биотипа. Кроме того, 2 (11,8 %) из 17 биотипов MDR штаммов А. baumannii встречались многократно: 57 (56,4 %) штаммов из 101 были представлены биотипом 00062730; 26 (25,7 %) из 101 – биотипом 00062720.
Среди 52 штаммов А.baumannii , выделенных с объектов больничной среды, обнаружено 9 различных биотипов, из них 2 (22,2 %) биотипа были представлены «дикими» штаммами и имели чувствительность практически ко всем группам антибактериальных препаратов, 7 (77,8 %) биотипов представлены MDR штаммами. Однократно встречались 7 биотипов, многократно встречались 2 биотипа MDR штаммов А.baumannii из 9: 21 (39,6 %) штамм из 53 был представлен биотипом 00062730, 24 (45,3 %) из 53 – биотипом 00062720.
В целом, 83 (82,2 %) штамма А. baumannii из 101, выделенного из патологических материалов больных, и 45 (84,9 %) штаммов из 53, выделенных с объектов больничной среды, являются госпитальными и представлены биотипами 00062730 и 00062720. При оценке идентификационных тестов системы WalkAway установлено, что идентификационные коды биотипов 00062730 и 00062720 практически идентичны и отличаются только одним тестом: MIC к тобрамицину.
Биотипы комплекса A.baumannii ( A.baumannii/haemolyticus комплекса)
|
Виды биотипов |
Ia (n=101) |
IIb(n=53) |
|
00062730 |
57 (56,4 %) |
21 (39,6 %) |
|
00062720 |
26 (25,7 %) |
24 (45,3 %) |
|
00066730 |
3 (2,9 %) |
1 (1,9 %) |
|
40066730 |
2 (1,9 %) |
- |
|
00020620 |
1 (0,9 %) |
- |
|
40020620 |
1 (0,9 %) |
- |
|
00020660 |
1 (0,9 %) |
- |
|
00020720 |
1 (0,9 %) |
- |
|
00060720 |
1 (0,9 %) |
- |
|
00060730 |
1 (0,9 %) |
- |
|
00062330 |
1 (0,9 %) |
- |
|
40062730 |
1 (0,9 %) |
- |
|
00066720 |
1 (0,9 %) |
1 (1,9 %) |
|
00066770 |
1 (0,9 %) |
1 (1,9 %) |
|
00020620 |
1 (0,9 %) |
- |
|
42060660 |
1 (0,9 %) |
- |
|
42066730 |
1 (0,9 %) |
- |
|
00060620 |
- |
1 (1,9 %) |
|
02062720 |
- |
1 (1,9 %) |
|
02062620 |
- |
1 (1,9 %) |
|
02062730 |
- |
1 (1,9 %) |
Примечание: Ia – биотипы штаммов А. baumannii , выделенные от онкологических больных; IIb – биотипы штаммов А. baumannii , выделенные с объектов больничной среды.
таблица 4
Количество и чувствительность штаммов À.baumannii с биотипами 00062730 и 0006270
|
Антибиотики |
Биотипы/количество чувствительных штаммов (n=128) |
MIC mcg/ml |
|
|
00062730 (n=78) |
00062720 (n=50) |
||
|
Ампициллин/сульбактам |
6 (7,7 %) |
0 (0 %) |
<=8 |
|
Левофлоксацин |
37 (47,4 %) |
21 (42,0 %) |
<=2 |
|
Моксифлоксацин |
40 (51,3 %) |
17 (34,0 %) |
<=0,5 |
|
Цефтазидим |
0 (0 %) |
7 (14,0 %) |
<=8 |
|
Цефепим |
0 (0 %) |
25 (50,0 %) |
<=8 |
|
Имипенем/циластатин |
0 (0 %) |
0 (0 %) |
<=4 |
|
Меропенем |
0 (0 %) |
0 (0 %) |
<=4 |
|
Тетрациклин |
18 (23,1 %) |
19 (38,0 %) |
<=4 |
|
Колистин |
78 (100 %) |
50 (100 %) |
- |
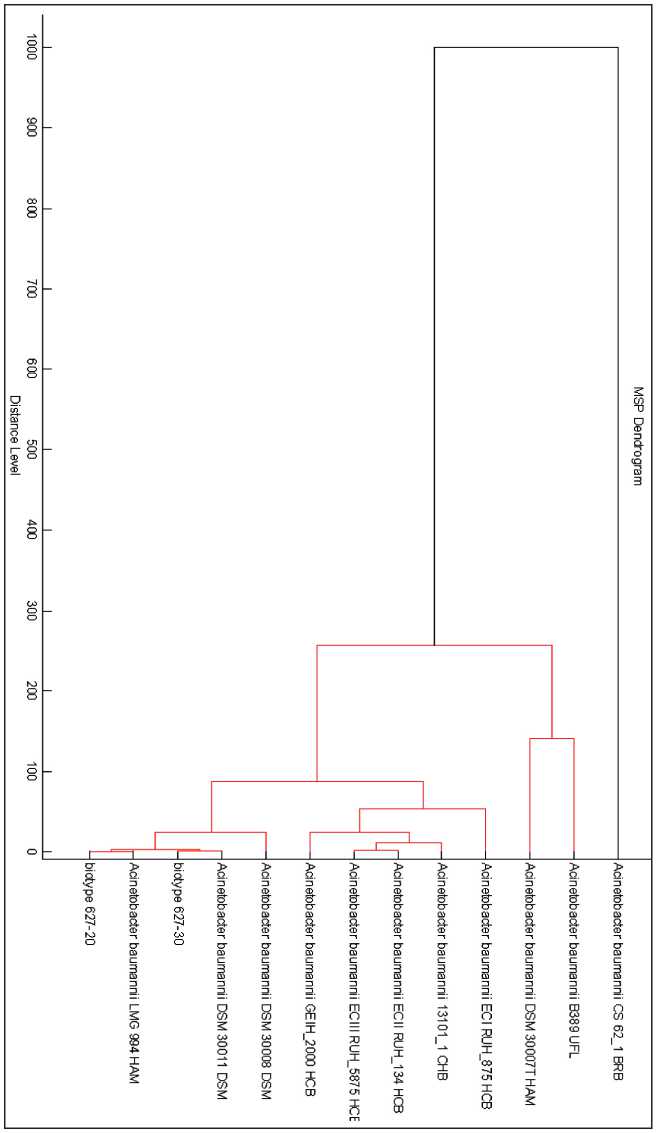
Рис. 1. Сопоставление биотипов MDR À. baumannii 00062730 и 00062720 с коллекционными штаммами À. bau-mannii в системе MALDI-TOF BIOTYPER
Список литературы Эпидемиология внутрибольничных инфекций в онкологическом стационаре, вызванных высокорезистентными (XDR) штаммами А. baumannii
- Григорьевская З.В., Дьякова. С.А. Формирование и распространение резистентных микроорганизмов в клиниках -всемирная проблема//Антимикробная терапия внутрибольничных инфекций/Под ред. Н.В. Дмитриевой, И.Н. Петуховой. М., 2014. 326 с
- Давыдов М.И., Дмитриева Н.В. Инфекции в онкологии. М., 2009. 472 с
- Ильина Е.Н. Создание интегрированной геномно-протеонной системы для типирования и изучения патогенов бактериальной и вирусной природы: Автореф. дис.... д-ра мед. наук. М., 2009. 264 с
- Antimicrobial resistance surveillance in Europe 2011. URL: http://www.ecdc.europa.eu (18.01.2016)
- Chan J.M., Halachev M.R., Loman N.J., Constantinidou C., Pal-len M.J. Defining bacterial species in the genomic era: insights from the genus Acinetobacter//BMC Microbiology. Vol. 12. P. 302 DOI: 10.1186/1471-2180-12-302
- Fishbain J., Peleg A.Y. Treatment of Acinetobacter infections//Clin. Infect. Dis. 2010. Vol. 51 (1). P. 79-84 DOI: 10.1086/653120
- Tak-chiu W.U. Carbapenem-resistant or Multidrug-resistant Acinetobacter baumannii -a Clinical’s perspective//The Hong Kong Medical Diary. 2011. Vol. 16 (4). P. 6-9
- Vila J., Pachon J. Therapeutic options for Acinetobacter baumannii infections//Expert Opin. Pharmacother. 2008. Vol. 9 (4). P. 587-599. Review DOI: 10.1517/14656566.9.4.587
- Григорьевская З.В. Актуальность проблемы госпитальных инфекций в онкологической клинике//Вестник РОНЦ им. Н.Н. Блохина РАМН. 2013. Т. 24, №. 3-4. С. 46-49
- Григорьевская З.В. Стратегия лечения нозокомиальных инфекций, вызванных резистентными микроорганизмами, в онкологической клинике: Дис.... д-ра мед. наук. М., 2015. 252 с
- Григорьевская З.В., Дьякова. С.А. Формирование и распространение резистентных микроорганизмов в клиниках -всемирная проблема//Антимикробная терапия внутрибольничных инфекций/Под ред. Н.В. Дмитриевой, И.Н. Петуховой. М., 2014. 326 с
- Давыдов М.И., Дмитриева Н.В. Инфекции в онкологии. М., 2009. 472 с
- Ильина Е.Н. Создание интегрированной геномно-протеонной системы для типирования и изучения патогенов бактериальной и вирусной природы: Автореф. дис.... д-ра мед. наук. М., 2009. 264 с
- Antimicrobial resistance surveillance in Europe 2011. URL: http://www.ecdc.europa.eu (18.01.2016)
- Chan J.M., Halachev M.R., Loman N.J., Constantinidou C., Pal-len M.J. Defining bacterial species in the genomic era: insights from the genus Acinetobacter//BMC Microbiology. Vol. 12. P. 302 DOI: 10.1186/1471-2180-12-302
- Fishbain J., Peleg A.Y. Treatment of Acinetobacter infections//Clin. Infect. Dis. 2010. Vol. 51 (1). P. 79-84 DOI: 10.1086/653120
- Tak-chiu W.U. Carbapenem-resistant or Multidrug-resistant Acinetobacter baumannii -a Clinical’s perspective//The Hong Kong Medical Diary. 2011. Vol. 16 (4). P. 6-9
- Vila J., Pachon J. Therapeutic options for Acinetobacter baumannii infections//Expert Opin. Pharmacother. 2008. Vol. 9 (4). P. 587-599. Review DOI: 10.1517/14656566.9.4.587


