Эпителиальные опухоли вилочковой железы с диссеминацией по плевре: роль циторедуктивной хирургии
Автор: Пикин О.В., Рябов А.Б., Александров О.А., Колбанов К.И., Глушко В.А., Бармин В.В., Багров В.А., Мартынова Д.Е.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Опыт работы онкологических учреждений
Статья в выпуске: 6 т.21, 2022 года.
Бесплатный доступ
Актуальность. Метастазы эпителиальных опухолей вилочковой железы диагностируют при первичном обследовании у 5-7 % пациентов и в процессе динамического наблюдения после радикальной операции по удалению первичной опухоли у 10 % больных. Удаление метастазов по плевре является основным методом в лечении этой категории больных. Цель исследования - определить роль хирургии в лечении больных с опухолью вилочковой железы и диссеминацией по плевре. Материал и методы. В исследование включен 21 больной с опухолью вилочковой железы (тимома - 13, рак вилочковой железы - 8) и наличием отсевов по плевре (IVA стадия - 11, изолированное поражение плевры после ранее выполненной радикальной операции - 10), оперированных в отделении торакальной хирургии МНИОИ им. П.А. Герцена с 01.01.10 по 30.06.21. Всем больным выполняли частичную плеврэктомию, при необходимости с резекцией легкого, диафрагмы. Циторедукцию дополняли интраоперационной фотодинамической терапией у 4, внутриплевральной гипертермической химиотерапией с препаратом цисплатин - у 4 больных. Результаты. Циторедукция в объеме R0 выполнена у 12 (57,2 %) больных. Послеоперационные осложнения отмечены в 6 (28,6 %) случаях, летальность составила 7,5 %. Общая 1-, 3- и 5-летняя выживаемость составила 78 % (95 % CI 61-95), 49 % (95 % CI 23-75), 41 % (95 % CI 15-67) соответственно. Медиана общей выживаемости - 29 мес (95 % CI 0-60,6). Рецидив заболевания диагностирован у 10 (47,6 %) больных. Безрецидивная 1-летняя выживаемость составила 60 % (95 % CI 30-90). При тимомах наблюдалась тенденция к большей общей выживаемости, чем при раке тимуса (р=0,064). Факторы неблагоприятного прогноза: рак вилочковой железы, неполная циторедукция, осложненный послеоперационный период, местный рецидив. Выводы. Хирургический метод является основным в лечении больных с метастазами эпителиальных опухолей вилочковой железы по плевре как при IVA стадии заболевания, так и при прогрессировании процесса после выполненной операции. Целесообразно удаление отдельных диссеминатов по типу частичной плеврэктомии для максимальной циторедукции, что наряду с гистотипом опухоли определяет прогноз заболевания.
Тимома, рак вилочковой железы, диссеминация по плевре, хирургия, прогноз
Короткий адрес: https://sciup.org/140296683
IDR: 140296683 | УДК: 616.438-006-089:616.25 | DOI: 10.21294/1814-4861-2022-21-6-106-113
Текст научной статьи Эпителиальные опухоли вилочковой железы с диссеминацией по плевре: роль циторедуктивной хирургии
Эпителиальные опухоли вилочковой железы – относительно редкие злокачественные новообразования, но самые частые опухоли, встречающиеся в переднем средостении [1]. Согласно классификации Masaoka и TNM (8-я редакция, 2017), тимому с метастазами по плевре относят к IVA стадии заболевания [2, 3]. При первичном обследовании метастазы по плевре диагностируют не более чем у 7 % больных с опухолью вилочковой железы [4, 5]. Метастазирование по плевре является наиболее частой локализацией рецидива заболевания после операции по удалению первичной опухоли [6]. Считают, что циторедукция у больных с опухолями вилочковой железы желательна как при одновременном выявлении отсевов по плевре, так и при изолированном прогрессировании опухолевого процесса [7–9].
Цель исследования – определить роль хирургии в лечении больных с опухолью вилочковой железы и диссеминацией по плевре.
Материал и методы
В отделении торакальной хирургии МНИОИ им. П.А. Герцена с января 2010 г. по июнь 2021 г.
оперирован 21 больной с опухолью вилочковой железы и диссеминацией по плевре. Средний возраст больных составил 57 ± 11 (35–74) лет (табл. 1). Метастазы по плевре вместе с первичной опухолью выявлены у 11 (52,4 %), прогрессирование болезни в виде метастатического поражения плевры – у 10 (67,6 %) больных в сроки от 8 до 108 мес (медиана – 20 мес). Повторное прогрессирование диагностировано у 2, третий рецидив – у 1 и шесть рецидивов заболевания – у 1 больного. Резекция смежных органов и структур потребовалась в 20 (95,2 %) случаях. Наиболее часто резецировали: легкое – у 18, перикард – у 11, диафрагмальный нерв – у 10, плечеголовную вену – у 7, диафрагму – у 5 и грудную стенку – у 2 больных. Всем больным выполняли частичную плеврэктомию, т.е. удаляли только диссеминаты на париетальной или висцеральной плевре с помощью электрокоагуляции. При инвазии в окружающие структуры выполняли их резекцию (легкое, диафрагма). Циторедукцию дополняли интраоперационной фотодинамической терапией у 4, гипертермической внутриплевральной химиотерапией с препаратом цисплатин – у 4 больных.
Статистический анализ проводился с использованием программы IBM SPSS v. 26. Описательная
Таблица 1/table 1
|
Параметр/Parameter |
Число больных/Number of patients |
|
Гистология/Histology |
|
|
Тимома/Thymoma: |
13 (61,9 %) |
|
- тип АВ/type AB |
3 (14,2 %) |
|
- тип В1/type B1 |
1 (4,7 %) |
|
- тип В2/type B2 |
2 (9,5 %) |
|
- тип В3/type B3 |
7 (33,3 %) |
|
Рак вилочковой железы (плоскоклеточный)/ Thymus cancer (squamous) |
8 (38,1 %) |
|
Стадия по Masaoka/Stage by Masaoka |
|
|
II |
4 (19,0 %) |
|
III |
6 (28,6 %) |
|
IVA |
11 (52,4 %) |
|
Миастения/Myasthenia gravis |
|
|
Да/Yes |
3 (14,3 %) |
|
Нет/No |
18 (85,7 %) |
|
Доступ для удаления первичной опухоли/Access to remove the primary tumor |
|
|
Стернотомия/Sternotomy |
7 (33,3 %) |
|
Торакотомия/Thoracotomy |
12 (57,2 %) |
|
Торакоскопия/Thoracoscopic |
2 (9,5 %) |
|
Доступ для удаления метастазов по плевре/Access for removal of metastases in the pleura |
|
|
Стернотомия/Sternotomy |
10 (47,7 %) |
|
Стерноторакотомия/Sternothoracotomy |
2 (9,5 %) |
|
Торакотомия/Thoracotomy |
7 (33,3 %) |
|
Торакоскопия/Thoracoscopic |
2 (9,5 %) |
|
Локализация метастазов/Localization of metastases |
|
|
Плевра/Pleura |
12 (57,4 %) |
|
Плевра + перикард/Pleura + pericardium |
3 (14,2 %) |
|
Плевра + легкое/Pleura + lung |
6 (28,4 %) |
|
Адъювантная терапия по поводу первичной опухоли/Adjuvant therapy for primary tumor |
|
|
ЛТ/RT |
2 (9,5 %) |
|
ХТ/CT |
3 (14,2 %) |
|
Предоперационная ХТ при выявлении прогрессирования по плевре/ Preoperative CT in the detection of pleura involvement |
8 (38,1 %) |
|
Послеоперационная ХТ/Postoperative CT |
7 (33,3 %) |
Характеристика оперированных больных
Characteristics of patients
статистика приведена в виде среднего значения или медианы с 95 % доверительным интервалом (CI) или интерквартильным размахом, в зависимости от типа распределения данных. Анализ выживаемости выполнен по методу Каплана–Мейера, с применением регрессии Кокса для оценки влияния факторов риска на исход. При сравнении полученных данных использовались показатели отношения шансов (OR) и отношения рисков (HR).
Результаты
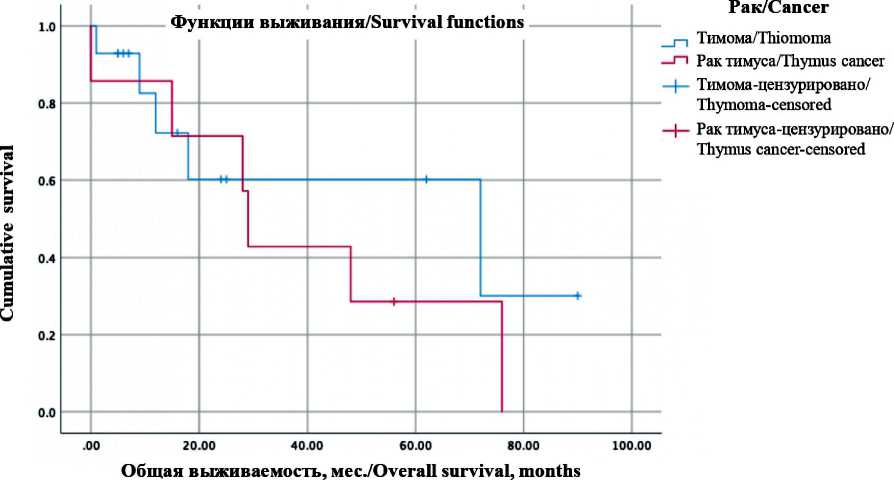
Послеоперационные осложнения диагностированы у 6 (28,6 %) больных, летальность составила 9,5 % (табл. 2). Медиана наблюдения составила 26 (0–153) мес. Общая 1-, 3- и 5-летняя выживаемость – 78 % (95 % CI 61–95), 49 % (95 % CI 23–75), 41 % (95 % CI 15–67) соответственно. Медиана общей выживаемости равнялась 29 мес (95 % CI 0–60,6). Рецидив заболевания диагностирован у 10 (47,6 %)
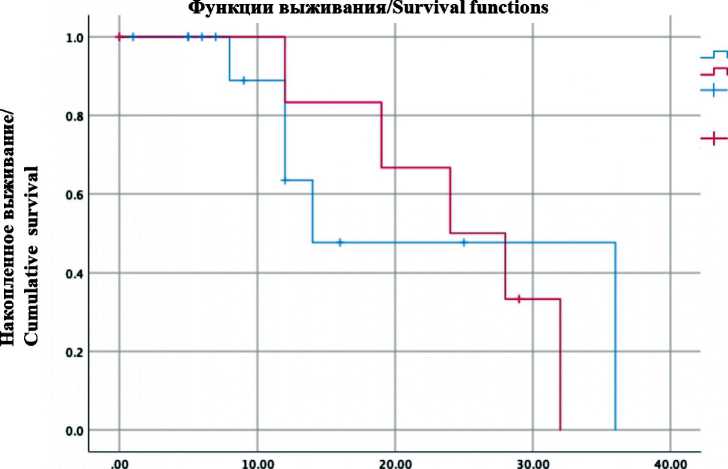
больных. Безрецидивная 1-летняя выживаемость составила 60 % (95 % CI 30–90). Все рецидивы были диагностированы в срок от 8 до 36 мес. Среди больных без рецидива 4 из 11 (36 %) пережили 12 мес, у 7 из 11 (64 %) срок наблюдения не превышает 12 мес. Двое больных пережили 2-летний интервал без местного рецидива. Медиана безрецидивной выживаемости – 14 мес (95 % CI 3,1–24,8) (рис. 1).
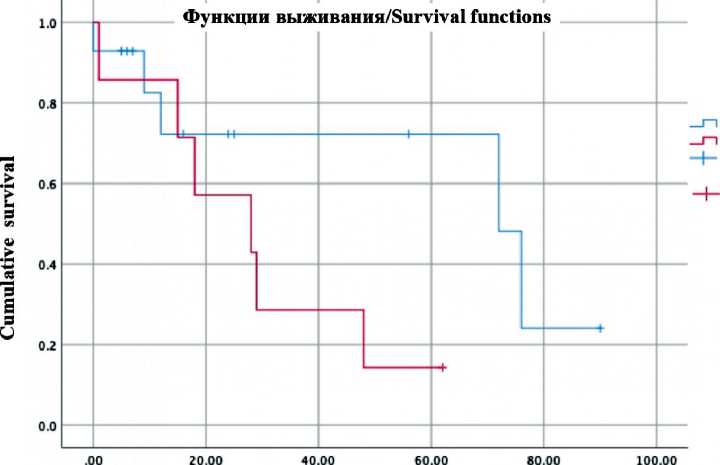
Больные, у которых при первичном обращении выявлен синхронный метастаз, имели худший прогноз. Медиана общей выживаемости при отсутствии синхронного метастаза не достигнута, при наличии синхронного метастаза составила 18 мес (95 % CI 15–41). Полученные результаты статистически различались (OR 2,8; 95 % CI 1,4–5,3; p=0,03). Отдаленные результаты в зависимости от радикальности операции/полноты циторедукции (рис. 2): медиана выживаемости при в x s a
■ И ч в I М
Рак/Cancer
Тпмома/Thiomoma
Рак тимуса/Thymus cancer Тимома-цензурировано/ Thymoma-censored
Рак тимуса-цензурировано/ Thymus cancer-censored
Безрецидивная выживаемость, мес./ Disease free survival, months
Рис. 1. Общая и безреци-дивная выживаемость Fig. 1. Overall and relapse-free survival
Радикальность/Radicality
RO
R1-R2
RO-цензурировано/
RO-censored
R1-R2 -цензурировано/
R1-R2-censored
Общая выживаемость, мес./Overall survival, months
Рис. 2. Общая выживаемость в зависимости от радикальности операции Fig. 2. Overall survival according to resection margin status радикальной операции составила 28,9 мес (95 % CI 15,3–128,6), при нерадикальной – 13 мес (95 % CI 2,3–53,6; p=0,115).
Средний размер опухоли у больных с нерадикальными операциями (R1-R2) составил 9 см (4,6–13,3), с радикальными – 5,4 см (3,5–7,2), различия статистически значимые (p=0,034). Ра- дикальность операции не зависела от гистологической структуры опухоли (р=0,127), солитарного либо множественного характера метастазирования (р=0,274), сочетанного поражения легкого, плевры, грудной стенки (р=0,428).
Гистологический подтип опухоли – важный прогностический фактор: после удаления метаста-
Таблица 2/table 2
Некоторые показатели оперативных вмешательств surgical parameters
|
Параметр/Parameter |
Значение/Value |
|
Длительность операции, мин/Duration of surgery, min |
211 (181–240) |
|
Кровопотеря, мл/Blood loss, ml |
200 (125–425) |
|
Койко-день в реанимации, сут/Bed-day in intensive care, days |
1 (1–1,5) |
|
Послеоперационный койко-день, сут/Postoperative bed-day, days |
12 (9–13) |
|
Оcложнения/Complications |
6 (28,6 %) |
|
II |
1 (16,7 %) |
|
IIIA |
1 (16,7 %) |
|
avenno IIIB |
2 (33,3 %) |
|
V |
2 (33,3 %) |
|
Флотирующий тромбоз глубоких вен голени/Floating deep vein thrombosis of the leg |
1 |
|
Двусторонний парез диафрагмы/Bilateral paresis of the diaphragm |
2 (1*) |
|
Пароксизм фибрилляции/Fibrillation Paroxysm |
1 |
|
Гемоторакс/Hemothorax |
1 |
|
Тромбоз верхней полой вены/Thrombosis of the superior vena cava |
1 (1*) |
|
Летальность/Mortality |
2 (9,5 %) |
|
Радикальность операции/Surgical margins |
|
|
R0 |
12 (57,2 %) |
|
R1 |
1 (4,8 %) |
|
R2 |
8 (38,0 %) |
Примечание: * – летальный исход.
Note: * – lethal outcome.
Таблица 3/table 3
Мультифакторный анализ общей выживаемости
Multivariate analysis of overall survival
|
Общая выживаемость/Overall survival |
|||
|
Показатель/Indicator |
HR |
95 % CI |
p |
При построении многофакторной модели регрессии Кокса выявлены независимые прогностические факторы летального исхода (табл. 3). Наличие осложнения в послеоперационном периоде повышало риск летального исхода в 4,8 раза, нерадикальный характер вмешательства (R1-R2) ‒ в 5 раз. Отсутствие местного рецидива снижало летальность в 5,81 раза.
Обсуждение
В литературе немного работ, посвященных лечению больных с метастазами тимом по плевре, серии наблюдений редко превышают 20 больных, что обусловлено редкостью патологии [4, 6–9]. Частота метастазирования по плевре при первичном обследовании не превышает 5,0–7,0 %, вероятность последующего, после удаления тимомы, прогрессирования с изолированным поражением плевры достигает 10,0 % [4–6]. Тактика лечения данной категории больных неоднозначна. Большинство исследователей отдают предпочтение максимальной циторедукции с предоперационной химиотерапией или без нее [1, 4–9]. Выполнения тотальной плеврэктомии обычно не требуется, рекомендуют удалять отдельные диссеминаты на париетальной плевре по типу частичной плеврэк-томии. Крайне редко возникает необходимость в выполении плевропневмонэктомии, однако эта операция не нашла широкого применения в хирургии диссеминированных тимом из-за высокой частоты осложнений и летальности [1, 4, 5]. Y. Ishikawa et al. [10] выполнили экстраплевральную плевропневмонэктомию у 4 больных с диссеминацией тимомы по плевре без летальных исходов, причем только в 1 случае отмечено прогрессирование опухоли. В нашей исследовании мы выполняли частичную плеврэктомию всем больным, при необходимости с резекцией легкого, диафрагмы, грудной стенки. Наиболее часто для удаления первичной опухоли использовали стернотомию, дополняя ее торакотомией в VII–VIII межреберье для удаления диссеминатов в нижних отделах гемиторакса и диафрагмальной поверхности. Для частичной плеврэктомии у больных с метастазами по плевре, выявленных при динамическом наблюдении, использовали боковой торакотомный доступ, дополняя его второй торакотомией в VII–VIII межреберье по показаниям, указанным выше. У двух больных единичные диссеминаты тимомы по плевре удалили при торакоскопии. В литературе описаны случаи диссеминации тимомы после торакоскопической тимэктомии, которые обусловлены повреждением капсулы опухоли при мобилизации опухоли или ее извлечении из плевральной полости без контейнера. Однако J. Vanucci et al. [11] сообщили о множественных метастазах по плевре и перикарду, возникших через 18 мес после торакоскопической тимомэктомии, выполненной с соблюдением всех правил абластики. Вполне вероятно, что микрометастазы опухоли в плевру уже существовали на момент первой операции.
Из-за относительно молодого возраста больных тимомой и их хорошего объективного статуса летальность невелика, послеоперационные осложнения не превышают 30,0 % [1, 4–9]. В нашем исследовании послеоперационные осложнения развились в 28,6 %, летальность составила 9,5 % (2/21). В первом случае летальный исход был обусловлен резекцией обоих диафрагмальных нервов, и, несмотря на выполнение двусторонней плика-ции диафрагмы, больной погиб от прогрессирования дыхательной недостаточности. Повреждение обоих диафрагмальных нервов – крайне тяжелое интраоперационное осложнение, единственным способом коррекции которого является двусторонняя пликация диафрагмы. Во втором случае в раннем послеоперационном периоде после удаления опухоли средостения и плевральных диссеминатов развился острый тромбоз верхней полой вены, попытка реконструктивной операции не увенчалась успехом, больная погибла от отека головного мозга.
M. Yano et al. [12] приводят данные о комбинированном лечении больных тимомой IVA стадии с предоперационной терапией кортикостероидами и послеоперационной лучевой терапией: общая 5-летняя выживаемость составила 73,6 %, в то время как без операции ни один больной не дожил до 5 лет. M. Lucchi et al. [6] приводят данные об общей 5- и 10-летней выживаемости после удаления метастазов по плевре, равной 43,1 и 25,8 % соответственно. По данным O. Rena et al. [4], применение комплексного подхода у больных эпителиальной опухолью вилочковой железы IVA стадии с предоперационной ХТ (4 курса) и послеоперационной лучевой терапией на средостение позволило добиться 5- и 10-летней выживаемости, равной 85,0 и 58,0 % соответственно. Мы получили сходные данные у больных после удаления метастазов тимомы по плевре.
Основной целью операции при метастазах эпителиальных опухолей вилочковой железы по плевре является достижение оптимальной циторедукции (R0-резекции). По данным литературы, полностью удалить все диссеминаты удается в 34–100 % [1, 4–6, 8, 9]. По нашим данным, R0-резекцию удалось выполнить у 12 (57,2 %) больных. Радикальность операции является основным прогностическим фактором, благоприятно влияющим на отдаленную и безрецидивную выживаемость. При этом гистотип опухоли (тимома или рак тимуса) не оказывает влияния на данные показатели. При наличии метастатического поражения плевры степень дифференцировки опухоли уходит на второй план, уступая место распространенности процесса. Принимая во внимание достоверное влияние радикальности операции на отдаленную выживаемость, при выборе лечебной тактики хирургический метод является ведущим при условии полной циторедукции.
В ряде работ авторы использовали после удаления диссеминатов внутриплевральную гипертермическую химиотерапию или фотодинамическую терапию [5, 13, 14]. Наибольшего внимания заслуживает исследование A. Yellin et al. [13], в котором представлен опыт внутриплевральной гипертермической химиотерапии у 35 больных эпителиальными опухолями вилочковой железы с метастазами по плевре: тяжелые осложнения IIIA степени и выше отмечены у 4 (11,4 %), летальность составила 2,5 %. Общая 5- и 10-летняя выживаемость составила 81,0 и 73,0 % у больных с IVA стадией, при прогрессировании заболевания ‒ 67,0 и 56,0 % соответственно, причем у больных раком вилочковой железы 5-летней выживаемости не отмечено. Мы также использовали данные методики: внутриплевральная гипертермическая химиотерапия с препаратом цисплатин применена у 4, интраоперационная фотодинамическая терапия – у 4 больных. Серьезных побочных эффектов мы не наблюдали. Анализ отдаленных результатов этой группы больных затруднен из-за малочисленности.
Усовершенствование методик лучевой терапии позволило пересмотреть ее использование при оли-гометастатическом прогрессировании. D. Okazaki et al. [15] применили прицельную лучевую терапию при единичных метастазах тимом по плевре у 20 больных с общей 5-летней выживаемостью 86,0 % и выживаемостью без прогрессирования на уровне 16,0. В целом, лучевая терапия не нашла широкого применения при метастатическом поражении плевры у больных опухолями вилочковой железы.
Список литературы Эпителиальные опухоли вилочковой железы с диссеминацией по плевре: роль циторедуктивной хирургии
- Ruffni E., Filosso P.L., Guerrera F., Lausi P., Lyberis P., Oliaro A. Optimal surgical approach to thymic malignancies: New trends challenging old dogmas. Lung Cancer. 2018; 118: 161-70. https://doi.org/10.1016/j.lungcan.2018.01.025.
- Masaoka A., Monden Y., Nakahara K., Tanioka T. Follow-up study of thymomas with special reference to their clinical stages. Cancer. 1981 Dec; 48(11): 2485-92. https://doi.org/10.1002/1097-0142(19811201)48:113.0.co;2-r.
- Markowiak T., Hofmann H.S., Ried M. Classification and staging of thymoma. J Thorac Dis. 2020; 12(12): 7607-12. https://doi.org/10.21037/jtd-2019-thym-01.
- Rena O., Mineo T.C., Casadio C. Multimodal treatment for stage IVA thymoma: a proposable strategy. Lung Cancer. 2012; 76(1): 89-92. https://doi.org/10.1016/j.lungcan.2011.10.004.
- Shapiro M., Korst R.J. Surgical approaches for stage IVA thymic epithelial tumors. Front Oncol. 2014; 3. https://doi.org/10.3389/fonc.2013.00332.
- Lucchi M., Davini F., Ricciardi R., Duranti L., Boldrini L., Palmiero G., Basolo F., Mussi A. Management of pleural recurrence after curative resection of thymoma. J Thorac Cardiovasc Surg. 2009; 137(5): 1185-9. https://doi.org/10.1016/j.jtcvs.2008.09.033.
- Huang J., Rizk N.P., Travis W.D., Seshan V.E., Bains M.S., Dycoco J., Downey R.J., Flores R.M., Park B.J., Rusch V.W. Feasibility of multimodality therapy including extended resections in stage IVA thymoma. J Thorac Cardiovasc Surg. 2007; 134(6): 1477-83. https://doi.org/10.1016/j.jtcvs.2007.07.049.
- Turna A., Sarbay İ. Multimodality approach in treatment of thymic tumors. J Thorac Dis. 2020; 12(12): 7626-34. https://doi.org/10.21037/jtd-20-818.
- Funaki S., Shintani Y., Fukui E., Kanzaki R., Kanou T., Ose N., Minami M., Okumura M. Surgical treatment strategies for invasive thymoma. J Thorac Dis. 2020; 12(12): 7619-25. https://doi.org/10.21037/jtd-19-3045.
- Ishikawa Y., Matsuguma H., Nakahara R., Suzuki H., Ui A., Kondo T., Kamiyama Y., Igarashi S., Mori K., Kodama T., Yokoi K. Multimodality therapy for patients with invasive thymoma disseminated into the pleural cavity: the potential role of extrapleural pneumonectomy. Ann Thorac Surg. 2009; 88(3): 952-7. https://doi.org/10.1016/j.athoracsur.2009.05.019.
- Vannucci J., Pecoriello R., Ragusa M., Puma F. Multiple pleuropericardial implants of thymoma after videothoracoscopic resection. Interact Cardiovasc Thorac Surg. 2010; 11(5): 696-7. https://doi.org/10.1510/icvts.2010.246322.
- Yano M., Sasaki H., Yukiue H., Kawano O., Okuda K., Hikosaka Y., Fujii Y. Thymoma with dissemination: efcacy of macroscopic total resection of disseminated nodules. World J Surg. 2009; 33(7): 1425-31. https://doi.org/10.1007/s00268-009-0069-4.
- Yellin A., Simansky D.A., Ben-Avi R., Perelman M., Zeitlin N., Refaely Y., Ben-Nun A. Resection and heated pleural chemoperfusion in patients with thymic epithelial malignant disease and pleural spread: a single-institution experience. J Thorac Cardiovasc Surg. 2013; 145(1): 83-7. https://doi.org/10.1016/j.jtcvs.2012.10.013.
- Belcher E., Hardwick T., Lal R., Marshall S., Spicer J., LangLazdunski L. Induction chemotherapy, cytoreductive surgery and intraoperative hyperthermic pleural irrigation in patients with stage IVA thymoma. Interact Cardiovasc Thorac Surg. 2011; 12(5): 744-7. https://doi.org/10.1510/icvts.2010.255307.
- Okazaki D., Shibamoto Y., Yanagi T., Ishikura S., Kondo T., Yamada Y., Niwa M. Local radiotherapy for pleural dissemination of thymic tumors after initial treatment. J Radiat Res 2021; 62(4): 676-81. https://doi.org/10.1093/jrr/rrab046.


