Эпителиоидная гемангиоэндотелиома лёгкого: клинический случай
Автор: Туромша А.Н., Протасова А.Э., Шеремет М.Ю.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Клинические случаи
Статья в выпуске: 3 т.15, 2025 года.
Бесплатный доступ
Эпителиоидная гемангиоэндотелиома (ЭГЭ) — крайне редкая сосудистая саркома, характеризующаяся уникальными морфологическими и молекулярными признаками. Заболеваемость составляет около 1 случая на миллион человек. В данной публикации представлены данные клинических случаев с различными локализациями ЭГЭ, опубликованных в отечественной литературе. Представлен наш уникальный клинический пример ЭГЭ лёгкого, сопровождавшийся значительными трудностями гистологической верификации. В работе проанализированы особенности диагностики данного заболевания, а также представлены данные о проведённом лечении и его результатах.
Эпителиоидная гемангиоэндотелиома, эпителиоидная гемангиоэндотелиома лёгкого, сосудистые опухоли, компьютерно-томографические признаки эпителиоидной гемангиоэндотелиомы
Короткий адрес: https://sciup.org/140312609
IDR: 140312609 | DOI: 10.18027/2224-5057-2025-052
Текст научной статьи Эпителиоидная гемангиоэндотелиома лёгкого: клинический случай
Эпителиоидная гемангиоэндотелиома (ЭГЭ) — одна из редких опухолей; её заболеваемость составляет примерно 1 случай на 1 миллион [1]. В отечественной литературе и зарубежных источниках описаны преимущественно отдельные клинические случаи ЭГЭ, однако существуют и более крупные серии наблюдений, включающие до 93 пациентов [2]. Несмотря на редкость, ЭГЭ обладает уникальными характеристиками, которые делают её предметом особого интереса.
Чаще всего эпителиоидная гемангиоэндотелиома диагностируется у пациентов среднего возраста (около 50 лет). Она может поражать различные органы: печень, легкие, мягкие ткани и кости. Также возможно и одновременное поражение нескольких органов [3].
По классификации Всемирной организации здравоохранения 2020 года данный вид опухоли относится к со- судистым опухолям низкой степени злокачественности, которые возникают из эндотелиальных клеток [1,3].
С морфологической точки зрения ЭГЭ состоит из эпителиоидных клеток со стекловидной эозинофильной цитоплазмой и интрацитоплазматическими вакуолями, располагающихся в тяжах, гнездах или трабекулах на фоне миксогиалинового стромального компонента. Встречаются участки кровоизлияний и, реже, криброзные структуры, имитирующие карциному. Примерно в 10 % случаев наблюдаются участки высокой митотической активности, ядерной атипии и некроза, ассоциированные с более агрессивным течением. Иммуногистохимически ЭГЭ постоянно экспрессирует маркеры эндотелиальной дифференцировки: CD31, ERG, CD34 и FLI-1. Очаговая позитивность по цитокератину выявляется менее чем в 30 % случаев, выраженная и диффузная позитивность — крайне редко [4].
Термин ЭГЭ был введен в 1982 году в работе S. Weiss и F. Enzinger. В своем исследовании они классифицировали эту опухоль как сосудистую, с признаками как гемангиомы, так и эндотелиомы, что позволило выделить её среди других опухолей. Их работа стала основой для более широкого понимания этой редкой патологии [5]. Этиология эпителиоидной гемангиоэндотелиомы не до конца изучена. Считается, что ЭГЭ развивается в результате специфических генетических изменений, которые приводят к злокачественной трансформации эндотелиальных клеток сосудов. Основной причиной, установленной на сегодняшний день, является характерная хромосомная транслокация t(1;3) (p36.3; q25), которая встречается более чем в 90% случаев и приводит к слиянию генов WWTR1 и CAMTA1 . При этом установлено, что подобные перестройки отсутствуют в эпителиоидной гемангиоме — доброкачественной сосудистой опухоли, которую иногда ошибочно принимают за ЭГЭ. Слияние генов WWTR1 и CAMTA1 играет основополагающую роль в биологии опухоли. Этот белок действует как фактор транскрипции и может стать перспективной мишенью для таргетной терапии эпителиоидной гемангиэндотелиомы [6].
Диагностика ЭГЭ представляет значительные сложности ввиду морфологического и иммуногистохимического сходства с рядом других опухолей. Основной дифференциальный диагноз ЭГЭ проводится с первичными и метастатическими карциномами, мезотелиомой, эпителиоидной саркомой, ангиосаркомой и псевдомиогенной гемангиоэндотелиомой [7]. Ключевыми признаками ЭГЭ служат экспрессия эндотелиальных маркеров (CD31, ERG и др.) и отсутствие характерных маркеров других опухолей [8].
Рентгенологическая картина ЭГЭ легких может варьировать. По данным литературы, описаны четыре основных паттерна, выявляемых при компьютерной томографии: множественные легочные очаги, ретикулонодулярные затемнения, диффузное утолщение плевры и узловое образование с вовлечением плевры, имитирующее злокачественную мезотелиому плевры [9].
В настоящее время не существует единого подхода в тактике ведения пациентов с ЭГЭ. Могут применяться хирургическое лечение, лучевая и лекарственная терапия. Хирургический метод лечения направлен на полную резекцию опухоли и является основным при технической возможности. Лучевая терапия используется чаще всего как дополнение при неполной резекции опухоли или невозможности выполнения хирургического вмешательства [10]. Нет достаточных данных для назначения системной лекарственной терапии в неоадъювантном или адъювантном режимах. При наличии у пациента распространенной формы заболевания с бессимптомными нерезектабель-ными метастазами предпочтительной тактикой является активное наблюдение с последующим началом системной терапии при появлении новых очагов, их быстром росте либо возникновении симптомов заболевания [11].
У пациентов с наличием симптомов заболевания или при прогрессировании процесса назначается системная лекарственная терапия.
До настоящего времени не проводилось ни одного рандомизированного исследования II или III фазы, посвященного ЭГЭ. Доступны лишь результаты двух исследований II фазы.В настоящее время проводятся только два проспективных клинических исследования с использованием эрибулина и траметиниба (ClinicalTrials. gov ID: NCT03331250 и NCT03148275). Таким образом, текущая клиническая практика в основном опирается на ретроспективные серии случаев или отдельные клинические наблюдения (уровень доказательности IV–V). В литературе описаны данные о применении ингибиторов тирозинкиназ сосудистого эндотелиального фактора роста (VEGFR), например, препарата пазопаниб. В исследовании с участием 10 пациентов с ЭГЭ, получавших пазопаниб, был достигнут объективный ответ у 20 % больных, медиана выживаемости без прогрессирования и общая выживаемость составила примерно 26 месяцев [12].
Альтернативным вариантом, особенно у пациентов с выраженным болевым синдромом, может служить применение MEK-ингибитора траметиниба. В исследовании II фазы с участием 42 пациентов с ЭГЭ с транслокацией TAZ-CAMTA1, подтвержденной FISH-исследованием, траме-тиниб продемонстрировал медиану времени до прогрессирования 10 месяцев и объективный ответ в 4% случаев. Медиана двухлетней общей выживаемости составила 33%. Среди пациентов, получавших опиаты, в течение четырех недель после начала терапии траметинибом отмечалось снижение интенсивности болевого синдрома [13].
При наличии противопоказаний к анти-VEGFR терапии или MEK-ингибиторам возможно применение цитостатиков — гемцитабина, паклитаксела или схем с карбо-платином, хотя данные об эффективности химиотерапии остаются противоречивыми [14–16].
Дополнительные опции включают сиролимус (ингибитор mTOR) и леналидомид, применение которого в отдельных случаях сопровождалось стабилизацией заболевания до 3 лет [17,18]. Учитывая ограниченные опции терапии пациентов с ЭГЭ, следует рассматривать возможность участия пациентов в клинических исследованиях.
В 2020 году Европейское общество медицинской онкологии (ESMO) провело консенсусное совещание, чтобы обновить свои рекомендации по лечению сарком, уделив особое внимание ЭГЭ. Эксперты подчеркнули важность мультидисциплинарного подхода к диагностике и лечению пациентов с данным заболеванием [19].
В отечественной литературе за последние годы описаны несколько клинических случаев ЭГЭ. Представлены данные о хирургическом лечении ЭГЭ и о применении лучевой терапии. В то же время в российских публикациях практически отсутствуют данные о возможности лекарственного лечения ЭГЭ.
В 2022 году в журнале «Архив патологии» опубликована статья, в которой описаны клинико-рентгенологические и патологоанатомические характеристики ЭГЭ на примере 27 пациентов. Средний возраст больных составил 35 лет. Согласно представленным данным, заболевание в большинстве случаев протекало бессимптомно на начальных стадиях, а патологические изменения в лёгких выявлялись случайно при проведении рентгенографии при профилактическом осмотре. Почти у всех пациентов, за исключением одного случая, течение болезни носило доброкачественный характер, демонстрируя тенденцию к стабилизации заболевания. Морфологическим подтверждением такого течения являлось развитие выраженных склеротических изменений в тканях [20].
В 2019 году в журнале «Вестник рентгенологии и радиологии» описан клинический случай ЭГЭ печени у 47-летнего пациента. При проведении компьютерной томографии в паренхиме печени были выявлены множественные, частично сливающиеся образования. Для верификации диагноза пациенту дважды выполняли чрескожную трепан-биопсию образований в правой доле печени под контролем УЗИ. Однако результаты гистологического исследования указывали на высокую вероятность метастатического поражения печени, исходящего из хрящеобразующей опухоли. Окончательный диагноз был установлен после проведения диагностической лапароскопии с биопсией очагов в печени. Комплексное гистологическое и иммуногистохимическое исследование позволило верифицировать диагноз эпителиоидной гемангиоэндотелиомы [21].
В 2020 году в журнале «Голова и шея» описан случай лечения 6 0 -летней пациентки с ЭГЭ носовой полости. Пациентка в течение 3–4 месяцев отмечала периодические носовые кровотечения и затруднение носового дыхания. Ей была выполнена эндоназальная эндоскопическая резекция опухоли, после чего, по результатам послеоперационного гистологического исследования был подтвержден диагноз «эпителиоидная гемангиоэндотелиома» синоназальной локализации [22].
В 2022 году в журнале «Российская ринология» был так же представлен клинический пример хирургического лечения ЭГЭ полости носа у пациентки 82 лет [23].
В 2024 году в журнале «Онкологический вестник» представлен клинический случай ЭГЭ мягких тканей правого бедра у 60-летней пациентки. Пациентка обратилась с жалобами на образование в области бедра ещё в 2019 году, однако окончательный диагноз был установлен лишь в 2021 году на основе гистологического исследования [24].
В 2022 году в журнале «Российский журнал детской гематологии и онкологии» представлено чрезвычайно редкое клиническое наблюдение первичной множественной гемангиоэндотелиомы с поражением центральной нервной системы у девочки 14 лет.С 7 лет пациентка страдала эпилепсией и принимала медикаментозную терапию, которая не оказывала ожидаемого контроля над заболеванием. При выполнении магнитно-резонансной томографии выявлены множественные очаги в головном мозге. После проведения дифференциальной диагностики и выполнения биопсии очага в головном мозге подтвержден диагноз ЭГЭ [25].
Представленные клинические примеры еще раз подчеркивают сложность диагностики и лечения ЭГЭ, а также акцентируют внимание на важности индивидуализированного подхода в каждом конкретном случае.
КЛИНИЧЕСКИЙ СЛУЧАЙ
В данном клиническом примере описано редкое наблюдение пациента с эпителиоидной гемангиоэндотелиомой лёгкого, описываются сложности, возникшие при гистологической верификации данного заболевания, а также вопросы диагностики и лечения.
Пациент П. 62 года.
Анамнез заболевания:
В 2021 году при плановом медицинском осмотре направлен на выполнение флюорографии. Выявлены двусторонние множественные образования в лёгких, что послужило основанием для дальнейшего обследования. В августе 2022 г. пациенту была выполнена видеоторакоскопия с атипичной резекцией нижней и верхней долей левого лёгкого.
Послеоперационное гистологическое исследование установило наличие в ткани лёгкого очагов неспецифического гранулёматозного воспаления, характерных для саркоидоза.
На основании этого заключения пациенту было рекомендовано динамическое наблюдение.
В январе 2024 г. пациент самостоятельно обратился для пересмотра патоморфологического материала в ФГБУ «НМИЦ онкологии им. Н. Н. Петрова», где был установлен диагноз: эпителиоидная гемангиоэндотелиома лёгких.
В феврале 2024 г. на основании ПЭТ-КТ в режиме «всё тело» с 18-фтордезоксиглюкозой установлено прогрессирование заболевания: в сравнении с данными ПЭТ-КТ от 12.2021 г. картина множественных очагов в лёгких. В динамике отмечается увеличение размеров и появление новых очагов, увеличение размеров гиподенсных очагов в печени и появление гиперметаболизма глюкозы в единичном очаге (см. рис. 1).
В марте 2024 г. выполнен пересмотр гистологического материала в ФГБУ «НМИЦ онкологии им. Н.Н. Блохина», где подтвержден диагноз эпителиоидная гемангиоэндотелиома лёгких. При иммуногистохимическом исследовании: опухолевые клетки: СDЗ4, ЕRG (ярко, диффузно) — позитивны.
При молекулярно-генетическом исследовании не обнаружены мутации в генах EGFR и BRAF.Выполнена биопсия печени: иммунофенотип опухоли в печени соответствует эпителиоидной гемангиоэндотелиоме. Учитывая редкость заболевания, прогрессирование по данным ПЭТ-КТ от 02.2024, отсутствие стандартных методов лечения и распространение процесса, в ФГБУ «НМИЦ онкологии им. Н. Н. Петрова» и в ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» пациенту рекомендовано проведение таргетной терапии препаратом пазопаниб.
На момент начала лечения пациент предъявлял жалобы на боли в грудной клетке (1–2 балла по шкале ВАШ). С 10.04.2024 по настоящее время пациенту проводится тар-гетная терапия ингибитором тирозинкиназ — препаратом пазопаниб в стандартной дозе с выполнением контрольных обследований: ПЭТ-КТ в режиме «всё тело» с 18-фтордезоксиглюкозой каждые 3 месяца (см. рис. 2).
На фоне лечения у пациента сохраняется дискомфорт в области грудной клетки. Клинико-биохимические показатели крови в рамках референсных значений.
Из побочных эффектов таргетной терапии у пациента на 2 месяце лечения появилась сухость кожных покровов 1 степени по NCI CTCAE v5.0. Данный побочный эффект не оказывает значимого влияния на качество жизни пациента и не требует редукции дозы препарата. Симптоматика купируется наружной терапией. На март 2025 года эффект лечения расценивается как стабилизация заболевания, что подтверждается результатами контрольных обследований.
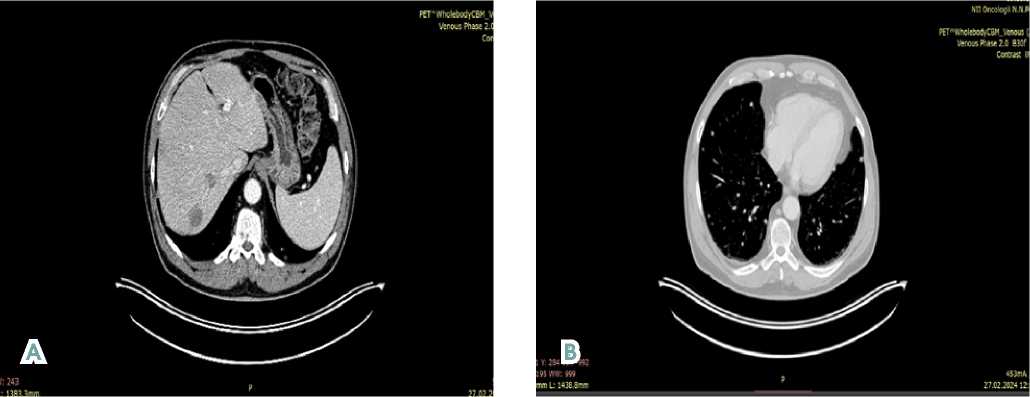
Рисунок 1. ПЭТ-КТ в режиме «всё тело» с 18-фтордезоксиглюкозой (от 27.02.2024 г.). A — визуализируются крупные очаги в печени, B — визуализируются множественные очаги в лёгких
Figure 1. 18-FDG “whole body”PET-CT (from 02/27/2024). A — largefoci in the liver, В — multiple foci in the lungs
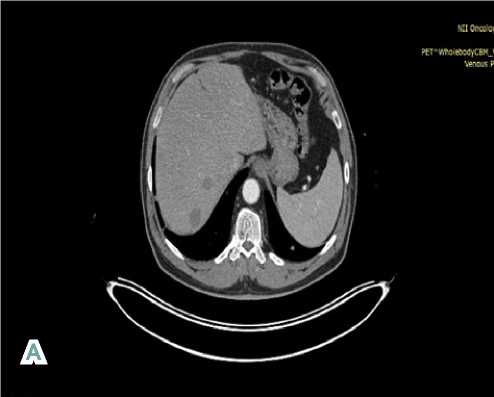
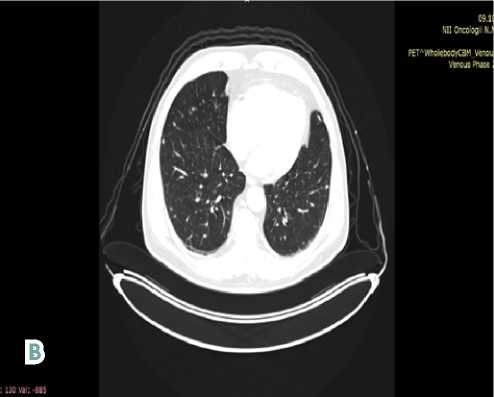
Рисунок 2. Контрольная ПЭТ-КТ в режиме «всё тело» с 18-фтордезоксиглюкозой (от 17.01.2025 г.). Стабилизация заболевания. A — очаги в печени; B — множественные очаги в лёгких
Figure 2. Control 18-FDG PET-CT (from 01/17/2025). Stabilization of the disease. A — foci in the liver; В — multiple foci in the lungs
ОБСУЖДЕНИЕ
В настоящее время длительность терапии пазопанибом данного пациента составляет 1 год и 3 месяца. На фоне лечения достигнута стабилизация заболевания. Подобный клинический ответ соответствует опубликованным данным в ранее приведенном исследовании о применении ингибиторов тирозинкиназ VEGFR при эпителиоидной гемангиоэндотелиоме. Несмотря на ограниченность доказательной базы и отсутствие рандомизированных исследований, результаты отдельных наблюдений, включая наш случай, подтверждают, что пазопаниб может рассматриваться как возможный вариант системной терапии у пациентов с нерезектабельным или метастатическим течением ЭГЭ.
ВЫВОДЫ
Представлен уникальной опыт эффективного лекарственного лечения диссеминированной ЭГЭ легкого. Цель данной публикации заключается в обмене опытом между специалистами, что способствует совершенствованию диагностики и выбора лечебной тактики представленного заболевания. Каждый клинический случай является важным вкладом в накопление знаний об особенностях течения заболевания и эффективных методах лечения ЭГЭ.


