Эпштейна-Барра вирусная инфекция у детей: особенности цитокинового ответа и иммунопатологические реакции
Автор: Хмилевская Светлана Анатольевна, Зайцева Ирина Александровна, Михайлова Елена Владимировна
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Инфекционные болезни
Статья в выпуске: 2 т.5, 2009 года.
Бесплатный доступ
В работе представлены результаты наблюдения за 100 пациентами в возрасте от 1 до 18 лет с различными вариантами течения Эпштейна-Барра вирусной инфекции. Выявлены клинические особенности инфекционного мононуклеоза при первичной инфекции и ее реактивации. Проведена оценка напряженности процессов аутосенсибилизации. Показаны взаимосвязь аутоиммунных и цитокиновых реакций, а также их участие в формировании органопатологии при Эпштейна-Барра вирусной инфекции.
Эпштейна-барра вирусная инфекция, цитокины, аутоантитела
Короткий адрес: https://sciup.org/14916891
IDR: 14916891
Текст научной статьи Эпштейна-Барра вирусная инфекция у детей: особенности цитокинового ответа и иммунопатологические реакции
1Иммунопатологические процессы, как правило, обусловлены нарушением механизмов иммунорегуляции в результате воздействия различных факторов, в том числе инфекционных агентов. В последние годы все больше исследователей привлекает проблема вирусиндуцированной иммунопатологии и ее роль в формировании исходов заболевания [6].
Особенности Эпштейна-Барра вирусной инфекции позволяют рассматривать ее как заболевание иммунной системы, при котором возможно развитие целого ряда иммунопатологических реакций и создаются условия для возникновения аутоиммунных нарушений, агрессии провоспалительных цитокинов и свободных радикалов, обусловливающих различные осложнения со стороны функционирования органов и систем [5].
У вируса обнаружено большое количество генов, дающих ему возможность в определенной мере ускользать от иммунной системы человека. Его способность угнетать клеточный иммунитет, высокая му-табельность могут явиться причиной формирования хронических форм инфекции. Так как является генетическим «паразитом», в основе его взаимодействия с организмом всегда лежит патологический процесс на уровне клетки, который реализуется путем взаи модействия вирусных и клеточных генов. Особен-
ности репликации, необходимость перманентного достраивания доминирующей цепи определяет вероятность ошибок, многовариативность и гетерогенность вируса. Выживание возбудителя путем интеграции с геномом инфицированных лимфоцитов при ЭБВ-инфекции может стать причиной ряда аутоиммунных заболеваний [3].
Иммунотерапия при данном заболевании, как правило, обоснована, однако ее использование, при наличии иммунной дисфункции и наследственной предрасположенности, может привести к развитию иммунопатологических состояний. В связи с этим становится понятной необходимость дальнейшего изучения показателей как иммунных, так и аутоиммунных реакций у больных различными формами Эпштейна-Барра вирусной инфекции.
Цель работы : оценить напряженность аутоиммунных реакций в зависимости от варианта течения инфекции и уровня цитокинов, выявить особенности цитокинового статуса и аутоиммунного профиля органов у детей с Эпштейна-Барра вирусной инфекцией.
Материалы и методы исследования. Обследовано 100 пациентов в возрасте от 1 до 18 лет, находившихся на стационарном лечении в 5 детской инфекционной больнице г. Саратова с диагнозом «Инфекционный мононуклеоз Эпштейна-Барра вирусной этиологии». Больные отбирались методом случайной выборки. Для верификации диагноза применялись клинические, серологические и молекулярные методы диагностики.
Критериями включения в протокол исследования являлись: наличие активно протекающей Эпштейн-Барр вирусной инфекции в форме инфекционного мононуклеоза, возраст от 1 до 18 лет, информированное согласие законного представителя больного. Критерии невключения: отсутствие маркеров Эпштейна-Барра вирусной инфекции, тяжелые сопутствующие и обострения хронических заболеваний, диффузные заболевания соединительной ткани, ревматическая патология. Критерии исключения ребенка из протокола: отказ законных представителей больного от участия в протоколе, нарушения протокола.
На основании профиля антител к АГ ЭБВ (определение серологических маркеров Эпштейна-Барра вирусной инфекции осуществлялось с помощью диагностических наборов фирмы «Вектор-Бест», Россия) пациенты были разделены на 2 группы. Первую группу составили 57 детей, у которых на момент поступления в стационар обнаруживались маркеры первичной Эпштейна-Барра вирусной инфекции (IgM к VCA и\или IgG к ЕА при отсутствии IgG к EBNA). Во вторую группу вошли 43 ребенка, имевшие, наряду с диагностическими титрами IgM к VCA, IgG к EBNA (ОП>0,5), что свидетельствовало о реактивации инфекции [1,2]. Группу контроля составили 25 относительно здоровых детей аналогичного возраста.
Помимо рутинных методов исследования у всех больных определялся ряд биохимических показателей сыворотки крови (активности аланинаминотрансферазы (ALT), аспартатаминотрансфераза (AST), щелочной фосфатазы (ЩФ), билирубина на биохимическом анализаторе Vitalab Flexor E наборами реагентов фирмы DiaSys, Германия). 94 пациентам произведено ультразвуковое исследование печени, поджелудочной железы и селезенки. Всем обследованным при поступлении, в периоде ранней реконвалесценции и через полгода после выписки из стационара проводилась 12-канальная ЭКГ в общепринятых отведениях на компьютерном аппарате с мониторным наблюдением фирмы «Волготех» (г. Саратов).
С целью изучения выраженности иммунопатологических реакций определялись ЦИК (метод преципитации полиэтиленгликолем) и титры аутоантител в сыворотке крови к тканям сердца, печени, селезенки, поджелудочной железы, почек, кишечника, тимуса, легких и мозга микрометодом в РПГА с использованием приоритетных противоорганных эритроцитарных диагностикумов (по методике Л.Н. Шаниной 1985 г., step-test). Для адекватной оценки полученных результатов было произведено обратное преобразование показателей с последующим вычислением среднего геометрического (учитывая характер и распределение данных).
Уровень цитокинов (интерлейкина-1β (ИЛ1), интерлейкина-2 (ИЛ2), интерлейкина-4 (ИЛ4), интерлейкина-6 (ИЛ6), фактора некроза опухоли α (ФНОα), интерферона-α (ИФНα), интерферона-γ (ИФН-γ) в сыворотке крови определяли методом твердофазного иммуноферментного анализа с использованием стандартных систем производства ООО «Цитокин» (СПб).
Лабораторные исследования проводились в динамике заболевания (при поступлении (4–7 дни болезни) и в периоде реконвалесценции (12–18 дни болезни), а также при диспансерном осмотре (через 6, 9, 12 и 18 месяцев после выписки из стационара).
Обработка результатов исследования выполнялась на компьютерах серии Pentium, с использованием пакета прикладных программ Statistica 6,0 и Microsoft Exel for Windows 4,0. Для описательной статистики использовали параметрические и непараметрические методы с указанием средних величин и стандартной ошибки среднего (формат М+m). Оценка различий между двумя долями (учитывая достаточный объем выборки) и средними арифметическими (для показателей с нормальным распределением) проводилась с помощью t-критерия. При несоблюдении нормальности распределения количественных показателей для сравнения использовался U тест Манна-Уитни. Анализ зависимости маркеров эндотоксикоза, показателей аутоантителообразования и уровней цитокинов проводился с помощью метода ранговой корреляции по Спирмену.
Результаты исследования. Первичная форма ЭБВ-инфекции встречалась преимущественно у детей от 3 до 7 лет — 35% (20 человек) и от 12 до 18 лет — 33% (19 человек), что согласуется с данными литературы о двухпиковом возрастном распределении заболеваемости в нашей стране [6, 7]. В возрасте от 1 до 3 лет и от 7 до 12 лет заболевание регистрировалось в 2 раза реже (16% (9 человек) и 16% (9человек) соответственно).
Случаи реактивации инфекции были более характерны для пациентов младшего возраста (от 1 до 3 лет — 44% (19 человек), от 3 до 7 лет — 30%(13 человек), со снижением частоты до 8% (3 больных) у детей от 7 до 12 лет, и некоторым увеличением в старшей возрастной группе (до 18% (8 человек) в возрасте от 12 до 18 лет). Подобное распределение, вероятнее всего, вызвано особенностями иммунологической реактивности в данном возрасте. На основании вычисления t-критерия наиболее значимым (р<0,05) явилось преобладание во 2 группе детей младшего возраста.
Клиническая картина у находившихся под нашим наблюдением больных носила типичный характер с развитием основного симптомокомплекса, включавшего лихорадку, тонзиллит, затруднение носового дыхания, лимфоаденопатию с преимущественным увеличением лимфоузлов шейной группы, гепато-спленомегалию и изменения периферической крови. Однако выраженность и частота выявления данных симптомов зависела от варианта течения инфекции — первичная или реактивация.
При реактивации процесса течение заболевания протекало в более легкой форме, были менее выражены лихорадочная реакция, симптомы интоксикации, лимфопролиферативный синдром, воспалительные изменения в рото- и носоглотке (р<0,05) (рис.1). Продолжительность таких клинических проявлений, как лихорадка, боль в горле и затруднение носового дыхания у детей 2 группы была короче (р<0,05). Обращал на себя внимание тот факт, что частота гепато- и спленомегалии на момент выпи-
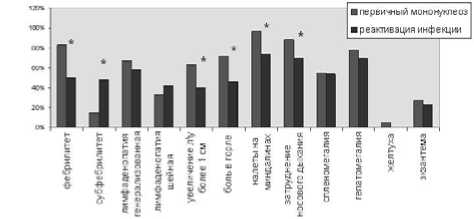
Рис.1. Частота основных симптомов заболевания в зависимости от варианта ЭБВ-инфекции при поступлении в стационар
* - достоверное отличие показателей при р<0,05
ски из стационара при реактивации ЭБВ-инфекции несколько превышала показатели при первичном инфекционном мононуклеозе (65% против 50% и 16% против 8% соответственно), несмотря на слабую выраженность данного симптома.
Гематологические сдвиги, такие как лейкоцитоз, лимфомоноцитоз, характеризовались большей частотой и выраженностью при первичной инфекции. Однако при поступлении в стационар процент выявления атипичных мононуклеаров и маркеров острого воспалительного процесса (ускорение СОЭ; сдвиг лейкоцитарной формулы влево) превалировал у больных 2 группы (68%, 90%, 40% и 47%, 75%, 28% соответственно) . К моменту выписки из стационара описанные выше изменения при реактивации инфекции встречались значительно реже, чем при первичном процессе (20%, 40%, 3% и 36%, 61%, 7% соответственно) .
Нарушение функционального состояния печени преимущественно проявлялось в виде повышения активности аминотрансфераз в 2–3 раза по сравнению с нормальными показателями, причем при впервые возникшем заболевании АЛТ была повышена в 50% случаев, а при реактивации — в 66%. Несмотря на тот факт, что отклонения перечисленных биохимических показателей достоверно чаще встречались при реактивации инфекции, выраженность их была значительно меньше, чем при первичном мононуклеозе (активность АЛТ составила 67,2 + 8,5 и 94,3 + 10,1 соответственно, различия достоверны при р<0,05). Осложнения в виде острого гепатита с гипербилирубинемией зарегистрированы только при первичной форме заболевания (5% случаев).
Данные УЗИ печени по ряду параметров, таких как увеличение размеров и изменение эхогенности, были сопоставимы с выраженностью клинических признаков поражения печени (увеличение размеров, боли в области печени) (коэффициенты корреляции 0,88 и 0,32; 0,74 и 0,39 соответственно при попарном определении). В то же время изменение биохимических показателей в большей части случаев не соответствовало данным полученным в ходе клинического и ультразвукового исследований. Значительная вариативность биохимических изменений, возможно, связана не только с цитолитической природой энзимологических сдвигов, но и с метаболическими осо- бенностями рассматриваемых вариантов Эпштейна-Барра вирусной инфекции [4].
Изменения сердечной деятельности по данным ЭКГ чаще регистрировались у пациентов 2 группы и проявлялись в виде нарушения функции автоматизма (снижения частоты сердечных сокращении и эктопических предсердных ритмов) — 24% против 15%; функции возбудимости (наджелудочковой экстрасистолии) — 2% против 0%; проводимости (неполной блокадой правой ножки пучка Гиса, атриовентрикулярной блокадой) — 32% против 24%. Диффузное снижение амплитуды зубца Т при отсутствии подъема сегмента ST и изменений комплексов QRS, расцененное нами как проявление миокардиодистрофии, было выявлено у 9% пациентов с первичным инфекционным мононуклеозом и у 25% — при реактивации инфекции (различия достоверны при р<0,05).
Изучение содержания циркулирующих иммунных комплексов при различных вариантах ЭБВ-инфекции показало его достоверное (р<0,05) увеличение на высоте клинических проявлений по сравнению со здоровыми детьми (рис. 2). Для первичного ИМ было характерно повышение уровня ЦИК до максимальных значений на пике клинических проявлений с последующим снижением до показателей нормы у 90% детей в течение 1–2 месяцев наблюдения. Изменения ЦИК при реактивации инфекции носили более сглаженный характер. Умеренное повышение показателя сохранялось у основной массы детей на протяжении последующего наблюдения в течение 1 года, с последующими колебаниями в зависимости от активности ЭБВ-инфекции.
Период максимальной выраженности симптомов заболевания сопровождался повышением концентрации исследуемых цитокинов в сыворотке крови у детей обеих групп. Однако при первичной инфекции уровень ИФНα, ИФНγ и ИЛ2 достоверно превышал таковые значения при рецидиве ИМ (р<0,05), что косвенно свидетельствует в пользу большей активности Тх-1 типа при данном варианте инфекции. Соотношение ИФНγ\ИЛ4 при остром ИМ было выше нормы в 1,6 раза. Реактивация сопровождалась менее выраженной активацией синтеза ИФНα, ИФНγ и ИЛ2 (что свидетельствует о слабой активации кле-
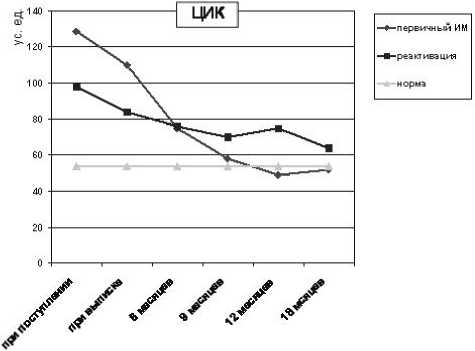
Рис.2. Динамика содержания в крови ЦИК при различных вариантах ЭБВ-инфекции
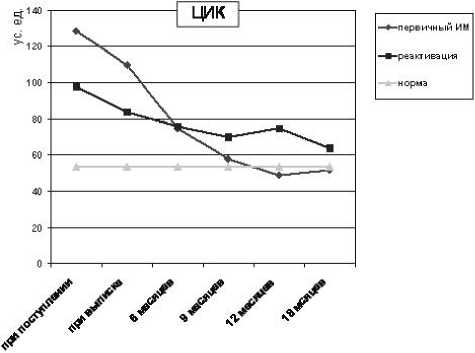
Рис.3. Уровень цитокинов в сыворотке крови у детей в зависимости от варианта ЭБВ-инфекции при поступлении в стационар
* — достоверное отличие показателей при р<0,05
точного звена иммунитета), а также более высоким содержанием в сыворотке крови ИЛ1, ИЛ4 и ФНОα (р<0,05). Отмечалось уменьшение соотношения ИФНγ\ИЛ4 в 1,9 раз по сравнению с показателями группы с первичной инфекцией и в 1, 2 раза по сравнению с показателями контрольной группы, что позволило говорить о наличии смещения иммунного ответа при реактивации инфекции в сторону гуморального (рис.3).
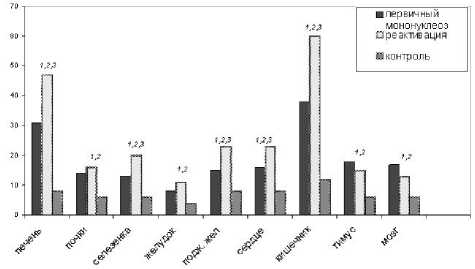
Рис.4. Уровень сенсибилизации к тканям различных органов у больных с разными вариантами ЭБВ-инфекции при поступлении в стационар (преобразованные показатели титров)
У больных с первичным ИМ установлено наличие умеренной по силе положительной связи между отдельными провоспалительными цитокинами (ИЛ1 и ФНОα) (r=0,58; р<0,01) и умеренной по силе отрицательной связи между провоспалительным цитокином ИФНγ и противовоспалительным ИЛ4 (r=-0,47; р<0,05). Реактивация инфекции характеризовалась той же направленностью связей.
При первичном инфекционном мононуклеозе имелась положительная связь между уровнями ИФНγ, ИЛ-1 и ЦИК (r= 0,59; 0,64 соответственно; р<0,05). Отрицательная связь установлена между показателями ЦИК и ИЛ-4 (r= -0,48; р<0,05) .
-
1 — достоверные отличия показателей группы с первичным мононуклеозом и контрольной (р<0,05);
-
2 — достоверные отличия показателей группы с реактивацией инфекции и контрольной (р<0,05);
-
3 — достоверные отличия показателей группы с первичным мононуклеозом и реактивацией инфекции (р<0,05);
В разгаре заболевания у детей обеих групп отмечалось повышение титров аутоантител к тканям всех исследуемых органов (р<0,05). Напряженность процессов аутосенсибилизации в большей степени зависела от давности инфицирования (коэффициент корреляции между вариантом инфекции и аутоантителами от 0,27 до 0,65 при р<0,001). При реактивации на высоте клинической симптоматики титры аутоантител к тканям печени, селезенки, кишечника, поджелудочной железы и сердца были достоверно выше, чем при первичном ИМ (уровень значимости критерия Манна-Уитни от 0,0002 до 0,001). В обеих группах наиболее высокие значения определялись к тканям кишечника и печени (рис.4).
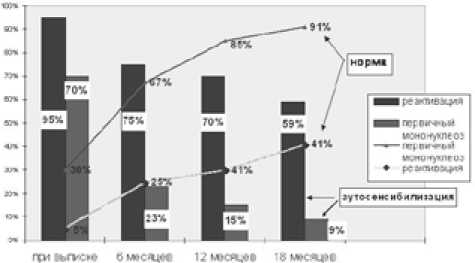
Рис.5. Удельный вес лиц с повышенными и нормальными титрами аутоантител в динамике наблюдения
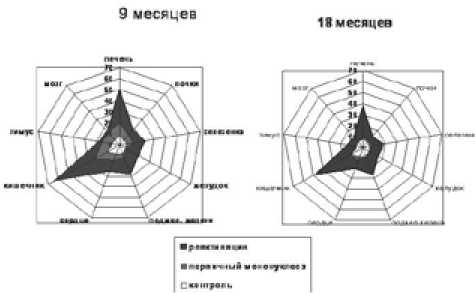
Рис.6. Напряженность аутоиммунных реакций у детей с различными вариантами ЭБВ-инфекции в динамике наблюдения (преобразованные показатели титров)
Анализ зависимости показателей аутоантителоо-бразования от уровня цитокинов и показателей ЦИК при первичном мононуклеозе показал наличие достоверных положительных связей между титрами аутоантител и провоспалительными цитокинами ИФНγ, ИЛ1 (коэффициенты корреляции от 0,35 до 0,57 при р<0,05); а также аутоАТ и ЦИК (коэффициенты корреляции от 0,31 до 0,44, при р<0,05).
При реактивации инфекции наиболее тесные положительные связи выявлены между уровнем ФНОα и титрами органоспецифических антител к тканям кишечника, печени, сердца, поджелудочной железы и селезенки (r= 0,72; 0,69; 0,65; 0,64; 0,62 соответственно; p<0,05).
С целью уточнения патогенетического значения роста титра органоспецифических антител у больных ЭБВ-инфекцией нами были изучены взаимосвязи между показателями аутоантителообразования и наличием клинико-лабораторных и иных признаков поражения соответствующих органов (по данным ЭКГ, УЗИ).
Так, выраженность аутоиммунных процессов в отношении тканей печени находилась в прямой зависимости от степени цитолиза печеночных клеток (r=0,44; 0,62 соответственно, р<0,05). В обеих группах у всех обследованных больных с повышенной активностью АЛТ были повышены уровни аутоантител к тканям печени в среднем до 64 + 5,4 (обратные титры), в то время как при нормальных показателях АЛТ повышение аутоантител наблюдалось лишь у 70% больных, а средние показатели составили 38 + 4,3. Примечателен тот факт, что наряду с повышением фермента и уровня аутоантител у всех обследуемых данной категории коэффициэнт Ритиса был менее 1, тогда как у всех других пациентов он находился на значениях превышающих 1. Более значимой оказалась связь относительно выраженности УЗ признаков изменения печени с напряженностью аутоиммунных процессов в отношении данного органа (коэффициенты корреляции от 0,49 до 0,75 при р<0,05).
Положительные умеренные по силе связи (r=0,45; при р<0,05) у больных ЭБВ-инфекцией выявлены между показателями аутоантителообразования и наличием ультразвуковых признаков панкреатита.
Независимо от формы заболевания выраженность аутоантителообразования к тканям сердца в большей степени коррелировала с клиническими признаками поражения сердца нежели с изменениями биохимических показателей (r=0,54 и r=0,31 соответственно; р<0,05). Однако частота выявления энзиматических сдвигов в группе детей с так называемыми «сердечными» симптомами была значительно выше (68% против 24%). Во всех случаях наиболее тесными были связи при реактивации инфекции.
Выводы:
-
1. Изменения цитокинового статуса и аутоиммунного профиля у детей с инфекционным мононуклеозом зависят от варианта течения инфекции (первичная, реактивация).
-
2. Недостаточная активация клеточного иммунитета и смещение баланса в сторону Тh2 при реактивации инфекции сопровождается значимым усилением выраженности аутосенсибилизации к тканям различных органов. Наибольшие уровни аутоантител отмечаются к тканям кишечника и печени.
-
3. Наличие корреляционных связей между титрами противоорганных антител, уровнями цитокинов и ЦИК свидетельствует в пользу координированного течения (иммунных и аутоиммунных реакций) данных реакций в ходе развития инфекционного процесса и их вероятной взаимообусловленности.
-
4. Выявление взаимосвязи между титрами аутоантител и поражением соответствующих органов свидетельствует в пользу активного участия аутоиммунных процессов в формировании органопатологии при Эпштейна-Барра вирусной инфекции. Степень значимости возрастает с давностью инфицирования.
Список литературы Эпштейна-Барра вирусная инфекция у детей: особенности цитокинового ответа и иммунопатологические реакции
- Данилюк, Н.К. Вирус Эпштейн-Барр и серодиагностика связанных с ним заболеваний/Н.К. Данилюк//Новости «Вектор-Бест». -2000. -№ 4(18). -С. 10-13.
- Инфекционные болезни у детей/Под ред. Д. Марри; Пер. с англ. -М.: Практика, 2006. -928 с.
- Катягина, М.Г. Инфекционный мононуклеоз у детей/М.Г. Катягина, А.С. Сельков, А.С. Мартынкин -СПб., 1999 -С. 44.
- Рослый, И.М. Биохимические показатели в оценке цитолитических механизмов и метаболических процессов на примере инфекционного мононуклеоза/И.М.Рослый, С.В.Абрамов//Эпидемиология и инфекционные болезни -2005. -№ 5. -С. 33-41.
- Харламова, Ф.С. Вирусы семейства герпеса и иммунитет/Ф.С. Харламова//Детские инфекции. -2006. -Т. 5. -№ 3. -С. 3-10.
- Чеснокова, Н.П. О роли недостаточности резистентности и специфических иммунологических механизмов защиты в патогенезе хронического синусита/Н.П. Чеснокова//Саратовский научно-медицинский журнал. -2007. -№ 4(18). -С. 40-43.


