Эритропоэзиндуцирующая активность полисахаридов Tussilago farfara L. на фоне комбинированного применения цисплатина и этопозида
Автор: Сафонова Елена Андреевна, Лопатина Ксения Александровна, Разина Татьяна Георгиевна, Федорова Елена Павловна, Зуева Елена Петровна, Гурьев Артем Михайлович, Белоусов Михаил Валерьевич
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 4 т.16, 2017 года.
Бесплатный доступ
Изучено влияние полисахаридов Tussilago farfara L. на эритроидный росток кроветворения, а также развитие опухоли и метастазов у мышей с раком легкого-67 в условиях терапии цисплатином и этопозидом. Установлено, что применение полисахаридов уменьшает миелосупрессию, индуцируемуюцитостатиками в отношении эритроидного ростка кроветворения и приводит к повышению противоопухолевого и антиметастатического эффекта полихимиотерапии. Гемопоэзиндуцирующее воздействие полисахаридов оказалось сравнимо с таковым у известного стимулятора эритропоэза - рекормона.
Полисахариды tussilago farfara l, полихимиотерапия, миелосупрессия, цисплатин, этопозид, рекормон
Короткий адрес: https://sciup.org/140254433
IDR: 140254433 | УДК: 616.24-006.6-08-059:615.28:577.114.5:547.458]-092.9 | DOI: 10.21294/1814-4861-2017-16-4-42-48
Текст научной статьи Эритропоэзиндуцирующая активность полисахаридов Tussilago farfara L. на фоне комбинированного применения цисплатина и этопозида
В мире рак толстой кишки занимает четвертое место среди наиболее часто выявляемых опухолей [1]. В настоящее время предоперационное определение стадий у пациентов с колоректальным раком (КРР) включает радиографические исследования, в том числе компьютерную томографию [2]. Гистологическое исследование хирургических образцов зачастую приводит к изменению первоначально установленной стадии. В частности, во время операции определяются глубина опухолевой инвазии и вовлеченность лимфатических узлов. Однако оккультные метастазы могут быть пропущены современными методами диагностики. В послеоперационном периоде проводится мониторинг пациентов для выявления признаков прогрессирования заболевания, поскольку раннее выявление рецидива и/или отдаленных метастазов улучшает прогноз и эффективность лечения [3].
Руководство American Society of Clinical Oncology [4] рекомендует проведение ежегодного исследования с помощью компьютерной томографии, а также определение раково-эмбрионального антигена в сыворотке крови (РЭА) каждые 3 мес после радикальной операции при КРР II–III стадии в течение не менее 3 лет, если пациент может являться кандидатом на хирургическое вмешательство или химиотерапию при развитии метастатической болезни [5–7].
Таким образом, биомаркеры, которые облегчают обнаружение оккультных метастазов до или после операции, будут улучшать уточняющую диагностику КРР, что потенциально влияет на тактику лечения. Пируваткиназа Tumor M2-PK является веществом, которое при определенном содержании в организме свидетельствует о наличии новообразований [8]. В нормальных клетках она находится в нескольких формах: L, R, М1, М2, – которые соответственно локализуются в почках и печени, эритроцитах, мозге и мышцах, легких. Они обладают высокой специфичностью.
Цель исследования – определить возможности современных высокочувствительных неинвазивных физико-химических методов в диагностике колоректального рака у пациентов с различной локализацией метастазов. Для этого с помощью методов спектральной эллипсометрии вблизи наблюдения поверхностного плазмонного резонанса, флуоресцентной оптической спектрометрии, Raman-спектроскопии и КНИ-нанопроволочного (кремний на изоляторе) биосенсора проведена детекция опухолевой М2-пируваткиназы (Tumor M2-PK) сыворотки крови пациентов с помощью высокоспецифичных моноклональных антител, выступающих в качестве зонда к детектируемому белковому маркеру.
В настоящем исследовании использована сыворотка крови пациентов, поскольку появились исследования [9], показывающие недостаточную эффективность исследования опухолевой пиру-ваткиназы кала.
Материал и методы
В исследование включены 68 человек: 19 условно здоровых лиц (средний возраст – 53 ± 8 лет) без онкологической патологии и заболеваний внутренних органов и 49 пациентов (средний возраст – 52 ± 9 лет, 22 женщины, 27 мужчин) с КРР различных локализаций: поперечно-ободочная кишка (n=3), нисходящие отделы толстой кишки (n=3), сигмовидная кишка (n=9), ректо-сигмоидный переход (n=6), прямая кишка (n=22), первичномножественные опухоли толстой кишки (n=6). Гистологически у всех пациентов верифицирована аденокарцинома различной степени дифференцирования. Диагноз был установлен на основе комплексного клинико-инструментального обследования (УЗИ, мультиспиральная компьютерная томография, колоноскопия, гистологические исследования) в условиях онкологического стационара.
Пациенты были разделены на 3 группы в зависимости от распространенности опухоли:
– 1-я группа: 15 пациентов с местнораспространенным КРР (у 7 – II стадия, у 8 – III стадия заболевания);
– 2-я группа: 18 больных КРР IV стадии с метастазами только в печень (у 12 – одиночные метастазы, у 6 – множественные, диаметром от 16 до 92 мм);
– 3-я группа: 16 пациентов КРР IV стадии с внепеченочными метастазами (надключичные лимфоузлы, легкие, кости, головной мозг).
Адъювантная полихимиотерапия в течение 3 мес была проведена в первой группе 3 (20 %) пациентам, во второй – 6 (33 %), в третьей – 11 (69 %) больным.
Использовалась сыворотка крови обследуемых, полученная центрифугированием цельной крови, взятой натощак, со скоростью 2000 об/мин в течение 20 мин. Для дальнейших исследований сыворотка крови при необходимости разбавлялась фосфатным буфером.
Иммобилизацию антител Anti-PKM2 antibody [EPR10138(B)] (Abcam RabMab, USA) осуществляли на предварительно обработанные карбонилдиимидазолом поверхности кремния (сканирующая эллипсометрия, КНИ-биосенсор) и золота (~40 нм, нанесенного тонким слоем на кремний, ППР-исследования), согласно методике, описанной в работе [10]. Разработана и апробирована методика детекции биологических макромолекул малой концентрации с помощью спектрального эллипсометрического ППР-комплекса «Эллипс-СПЭК» (ИФП СО РАН) [11].
Параллельно исследованию методом спектральной эллипсометрии реакцию опухолевой М2 пируваткиназы в сыворотках крови здоровых людей и больных с колоректальным раком с высокоспецифичными моноклональными антителами проводили на поверхности сенсорных чипов GLC при помощи прибора ProteOn XPR36 (BioRad), принцип действия которого также основан на эффекте ППР. Исследовано связывание сыворотки, разведенной в PBST в 10, 50, 250, 1250 и 6250 раз. Для скрининга были выбраны концентрации 1/50 и 1/250, при которых наиболее четко выявляются различия между образцами.
С помощью сканирующего эллипсометра высокого разрешения «Микроскан» (ИФП СО РАН) [12] был исследован отклик поверхности кремниевых пластин, на которые предварительно были нанесены моноклональные антитела к Tumor M2-PK в реакции взаимодействия сыворотки крови пациентов с КРР и здоровых лиц. Считывание эллипсометрических углов ν и ά осуществлялось в центральных областях кремниевых пластин 15×15 мм2 с шагом по осям «x» и «y» 0,1 мм. Угол падения луча света на образец составлял 60°. С помощью программного обеспечения прибора (пакет «AnResG») проводили статистическую обработку и систематизирование результатов измерений в целях очищения от случайного шума и выделения полезной информации в виде конечных значений концентрации биомолекул на поверхности биочипа.
Специфичность взаимодействия Tumor M2-PK сыворотки крови с высокоспецифичными моноклональными антителами подтверждена методом флуоресцентной оптической спектрометрии. Флуоресцентный анализ осуществлялся на сканере «ScanArray Express 2.0» фирмы «PerkinElmer Life Sciences» (США) при длине волны возбуждающего лазера, равной 543 нм. Изображение анализировали с использованием программы «ScanArray Express», входящей в математическое обеспечение сканера. На модельном чипе содержались зонды к опухолевой M2-PK – меченые высокоспецифичные моноклональные антетела к M2-PK, а также октатимидилат, содержащий флуоресцентный краситель TAMRA, используемый в качестве стандарта [13, 14].
Для проведения пилотных экспериментов с КНИ-нанопроволочным биосенсором [15, 16] использован полевой транзистор КНИ, основу которого составляет сенсорный элемент, на поверхность которого предварительно иммобилизовали зонды – высокоспецифичные моноклональные антитела к Tumor M2-PK. Растворы сывороток крови здоровых обследуемых и больных КРР тестировались в различных разведениях (от 10-3 до 10-15M).
Спектры комбинационного рассеяния света жидких сывороток крови пациентов записывались с помощью спектрометра с тройным монохроматором T64000 (Horiba Jobin Yvon, France) при комнатной температуре. Для возбуждения использовалась линия Ar+ лазера с длиной волны 514,5 нм, спектральное разрешение составляло 1,5 см-1. В качестве детектора использовалась кремниевая матрица фотоприемников, охлаждаемая жидким азотом. Применялась приставка для микроскопических исследований комбинационного рассеяния света. Мощность лазерного пучка, доходящего до образца, составляла 2–3 мВт (размер пятна 5–6 мкм).
Результаты и обсуждение
На первом этапе работы методом сканирующей эллипсометрии установлено значимое увеличение эффективной толщины покрытия биомолекул в результате специфического взаимодействия «антиген–антитело» в группах пациентов с КРР в отличие от группы здоровых лиц (рис. 1) (p<0,001– 0,042). Толщина слоя заметно увеличивается при местнораспространенном КРР, далее – при наличии метастазов в печень, достигая максимальных значений при наличии внепеченочных метастазов (табл. 1).
Поскольку метод эллипсометрии имеет особенность, связанную с параллельной детекцией примесей, способных к неспецифической сорбции на поверхности, для подтверждения наличия специфического взаимодействия была использована флуоресцентная оптическая спектрометрия. На рис. 2 приведены результаты сканирования участков поверхности со спотами, при этом участки с более высокой интенсивностью свечения светлее других – строки 1 и 6, соответствующие флуоресцентному маркеру 5-TAMRA-TTTTTTTT-3 (контроль), а также строка 2, отражающая результат добавления сыворотки здоровых лиц, в ходе которого сохраняется высокая концентрация флуоресцентного маркера. Интенсивность флуоресценции снижалась в строке 3 (сыворотка пациентов с местнораспространенным КРР), резко уменьшалась в строке таблица 1
Средние значения эффективной толщины сканограмм в результате взаимодействия tu M2-PK сыворотки крови с высокоспецифичными моноклональными антителами
|
Группы обследованных |
Среднее значение р эффективной толщины От группы От 1 группы От 2 группы слоя, нм сравнения |
|
Здоровые лица (группа сравнения) Местнораспространенный КРР (1-я группа) Больные КРР с метастазами в печень (2-я группа) Больные КРР с внепеченочными метастазами (3-я группа) |
5,73 ± 0,63 – – – 8,98 ± 0,26 0,042 – – 11,63 ± 0,37 0,015 0,029 – 26,49 ± 0,48 0,001 0,001 0,002 |
4 (сыворотка пациентов с КРР с метастазами в печень) и практически не выявлялась у пациентов с КРР с внепеченочными метастазами (строка 5). Гистограмма значений относительной интенсивности флуоресценции представлена на рис. 3.
Следует отметить, что флуоресцентная спектрометрия фиксирует только те биомолекулы, которые помечены флуоресцентной меткой, причем интенсивность флуоресцентного сигнала пропорциональна содержанию (концентрации) этих фрагментов и обратно пропорциональна уровню специфического взаимодействия типа «антиген–антитело», при котором «метки экранируются». Полученные результаты свидетельствуют о нарастающих концентрациях опухолевой М2 пируваткиназы от группы больных с местнораспространенным КРР до пациентов с внепеченочными метастазами. Таким образом, методом флуоресцентной оптической спектрометрии был подтвержден факт наличия специфического взаимодействия Tu M2-PK сыворотки крови с высокоспецифичными моноклональными антете-
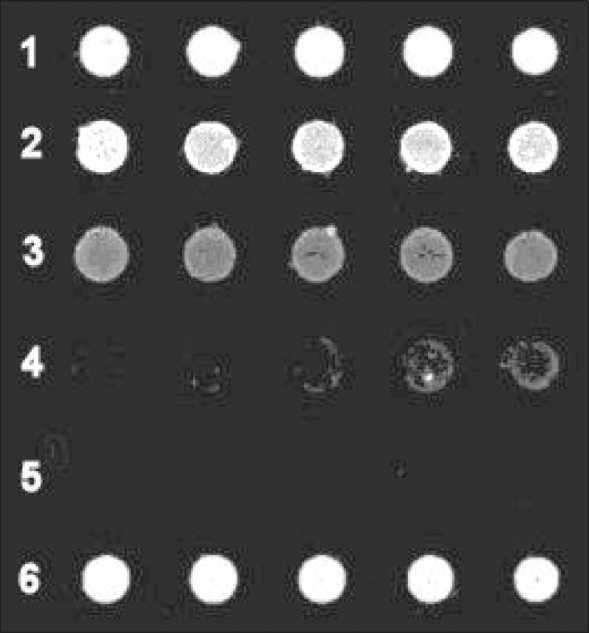
Рис. 2. Эффективная толщина сканирования биочипа после взаимодействия Tu M2-PK сыворотки крови с мечеными высокоспецифичными моноклональными антителами к Tu M2-PK (флуоресцентная спектроскопия, сканер «ScanArray Express 2.0»). Цифрами на рисунке обозначены:
1, 6 – флуоресцентный маркер 5-TAMRA-TTTTTTTT-3 (контроль); взаимодействие с зондом сыворотки; 2 – у здоровых лиц; 3 – у больных с местнораспространенным КРР;
4 – у больных с метастазами в печень; 5 – у больных с внепеченочными метастазами
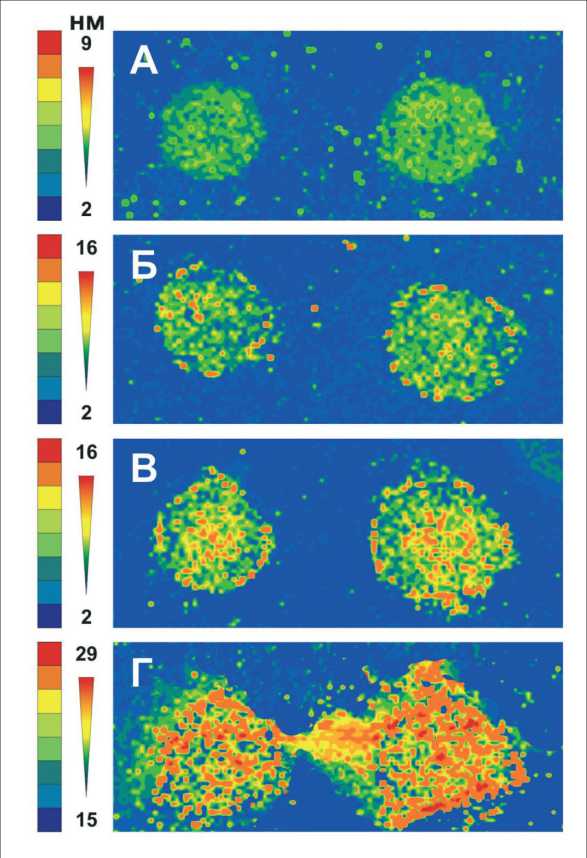
Рис. 1. Сканограммы (зависимости эффективной толщины поверхности пленок, полученные с помощью «Микроскана» в результате специфического взаимодействия антигенов сыворотки крови с Tu M2-PK: А – у здоровых обследуемых; Б – у пациентов с местнораспространенным КРР; В – с метастазами в печень; Г – с внепеченочными метастазами. Слева показаны значения эффективной толщины слоя
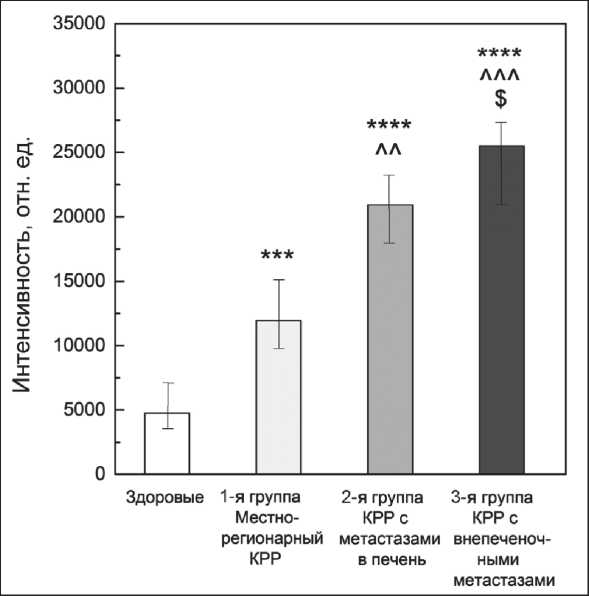
Рис. 3. Гистограмма средних значений относительной интенсивности флуоресценции в группах. Примечание: значимость различий:
* – от группы сравнения (*** – p<0,001, **** – p<0,0001);
^ – от 1-й группы (^^ – p<0,01, ^^^ – p<0,0001);
$ – от 2-й группы (p<0,05)
лами, причем полученные данные сопоставимы с таковыми, полученными методом сканирующей эллипсометрии (в нем эффективная толщина слоя пропорциональна общему количеству иммобилизованных молекул). При этом метод эллипсометрии при высокой чувствительности не требует предварительной модификации образца (использование флуоресцентных меток).
На рис. 4 представлена кинетика взаимодействия Tumor M2-PK в сыворотках крови пациентов в исследуемых группах с высокоспецифичными моноклональными антителами методом спектральной эллипсометрии вблизи условий наблюдения ППР.
Средний уровень сывороточной Tu M2-PK, определенной в группе здоровых обследуемых, составил 11,6 ± 4,5 RU (1 RU ~ 1 пг белка) и не зависел от пола (p=0,51) и возраста (p=0,61), что согласуется с данными ряда исследований [17, 18]. Средний сывороточный уровень Tu M2-PK среди пациентов с местнораспространенным КРР (1-я группа) оказался равным 77,4 ± 5,8; среди больных с КРР с метастазами в печень (2-я группа) – 192,5 ± 12,8; у больных с внепеченочными метастазами (3-я группа) – 284,2±14,6 (p<0,0001–0,05), отличаясь в ~ 6–23 раза от такового в группе здоровых. C. Tonus et al. также выявили корреляции уровня фекальной Tu M2-PK со стадией заболевания согласно классификациям TNM и Duke’s [19].
Низкие уровни сывороточной Tu M2-PK среди здоровых обследуемых и отсутствие выраженных вариаций значений в связи с полом и возрастом обусловлены связью данного фермента с опухолевым метаболизмом [20]. Полученные ассоциации сывороточного уровня Tu M2-PK со стадией за- болевания согласно классификациям TMN Duke’s подтверждаются рядом клинических исследований [21, 22].
Диагностическая чувствительность определения сывороточного уровня Tu M2-PK для выявления различия случаев КРР от здоровых лиц составила 100 %, что сопоставимо с данными W. Meng et al. (2012) [18]. Это значительно выше, чем при использовании колоноскопии, исследовании кала на скрытую кровь и определении фекальной опухолевой М2 пируваткиназы [23, 24]. В случае, когда cut-off уровень сывороточной Tu M2-PK составлял 11,6 ± 4,5 RU, не было пропущено ни одного случая пациентов с КРР и можно было бы избежать 43,4 % проведенных колоноскопий. Диагностическая чувствительность для всех случаев колоректальных поражений возрастала при снижении cut-off уровня сывороточной Tu M2-PK.
Таким образом, полученные с помощью спектрального эллипсометрического ППР-комплекса «Эллипс-СПЭК» данные свидетельствуют о перспективности предложенного подхода для диагностики ранних стадий КРР; данные оказались сопоставимы с результатами, измеренными на приборе ProteOn XPR36 (BioRad, USA), не уступали им по чувствительности (~10-11–10-12 M) и точности при существенно более низкой стоимости аппаратуры [11].
Вместе с тем отмечены возможности оптических методов в определении метастазов различных локализаций. При проведении ROC-анализа по выявлению метастазов при КРР величина AUC для сывороточной Tu M2-PK составила 0,89 (0,84; 0,94), 95 % доверительный интервал (рис. 5). Пред-
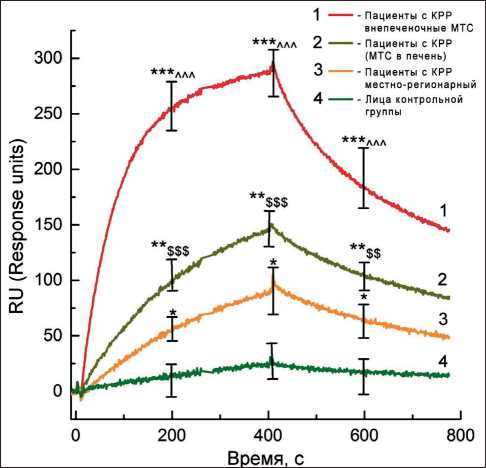
Рис. 4. Сенсограммы связывания и распада комплексов при взаимодействии антигенов сыворотки крови и высокоспецифичных моноклональных антител к Tumor M2-PK у пациентов с КРР и лиц группы сравнения при разбавлении сыворотки крови 1:250
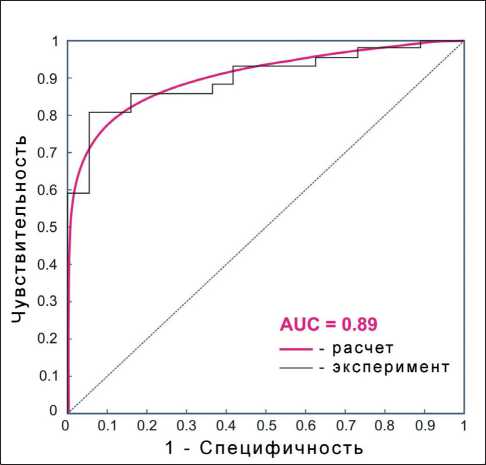
Рис. 5. ROC-кривая для уровней сывороточной Tu M2-PK в дифференцировании больных КРР с метастазами
таблица 2
Площадь пиков комбинационного рассеяния света у больных с Крр с различной локализацией метастазов и в группе сравнения
|
Положение пика, см-1 |
Площадь пика, усл. ед. , Больные КРР с метаста- Больные КРР с внепече- Здоровые лица Местнораспространен- зами в печень ночными метастазами (3 (группа сравнения) ный КРР (1 группа) (2 группа) группа) |
|
1005 1157 1520 |
990 ± 84 557 ± 103* 387 ± 90**^ 129 ± 78***^^^$$ 2570 ± 301 2004 ± 264* 908 ± 115**^^ 712 ± 132***^^^$$ 3258 ± 190 2404 ± 162** 714 ± 135***^^^ 474 ± 108***^^^$$ |
Примечание: статистическая значимость различий по сравнению со здоровыми лицами: * – p<0,05, ** – p<0,02, *** – p<0,0001; статистическая значимость различий по сравнению с 1-й группой: ^ – p<0,05, ^^ – p<0,02, ^^^ – p<0,0001; статистическая значимость различий по сравнению со 2-й группой: $ – p<0,05, $$ – p<0,01.
сказательная точность использования данного метода составила 85, 90, 94, 96 % сыворотки здоровых лиц, пациентов с местнораспространенным КРР, КРР с метастазами только в печень, КРР с внепеченочными метастазами соответственно.
Различная интенсивность пиков спектров комбинационного рассеяния света в определенной степени отражает существующие различия в интегральных метаболомических профилях сывороток крови пациентов с КРР [25]. Площади пиков (1005–1520 см-1) Raman-спектров оказались достоверно ниже у больных КРР по сравнению со здоровыми (р<0,0001-0,05) (табл. 2, рис. 6), коррелируя со стадией процесса (г = -0,68, p<0,001) и наличием метастазов (г = -0,57, p<0,003). Мета-боломический профиль изменяется в зависимости от места локализации опухоли, и ответ хозяина на опухоль может меняться при метастазировании [26]. Метастатическая болезнь биологически отлична от рака, не выходящего за пределы органа. Многие другие агрессивные опухоли провоцируют более (или менее) бурный ответ хозяина [27], который может также отличаться из-за локального воздействия опухоли. Например, опухоль может оказывать множество паракринных эффектов на микроокружение, кроме того, метаболические или
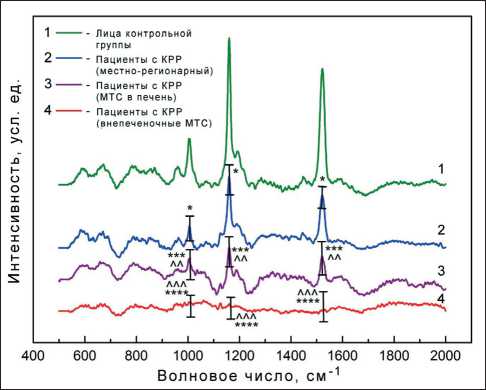
Рис. 6. Спектры комбинационного рассеяния света жидких сывороток крови больных КРР и лиц группы сравнения воспалительные ответы окружающих нормальных тканей могут отличаться при локализации метастазов в печени и в других местах [28].
Следующим этапом исследования, направленным на повышение чувствительности выявления биомолекул в ультрамалых концентрациях, были пилотные эксперименты с КНИ-нанопроволочным биосенсором [15, 16]. Среди различного вида сенсорных устройств [29], разработанных в последнее время на основе нанотехнологий, наиболее перспективными считаются электронные детекторы, где в качестве сенсорных элементов (преобразователей) используются кремниевые нанопроволочные транзисторы, поскольку эти приборы удовлетворяют сразу следующей совокупности требований:
– отсутствие маркеров («label-free» детекция);
– высокая чувствительность (в пределе – одна частица на сенсорный элемент);
– измерения в реальном масштабе времени;
– мультиплицирование сенсорных элементов (обеспечивает детекцию разных маркеров на разных сенсорных элементах в одном биочипе по одной пробе биожидкости человека);
- совместимость с КМОП-технологией (обеспечивает возможность организации промышленного производства приборов для широкого круга пользователей без требований их специальной подготовки).
Принцип действия таких сенсоров основан на полевом эффекте – изменении концентрации носителей заряда в приповерхностном слое полупроводника под воздействием внешнего электрического поля. Изменение концентрации носителей заряда в полупроводнике приводит к изменению его проводимости, что и фиксируется в режиме реального времени при адсорбции целевых частиц на поверхность сенсорного элемента [15, 16]. В исследованиях G.-J. Zhang et al. (2012), F. Yang et al. (2014) представлены результаты использования КНИ-нанопроволочных биосенсоров в целях диагностики ряда патологий [30, 31] с акцентом на межмолекулярные взаимодействия, в которых в качестве тестируемого аналита использованы специфические антигены.
В настоящем пилотном исследовании протестирована сыворотка (представляющая собой сложную смесь органических соединений, антигенов) здоровых людей и пациентов с КРР, что является важным аспектом в разработке данного подхода диагностики. Для придания сенсору специфичности выявления определенных био-молекулярных маркеров (Tu M2-PK) в образце на поверхность кремниевых сенсорных элементов ковалентно иммобилизовали высокоспецифичные моноклональные антитела к Tu M2-PK, выступающие в качестве зонда к детектируемому белковому маркеру. Тестировались растворы сывороток крови здоровых и больных с колоректальным раком, при этом оптимизированы условия подготовки поверхности сенсоров для воспроизводимого получения результатов с максимальным откликом [32].
Рис. 5а демонстрирует временную зависимость тока сенсорного элемента, измеренную в буферном растворе и в растворах сывороток крови обследуемых. Стационарные значения тока в растворах сывороток меньше, чем в чистом буфере PBS (p<0,05). Это означает увеличение отрицательного заряда на поверхности сенсора. Относительные изменения тока (отклик сенсора) на неспецифическое взаимодействие (~33%, N1) достоверно меньше, чем на специфическое (52–56 %, N2) (p<0,001). Отклик сенсора увеличивается при увеличении концентрации аналита (Tu M2-PK, N2) в растворе (p<0,01).
Для сравнения представлен отклик сенсора на сыворотку крови здорового человека (~const) в широком 10-15–10-3M диапазоне концентраций сыворотки в буфере PBS (рис. 5б). Отклик сенсора на неспецифическое взаимодействие остается практически неизменным в диапазоне концентраций 10-15–10-3M сыворотки в PBS (p=0,78).
Таким образом, данные этого пилотного исследования демонстрируют возможность экспресс-анализа сыворотки крови, высокие чувствительность (~10-13–10-15М) и специфичность,
Список литературы Эритропоэзиндуцирующая активность полисахаридов Tussilago farfara L. на фоне комбинированного применения цисплатина и этопозида
- Покровский В.С., Трещалина Е.М., Бычков М.Б. Перспективыразвития комбинированной химиотерапии диссеминированногомелкоклеточного рака легкого. Российский биотерапевтическийжурнал. 2009; 8 (3): 61-68.
- Машковский М.Д. Лекарственные средства. М., 2008; 1206.
- Птушкин В.В. Совершенствование методов поддерживающейтерапии при проведении цитостатического лечения. Современнаяонкология. 2002; 4 (2): 28-30.
- Сафонова Е.А., Лопатина К.А., Разина Т.Г., Федорова Е.П., Пахомова А.В., Вычужанина А.В., Зуева Е.П., Ефимова Л.А. Коррекция токсического эффекта паклитаксела на систему крови и эпителий тонкой кишки водорастворимыми полисахаридами мать-и-мачехи обыкновенной, аира болотного и эхинацеи пурпурной. Российский биотерапевтический журнал. 2010; 2 (9): 19-23.
- Директива 2010/63/EU Европейского парламента и Совета Европейского союза по охране животных, используемых в научныхцелях (пер. с англ.). СПб., 2012; 48.


