Эволюция хирургического лечения рака поджелудочной железы
Автор: Потапов В.А., Мусаилов В.А., Аванесян И.О., Цыпляев Д.П.
Журнал: Вестник Национального медико-хирургического центра им. Н.И. Пирогова @vestnik-pirogov-center
Рубрика: Обзоры литературы
Статья в выпуске: 2 т.20, 2025 года.
Бесплатный доступ
Постоянный рост частоты встречаемости злокачественных новообразований поджелудочной железы (ПЖ) заставляет исследователей продолжать поиск наиболее эффективных методов их диагностики и лечения. Строение протоковой аденокарциномы встречается в 80-90% всех экзокринных опухолей ПЖ. Ключевой составляющей диагностики является определение дальнейшей тактики лечения. Скрининговым методом диагностики рака ПЖ (РПЖ) является мультиспиральная КТ. Практическое значение среди лабораторных показателей имеют радиоиммунохимические тесты сыворотки крови на 2 антигена - карбогидратный антиген (СА 19-9), раковый эмбриональный антиген. В настоящее время системная химиотерапия РПЖ малоэффективна: ответ на лечение наблюдается менее чем у 20% больных, при этом медиана продолжительности жизни составляет около 6 мес. Однако в исследованиях ряда авторов доказано, что адъювантное лечение, включающее химиотерапию и лучевую терапию, увеличивает отдаленную выживаемость. Современной тенденцией хирургии ПЖ является уход от радикальности в сторону органосохраняющих модификаций тотальной дуоденопанкреатэктомии, панкреатодуоденальной резекции. Решать проблему лечения рака ПЖ следует комбинированием принципов селективного выбора вмешательств, а также определением чётких показаний к ним. Перспективными являются поиск новых маркеров скрининга РПЖ, повышение доступности лучевых методов исследования, поиск новых химиопрепаратов. Актуальным остаётся поиск обоснованных вариантов реконструктивных анастамозов, позволяющих сохранить физиологическую целостность организма и, как следствие, снизить летальность и частоту послеоперационных осложнений.
Рак поджелудочной железы, панкреатодуоденальная резекция, панкреатэктомия, резектабельность
Короткий адрес: https://sciup.org/140309988
IDR: 140309988 | DOI: 10.25881/20728255_2025_20_2_101
Текст обзорной статьи Эволюция хирургического лечения рака поджелудочной железы
В экономически развитых и экологически неблагополучных странах. заболеваемость раком поджелудочной железы (РПЖ) составляет 2,2 на 100 тыс. населения в Индии, Кувейте, Сингапуре; 4,0–6,0 в Японии и странах южной Европы; 11,0 – в США и Канаде; 9,0–12,5 – в странах Западной Европы; 8,6 на 100 тыс. населения – в России [1]. Соотношение смертности к заболеваемости близко к единице – 0,98 [2].
Цель
Рассмотреть основные аспекты диагностики и лечения РПЖ, а также частоту осложнений, летальность при различных тактиках лечения.
Материалы и методы
Морфология РПЖ
Злокачественные новообразования ПЖ принято подразделять на эпителиальные, неэпителиальные, смешанные и неклассифицируемые. Строение протоковой аденокарциномы встречается в 80–90% всех экзокринных опухолей ПЖ, хотя протоковые клетки составляют только 10–30% нормальной панкреатической паренхимы [3]. Наиболее частой гистологической разновидностью аденокарциномы является светлоклеточная аденокарцинома с фиброзной стромой, иногда с выраженным слизеобразованием. Далее по частоте следует скиррозная аденокарцинома и недифференцированная аденокарцинома. Кроме указанных разновидностей встречается анапластический, плоскоклеточный, железисто-плоскоклеточный, гигантоклеточныи рак, указанные формы которого могут быть самостоятельными, но чаще являются компонентами других форм рака. Реже выявляют карциносаркому и другие разновидности рака [4].
По степени морфологической дифференцировки выделяют высокодифференцированную, умеренно

дифференцированную и низкодифференцированную аденокарциномы.
Высокодифференцированные аденокарциномы образованы железистыми структурами крупных и средних размеров. Умеренно дифференцированные аденокарциномы образованы из протокоподобных и тубулярных структур средних размеров причудливой формы, заключенных в фиброзную строму, и практически полностью замещающих паренхиму органа. В этих опухолях более выражен клеточный полиморфизм и больше фигур митоза. Низкодифференцированные аденокарциномы состоят из плотно расположенных мелких, неправильно сформированных желез, отдаленно напоминающих обычные протоки, в слабо развитой строме. Опухолевые клетки с выраженным атипизмом, большое количество фигур митоза [5].
РПЖ часто развивается мультицентрически, когда опухолевым полем является весь орган. В различных его участках отмечаются различные фазы роста. Это явление наблюдается у 30–38% больных [6]. Этим обстоятельством В.А. Кубышкин и соавт. [7] объясняют случаи развития рецидивов заболевания. Аденокарцинома ПЖ очень быстро инфильтрирует окружающие ткани и рано метастазирует. Отдаленные метастазы обнаруживается во время операции у 43,4% больных, стадированных по данным предоперационного обследования как М0 [8]. По данным Н.В. Путова и соавт. [9], если размеры опухоли не превышают 1 см, опухоль не выходит за пределы органа и отсутствуют видимые метастазы в лимфатических узлах, при патологоанатомическом исследовании метастазы в парааортальных лимфоузлах обнаруживают в среднем в 50% наблюдений.
Особенности диагностики РПЖ
У большинства пациентов обнаруживаются не-резектабельные формы РПЖ, более чем у 70% из них с признаками механической желтухи [9]. Механическая желтуха при РПЖ нередко рассматривается едва ли не как «финал» заболевания. Но этот синдром нельзя рассматривать как признак «запущенного» заболевания, хотя именно желтуха является, как правило, основной причиной позднего целенаправленного обследования в хирургическом стационаре. Желтуха может быть достаточно ранним и нередко спасительным в диагностическом отношении симптомом [10].
Диагностическая холангиография, выполненная через 3–5 суток после наружного дренирования желчных протоков, отличается высокой информативностью и безопасностью, что связано с ликвидацией желчной гипертензии и холангита. Уровень общего билирубина cвыше 70 мкмоль/л достоверно сопровождается повышенной частотой осложнений и летальности, при этом только 20% больных, перенесших желчеотведение, рассматриваются в качестве кандидатов на радикальную операцию [11].
Практическое значение в диагностике имеют радио-иммунохимические тесты сыворотки крови на 2 антиге- на – карбогидратный антиген (СА 19-9), раковый эмбриональный антиген (РЭА). Определение уровня антигенов в крови имеет определенное прогностическое значение, поскольку чрезмерное их увеличение до операции свидетельствует обычно о нерезектабельности опухоли, а после операции – о рецидиве или метастазировании. Невысокая специфичность маркеров обусловливает их роль как метода мониторинга больных РПЖ, у которых ранее, до лечения, отмечались положительные иммуно-химические тесты. Было доказано, что уровень общего билирубина в крови менее 7 мг/дл и CA 19-9<37 Ед/мл является прогностическим фактором для определения продолжительности жизни после операций при РПЖ. В группе пациентов с дооперационным уровнем общего билирубина в крови менее 7 мг/дл послеоперационная продолжительность жизни составила 38,1 месяца по сравнению с 16,6 месяца у пациентов с дооперационным уровнем 7 мг/дл и более. В группе пациентов с доопера-ционным уровнем CA 19-9<37 Ед/мл послеоперационная продолжительность жизни составила 46,6 месяца по сравнению с 23 месяцами с дооперационным уровнем CA 19-9≥37 Ед/мл [12].
Диагностика РПЖ включает УЗИ, эндоУЗИ, мульти-спиральную КТ (МСКТ), ангиографию, эндоскопическую ретроградную холангиопанкреатикографию (ЭРХПГ). Скрининговым методом диагностики является МСКТ. Показатели диагностической с контрастным усилением достигают 95,4%, чувствительность – 93,3%, специфичность – 95,8% [13]. МСКТ обнаруживает нерезекта-бельность опухоли в 100% наблюдений, резектабель-ность – в 75% [1].
Основные аспекты хирургического лечения РПЖ
В хирургическом лечении отмечены две тенденции: стандартные операции, заключающиеся в удалении опухоли с регионарными лимфоузлами, и расширенные операции, при которых удаляют лимфоузлы следующего этапа метастазирования и иссекают забрюшинную клетчатку. Агрессивный хирургический подход к лечению местнораспространённого РПЖ, независимо от размера опухоли и вовлечения сосудов, оправдывается однолетней выживаемостью после расширенной панкреатодуоденальной резекции (ПДР) (R0) у 81% больных, в то время как у больных после стандартной ПДР (R0, N1) аналогичный показатель составляет 50% [14]. ПДР с резекцией R0 в настоящее время является стандартом в хирургическом лечении РПЖ [15]. Расширенная резекция с расширенной лимфаденэктомией позволяет увеличить трехлетнюю выживаемость с 10 до 39% [16]. Существует и противоположное мнение. T.E. Pavlidis и соавт. [17] при сравнении результатов обычной и расширенной ПДР пришли к выводу, что лимфаденэктомия существенно не влияла на отдаленные результаты лечения. По данным А.И. Дронова [13], до 77,5% больных РПЖ составляют пациенты с III–IV стадиями заболевания. Расширение объема лимфаденэктомии при протоковой аденокарциноме

ПЖ не ведет к увеличению частоты послеоперационных осложнений и летальности. Расширенная ПДР позволяет более точно определить стадию заболевания, значимо уменьшить частоту резекций R1 и местного рецидива, а также увеличить продолжительность жизни больных [18]. По данным Ake Andrem-Sandberg [19], медиана продолжительности жизни после ПДР составила 15 мес. (диапазон – 4–42 мес.) при резекции R1 и 22 мес. при R0 резекции (диапазон – 1–75 мес.).
Установлено, что на выживаемость после ПДР достоверно негативно влияют размеры опухоли более 2 см, инвазия ее в верхние брыжеечные сосуды, метастазы в регионарные лимфатические узлы; низкая степень дифференцировки опухоли, анеуплоидность ДНК в опухоли, локализация опухоли в крючковидном отростке, объем гемотрансфузии более 500–1000 мл (иммуносупрессивное действие при массивных гемотрансфузиях). Объем лимфаденэктомии достоверно не влияет на выживаемость в отдаленные сроки [20].
После выполнения ПДР сохраняется вероятность осложнений при разных вариантах включения в пищеварительную систему культи ПЖ. По данным А.Ю. Попова и соавт. [21] было отобрано 262 пациента, 177 из которых с злокачественным новообразованием головки ПЖ. Всего зафиксировано 80 послеоперационных осложнений. Наиболее частым осложнением явился панкреоне-кроз – 58 (24,0%) больных, или 72,3% всех осложнений, и нагноение послеоперационной раны – 8 (3,3%) пациентов, или 10% всех осложнений. По большинству анализируемых показателей данные свидетельствуют об отсутствии статистически значимых различий между панкреато-гастроанастамозом и панкреатикоеюноанастамозом. В исследовании В.А Солодкого и соавт. [22] были описаны результаты проведенных 310 оперативных вмешательств по поводу опухолей ПЖ, где самыми частыми ранними осложнениями были: панкреатический свищ 67 (21,6%), гастростаз 60 (19,4%), аррозионное позднее кровотечение 43 (13,8%). Отмечается, что для уменьшения агрессивности проявлений панкреатического свища формируется панкреатодигестивный анастомоз на изолированной петле тощей кишки. В своей работе S. Kokkinakis и соавт. показали клиническую значимость послеоперационного риска развития свищей ПЖ, развившихся у 14,3% больных [23].
Органосохраняющий вариант тотальной дуо-денопанкреатэктомии (ТДПЭ) способен обеспечить пациентам быстрое восстановление и низкий уровень послеоперационных осложнений. По данным А.В. Шабунина и соавт. [24] было произведено 37 ТДПЭ, из них 12 больных, которым выполнили органосохраняющую модификацию ТДПЭ (1-я группа), и 25 больных, которым выполнили классическую ТДПЭ (2-я группа). В 1-й группе отмечено 4 (33,3%) общехирургических осложнения, во 2-й – 18 (72%). Явления гастростаза в 1-й группе больных выявлены у 3 (25%) пациентов, во 2-й – у 14 (56%). Геморрагических осложнений в 1-й группе не было. В группе сравнения они выявлены у 8 (32%) пациентов. S. Guo и соавт. [25] так же отмечают большее число послеоперационных осложнений при классическом варианте ТДПЭ. В.В. Бедин и соавт. [26] из 52 пациентов после ТДПЭ выделяют две группы: в первой – 27 пациентов (выполнена органосохраняющая модификация ТДПЭ), во второй – 25 (выполнен классический вариант ТДПЭ). В 1-й группе явления гастростаза выявлены у 25,9% пациентов. Во 2-й группе гастростаз отмечен у 56% пациентов.
Современные возможности заместительной эндо-и экзокринной терапии, а также совершенствование диагностических методов позволили увеличить частоту выполнения панкреатэктомий (ПЭ) [27]. По данным M. Janot и соавт. [28], из 63 больных, перенесших ПЭ, у 23 (36,5%) вмешательство выполнено по поводу опухолевого поражения ПЖ. Послеоперационная летальность составила 13% (3 больных), однако данные об отдаленных результатах отсутствуют. По данным многоцентрового исследования M. Murphy и соавт. [29], послеоперационные осложнения составляют 28%, летальность – 5,6%. M. Muller и соавт. [30] в 2007 г. сообщили о 140 ПЭ, выполненных за 5 лет; послеоперационные осложнения зарегистрированы в 24% наблюдений, летальность составила 4,8%.
Основной причиной незначительного прироста продолжительности жизни после ПЭ является то, что операцию при протоковой аденокарциноме ПЖ производят при больших размерах опухоли, часто при местнораспространенных вариантах, т. е. в случаях, когда даже при отсутствии отдаленных метастазов прогноз неблагоприятен [31].
Современный взгляд на химиотерапию РПЖ и перспективные методы миниинвазивного лечения
В связи с незначительным прогрессом в лечении РПЖ актуальны поиск и совершенствование методов лекарственного воздействия. РПЖ относится к химио-резистентным опухолям. Системная химиотерапия РПЖ малоэффективна: ответ на лечение наблюдается менее чем у 20% больных [32].
Однако в исследованиях ряда авторов убедительно доказано, что адъювантное лечение, включающее химиотерапию (ХТ) и лучевую терапию (ЛТ), увеличивает отдаленную выживаемость. Так, по данным J.H. Klinkenbijl и соавт. [33], химиолучевая терапия увеличивает медиану продолжительности жизни с 12,6 до 17,1 мес. J.P. Neop-tolemos и соавт. [34] отметили, что адъювантная ХТ без ЛТ повышает отдаленную выживаемость, увеличивая медиану продолжительности жизни с 15,5 до 20,1 мес. На конференции американского общества клинической онкологии 2006 г., посвященной изучению роли пред- и послеоперационной ЛТ и неоадъювантной и адъювантной ХТ, были доложены результаты крупного исследования 442 больных. Больные были рандомизированы на 2 подгруппы. ЛТ была одинаковой – 50,1 Гр, а ХТ различалась: в первой подгруппе применяли 5-фторурацил,

во второй – 5-фторурацил и гемцитабин. Медиана продолжительности жизни и трехлетняя выживаемость для подгруппы без гемцитабина составили, соответственно, 16,7 мес. и 21%, для группы с гемцитабином – 18,8 мес. и 31% (p = 0,04) [35].
Тем не менее, по данным ряда авторов, химиолучевая терапия сопровождается большим числом осложнений без существенного увеличения показателей выживаемости [36].
Устойчивость аденокарциномы ПЖ к ХТ обусловлена наличием в клетках опухоли высокой концентрации генов множественной лекарственной резистентности [37]. Установлено усиление противоопухолевого эффекта при повышении концентрации препаратов и времени воздействия на культуру клеток рака ПЖ. M.J. Swartz и соавт. [38] анализировали эффективность химиотерапии после резекции ПЖ. Установлено, что химиотерапия на 57% снижала риск летальности после операции. Даже у пациентов с метастазами в лимфоузлы и R1 получен положительный эффект химиотерапии. Один из путей повышения эффективности химиотерапии – селективное введение препаратов в артерии, кровоснабжающие опухоль. За счет эффекта «первого прохождения» при регионарном введении около 50% препарата остается в соответствующем регионе. Таким образом, достигается высокая концентрация лекарственного средства в окружающем опухолевые клетки пространстве, что, в свою очередь, приводит к интенсивному захвату препарата тканью опухоли, не вызывая побочных эффектов, характерных для ХТ [18]. Применение регионарной ХТ при местнораспространенном раке (с метастазами в печень или без них) позволяет добиться увеличения выживаемости и улучшения качества жизни у этой категории больных.
Одним из перспективных методов лечения РПЖ является артериальная химиоэмболизация (ХЭ). Введенный масляный эмболизат дезагрегируется по микроцирку-ляторному руслу, из которого происходит его диффузия непосредственно в ткани. Таким образом, масляная ХЭ обеспечивает пролонгированный локальный контакт опухоли с высокой концентрацией химиоэмболизата, что способствует повышению противоопухолевого эффекта. Этот метод следует использовать преимущественно у пациентов с местнораспространенными формами заболевания без отдаленных метастазов. ХЭ имеет перспективы при использовании в комбинации с лучевой терапией, а также в качестве неоадъювантного лечения у больных с резектабельными опухолями [38].
Таким образом, отмечены лучшие отдаленные результаты при применении комплексного и комбинированного лечения, позволяющие добиться, по данным отдельных авторов [9; 12], 20% пятилетней выживаемости. Ни терапевтические, ни хирургические методы лечения раздельно не позволяют длительное время контролировать течение РПЖ. Адъювантная ЛТ в комбинации с ХТ и неоадъювантное химиолучевое лечение увеличивают медиану выживаемости по сравнению с изолированным хирургическим вмешательством на 6 и 10 мес., соответственно. До-, интра-и послеоперационное облучение позволяет повысить одно- и двухлетнюю выживаемость до 28% [2].
Современная тактика комплексного лечения рака головки ПЖ
Рак головки и дистальных отделов ПЖ, а в преобладающем числе наблюдений – это протоковая аденокарцинома, характеризуется весьма низкой резектабельностью. В первую очередь это обусловлено сравнительно поздним появлением клинических симптомов, скудными данными общеклинических лабораторных методов, малой информативностью традиционных инструментальных методов исследования и трудностью интерпретации начальных изменений в головке ПЖ даже при интраоперационной ревизии. В итоге, опухоли диагностируют поздно [10]. Резектабельность при раке головки поджелудочной железы (РГПЖ) составляет 25%, при раке тела и хвоста ПЖ – 10,1% [9]. По данным Р.И. Расулова, местнораспространенный опухолевый процесс составил 76,1%, а резектабельными признаны опухоли в 20,2% наблюдений [39].
Главный путь лимфогенной диссеминации при РГПЖ – поражение лимфоузлов вокруг головки ПЖ, прежде всего задней поджелудочно-двенадцатиперстной группы. Далее лимфогенная миграция метастазов может идти прямо в парааортальные лимфоузлы или сначала в лимфоузлы вокруг верхней брыжеечной артерии (ВБА) и чревного ствола, а затем в парааортальные лимфоузлы. Метастатическое поражение задней поджелудочно-двенадцатиперстной группы происходит в 51% наблюдений, передней группы – в 39%, лимфоузлов вокруг ВБА – в 23%, парааортальных лимфоузлов – в 26% [40]. Углубленный анализ морфологического материала при опухолях Т3–Т4 головки ПЖ, проведённый Р.И. Расуловым с соавт., обозначил характерные признаки изучаемого опухолевого процесса: наличие периневральной инвазии (31,8%), различные варианты опухолевого поражения магистральных сосудов живота (54,5%), метастатическое поражение регионарных лимфоузлов (82,9%) и метастатическое поражение отдаленных лимфатических узлов (75,0%). Таким образом, визуально резектабельный местнораспространенный РГПЖ в подавляющем большинстве наблюдений уже является диссеминированным процессом [39].
А.Г. Кригер в своей работе [41] подробно раскрывает проблемы определения тактики хирургического лечения злокачественных опухолей ПЖ. При наличии резекта-бельного РГ ПЖ на первом этапе лечения производится ПДР или корпорокаудальную резекцию ПЖ. К дуоде-нопанкреатэктомии прибегают при распространенном поражении ПЖ.
Проблема резектабельности опухоли при поражении магистральных сосудов занимает особое место. Частота инвазии опухоли в крупные сосуды достигает 7,7%. Ре-

зекция магистральных сосудов не является значительно отягчающей само оперативное вмешательство и послеоперационное течение заболевания [1]. Изолированное поражение воротной или верхней брыжеечной вен не расценивается многими хирургами как признак нерезек-табельности, в то время как явные признаки вовлечения ВБА с наибольшей долей вероятности свидетельствуют о нерезектабельности [42].
Для улучшения ближайших послеоперационных результатов предложены различные модификации радикальных операций и несколько десятков вариантов реконструкции органов желудочно-кишечного тракта. Расширенная гастропанкреатодуоденальная резекция (ГПДР) является единственным радикальным объемом оперативного пособия при местнораспространенном РГПЖ [39]. После удаления гастропанкреатодуоденаль-ного комплекса операцию завершают одним из пяти вариантов восстановления ЖКТ (Рис. 1).
Первый вариант реконструкции ЖКТ включает позадиободочное формирование панкреатикоеюноана-стомоза (ПанкреатикоЕА) и гепатикоеюноанастомоза (ГЕА), впередиободочное формирование гастроеюана-стомоза (ГастрЕА) на одной петле тощей кишки. Второй вариант – проксимальная еюностомия, позадиободочное формирование ПанкреатикоЕА и ГЕА, впередиободочное формирование ГастрЕА с межкишечным анастомозом по Брауну. Третий вариант – формирование панкреатикога-строанастомоза (ПГА), позадиободочное формирование ГЕА, впередиободочное формирование ГастрЕА на одной петле тощей кишки. Четвертый вариант – позадиобо-дочное формирование ПанкреатикоЕА и ГЕА на разных петлях тощей кишки с межкишечным анастомозом по Ру, впередиободочное формирование ГастрЕА с межкишечным анастомозом по Брауну.
Пятый вариант – позадиободочное формирование ПанкреатикоЕА (двухрядным инвагинационным швом) и ГЕА с заглушкой по Шалимову, межкишечным анастомозом по Брауну, впередиободочное формирование ГастрЕА с межкишечным анастомозом по Брауну. По данным Р.И. Расулова пятый вариант реконструкции ЖКТ позволил значимо уменьшить частоту послеоперационных осложнений в целом и частоту несостоятельности ПанкреатикоЕА в частности. При этом варианте реконструкции ЖКТ несостоятельности ГЕА не было [39].
Подавляющее число пациентов с проточной аденокарциномой ПЖ имеют нерезектабельную форму рака. Применение технологии необратимой электропорации (НЭП) позволяет помочь пациентам с нерезектабель-ными аденокарциномами ПЖ. В исследовании А.Н Полякова и соавт. [43] описан опыт применения НЭП при местнораспространенной аденокарциноме ПЖ в период с 2015 по 2022 гг. Данное оперативное вмешательство проводилось 23 пациентам. Осложнения после НЭП развились у 5 (21,7%) пациентов. У 3 (13,0%) больных отмечена аритмия, у 2-х (8,7%) – панкреонекроз. Девяностодневная летальность после процедуры составила 4,3% (n = 1),
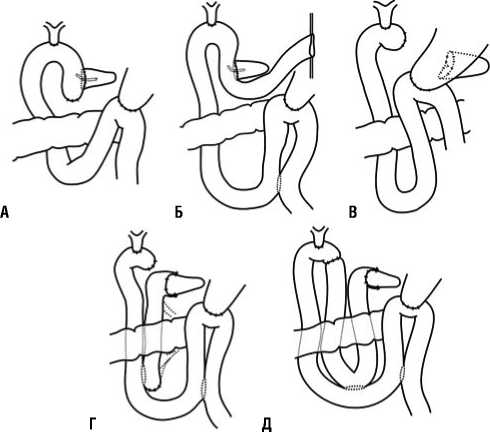
Рис. 1. Схема. Варианты реконструктивного этапа ГПДР: а – вариант I, б – вариант II, в – вариант III, г – вариант IV, д – вариант V (Расулов Р.И. с соавт., 2013).
причина – панкреонекроз. Медиана выживаемости составила 16 месяцев после электропорации. В исследовании M. Holland и соавт. [44] приняло участие 152 пациента. Смертность составила 2%, тяжелые осложнения наблюдались у 13% пациентов. Общая медиана выживаемости составила 30 месяцев.
С появлением фармакологических средств, угнетающих секрецию ПЖ, и накоплением опыта расширенной ГПДР в специализированных клиниках удалось уменьшить летальность при РГПЖ до 2% [39]. R.С. Martin и соавт. [45], проведя анализ литературы, посвященной хирургическому лечению РГПЖ, в который были включены все рандомизированные исследования и ретроспективные работы, приводят следующие данные: при оценке со средним временем наблюдения 24 месяца летальность составляет 0,4–15%, частота осложнений – 11–65%, несостоятельность ПанкреатикоЕА достигает 1–18%. По данным C.J. Yeo и соавт. [46], частота несостоятельности ПанкреатикоЕА коррелирует с опытом хирурга. Однако ведущая роль в развитии несостоятельности Панкреати-коЕА принадлежит состоянию паренхимы ПЖ. Согласно проведенным исследованиям, фиброзные изменения культи ПЖ вследствие хронического панкреатита способствуют формированию надежного ПанкреатикоЕА, а «сочная» ПЖ предрасполагает к высокой частоте несостоятельности обсуждаемого анастомоза. Так, по данным F.G. Bartoli и соавт. [47], частота этого осложнения при хроническом панкреатите составляет 5%, при РГПЖ – 12%, при периампулярном раке – 24%. Исследования I. Klempa и соавт. [48] показали, что сандостатин позволяет уменьшить частоту осложнений после ГПДР. В дальнейшем было проведено 6 рандомизированных исследований по влиянию сандостатина на развитие осложнений, в частности несостоятельности Панкре-
ато-панкреатикоеюноанастомоза (П-ПанкретикоЕА). В четырех европейских исследованиях была доказана эффективность октреотида в предупреждении развития несостоятельности П-ПанкреатикоЕА и формирования панкреатических свищей. Однако в исследованиях C.J. Yeo и соавт. [49] достоверного снижения частоты осложнений (несостоятельности П-ПанкреатикоЕА) при использовании сандостатина не найдено.
Панкреато-(панкреатико)еюностомия считается классическим методом реконструкции дигестивного тракта после ГПДР. Этот анастомоз выполняют в следующих вариантах: «конец в бок», «проток–слизистая», «конец в конец», «конец в бок» с инвагинацией тонкой кишки. Сравнивая анастомозы «проток–слизистая» с инвагинационными, J.М. Funovics и соавт. [50] не нашли значимых различий частоты развития панкреатических свищей. Однако в метаанализе F.G. Bartoli и соавт. [46], насчитывавшем 2361 пациента, выявлена более высокая частота развития панкреатического свища при инвагина-ционным анастомозе (26%) по сравнению с анастомозом «проток–слизистая» (16%). Несмотря на эти данные, оба технических приема широко используют и по настоящее время. В литературе также нет убедительных данных о преимуществах формирования ПанкреатикоЕА и ГЕА на одной петле или на двух. Предложенный Р.И. Расуловым с соавт. вариант реконструкции дигестивного тракта, включающий формирование ПанкреатикоЕА и ГЕА на разных петлях тощей кишки и ПанкреатикоЕА, представленный двухрядным инвагинационным швом, позволил снизить частоту несостоятельности П-ПанкреатикоЕА и вторичных осложнений с 39 до 6,6% [39].
Заключение
Таким образом, в отношении РПЖ, как одного из лидирующих в настоящее время онкологических заболеваний, должна быть предпринята широкая система мер по ранней диагностике, профилактическому обследованию групп риска, расширению доступности радикального хирургического и комбинированного лечения. Во всех индустриально развитых странах эта проблема давно последовательно решается на государственном уровне. Современной тенденцией хирургии поджелудочной железы является уход от радикальности в сторону органосохраняющих операций. Данный подход позволяет сохранить физиологическую целостность организма, что влечет за собой снижение летальности и встречаемости осложнений. Решать проблему лечения РПЖ следует комбинированием принципов селективного выбора вмешательств, а также определение четких показаний к ним. Перспективными являются поиск новых маркеров скрининга РПЖ, повышение доступности лучевых методов исследования, поиск новых химиопрепаратов.


