Эволюция реконструктивной хирургии брахиоцефальных артерий
Автор: Засухин Д.А., Яриков А.В., Фраерман А.П., Светанков В.А., Агеева Ю.А., Барченкова И.Ю., Зайцева Н.Е., Слипенко Е.В., Захарова Н.А., Поливцева Е.А., Левшаков В.А., Хаванская Е.В., Цисарь С.В., Личикова Г.А., Абрамычев Н.И., Янакаева О.В., Маричев Д.А., Смолин А.А., Медведева М.О., Шлыкова М.Н., Шигорина А.А., Залетова И.А., Зольникова А.П., Шарова В.В., Мельникова А.В., Горбунова Л.Ю., Котова Г.В., Лукьянова Д.Р., Садкова Н.В., Наумова И.Г., Загляднова Л.В., Емельянова Е.А., Наумов А.К., Жукова Ю.А., Земляникин К.О., Игнатова И.А., Комкова Е.Ф., Пономарева А.И., Хасянов М.К., Ермаков С.В., Хоряева О.М., Ястребов А.А.
Журнал: Бюллетень науки и практики @bulletennauki
Рубрика: Медицинские науки
Статья в выпуске: 3 т.11, 2025 года.
Бесплатный доступ
Эволюция реконструктивной хирургии брахиоцефальных артерий берет свое начало от первых операций в виде лигирования сосудов до высокотехнологичных (каротидная эндартерэктомия, каротидной стентирование, протезирование сонных артерий, сонно-подключичный анастомоз, сонно-подключичное шунтирование и др.). В работе подробно описаны взаимосвязи развития ОНМК с патологией брахиоцефальных артерий (атеросклероз, диссекция, аневризма, аномалия Киммерле). Далее в работе описаны этапы становления основных методов оперативного лечения данных патологий. Рассмотрены различные техники каротидной эндартерэктомии: классическая, эверсионная, гломус-сберегающая. Описаны варианты патологической извитости сонных артерий и способы ее хирургическая коррекция, в том числе с применением эндоскопической ассистенции. Авторы разобрали вопросы методов анестезии, интраоперационной церебральной нейропротекции, доступа к сонным артериям, диагностики патологии брахиоцефальных артерий. В заключение приводятся данные о расширении спектра оперативных вмешательств и активном привлечении нейрохирургов к реконструктивной хирургии на брахиоцефальных артериях.
Каротидная эндартерэктомия, сосудистая нейрохирургия, внутренняя сонная артерия, реваскуляризация головного мозга, протезирование сонных артерий, аномалия киммерле
Короткий адрес: https://sciup.org/14132496
IDR: 14132496 | УДК: 616.8-089 | DOI: 10.33619/2414-2948/112/20
Текст обзорной статьи Эволюция реконструктивной хирургии брахиоцефальных артерий
Бюллетень науки и практики / Bulletin of Science and Practice
УДК 616.8-089
Ежегодно в Мире ОНМК переносит 6 млн. человек и эта цифра постоянно растет [1]. В РФ ежегодно регистрируется 500 тыс. новых случаев ОНМК, приводящих к смерти 50 тыс. человек [2].
В развитых странах ОНМК располагается на втором-третьем месте среди этиологии смертности населения, а также 1 место среди причин инвалидизации людей трудоспособного возраста [3-6].
В настоящее время первичная и вторичная профилактики ОНМК является актуальным [7-9].
При атеросклеротических окклюзионностенотических поражениях брахиоцефальных артерий (БЦА) применяют реконструктивные операции на каротидном артериальном бассейне [10-13].
История развития изучения патологии БЦА и ее влияние на развитие ОНМК [14-18]. V век до н.э. Hippocrates сделал первый очерк того, что возможно именовать в настоящий момент транзиторной ишемической атакой (ТИА): «Исключительные атаки оцепенения и анестезии значатся предвестниками надвигающейся апоплексии». 1664 г. Willis T. подробно описал строение головного мозга (ГМ) и системы его кровообращения. 1743 г. von Haller A. впервые анатомическое упоминание об опухоли каротидного гломуса. 1818 г. Abercombie J. сообщил об окклюзии внутренней сонной артерии (ВСА), как о причине стойких нарушений функции ГМ, связав окклюзию с формированием очага ишемии в ГМ. 1855 г Gull W. выявил взаимосвязь между поражением экстракраниальных артерий и ОНМК. 1856 г. Virchow R. описал тромбоз сонных артерий (СА) с развившейся ипсилатеральной слепотой. 1879 г. Allen W. впервые описал аномалию краниовертебрального перехода в виде костной перемычки – аномалия Киммерле (АК). 1881 г. Penzoldt F. (Германия) впервые описал клиническую картину тромбоза внутренней сонной артерии (ВСА) и позвоночной артерии. 1905 г. Chiari Н. в серии 400 аутопсий выявил 7 случаев наложения тромба на атеросклеротическую бляшку (АСБ) в СА. Еще тогда он убедительно рекомендовал обследовать СА у лиц с «апоплектическим ударом». 1914 г. Hunt R. в г. Нью-Йорк на основе аутопсии установил взаимосвязь между окклюзирующим поражением артерий нижних конечностей и СА, стало быть, впервые показал на генерализованный характер атеросклероза. 1914 г. Mattas P. разработал компрессионный тест, дающий возможность оценить потенциал коллатерального кровообращения ГМ. 1922 г. Moore R. описана преходящая монокулярная слепота. 1923 г. Sicard J. и Forestier J. Впервые выполнили церебральную ангиографию. 1927 г. нейрохирург Moniz Е. не выполнил первую прижизненную ангиографию и он показал 5 удовлетворительных ангиограмм СА больных, где в качестве контраста использовали бромид стронция и йодид соды, вводимые в СА. 1930 г. Kimmerle А. (Венгрия) подробно описал АК, и обратил внимание на то, что данное изменение может приводить к ОНМК. 1940 г. Kouretas D. и Dyacos С. описали больную 23 лет, которая предъявляла жалобы на ухудшение зрения и кратковременные потери сознания. При обследовании у нее обнаружили окклюзию СА и подключичной артерии (ПкА). 1951 г. Johnson Н. и Walker А. подобрали 107 инцидентов тромбоза СА, верифицированных при помощи ангиографии сосудов ГМ, и на этой основе сделали вывод, что данная патология гораздо более частая, чем полагалось прежде. 1951 г. Rieser отметил взаимосвязь между патологической извитостью (ПИ) СА и недостаточностью кровоснабжения ГМ. 1951-1954 г. Miller Fisher С. показал взаимосвязь между стенооклюзирущей патологией шейного сегмента СА и, как он изложил «главными причинами ИИ». В обследованиях СА на шее он зафиксировал 45 инцидентов тотальной или субтотальной стенозов одной или обеих СА в числе 432-х аутопсий. У 4-х лиц с установленной эмболией сосудов ГМ атероматозной материал был выявлен в бифуркации ОСА. 1955 г. Jates и Hatchinson (г. Лондон) отметили, что почти у всех больных, страдающих церебральной ишемией, были найдены окклюзионные поражения БЦА на аутопсии, и что диагноз церебральной ишемии был часто ошибочным. 1956 г. Milliken и Seikert (клинике Mayo) описали синдромы каротидной и вертебральной недостаточности. 1956 г. Meyer J. искусственно вызывали клинику недостаточности кровообращения ГМ у пациентов с атеросклерозом СА, изменяя их положение на наклоненном столе. 1965 г. Weibel J., Fields W.S. предложили классификацию ПИ СА. 1969 г. после окончания исследования Joint Study of Extracranial Arterial Occlusion привели данные о том, что при выполнении 2400 операций за период 1961-1968 гг. летальность во время проведения хирургического вмешательства составила 4,5%, варьировалась от <2% до 36% между 24 участвующими в исследовании учреждениями, хотя в течение 8 лет происходило постоянное снижение этого показателя. 1971 г. выполнена первая КТ ГМ. 1971 г. Shamblin W. R. топографо-анатомическую классификацию каротидных параганглиом, в основу которой легла степень вовлеченности СА в опухолевый процесс. 1972 г. Margolis M. T. в своей работе описал 20 случаев экстракраниальных аневризм ВСА в Клинике Калифорнийского Университета. В 5 случаях атеросклероз был причиной их формирования, 7 на фоне врожденных диспластических нарушений соединительной ткани, 6 травматической этиологии и в 2 случаях местный инфекционный процесс. 1980 г. Axel впервые предложил методику КТ-перфузии. 1983 г. Reilly L.M. впервые обратил внимание на отличия структуры внутри АСБ. 1986 г. ОФЭКТ впервые применили для оценки кровотока ГМ. 1993 г. Geroulakos G. et al. представил классификацию (пять типов атеросклеротических бляшек СА) на основании эхогенности и однородности на основании B-режима при УЗИ. 1995 г. опубликованы результаты NASCET (North American Symptomatic Carotid Endarterectomy Trial). В группе с выраженным стенозом (70-99%) исследование закончилось досрочно: кумулятивный 2-х летний риск ипсилатерального — ОНМК у пациента, которым проводили медикаментозную профилактику 26%, хирургии — 9%. У пациентов с умеренными (50-69%) зафиксировано небольшое, но статистически значимое преимущество КЭ, в группе с малыми (30-49%) преимущества не было выявлено. 1995 г. исследование ACAS (Asymptomatic Carotid Atherosclerosis Study). Исследование показало, что КЭ не предотвращает развитие инвалидизирующего ОНМК и имеет меньшую эффективность у женщин из-за частого развития рестеноза. 1996 г. исследование ECST (European Carotid Surgery Trial): частота развития повторных ОНМК в бассейне стенозирования > 70% СА у больных перенесших КЭ шестикратно снижалось по сравнению с медикаментозным лечением. 1996 г. Alsop D. и Detre J. применили метод ASL (Arterial Spin Labeling — спиновое маркирование артериальной крови) для визуализации мозговой перфузии человека в магнитном поле. 1999 г. опубликованы результаты первых клинических применений метода ASL. 2000 г. после выхода работ R. El-Sabrout и D. Cooley консервативное лечение пациентов с аневризмами СА с помощью антиагрегантов и антикоагулянтов сведено к минимуму. 2001 г. исследование CAVATAS (24 медицинских центрах Европы, Канады, США и Австралии) показало равный риск относительно главных осложнений (ОНМК и смерть) как для КС, так и для КЭ, в то время как было выявлено статистически существенное различие в пользу КС касательно малых осложнений, таких как травма черепных нервов или гематомы. 1-летнее наблюдение показало в среднем высокий процент развития рестенозов при КС, но при этом 3-летнее наблюдение не выявило значительных различий по основным показателям (ОНМК и смерть). 2003 г. испытание CARESS показало в течение 30 дней одинаковое число ОНМК и случаев развития ОКС и связанных с ними смертельных исходов (2%) для обоих методов (КС и КЭ). 2004 г. в исследовании SAPHIRE частота ОНМК и летальности за 30 дней составила 2,1% при КС и 9,3% при проведении КЭ (p=0,18). Фокусируя свое внимание также на средних показателях смертности, а так же ОНМК и инфаркте миокарда в течение 1 года, были получены результаты 12,2% и 20,1% для КС и КЭ соответственно (p=0,004). Количество повторных операционных вмешательств в течение 1 года в среднем составило 0,6% и 4,3% для КС и КЭ соответственно (p=0,04). 2004 г. исследование ACST (Asymptomatic Carotid Surgery Trial). Хирургическая профилактика была эффективна у мужчин. Статистически значимого преимущества хирургии у пациентов старше 75 лет не было выявлено. 2005 г. Balotta Е. провели сравнительный анализ между хирургическим и консервативным лечением лиц ПИ CА. Они показали преимущества хирургии в виде снижения частоты повторных ОНМК, а также улучшение неврологического статуса после вмешательства. 2006 г. исследование EVA-3S (Endarterectomy versus Stenting in Patients with Symptomatic Severe Carotid Stenosis), проведенное в 20 академических и 10 неакадемических медицинских центрах Франции. Результаты 30-дневного периода наблюдения по первичным конечным точкам (ОНМК/смерть) показали, что риск развития ОНМК/инфаркта был ниже при КЭ (3,9%) по сравнению с КС (9,6%) (p = 0,01), при этом частота ОНМК со стойким неврологическим дефицитом и летальности в этих группах составила 1,5 и 3,4% соответственно. Исследование EVA-3S было остановлено досрочно, поскольку частота ОНМК и смертей была в 2,5 раза выше в группе больных КС. По результатам исследования были сделаны выводы, что риск развития ОНМК/смерти в отдаленном периоде у симптомных пациентов со стенозами ВСА более 60% меньше при КЭ, чем при КС. 2008 г. исследовании SPACE (Stent-protected Percutaneous Angioplasty of the Carotid vs Endarterectomy), проходившего в германоязычных странах Европы. SPACE было посвящено изучению оптимальной стратегии лечения симптомного стеноза ВСА (>50% диаметра просвета). Риск смерти и ОНМК в течение 30 суток после вмешательства в обеих группах не отличался достоверно, как и риск ипсилатерального ОНМК в долгосрочнй перспективе – частота неблагоприятных осложнений как после КС, так и после КЭ была достаточно низкой и без статистически значимых различий. 2010 г. испытание CREST (Carotid Revascularization Endarterectomy vs. Stenting Trial): существенных различий в составной конечной точке в виде ОНМК, инфаркта миокарда и летального исхода у пациентов с симптомным или бессимптомным стенозом СА между группами КЭЭ и КС не было. 2010 г. исследование ICSS (International Carotid Stenting Study) показало соотношение событий ОНМК/смерть в группах КС и КЭ – 72 (8,5%) и 40 (4,7%) соответственно. ICSS показало, что КЭ является более безопасным вмешательством по сравнению с КС. 2016 г. исследование ACT-1. Пациенты наблюдались в течение 5 лет. Сравнительный анализ групп с КС и КЭ показал отсутствие достоверной разницы по первичной конечной точке (смерть, ОНМК, ИМ) в группах.
История развития хирургии БЦА [19-25]. Первые оперативные вмешательства на СА производились при их повреждении и сводилось к их лигированию. 1552 г. Pare A. при перевязке общей сонной артерии (ОСА) описал развитие у больного паралича в конечностях с противоположной стороны и постепенное угнетение сознания. 1803-1809 гг. британский хирург Cooper А. выполнил операции по поводу аневризм СА. Операции включала в себя лигирование артерии дистальнее и проксимальнее аневризматического мешка. Позже Cooper А. высказал предположение о возможности формирования ишемического инсульта (ИИ) после выполнения лигирования CА. 1823 г. Mc Geil произвел двустороннюю перевязку ОСА с промежутком в 1 месяц. 1843 г. Twitchell А. сообщил об удачной операции по остановке кровотечения из СА после огнестрельного ранения шеи. 1880 г. Рейгнер (Reigner) предпринял первую попытка хирургического удаления каротидной хемодектомы. 1886 г. Maydl впервые провел успешную операцию по удалению хемодектомы, с развившимся затем осложнением в виде афазии и гемипареза. 1898 г. Gluck T. (Германия) показал возможность восстановления тока крови по ВСА с применением аутовенозного трансплантата в эксперименте. 1903 г. Scudder (США) выполнил первую операцию по удалению хемодектомы с сохранением ВСА и без развития осложнений. 1906 г. — открытие сосудистого шва, преимущество которого заключалось в применении 3, так называемых «ситуационных нитей», превращающих круглый просвет сосуда в треугольный с равными сторонами, что позволяет более доступно наложить обвивной шов (Рисунок 1). 1916 г. Паржевский А.С. в впервые благополучно сформировал анастомоз по типу «конец в конец» на СА после резекции артериовенозной аневризмы ОСА. 1918 г. Haberer H. произвел резекцию травмированного участка ОСА с дальнейшим формированием анастомоза по типу «конец в конец» раненому в шею солдату. 1918 г. французский хирург Le Fevre доложил хирургическому обществу об анастомозе между ветвями наружной сонной артерии (НСА) и дистальной частью ВСА с целью восстановления интракраниального кровотока после резекции опухоли на шее. 1920 г. Sloan
Н. (Великобритания) первым доложил о реконструкции СА. Он оперировал пациента с рецидивом рака губы с метастазами в область шеи. Он писал: «Мы повредили СА, поскольку она находилась в рубцовой ткани, окружающей опухоль. Кровотечение было приостановлено зажатием пальцем СА над и под дефектом стенки, который имел длину 3-4 см. Используя москитный гемостатический зажим в качестве иглодержателя, нам удалось наложить швы, применяя метод Carrel А.». 1938 г. Chao (Китай) резецировал окклюзированную ВСА у 2-х больных: улучшение у больных было весьма незначительным. 1940 г. Gordon-Taylor описал особенности оперативной хирургии опухолей бифуркации СА, а также результаты применения субадвентициальной техники удаления каротидных хемодектом. 1951 г. Conley J. провел протезирование ВСА по поводу каротидной параганглиомы, которому произвели резекцию вовлеченного в опухолевый процесс фрагмента ОCА и ВСА с дальнейшим восстановлением кровотока, вшивая протез из большой подкожной вены с наложением 2-х анастомозов «конец-в-конец». 1951 г. в г. Буэнос-Айресе Carrea R., Molins М. и Murphy G. (нейрохирург, сосудистый хирург и терапевт) произвели с успехом реконструкцию ОСА и ВСА после резекции стенозирующего участка в бифуркации, выполнив единовременно шейную симпатэктомию. У данного 41-летнего больного регрессировали систематические инциденты афазии, правосторонней пирамидной недостаточности и слепоты на левый глаз. 1951 г. Riser М. выполнил первую операцию по поводу коррекции извитости ВСА. Она заключалась в подшивании избыточной части ВСА к грудино-ключичнососцевидной мышце. 1953 г. DeBakey М. Е. произвел благополучной продольной артериотомии ВСА и тромбэндартерэктомии из нее, эта операция стала главной в лечении атеросклероза магистральных артерий ГМ. Хирургический результат был подтвержден послеоперационной ангиографией. Оперированная СА была проходима и спустя 19 лет, когда пациент скончался от сердечной недостаточности. 1954 г. Eastcott Н. с коллегами из St Mary's Hospital (г. Лондон) резекция СА с формированием анастомоза «конец в конец» между ОСА и ВСА у лица с эпизодами ТИА. 1954 г. Denman F. R. выполнил протезирование ВСА при ее атеросклеротическом поражении, применив в качестве трансплантата лиофилизированную гомоартерию. 1956 г. Couli J. впервые использовал временный шунт на основном этапе каротидной эндартерэктомии (КЭ). 1956 г. Lin Р., Javid Н., Doyle Е. применили аутовену после резекции окклюзированного сегмента СА. Эти сообщения стали причиной процесса, так именуемым «эпидемии КЭ», в основном, в Северной Америке в 1960-1970 гг. 1956 г. Hsu I. и Kisten А. впервые провели реконструкцию ВСА при ее патологической извитости (ПИ), но тромбоз анастомоза привел к летальности пациента. 1958 г. Quattlebaum J. К. выполнил первую успешную операцию пациентке с кинкингом левой ВСА с наложением анастомоза конец в конец в сочетании с перевязкой и пересечением НСА. У пациентки развился правосторонний гемипарез. 1959 г. De Backey M. Е. представлена идея эверсионной КЭ (ЭКЭ) (Рисунок 2). 1960 г. Hurwitt Е. провел резекцию измененного сегмента ВСА и наложение анастомоза «конец в конец». 1960 г. Злотник Э. И. впервые в СССР выполнил успешную классическую КЭ, использовав при закрытии артериотомического отверстия прямой шов (Рисунок 3). 1961 г. Lorimer W. предложил проводить резекцию и низведение ВСА с имплантацией в переднюю или боковую стенку ОСА ниже ее бифуркации — это в отличие от метода Quattlebaum J., не требовала перевязки НСА. 1962 г. Покровский А. В. впервые в СССР произвел расширение просвета СА выполнил у 2 пациентов пластику ВСА заплатой, при этом бляшки не удалялись. 1962 г. Богатырев Ю. В. сообщил об успешном протезировании ВСА лавсановым протезом у 2 пациентов при остром тромбозе. 1962 г. Derrick и Smith указали на роль ПИ в развитии ОНМК и предложили выполнение транспозиции ВСА более поверхностно с фиксацией за грудино-ключично-сосцевидную мышцу как самостоятельный метод оперативного лечения. 1964 г. Parrot J.С. исполнил сочетанную операцию: КЭ с применением заплаты и резекцию подключичной артерии с репозицией в ОСА. 1965 г. DeВакеу M. Е. впервые выполнил операцию сонноподключичного шунтирования (Рисунок 4).
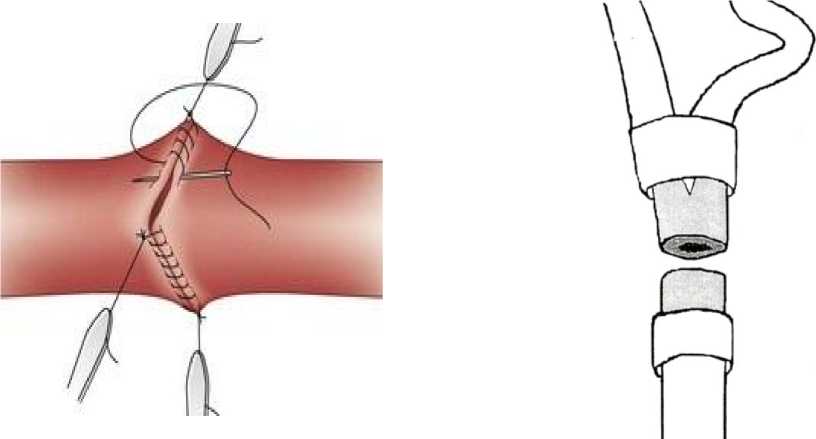
Рисунок 2. Схема ЭКЭ по De Backey M. Е.
Рисунок 1. Схема сосудистого шва Carrel A.
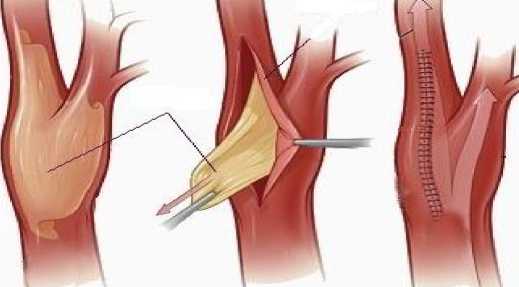
Рисунок 4. Современная техника выполнения сонно-подключичного шунтирования
Рисунок 3. Классическая КЭ без заплаты
1966 г. Clark K., Perry M. O. описали транспозицию ПА в ОСА. 1967 г. Yasargil M. G. впервые проведена операция по созданию экстра-интракраниального микрососудистого анастомоза (ЭИКМА). 1967 г. Morris D., Letcher А. и De Bakey M. Е. впервые выполнили ангиопластику ВСА с применением открытой техники у больного с диагностированной фибромускулярной дисплазией. При этом они использовали дилататор, предназначенный для расширения желчных протоков. Из 12 пациентов, прооперированных таким способом, не наблюдалось никаких неврологических осложнений. 1970 г. Crispin H. и Van Baarle A. применили видеоангиоскопию при тромбэндартерэктомии и она позволили выявить внутрисосудистые дефекты СА. 1971 г. в США было выполнено 15 тыс. КЭ. 1976 г. США было выполнено 34 тыс. КЭ. 1977 г. Mathias К. проинформировал об ангиопластике ВСА. 1977 г. Carney А. впервые выполнил хирургическое вмешательство на дистальном отделе ПА. 1980 г. Fry R.E. et. al. с целью визуализации дистального отдела ВСА у пациента с травматическим повреждением артерии. Они выполнили максилло-мандибулярную фиксацию через альвеолярные отростки верхней и нижней челюстей для двусторонней сублюксации. 1981 г. Welsh P. et. al. у 7 пациентов выполнили поднадкостничную остеотомию в области угла нижней челюсти, что позволило осуществить боковое вращение ветви нижней челюсти в височно-нижнечелюстном суставе [26, 27]. 1981 г. Sundt et. al. дал определение «синдром церебральной гиперперфузии», однако описания клинической картины этого феномена были ранее, но авторы связывали их с другой причиной. 1984 г. Kieny R. описал технику ЭКЭ. Способ содержит в себе отсечение ВСА в области устья, эверсии ее в дистальном направлении c удалением АСБ и реимплантации ВСА в старое устье (Рисунок 5). 1984 г. Pellegrini R.V. et. al. описали методику выполнения доступа к дистальному отделу ВСА путем продления кожного разреза пре- или ретроаурикулярно, рассечения околоушной железы и лицевого нерва, и удаления части сосцевидного отростка, таким образом улучшая дистальную визуализацию ВСА у основания черепа. 1985 г. США было выполнено 107 тыс. КЭ. 1987 г. Railthel D. модернизировал технику Kieny R. и стал отсекать ВСА с капюшоном ОСА, что уменьшало вероятность рестеноза в зоне длинного анастомоза. 1987 г. Reigel M. M. et al. описали клинические проявления синдрома церебральной гиперперфузии. 1989 г. Паулюкас П. А. и Баркаускас Э. М. предложили применять мобилизацию, резекцию ВСА, низведение излишней длины, резекцию проксимального сегмента ВСА и имплантации ее в «старое» устье с формированием широкого анастомоза. 1993 г. Chevalie J. модифицировал технику выполнения ЭКЭ. Он состоит в поперечном пересечении ВСА дистальнее АСБ и произведении короткой продольной артериотомии ОСА с переходом на устье НСА. Проксимальный сегмент ВСА выворачивался в просвет ОСА, АСБ удаляется N-блоком. Далее воссоздается целостность ВСА и зашивался участок артериотомии в ОСА (Рисунок 6).
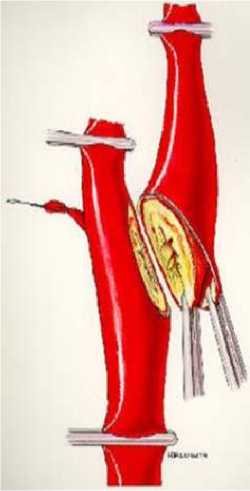
Рисунок 5. Схема КЭ по Kieny R.
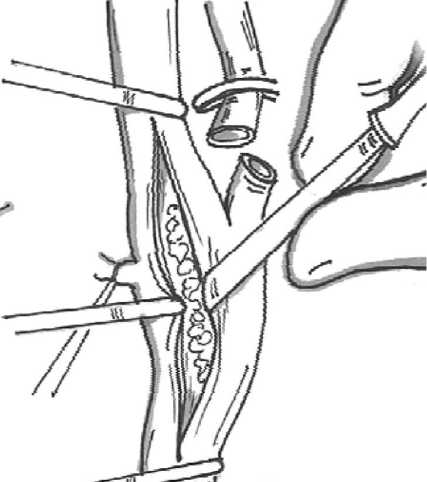
Рисунок 6. КЭ по Chevalie J.
1993 г. Mathias K. аннонсировали опыт применения стента Palmaz для дилатации и стентирования ВСА у 2 больных, у которых консервативное лечение было без эффекта. 1993 г. Williams и McCollum во время плановой КЭ применили комбинированный мониторинг мозгового кровотока и церебральной оксигенации на основе комплекса транскраниальной допплерографии и церебральной оксиметрии. 1993-1994 гг. Американским обществом нейрохирургов организованы специальные комиссии (Carotid endarterectomy task force), целью которых было изучение причин активности нейрохирургов в реконструктивной хирургии СА, а также популяризация КЭ среди нейрохирургов. 1995 г. США было выполнено рекордное количество КЭ —132 тыс. 1996 г. Lyberiadis D. выполнил резекцию и редрессацию ОСА при ПИ с формированием анастомоза «конец в конец». 1996 г. Mordasini Р. впервые выполнил ретроградного транскаротидного КС. 1997 г. J. Towne и V. Bernhard внедряют сосудистую эндоскопию на СА. 1998 г. Cao Р. et al. 1190 ЭКЭ и 1173 ККЭ. Риск развития гемодинамически значимых рестенозов (более 75%) в зоне оперированного сегмента также был меньше у пациентов после ЭКЭ по сравнению с ККЭ (2,5 и 5,2% соответственно). 1998 г. Алекян Б.Г. сообщил о первом КС ВСА в РФ. 1998 г. Giordano J.M. рекомендовал воздержаться от реконструкции СА в период до 4 нед. от возникновения ИИ. 2005 г. Ballotta Е. et al описал операцию каудальной реимплантации ВСА по типу «конец-в бок» в ОСА или в НСА при ПИ. 2006 г. Исследование STACI (Surgical Treatment of Acute Cerebral Ischemia) доказала безопасность КЭ в острый период ИИ у больных с небольшой областью инфаркта ГМ. При этом отсутствовала статистически значимая разница в группах ранней и отсроченной реваскуляризации в отношении показателей периоперационных осложнений, в том числе геморрагической трансформации очага. 2006 г. Rockman C.B. et. al. выявили высокий риск периоперационного ОНМК у лиц, прооперированных в течение 4 нед. после развития ОНМК. Они не выявили статистически значимой разницы по частоте развития периоперационного ОНМК в группах пациентов с КЭ до 1 нед. и от 1 до 4 нед. При этом в группе больных с КЭ в период более 1 мес. безопасность реконструкции была статистически подтверждена. 2008 г. в крупном рандомизированном многоцентровом исследовании GALA (General Anaesthesia versus Local Anaesthesia for carotid surgery) не выявлена существенная разница в частоте развития ОНМК, инфаркта миокарда или смерти между пациентами групп общей и местной анестезии. Но более низкая стоимость местной анестезии связана преимущественно с уменьшением срока пребывания пациента в палате интенсивной терапии и сокращением использования расходных материалов, таких как шунты и синтетические заплаты. 2008 г. был разработан новый способ ЭКЭ по Покровскому А.В. и соавт. (ЭКЭ с «формированием новой бифуркации»). После отсечения ВСА от устья проводилось ее продольное рассечение по медиальному краю в дистальном направлении до уровня, на котором АСБ заканчивается. Далее на такое же расстояние рассекается НСА. После эндартерэктомии из всех СА сшивается ВСА и НСА с переходом на ОСА по типу «бок-в-бок». Таким образом формируется бифуркация на 2–3 см. выше изначального расположения. ЭКЭ «с фомированием новой бифуркации» может служить хорошей альтернативой протезированию у больных с АСБ во ВСА и у лиц с неадекватной КЭ (Рисунок 7). 2014 г. Сергеев В. Л. и соавт. модифицировали технику выполнения ЭКЭ по Kieny R. Суть нового способа заключается в отсечении ВСА от зоны бифуркации с широким захватом ОСА с оставлением узкой полоски задней стенки ОСА в виде мостика (Рисунок 8). 2015 г. Лукьянчиков В.А. выполнил декомпрессию V3 сегмента ПА при АК. 2016 г. результаты исследования ACT-1. Пациенты наблюдались в течение 5 лет. Сравнительный анализ групп с КС и КЭ показал отсутствие достоверной разницы по первичной конечной точке (смерть, ОНМК, ИМ) в группах.

Рисунок 7. ЭКЭ по Покровскому ЭКЭ с «формированием новой бифуркации»

Рисунок 8. Схема ЭКЭ по Сергеев В.Л. и соавт.
2017 г. Savanto L. и Siebel J. изучали просвет СА с помощью прямой ангиоскопии и отметили, что источником ОНМК АСБ, имеющие язвы и эрозии. Они разработали особый вид эндоскопии Scanning Fiber Angioscopy (SFA) – применение фиброскопа с эффектом флуоресценции и отражения света. 2017 г. Лукьянчиков В.А. выполнил редрессацию высокой извитости ВСА с применением эндоскопии. 2017 г. Kakisis J. D. et al. показали, что общая анестезия при КЭ связана с более высокой смертностью (более чем в 2 раза) по сравнению с региональной, она также является независимым фактором риска развития послеоперационного инфаркта миокарда, особенно у пациентов с предоперационными неврологическими симптомами: из 584 прооперированных пациентов инфаркт отмечен у 2,5% пациентов в группе общей и только у 0,6% пациентов в группе региональной (р=0,07).
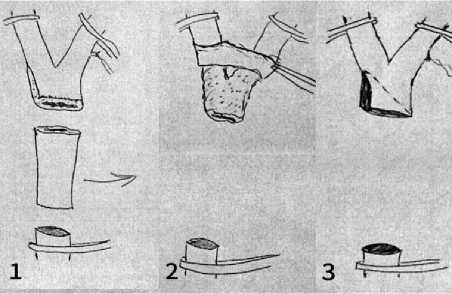
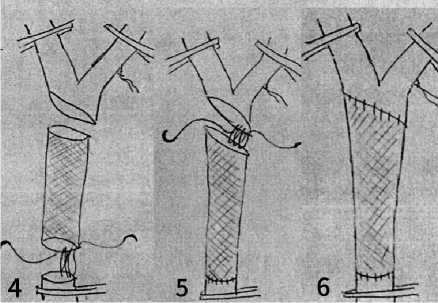
Рисунок 9. Схема хирургической коррекции при сочетанном поражении СА. 1 - Поперечная артериотомия ОСА с продолжением на латеральную стенку ВСА; 2 - Эверсия бифуркации ОСА, ВСА и НСА; 3 - Резекция избыточных краев ВСА и ОСА; 4 - Проксимальный анастамоз между протезом и ОСА; 5 - Дистальный анастомоз между протезом и бифуркацией; 6 - Конечный вид реконструкции
2018 г. Ларьков Р. Н., Вишнякова М. В., Казанский М. Ю. описали новый способ хирургической коррекции сочетанного поражения СА. Сущность метода заключается в поперечном пересечении ОСА с продолжением разреза на латеральную стенку ВСА до верхнего полюса АСБ. Следующим этапом является резекция патологически измененного фрагмента ОСА. Затем выполняется эверсионная эндартерэктомия из бифуркации ОСА, ВСА и НСА с полной визуализацией и удалением АСБ. После ее удаления ОСА и ВСА возвращают в исходное положение и сегментарно резецируют избыточные края ОСА и ВСА.
Выполняется протезирование по типу «конец-в-конец», при этом верхний край протеза выполняют конгруэнтным линии иссечения стенок ОСА и ВСА. Способ позволяет выполнить лечение пациентам при сочетанном поражении СА с высокой эффективностью, снизить риск возникновения неврологического дефицита и окклюзий реконструированного участка ОСА и ВСА. 2019 г. разработана ЭКЭ по Ларькову Р.Н. и соавт. Новый способ заключается в косом пересечение ВСА на уровне луковицы, рассечении ВСА со стороны, прилегающей к «каротидному тельцу» продольно вверх до верхнего уровня артериотомии на ОСА (Рисунок 10). 2019 г. Izumo T. et. al. (Япония) впервые применили экзоскоп при КЭЭ. 2021 г. Grieff A. N. et. al. доказали, что региональная анестезия сопровождается значимо меньшей частотой повреждения черепно-мозговых нервов по сравнению с общей: 1,7 против 2,9% соответственно (p<0,002). Гломус-сберегающие техники КЭ. Анализируя возможные причины неконтролируемой послеоперационной гипертензии, ряд авторов связали и доказали ее патогенез с повреждением каротидного гломуса. Это привело к созданию гломус-сберегающих техник КЭ. Анцупов К. А. с соавт. разработали сложную S-образную артериосекцию, позволяющую привычно отсечь ВСА и выполнить уже известный ход операции. Однако эта методика не обеспечивала полной визуализации просвета ОСА и НСА и не позволяла выполнить КЭ. 2017 г. Виноградов Р. А. с соавт. предложили более совершенную методику ЭКЭ с выполнением нестандартного S-образного разреза с полным отсечением ОСА. Данный подход позволял сохранить гломус с выполнением тотальной ЭКЭ из всех СА. Однако недостатком перечисленных гломус-сберегающих техник является значительное усложнение операции при протяженной АСБ во ВСА, которая распространяется до основания черепа и не заканчивается. Такая ситуация может вызвать необходимость в аутотрансплантации ВСА. 2020 г. Казанцев А. Н. и соавт. разработал новый вид гломус-сберегающей КЭ, в результате чего каротидной гломус не травмируется. По внутреннему краю НСА, прилегающему к каротидному синусу, на 2–3 см выше устья в зависимости от распространения АСБ выполнялась артериотомия с переходом на ОСА (также на 2–3 см ниже устья НСА). Проводилось отсечение ВСА на площадке, образованной участками стенки НСА и ОСА. Осуществляется эндартерэктомия из ВСА по эверсионной технике и эндартерэктомия из НСА и ОСА (Рисунок 11).
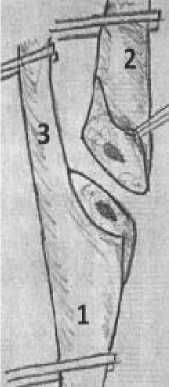
Рисунок 10. Схема выполнения ЭКЭ по Ларькову Р.Н. и соавт. (1- ОСА, 2 – ВСА, 3 - НСА)
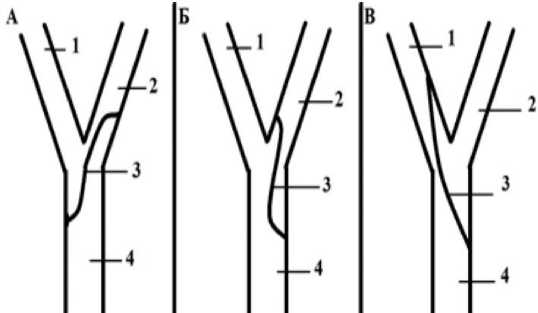
Рисунок 11. Гломус-сберегающая КЭ: по Р.А. Виноградову (А); К.А. Анцупову (B); А.Н. Казанцеву (C). Примечание. 1 — НСА; 2 — ВСА; 3 — линия артериотомии; 4 — ОСА
Хирургия СА при патологических извитостях (ПИ). Частота выявления ПИ ВСА достигает 25-30% у взрослых и 43% у детей [28]. Наиболее часто применяемая классификация ПИ СА предложена Weibel J., Fields W. S. (1965 г.), в которой выделяется 3 вида ПИ (Рисунок 12) [29-31]: C- и S-образные извитости СА (без образования острых углов); кинкинг – перегиб CА под острым под углом, что приводит к образованию септального стеноза. Септальные стенозы формируются из-за резкого изгиба СА в области деформации; койлинг – петле- и спиралеобразование;С и S-образные извитости и петли, обусловленные фибромускулярной дисплазией.деформации в сочетании с аневризматическими расширениями.
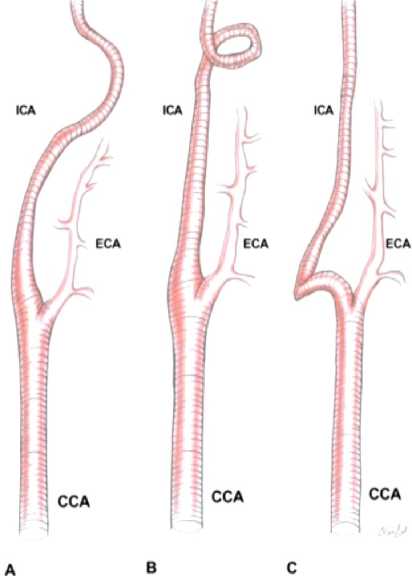
Рисунок 12. Основные виды патологических извитостей. А – С-образная извитость; В-койлинг (петля); С-кинкинг (перегиб )
Для классификации септальных стенозов СА применяется классификация Metz H. [32]: 1-й тип — перегиб более 60˚; 2-й тип — перегиб в 30- 60˚; 3-й тип — острый перегиб менее 30˚. При ПИ выполняют следующие операции: артериолиз, резекция извитости с редрессацией, резекция извитости с протезированием, резекция извитости с формированием анастомоза [33]. В настоящее время активно развивается хирургическая коррекция дистальных ПИ ВСА с применением эндоскопии. Эндоскопические методики позволяет снизить травматичность операций, улучшить функциональные исходы. Доступ к ПИ ВСА с применением эндоскопической ассистенции (Рисунок 13). На коже отмечают: угол нижней челюсти, точку бифуркации ОСА, точки начала изгиба 4 (или проксимального конца извитости, когда артерия отклоняется от прямолинейного хода) и окончания изгиба 5 (или дистального конца извитости, когда артерия принимает прямолинейный ход), отрезок, соединяющий данные точки, отмечен как B, а также точку 6, являющуюся центром полученного отрезка (центром извитости). Проводят перпендикуляр от центра извитости к ветви нижней челюсти — отрезок А. Проводят линию на коже через точку 1, соответствующую бифуркации C, по внутреннему краю проекции грудино-ключичнососцевидной мышцы длиной 3 см — отрезок С.
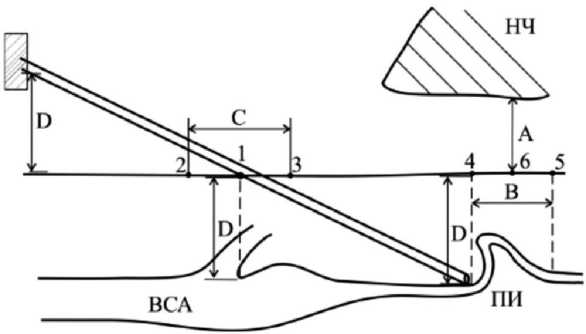
Рисунок 13. Схема эндоскопического выделения высокой извитости ВСА. ПИ — патологическая извитость, НЧ — нижняя челюсть. А — отрезок от НЧ до проекции середины извитости ВСА на коже (отрезок, являющийся перпендикуляром от центра ПИ, отмеченного на коже пациента, к ветви НЧ); В — отрезок между точками, соответствующими проекции начала ПИ (проксимального ПИ и окончания ПИ (дистального конца ПИ); С — отрезок по внутреннему краю проекции грудино-ключично-сосцевидной мышцы длиной 3 см с центром в точке, соответствующей проекции бифуркации ОСА; D — глубина залегания бифуркации ВСА, которая равна глубине залегания ПИ ВСА, а также высоте расположения камеры эндоскопа над поверхностью кожи (D) [34]
Выбор метода анестезии при реконструкции СА. В Таблице суммированы все описанные мотивы выбора метода анестезии при КЭ [35-39]. Выбор операции – КЭ или ЭКЭ. В настоящее время среди многочисленных способов реконструкции СА наиболее часто применяемыми являются ЭКЭ и ККЭ с заплатой. Однако вопрос эффективности, риска интра- и послеоперационных осложнений, частоты выполнения повторных вмешательств в отношении этих методов остается открытым и активно обсуждается специалистами. По данным Российского общества ангиологов и сосудистых хирургов, в 2018 г. в РФ ЭКЭ выполнено почти в 3 раза больше чем ККЭ [42]. Исследование по изучению физических свойств области реконструкции после проведения ККЭ с заплатой свидетельствует о значительной вероятности развития рестеноза и окклюзии ВСА вследствие изменения гемодинамических свойств кровотока [43]. При выполнении ЭКЭ отмечается повышенный риск тромбоза в результате отслойки интимы. В исследовании H.Dakour-Aridi среди пациентов, перенесших ЭКЭ, было выявлено протективное действие данной техники по отношению развития ИИ и летального исхода спустя 30 дней и 1 год после операции по сравнению с ККЭ, однако наблюдался рост геморрагических осложнений, что создает необходимость ревизии раны [44]. Таким образом, анализ проведенных исследований, благоприятный послеоперационный период пациентов, отсутствие развития грозных осложнений, объясняет предпочтение выбора специалистов ЭКЭ. Клинико-экономический анализ КС и КЭ. В настоящее время использование КС или КЭ как основного метода хирургической коррекции атеросклеротического поражения СА должно быть связанно с возможностью оптимизации эффективности и стоимости лечения [40]. На базе ГБОУ ВПО «Иркутский государственный медицинский университет» был проведен клиникоэкономический анализ применения КС и КЭ, базирующийся на двух группах пациентов (1 группа – КС, 2 группа – КЭ). Общими признаками являлись возраст исследуемых, характер сопутствующей патологии (гипертоническая болезнь и сахарный диабет), степень стеноза
СА, отличительными – вид операции (КС и КЭ) и перенесенные заболевания (ИБС 1 гр. > ИБС 2 гр.; ИИ 1 гр. < ИИ 2 гр., так как больных с ИБС чаще направляли на КС, а пациентов с ИИ на КЭ).
Таблица
СВОДНАЯ ТАБЛИЦА МОТИВОВ ВЫБОРА МЕТОДА АНЕСТЕЗИИ ПРИ КЭ
|
Мотив выбора |
Местная анестезия Общая анестезия |
|
Мотив в пользу метода |
-выраженные сопутствующие -прием клопидогреля заболевания; -высокая вероятность использования -недоступность временного интраоперационного внутрипросветного шунтирования физиологического мониторинга -неблагоприятные анатомические условия -наличие кардиостимулятора -необходимость сублюксации или -возможность выполнения большего остеотомии нижней челюсти количества операций -синдром ночного апноэ -уменьшение срока госпитализации -экстренная операция -дефицит коек интенсивной терапии -невозможность выполнения теста с -экономическая выгода пробуждением -отказ пациента от общей анестезии -возможность анестетического прекондиционирования и посткондиционирования -предпочтения пациента и хирурга -симультантная операция на других артериальных бассейнах |
|
Мотив отказа от |
-выраженный неврологический -ограниченные ресурсы |
|
метода |
дефицит -выраженные явления -риск развития когнитивной дисфункции энцефалопатии -афазия -языковой барьер -анатомические особенности (извитость дистальных отделов ВСА, протяженные стенозы, высокая бифуркация ОСА, короткая толстая шея) -лучевая терапия в области шеи |
Экономическая составляющая оценивалась по принципу «затраты-эффективность», где за основу принимались расходы на достижение одного положительного результата лечения. Анализ, целью которого являлось определение непосредственной клинической эффективности, включал в себя два параметра – отсутствие регресса симптоматики и развитие осложнений в раннем послеоперационном периоде, где отношение пациентов среди групп составило 14к23 [41]. Анализ финансов на достижение положительного эффекта у одного пациента, включая оценку операционных затрат, расходов на госпитализацию и длительность госпитализации, фармакотерапию, показал значительное преимущество КЭ над КС, где экономическая выгода составила более 80 тыс. рублей. Таким образом, результаты показали преимущество КС перед КЭ в отношении клинической эффективности, однако второй метод оперативного лечения стенозов СА характеризуется более низкими медицинскими затратами.
Обсуждение. Конец XX века ознаменовался невероятным ростом числа хирургических вмешательств при атеросклерозе СА [45- 48]. За это время сформировались четкие показания к реконструкции СА, отбор пациентов для операций (оценка хирургических рисков, тяжесть неврологического дефицита, возраст пациента, поражение коронарных артерий), время проведения реконструкции (от момента ОНМК, двухстороннее поражение СА), выбор способа реконструкции СА (ККЭ, ЭКЭ, протезирование СА, КС), техника оперативного вмешательства (сохранение каротидного гломуса, ангиоскопия, применение увеличительной оптики и микрохирургического инструментария, экзоскоп, микроскоп), применяемые доступов к СА (классический, позадияремный, продольный мини-доступ, протяженный/поперечный доступ по естественной кожной складке и мини-доступ по кожной складке), методы анестезии (общая, региональная, местная), методы интраоперационная диагностика церебральной ишемии (церебральная оксиметрия, ЭЭГ, соматосенсорный вызванный потенциал, транскраниальный моторный вызванный потенциал, измерение концентрации лактата крови из внутренней яремной вены, транскраниальное измерение линейной скорости кровотока в СМА, маркеры повреждения ГМ (протеин-S100, нейронспецифическая енолаза (NSE)), динамический неврологический контроль), интраоперационной церебральной нейропротекции (управляемая артериальная гипертензия, управляемая гипотермия, фармакотерапия, использование временного шунта), инструментальной оценки тяжести ишемии ГМ (КТ-перфузия, МР-перфузия, ОФЭКТ), оценки различных способов реконструкции СА методами компьютерного моделирования кровотока [49-57]. Отмечается расширение спектра патологии, при которых производят оперативные вмешательства на БЦА: атеросклероз, ПИ, диссекция, аневризма, каротидная хемодектома, аномалия Киммерле [58-61].
Реконструктивная хирургия БЦА в России в настоящее время. В России большой вклад в развитие хирургии БЦА внесли следующие сосудистые хирурги и нейрохирурги: А. В. Покровский, А. А. Фокин, Г. Ю. Сокуренко, П. О. Казанчян, И. П. Дуданов, Д. Ю. Усачев, В. В. Крылов, Р. Н. Ларьков, Ф. А. Сербиненко, А. Н. Вачев, И. М. Игнатьев, Г. И. Антонов, В. Л. Леменев, В. Г. Дашьян, В. А. Лукьянчиков, Ю. И. Казаков, Р. А. Виноградов, В. А. Лукшин, А. Н. Казанцев [62].
А реконструктивные операции на БЦА стали рутинной операцией в следующих отделениях нейрохирургии России: НИИ СП им. Н. В. Склифосовского, НМИЦ нейрохирургии им. ак. Н. Н. Бурденко, МОНИКИ им. М. Ф. Владимирского, Федеральный центр мозга и нейротехнологий ФМБА России, Научный центр неврологии, Российский университет медицины, НМИЦ им. Н. И. Пирогова, Городская клиническая больница №13, Городская клиническая больница им. Ф. И. Иноземцева, Коммунарка (г. Москва), ЦВКГ им. А. А. Вишневского (г. Красногорск), НИИ СП им. И. И. Джанелидзе, ВЦЭРМ им. А. М. Никифорова МЧС России, ВМА им. С. М. Кирова (г. Санкт-Петербург), Областная клиническая больница (г. Тверь), Областная клиническая больница (г. Ярославль), Областная клиническая больница (г. Владимир), Областная клиническая больница (г. Иваново), Брянская городская больница №1 (г. Брянск), Областная клиническая больница (г. Калуга), БСМП им. Д.Я. Ваныкина (г. Тула), ПОМЦ ФМБА России, Городская клиническая больница №13, Городская клиническая больница №39 (г. Нижний Новгород), Йошкар-Олинская городская больница (г. Йошкар-Ола), Тамбовская областная клиническая больница им. В.Д. Бабенко (г. Тамбов), Городская клиническая больница №3 им. С.М. Кирова (г. Астрахань), Республиканская клиническая больница им. Н. А. Семашко (г. Симферополь), МКДЦ, Городская клиническая больница №7 (г. Казань), НИИТОН СГМУ им. В. И. Разумовского (г. Саратов), Городская клиническая больница №40 (г. Екатеринбург), Сургутская клиническая травматологическая больница (г. Сургут), Федеральный центр нейрохирургии (г. Новосибирск), Федеральный центр нейрохирургии (г. Тюмень), Иркутская областная клиническая больница (г. Иркутск), Краевая клиническая больница проф. О. В. Владимирцева (г. Хабаровск), ДВФУ (г. Владивосток) [63]. Стоит отметить, что количество операций на БЦА в отделениях нейрохирургии возрастает с каждым годом.
Заключение. Как было сказано из вышеперечисленного реконструктивные операции на СА за последнее время претерпели большие изменения. Реконструктивные операции на СА в настоящее время не ограничиваются КЭ, а появляются новые виды операции шунтирования с другими БЦА (подключичными, позвоночными, ЭИКМА). Произошли большие перемены в оценке хирургических рисков вмешательства, анестезии, интраоперационной защите ГМ от ишемии, инструментальной оценки эффективности реваскуляризации. Последние годы ознаменовались активных привлечением нейрохирургов и рентгенэндоваскулярных хирургов в лечение атеросклероза СА. В некоторых регионах РФ в отделениях сосудистой нейрохирургии КЭ становится самой часто выполняемой операцией.


