К изучению липидного состава дикорастущих представителей рода Artemisia
Автор: Зубова С.Н.
Журнал: Самарская Лука: проблемы региональной и глобальной экологии @ssc-sl
Рубрика: Научные сообщения
Статья в выпуске: 2 т.26, 2017 года.
Бесплатный доступ
В статье рассматривается проблема адаптации растений к абиотическим факторам окружающей среды. Установлены физиолого-биохимические способы адаптации посредством изменения состава и структуры клеточных мембран. Выявлен качественный и количественный состав липидов трех представителей высших растений, произрастающих на засоленных почвах при высокой степени засушливости. Были идентифицированы три класса липидов.: гликолипиды, фосфолипиды, нейтральные липиды. Установлен вклад нейтральных липидов в адаптивную реакцию растений. Признаком деградации мембран является снижение уровня гликолипидов.
Адаптация, галофиты, липиды, клеточные мембраны
Короткий адрес: https://sciup.org/148315049
IDR: 148315049 | УДК: 581.1
Текст краткого сообщения К изучению липидного состава дикорастущих представителей рода Artemisia
Ареалы распространения дикорастущих видов травянистых растений постоянно изменяются и подвергаются влиянию со стороны хозяйственной деятельности человека и естественных воздействий. Одним из факторов, который ограничивает рост и продуктивность растений, является засоление почв. Площадь засоленных почв в России составляет 36 млн га (18 % общей площади орошаемых земель). Засоление почв ослабляет их вклад в поддержание биологического круговорота веществ. Исчезают многие виды растительных организмов, появляются новые растения галофиты. Уменьшается генофонд наземных популяций в связи с ухудшением условий жизни организмов, усиливаются миграционные процессы (География России, интернет источник).
В процессе эволюции у растений выработались различные стратегии адаптации к стрессовым условиям: анатомо-морфологических изменения, физиологобиохимические. Галофиты – экологически, физиологически и биохимически специализированные растения, которые способны нормально функционировать в засоленной среде (Орлова и др., 2007; Bay, Mishra, Jupta, 1992).Считается, что липиды клеточных мембран играют ключевую роль в процессах адаптации раститель- 145
ных организмов. Они являются основными структурными компонентами биомембран, выполняют регуляторные функции в клетках: участие в мембранном транспорте, в передачи информации в клетке, функционировании ДНК, влияют на активность мембранносвязанных компонентов. Нормальное функционирование тилакоидных мембран хлоропластов и как следствие фотосинтетическая активность тесно связаны с липид-белковыми комплексами. (Бурлакова, 1981; Розенцвет и др. 2000).
В связи с тем, что дикорастущие травянистые растения часто используют в фармакологии для выделения БАВ, эфирных масел, применяют в качестве индикатора природных экосистем, их изучение представляет практическое значение. Важное значение растения рода Artemisia имеют в сельскохозяйственной деятельности, как пастбищный корм. Со стороны ученых существует интерес в выявлении состава эфирных масел в зависимости от экологических факторов, где раскрываются аллелопатические явления в фитоценозах (Великородов и др. 2011).
Таким образом, цель нашего исследования заключалась в изучении липидного состава представителей рода Artemisia , произрастающих в условиях экстремальной засоленности почв.
ОБЪЕКТ И МЕТОДЫ ИССЛЕДОВАНИЯ
Объектами исследования были выбраны 3 вида полыней: A. dracuncu-lus L, A.taurica Willd, A. marschalliana Spreng. Это многолетние растения с многочисленными однолетними побегами, распространенные в Сибири, Европейской части России (преимущественно в южных районах), на Дальнем Востоке (Атлас флоры России)
Местом сбора материала была территория оз. Эльтон в Палласовском районе Волгоградской области. Данная местность является уникальной по природным условиям (Лысенко, Митрошенкова, 2010). Это соленое самосадочное озеро, с долинами впадающих рек, климат отличает резкая атмосферная засушливость и безводность, по типу почв преобладают солонцы и солончаки. Поэтому бассейн оз. Эльтон стал местом произрастания редких галотолерантных и галофильных видов (Nesterov, Bogdanova, Rozentsvet, 2016)
Растительный материал (листья) отбирали в первой половине дня в середине июня 2016 г. Пробы для анализа мезоструктуры листа фиксировали в этиловом спирте (70%), для анализа липидов – замораживали в жидком азоте. После фиксации кипящим изопропиловым спиртом липиды экстрагировали методу Блайя и Дайера (Bligh and Dyer, 1959). Полученные липидные экстракты разделяли методом двумерной тонкослойной хроматографии на основные классы нейтральных, глико- и фосфолипидов ( НЛ, ГЛ, ФЛ) (Кейтс, 1975). Для количественного определения ФЛ использовали метод Васьковского (Vaskovsky et al., 1975), НЛ и ГЛ определяли на денситометре Sorbfil (Россия).
Для оценки достоверности различий между разными видами использовали критерии Стьюдента при P< 0,05.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
На рис. 1 представлены данные по содержанию липидов в фотосинтезирующих органах изученных нами растений. Очевидно, что основной вклад в сумму липидов во всех трех образцах вносят нейтральные липиды (НЛ) (рис.1).
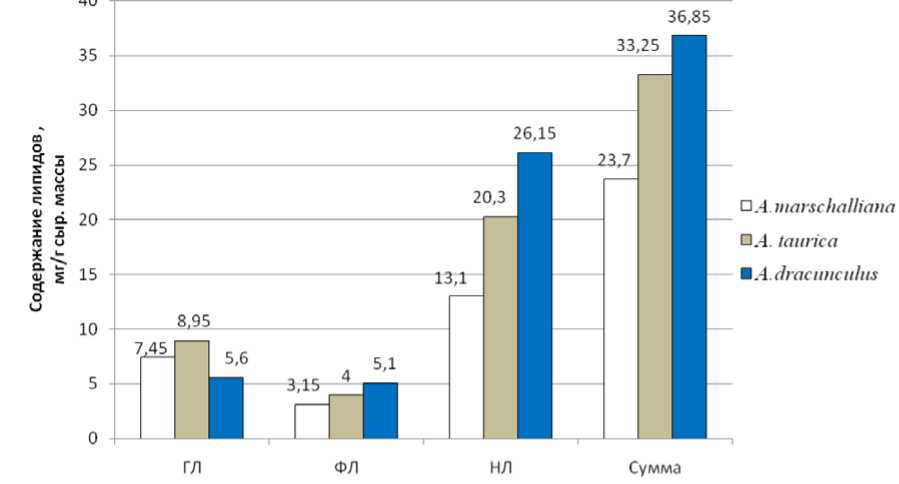
Рис. 1. Содержание липидов в фотосинтезирующих органах трех видов растений
В состав изученных липидов входили эфиры, воска, триацилглицерол (ТАГ), свободные жирные кислоты (СЖК), спирты (Сп), стерины (Ст), диацилглицерол (ДАГ)(табл. 1).
Таблица 1. Состав липидов растений рода Artemisia, мг/г массы сырого сырья (% от суммы липидов ± ст. откл.)
|
Липиды |
Виды растений |
||
|
A. dracunculus L. |
A.taurica Willd |
A. marschalliana- Spreng |
|
|
Гликолипиды |
|||
|
МГДГ |
1,6 (45,0 ±5,4) |
0,7 (27,4 ±0,7) |
5,25 (45,6±4,5) |
|
ДГДГ |
1,5 (39,2±2,8) |
1,2 (49,1 ±1,3) |
2,8 (39,3±6,9) |
|
СХДГ |
0,6 (16,0±2,6) |
0,6 (23,6 ±0,6) |
1,2 (15,3±2,3) |
|
Фосф |
олипиды |
||
|
ФХ |
1,5 (21,4±5,1) |
0,65 (29,0±3,3) |
0,7 (12,0±4,9) |
|
ФЭ |
0,6 (8,3±4,0) |
0,7 (3,0±0,1) |
0,06 (0,4±0,1) |
|
ФГ |
1,4 (19,7±1,6) |
0,35 (15,5±1,3) |
1,03 (16,8±7,4) |
|
ФИ |
0,9 (13,2±0) |
0,5 (22,1±0,6) |
0,7 (11,4±0,2) |
|
К |
2,85(37,1±11,2) |
0,6 (27,6±1,6) |
3,8 (58,4±11,8) |
|
ДФГ |
0,05 (0,7±0) |
0,065(2,9±0,0) |
0,13 (2,1±0,7) |
|
Нейтральные липиды |
|||
|
УВ |
- |
1,25 (10,8±2,3) |
- |
|
Э |
2,8 (16,2±0,6) |
2,65 (22,4±0,7) |
3,6 (38,4 ±2,9) |
|
В |
0,65 (3,8±0,8) |
1,0 (8,5±0,1) |
0,85 (9,0±0,1) |
|
ТАГ |
1.0 (6,1±0.9) |
1,4 (12,0±0,6) |
1,05 (10,9±0,8) |
|
СЖК |
1,9 (10,9±0,1) |
0,3 (2,5±0,8) |
1,05 (11,0±0,6) |
|
? |
8,55 (49,0±2,5) |
0,3 (2,5±0,8) |
- |
|
СП |
- |
- - |
0,65 (2,8±4,0) |
|
СТ |
1,05 (6,0±0,7) |
0,55 (6,1±0,8) |
0,82 (8,8±0,2) |
|
ДАГ |
1,4 (8,1±0,7) |
4,0 (34,5±0,2) |
1,8 (19,3±2,1) |
В небольшом количестве у A.taurica были обнаружены углеводороды (УВ). Высокое содержание эфиров отмечено у всех исследуемых образцов, ДАГ у A.taurica , A. marschalliana . В своем липидном составе среди нейтральной группы A . dracunculus имеет неизвестный компонент в большом количестве (49% от суммы НЛ). Воска и УВ образуют наружный кутикулярный слой и защищают растения от больших потерь влаги. Увеличение их синтеза имеет адаптивную реакцию растений к условиям среды (Бычек, 1995). Такая тенденция характерна для галофитов, произрастающих в условиях почвенного засоления (Розенцвет, 2013).Среди НЛ особое место занимают стерины. Этому классу соединений отводится определяющая роль в организации и функционировании мембраны. Они являются компонентами мембранных кластеров-рафтов, в пределах которых молекулы упакованы плотнее, чем в окружающей мембране. Причем, рафты присутствуют как в наружном, так и внутреннем монослое мембраны. Рафты определяются как динамичные нанометровые, обогащенные стеролом, сфинголипидами упорядоченные скопления (Петров, Зефиров, 2013).
В растениях стерины содержатся в тех органах, которые интенсивно функционируют и содержат большое количество делящихся клеток. Их содержание зависит от времени года, условий произрастания и других факторов. Отмечено, что максимальное количество их наблюдается в период покоя, во время наиболее низких температур. Свободные стерины, как биологические предшественники эфиров сте-ринов, постоянно переходят в связанную форму (Девятловская, 2014) Производные стеринов – эфиры фиксировано в пуле НЛ занимают второе место. Их содержание 2,8 мг/г сырой массы (16,2 %) у A . dracunculus , 2,65 мг/г сырой массы и 3,6 мг/г сырой массы (38,4%) у A.taurica и у A. marschalliana соответственно.
К фосфолипидам (ФЛ) относят липиды внешних мембран клеток и их органелл, они ответственны за формирование плазмалеммы и тонопласта. Во фракции были идентифицированы следующие ФЛ: фосфатилихолин (ФХ), фосфатидилэта-ниламин (ФЭ), фосфатидилинозит (ФИ), фосфатидилглицерин (ФГ) и фосфатидная кислота (ФК), дифосфатидилглицерина (ДФГ), отсутствует ФС (фосфатидилсерин). Ранее в работах (Рзенцвет, Макурина, 2007) был сделан вывод, что ФХ является наименее вариабельным компонентом водных растений и наиболее устойчивым компонентом мембран. В нашем случае его динамика также варьировала в узком диапазоне от 0,7 до 1, 5 мг/г сырой массы. Установлено, что уменьшение соотношения ФХ/ФЭ приводит к снижению структурированности и усилению проницаемости мембран, как следствие активируется работа рецепторов ионных каналов. (Болдырев, 2001). Этот показатель имел значение от 2,6 до 11,6. Количество минорных компонентов (ФИ, ДФГ, ФК) варьирует в зависимости от времени года, периода вегетации. ФК выполняет в растительных клетках сигнальную функцию и ее концентрация должна быть в небольшом количестве (Тарасова, 2009). Несмотря на это в опытных образцах растений зафиксировано лидирующее содержание этого соединения среди ФЛ (27-58% от суммы ФЛ).
Гликолипидные фракции содержали 3 основных липида, характерных для высших растений: моногалактозилдиацилглицерол МГДГ, дигалактозилдиацилг-лицерол (ДГДГ), сульфохиновозилдиацилглицерин (СХДГ). Вклад СХДГ, обладающего каталитической функцией, в сумму ГЛ был небольшим (0,6-1,2 мг/г сырой массы). У двух представителей рода Artemisia (A.dracunculus и у A. marschalliana) преобладал моногалактозилдиациллицерин (МГДГ) 45% и 45,6% соответственно, уA.taurica - дигалактозилдиациллицерин ДГДГ (49%). Установлено, что ГЛ играют основную роль при встраивании светособирающих компонентов фотосистем I и II в структуру мембран тилакоидов Их колебание в сторону снижения может свидетельствовать о деградации хлоропластных мембран (Бычек, 1995).
Список литературы К изучению липидного состава дикорастущих представителей рода Artemisia
- Атлас флоры Росси. Интернет источник: http://www-sbras.nsc.ru/win/elbib/atlas/flora/1850.html.
- Болдырев А.А. Матриксная функция биологических мембран // Соросовский образовательный журнал. 2001 №7 С. 2-8.
- Бурлакова Е.Б. Роль липидов в процессе передачи информации в клетке // Биохимия липидов и их роль в обмене веществ. М.: Наука, 1981. С. 28-34.
- Бычек И.А. Влияние температурных особенностей и уровня освещенности в среде обитания на состав липидов лишайников и бриофитов: Автореф. дис. к.б.н. Санкт-Петербург, 1995. 22 с.
- Великородов А. В., Морозова Л. В., Пилипенко В. Н., Ковалев В. Б. Химический состав эфирного масла четырех эндемичных видов полыни Астраханской области: Artemisia lerchiana, Artemisia santonica, Artemisia arenaria и Artemisia austriaca // Химия растительного сырья. 2011. №4. С. 115-120.


