К механизму диуретической активности фуросемида. Роль гидрофобного сегмента молекулы
Автор: Смирнов И.В., Бондарев А.А., Брюханов В.М., Постников П.С., Филимонов В.Д.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 1-1 т.26, 2011 года.
Бесплатный доступ
Цель исследования: изучение зависимости между величиной гидрофобного сегмента молекулы фуросемида и фармакологической активностью диуретика. Квантово-химические расчеты выполнялись неэмпирическим методом DFT B3LYP/6&311G* с помощью пакета программ GAMESS. Фармакологические исследования проведены на крысах-самцах Wistar массой 220-250 г. Животные были разделены на 2 группы: I группа - крысы, которым вводили фуросемид в дозе 15 мкмоль/кг; крысам II группы вводили йод-фуросемид в эквимолярной дозе. После расчета структур, который показал, что введение в фурановый цикл фуросемида атома йода мало изменяет зарядовые и конформационные характеристики основных фрагментов молекулы, произведен синтез йод-фуросемида. В опытах на крысах проведена сравнительная оценка мочегонной активности обоих веществ. В эквимолярной дозе йод-фуросемид вызывал значительно большее увеличение диуреза по сравнению с фуросемидом (в 1,8 раза). Примерно в такой же степени вновь созданный аналог превышал эффекты фуросемида в отношении экскреции с мочой ионов натрия и калия. Исследование показало, что увеличение величины гидрофобного сегмента молекулы фуросемида введением в фурановый цикл атома йода существенно увеличивает активность нового соединения. Подтверждено предположение о том, что при создании высоко активных и селективных мочегонных препаратов, наряду с введением в структуру ключевых полярных групп, способных к образованию прочной водородной связи с белками в водной среде, следует учитывать величину гидрофобного сегмента молекулы.
Фуросемид, мочегонное действие, гидрофобный эффект
Короткий адрес: https://sciup.org/14919357
IDR: 14919357 | УДК: 615.015.12:
Текст научной статьи К механизму диуретической активности фуросемида. Роль гидрофобного сегмента молекулы
Ранее нами была показана ключевая роль карбоксильной группы в обеспечении диуретической и салуретичес-кой активности фуросемида. Замещение активного атома водорода этой группы на гидрофобный метильный и этильный радикалы полностью лишало фуросемид возможности влиять на функцию почек в эксперименте у крыс [1]. В последующих работах нами было установлено, что изменения геометрии молекулы фуросемида, вызывающие выраженные стерические затруднения при образовании водородной связи с активным атомом водорода карбоксильной группы, приводят к потере мочегонной активности препарата. Было также показано, что пространственное строение молекулы фуросемида в значительной степени зависит от наличия в его структуре внутримолекулярной водородной связи между кислородом карбоксильной группы и водородом аминогруппы. Разрыв этой связи приводит к существенным изменениям пространственных характеристик вещества [5]. Био- логическая активность лекарственных веществ, действующих по принципу межмолекулярного взаимодействия с биологическими мишенями, реализуется двумя основными механизмами:
-
1) образованием прочных водородных связей между полярными группами лиганда и мишени;
-
2) гидрофобным эффектом при наличии в молекулах гидрофобных сегментов.
В связи с этим большинство эффективных и высокоселективных лекарственных веществ, являющихся сложными органическими соединениями, в своих молекулах содержат необходимый набор полярных групп, способных образовывать в водной среде прочные водородные связи с белками и гидрофобный сегмент. Гидрофобные участки молекул повышают селективность лигандов и дополнительно к полярным группам увеличивают прочность комплекса лиганд-мишень за счет энергии гидрофобного эффекта. Цель работы: изучение зависимости между величиной гидрофобного сегмента молекулы фуросемида и его мочегонной активностью.
Материал и методы
Объектами исследования являлись диуретическое средство фуросемид, его производное йод-фуросемид и лабораторные крысы. Квантово-химические расчеты выполнялись неэмпирическим методом DFT B3LYP/6-31G** (d, p) с обменным функционалом Беке В3 и корреляционным функционалом Ли, Янга и Пара (LYP). Расчеты осуществлены с помощью программного комплекса PC GAMESS (Firefly), версия 7.1.С, разработанного под руководством проф. А.А. Грановского в лаборатории химической кибернетики МГУ и содержащего все основные вычислительные алгоритмы, необходимые для теоретического исследования химических систем [2, 3]. В качестве вычислительного ядра для квантово-химических расчетов применялся 30-узловой вычислительный кластер на базе ЭВМ IBM PC под управлением ОС ASPLinux 12.0. Геометрия молекулы фуросемида была полностью оптимизирована, отсутствие мнимых частот колебаний подтверждало ее стационарный характер.
Фармакологические исследования проведены в осенний период на крысах-самцах Wistar массой 220–250 г, которых содержали на стандартной диете в естественном световом режиме. Животные находились в индивидуальных клетках, приспособленных для сбора мочи. Подопытные крысы были разделены на 2 группы: I группа (n=12) – крысы, которым вводили фуросемид; животным II группы (n=12) вводили йод-фуросемид. После определения контрольных показателей в каждой группе всем животным однократно подкожно был введен 1 мл 0,9-процентного раствора хлорида натрия в качестве контрольного вещества. Собирали мочу за сутки, определяя величину диуреза, экскрецию ионов натрия и калия. На следующий день животным I группы ввели подкожно фуросемид в дозе 15 мкмоль/кг в 1 мл 0,9%-го раствора хлорида натрия; крысам II группы – йод-фуросемид в эквимолярной дозе. Через сутки вновь определяли указанные параметры экскреторной функции почек. Ионы натрия и калия определяли методом плазменной фотометрии на фотометре ПАЖ-3. Исследования на животных проводили в соответствии с Правилами проведения работ с использованием экспериментальных животных (приказ МЗ СССР №75 от 12.08.1987 г.) и Федеральным законом РФ “О защите животных от жестокого обращения” от 01.01.1997 г. Результаты обрабатывали с помощью параметрического t-критерия Стьюдента с определением среднего арифметического значения М и его стандартной ошибки m. Анализ данных выполнен с использованием программы Biostat для Windows.
Результаты
Проведены квантово-химические расчеты пространственной и электронной структуры фуросемида и йод-фуросемида. Полученные молекулярные модели фуросемида и йод-фуросемида представлены на рисунках 1 и 2, а сравнение пространственных и электронных характеристик этих соединений – в таблице 1.
Эффективные заряды практически не изменяются, за исключением атомов, связанных с атомом йода или находящихся в непосредственной близости от этого заме-
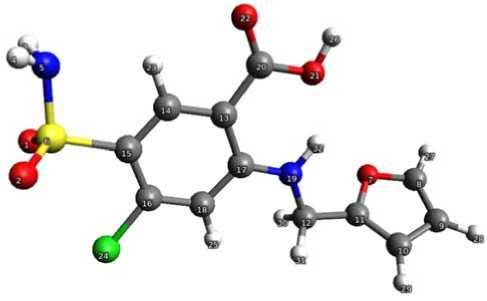
Рис. 1. Структура молекулы фуросемида, рассчитанная методом функционала плотности (DFT – B3LYP) в базисе 6–31G** (d, p)
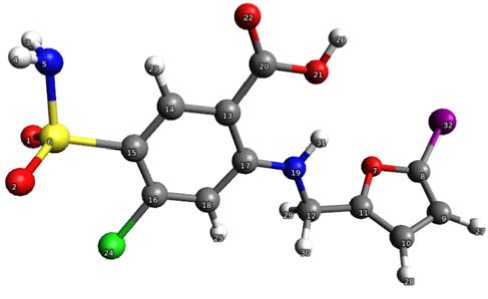
Рис. 2. Структура молекулы йод-фуросемида, рассчитанная методом функционала плотности (DFT – B3LYP) в базисе 6–31G** (d, p)
Таблица 1
Эффективные заряды на атомах по Милликену
|
Фуросемид |
Йод-фуросемид |
Фуросемид |
Йод-фуросемид |
||||||||
|
атом |
заряд |
атом |
заряд |
атом |
заряд |
атом |
заряд |
||||
|
1 |
O |
–0,521 |
1 |
O |
–0,519 |
17 |
C |
0,346 |
17 |
C |
0,340 |
|
2 |
O |
–0,519 |
2 |
O |
–0,518 |
18 |
C |
–0,102 |
18 |
C |
–0,046 |
|
3 |
H |
0,298 |
3 |
H |
0,299 |
19 |
N |
–0,640 |
19 |
N |
–0,641 |
|
4 |
H |
0,300 |
4 |
H |
0,300 |
20 |
C |
0,569 |
20 |
C |
0,571 |
|
5 |
N |
–0,711 |
5 |
N |
–0,711 |
21 |
O |
–0,529 |
21 |
O |
–0,529 |
|
6 |
S |
1,179 |
6 |
S |
1,180 |
22 |
O |
–0,479 |
22 |
O |
–0,476 |
|
7 |
O |
–0,441 |
7 |
O |
–0,430 |
23 |
H |
0,166 |
23 |
H |
0,168 |
|
8 |
C |
0,135 |
8 |
C |
0,092 |
24 |
Cl |
0,044 |
24 |
Cl |
0,173 |
|
9 |
C |
–0,136 |
9 |
C |
–0,102 |
25 |
H |
0,116 |
25 |
H |
0,117 |
|
10 |
C |
–0,136 |
10 |
C |
–0,136 |
26 |
H |
0,330 |
26 |
H |
0,332 |
|
11 |
C |
0,256 |
11 |
C |
0,257 |
27 |
H |
0,117 |
27 |
H |
0,122 |
|
12 |
C |
–0,050 |
12 |
C |
–0,051 |
28 |
H |
0,104 |
28 |
H |
0,113 |
|
13 |
C |
0,027 |
13 |
C |
0,032 |
29 |
H |
0,103 |
29 |
H |
0,140 |
|
14 |
C |
–0,108 |
14 |
C |
–0,115 |
30 |
H |
0,135 |
30 |
H |
0,134 |
|
15 |
C |
–0,170 |
15 |
C |
–0,132 |
31 |
H |
0,131 |
31 |
H |
0,302 |
|
16 |
C |
–0,118 |
16 |
C |
–0,342 |
32 |
H |
0,301 |
32 |
I |
0,075 |
Таблица 2
Структурные параметры молекул
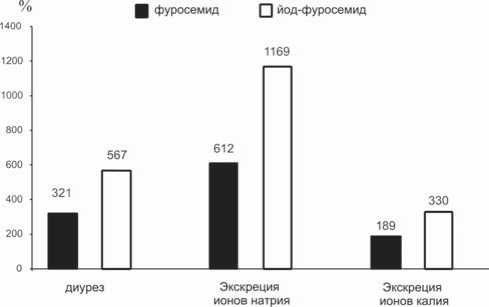
Рис. 3. Фармакологическая активность фуросемида и йод-фу-росемида стителя. Также практически не изменилось распределение зарядов на атомах карбоксильной и сульфаниламидной групп, способных образовывать водородные связи с субстратом и участвующих в специфической сольвата- претерпела существенных изменений, за исключением самого заместителя – йода, обладающего большим Ван-дер-Ваальсовым радиусом. Сравнительный анализ структур этих молекул показал, что их геометрические параметры практически одинаковы, а различия в длине связей незначительны. Распределение заряда на основных функциональных группах, участвующих в специфических взаимодействиях с белковым субстратом, также не претерпело существенных изменений. Это позволяет предположить, что основную роль в повышении биологической активности молекулы играет само наличие объемного заместителя – йода, в значительной степени увеличивающего гидрофобный эффект. Так, по литературным данным, введение йода приводит к увеличению ∆G гидрофобного эффекта для йод-бензола в сравнении с бензолом на 3,7 кДж/моль [4]. Теоретически это приводит к увеличению константы прочности комплекса с белковыми молекулами в 4,2 раза при температуре 310 К.
Результаты проведенных сравнительных фармакологических исследований диуретической и салуретической активности фуросемида и йод-фуросемида приведены на рисунке 3.
Представленные на рисунке 3 изменения основных показателей экскреторной функции почек выражены в процентах по отношению к контрольным значениям. Эквимолярная доза йод-фуросемида вызывала увеличение диуреза в 1,8 раза большее по сравнению с фуросемидом. Экскреция ионов натрия под влиянием йод-фу-росемида превысила эффекты фуросемида в 1,9 раза, а экскреция калия – в 1,8 раза.
Обсуждение
Для экспериментального подтверждения результатов квантово-химических расчетов нами было синтезировано производное фуросемида – йод-фуросемид. В полученном соединении во втором положении фуранового цикла фуросемида атом водорода был замещен на атом йода. Поскольку атом йода имеет значительно больший радиус, чем водород, и к тому же он неполярен, то полученное соединение должно было иметь существенно больший гидрофобный сегмент, чем исходный фуросемид. Проведенное экспериментальное исследование показало, что введение в молекулу фуросемида атома йода с целью увеличения площади гидрофобного сегмента фуранового цикла молекулы фуросемида повышает диуретическую и салуретическую активность препарата. Проведенное теоретическое исследование показало, что основные характеристики электронного строения фуросемида и йод-фуросемида не имеют существенных отличий, что также позволяет предполагать наличие у модифицированного соединения аналогичных фуросемиду фармакодинамических характеристик, однако с существенно большей активностью. Следует отметить, что атом йода не способен образовывать водородные связи, его роль заключается только в увеличении энергии гидрофобного эффекта.
Заключение
Полученные результаты свидетельствуют о существенной роли гидрофобного сегмента в реализации мочегонного эффекта фуросемида. Повышение мочегонной активности препарата прямо пропорционально увеличению площади гидрофобного сегмента его структуры. Уве- личение площади гидрофобного сегмента фуросемида за счет введения атома йода не оказывает сколько-нибудь значимого влияния на электронное строение диуретика. Этот факт позволяет предположить наличие идентичного фуросемиду механизма мочегонной активности у вновь полученного соединения. Проведенное исследование показало потенциальную возможность создания новых мочегонных препаратов с более высокой активностью. Это позволит существенно снижать их терапевтическую дозу, что приведет к резкому уменьшению выраженности многочисленных побочных эффектов этой группы лекарственных средств. В случае с фуросемидом основным побочным эффектом является выраженная гипокалиемия, особенно при курсовом применении препарата.
Список литературы К механизму диуретической активности фуросемида. Роль гидрофобного сегмента молекулы
- Смирнов И.В., Брюханов В.М., Бондарев А.А. и др. О роли карбоксильной группы в молекуле фуросемида//Психофармакология и биологическая наркология. -2007. -Т. 7, Ч. 2. -С. 1952-1953.
- Соломонов Б.Н., Седов И.А. Методы расчета энергии Гиббса гидрофобного эффекта и специфического взаимодействия неэлектролитов в водных растворах//Журнал физической химии. -2008. -Т. 83, № 7. -С. 1259-1263.
- Постников П.С., Бондарев А.А., Смирнов И.В. и др. Исследование влияния модификации аминогруппы фуросемида на диуретическую активность с применением экспериментальных и теоретических методов//Создание новых лекарственных препаратов: матер. конференции/под ред.Е.Д. Гольдберга. -Томск: Изд-во Том. ун-та, 2007. -С. 76-78.
- Granovsky A.A. PC GAMESS/Firefly version 7.1 [Электронный ресурс]. -URL: http://classic.chem.msu.su/gran/gamess/index.html.
- Schmidt M.W., Baldridge K.K., Boatz J.A. et al. General atomic and molecular electronic structure system//J. Comput. Chem. -1993. -No. 14. -С. 1347-1363.


