К методу аутофлуоресцентной диагностики ранних форм рака шейки матки: особенности эндогенной флуоресценции покровного эпителия шейки матки
Автор: Булгакова Н.Н., Трушина О.И., Новикова Е.Г., Фабелинский В.И., Андреева Ю.Ю., Смирнов В.В., Чиссов В.И.
Журнал: Московский хирургический журнал @mossj
Рубрика: Экспериментальные и лабораторные исследования
Статья в выпуске: 6 (28), 2012 года.
Бесплатный доступ
На основе анализа массива спектров нормального и патологического цервикального эпителия (включая фоновые, доброкачественные заболевания, CIN I-II-III, рак шейки матки) изучены особенности аутофлуоресценции покровного эпителия шейки матки. Показано, что при лазерном возбуждении 407 нм основным источником диагностической информации может рассматриваться только спектральный диапазон 420-600 нм. У 3-х пациенток с диагнозом CIN III в спектрах экзоцервикса были выявлены дополнительные полосы излучения эндогенных порфиринов, однако однозначной корреляции между очагами предрака и флуоресценцией в них эндогенных порфиринов не выявлено. Полученные результаты позволяют заключить, что излучение эндогенных порфиринов в красной области спектра не может рассматриваться в качестве диагностического признака наличия как доброкачественного патологического процесса, развивающегося на фоне инфицирования ВПЧ, так и предрака и ранних форм РШМ.
Цервикальная интраэпителиальная неоплазия, аутофлоуресцентная спектроскопии, лазер
Короткий адрес: https://sciup.org/142211063
IDR: 142211063 | УДК: 617-089
Текст научной статьи К методу аутофлуоресцентной диагностики ранних форм рака шейки матки: особенности эндогенной флуоресценции покровного эпителия шейки матки
На протяжении последних лет наблюдается тревожная тенденция роста заболеваемости раком шейки матки (РШМ) среди молодых женщин в возрастной группе до 40 лет, т.е. в репродуктивно значимой и социально активной части населения. В настоящее время доказано, что более 99% случаев РШМ вызывается высокоонкогенными типами вируса папилломы человека (ВПЧ), распространенность которого в мире увеличилась более чем в 10 раз, причем основной контингент составляют женщины детородного возраста.[1, 2].
Развитию рака шейки матки предшествуют различные стадии цервикальной интраэпителиальной неоплазии (CIN I, CIN II, CIN III), особенностью которых является отсутствие специфических визуально и пальпаторно выявляемых изменений. У 57,7% больных ранние формы РШМ протекают бессимптомно. В остальных случаях выявляются изменения, сходные с признаками фоновых заболеваний: псевдоэрозии, дискератозы, полипы, плоские кондиломы[3, 4].
На первой стадии диспансеризации населения для выявления неоплазии применяется метод цитологического скрининга или ПАП-тест. Данный метод достаточно прост, однако в силу большого количества ложноположительных результатов (от 15 до 40%), он обладает весьма низкой специфичностью. В случае подозрения на развитие CIN проводится кольпоскопическое исследование, предсказательная ценность которого весьма ограниченна даже в руках опытного гинеколога, поэтому для окончательной диагностики CIN требуется выполнение биопсии шейки матки с последующим гистологическим исследованием. Для улучшения диагностической ценности кольпоскопического исследования и уменьшения количества необоснованных биопсий, необходима разработка новых подходов к неинвазивной диагностике ранних форм РШМ [4].
В последние годы в различных областях онкологии все большее развитие получает метод аутофлуоресцентной диагностики (АФД) рака. Метод АФД основан на различиях в интенсивности и спектральном составе аутофлуоресцентного излучения нормальной и патологической ткани при возбуждении в УФ либо видимой областях спектра [5–7]. Диагностическая информация может быть получена при количественном анализе спектров лазер-индуцированной аутофлуоресценции (АФ) при локальных измерения in vivo в точке поверхности ткани, либо при визуальной оценке флуоресцентных изображении. В научной литературе метод измерения спектров флуоресцентного излучения биологических тканей in vivo получил название метод локальной флуоресцентной спектроскопии (ЛФС) [8, 9, 11]. Для анализа флуоресцентных изображений разрабатывается эндоскопическая (ауто) флуоресцентная аппаратура [10, 11].
Разработка метода АФД включает несколько этапов. Первым и необходимым этапом является выбор длины волны лазерного возбуждения, при которой in vivo регистрируются воспроизводимые, достоверные и наиболее информативные спектры АФ нормальных и патологических тканей. Второй этап включает наработку спектров АФ в норме и при развитии различных патологических изменений при возбуждении излучением с выбранной длиной волны и выявление спектральных диапазонов аутофлуоресцентного излучения с наибольшим диагностическим потенциалом. На следующем этапе проводится анализ массивов спектрально-флуоресцентных данных, и изучаются корреляции особенностей спектров с морфологическими диагнозами с целью выявления диагностически значимых спектрально-флуоресцентных параметров. Заключительный этап состоит в разработке диагностических алгоритмов вероятностной оценки наличия патологии по спектрам АФ in vivo и создании, на основании разработанных алгоритмов, специализированной диагностической аппаратуры.
С целью разработки метода АФД ранних форм РШМ нами были проведены измерения спектров АФ нормального эпителия шейки матки и патологических очагов, включая CIN I–II–III и микроинвазивный РШМ, при возбуждении лазерным излучением в трех спектральных областях (407 нм, 532 нм, 635 нм) [12]. Полученные результаты показали, что достоверные и воспроизводимые спектры АФ нормального эпителия, очагов предрака и ранних форм РШМ регистрируются при возбуждении лазерным излучением с длиной волны 407 и 532 нм. Однако достоверные различия между спектрами нормального эпителия и очагами предрака регистрируются только при возбуждении 407 нм. Это позволило оптимизировать длину волны лазерного возбуждения для разработки метода АФД ранних форм РШМ.
В данной работе представлены результаты выполнения второго этапа разрабатываемого нами метода АФД. На основе анализа массива спектров нормального и патологического цервикального эпителия (включая фоновые, доброкачественные заболевания, дисплазии различной степени выраженности и РШМ), измеренных в группе из 115 пациенток, изучены особенности эндогенной флуоресценции эпителия шейки матки в различных спектральных диапазонах.
Материалы и методы
Аппаратура для аутофлуоресцентной спектроскопии
Для измерения спектров АФ использовали компьютеризованную спектрально-флуоресцентную диагностическую установку «Спектр-Кластер» (ООО «Кластер», ИОФ РАН, Москва). Данная установка включала в себя: волоконнооптический зонд для доставки лазерного и сбора флуоресцентного излучения; спектрометр; персональный компьютер, специализированное программное обеспечение и лазер для возбуждения флуоресценциис длиной волны 407 нм (3 мВт, лазерный диод). Спектральный диапазон измерений составлял: 420–850 нм, спектральное разрешение с волоконно-оптическим зондом составляло не менее 3 нм.
Пациентки
В исследовании участвовали 115 пациенток, возраст которых составлял от 19 до 68 лет (в среднем 31 год) с патологическими изменениями цервикального эпителия различной степени выраженности. Всем пациенткам на первом этапе исследования была выполнена расширенная кольпоскопия с выделением зон неизмененного и патологического эпителия. При оценке кольпоскопических картин использовали Международную классификацию (обновленную Международной ассоциацией по патологии шейки матки и кольпоскопии в Барселоне, 2002).
На следующем этапе проводилась ЛФС c последующей прицельной биопсией из анатомических точек, в которых измеряли спектры лазер-индуцированной АФ. Количество биоптатов при одном обследовании составляло от 2 до 6 (в среднем 3). Распределение морфологических диагнозов было следующее: фоновые заболевания – 117, воспалительные заболевания – 8, койлоцитоз – 16, СIN I – 16, СIN II – 20, СIN III – 62, РШМ 1А1 ст. – 9. В большинстве наблюдений методом полимеразной цепной реакции (ПЦР) идентифицированы высоконкогенные генотипы ВПЧ (16, 18, 31, 33, 35, 45, 56, 58).
Все измерения проводили при мягком контакте торца волоконно-оптического катетера и поверхности цервикального эпителия после нанесения 3% р-ра уксусной кислоты. Спектры измеряли в участках ацето-белого эпителия (АБЭ), а так же многослойного плоского эпителия (МПЭ) без видимой патологии. В ходе обследования каждой пациентки записывалось от 11 до 30 спектров. Общее количество спектров собранного массива составляет около 3500.
Результаты
Анализ полученного массива подтвердил полученные ранее на ограниченной группе пациенток возможности регистрации воспроизводимых и достоверных спектров АФ нормального и патологического цервикального эпителия при лазерном возбуждении с длиной волны 407 нм. У всех пациенток данной группы, как в нормальном, так и патологическом эпителии в области 420 – 800 нм регистрировалась широкая полоса АФ с максимумом спектральной интенсивности в диапазоне 480–520 нм (зеленая область спектра). На рис. 1. представлены типичные спектры АФ, измеренные в участках морфологически подтвержденного неизмененного
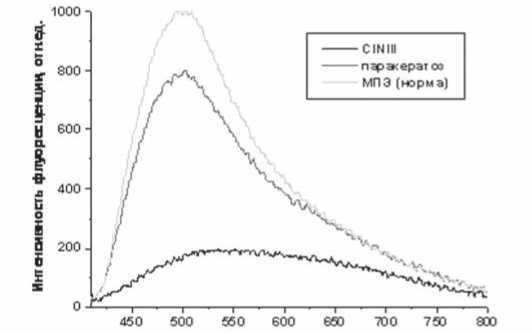
Длина волны, нм
Рис.1. Типичные спектры лазер-индуцированной АФ нормального многослойного плоского эпителия (МПЭ), участка паракератоза и CIN III, измеренные в ходе кольпоскопического исследования при длине волны возбуждения 407 нм
МПЭ, в очаге фонового заболевания (паракератоз) и CIN III. Как можно видеть на данном рисунке, в последнем случае интенсивность АФ значительно меньше, чем в нормальном МПЭ и в очаге паракератоза. Данная тенденция – падение интенсивности АФ в очагах предрака и раннего рака ШМ, была выявлена ранее на ограниченной группе пациенток в нашей первой работе [12] и согласуется с результатами АФД ранних форм злокачественных опухолей других локализаций [5–11].
Из особенностей аутофлуоресцентного излучения экзо-цервикса также следует отметить зависимость интенсивности АФ от возраста пациентки. В исследовании участвовали 8 пациенток в возрасте от 50 до 58 лет. Малочисленность группы не позволяет проводить статистические оценки, однако необходимо отметить, что у всех пациенток данной возрастной группы интенсивность АФ основной полосы с максимумом в области 480–520 нм была выше, чем у остальных пациенток (19–45 лет) как в норме, так и при развитии различных патологических изменений.
В отечественной литературе часто поднимается вопрос о возможности диагностики рака по «красной» флуоресценции опухолей, обусловленной накоплением в них эндогенных порфиринов. Как показали наши исследования, только у 3-х пациенток данной репрезентативной группы в спектрах были выявлены дополнительные полосы излучения в красной области. Положение максимумов (632, 633, 690 нм) позволяет приписать эти полосы эндогенным порфиринам. У всех трех пациенток морфологически был подтвержден CIN III, однако однозначной корреляции с флуоресценцией в них эндогенных порфиринов не выявлено.
Остановимся на описании этих случаев подробнее.
-
1) Пациентка Я., 34 г., измерения были проведены в трех зонах. Наиболее характерные спектры представлены на рис. 2.
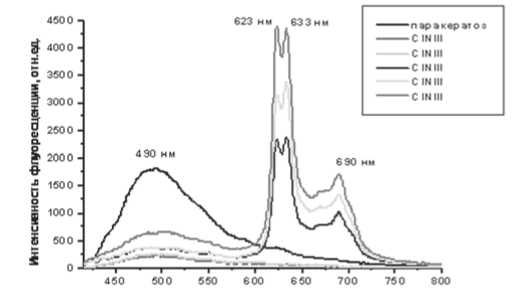
Длина волны, нм
Рис.2. Спектры лазер-индуцированной АФ, измеренные в участке паракератоза и CIN III. Спектры измерены в ходе кольпоскопическо-го исследования при длине волны возбуждения 407 нм
При измерениях на 6 ч на расстоянии 1,5 см от маточного зева (морфологически – паракератоз плоскоэпителиального покрова) в спектрах присутствовала интенсивная полоса флуоресценции с максимумом в зеленой области (500 нм), пики флуоресценции эндогенных порфиринов в красной области не выявлены. При измерениях у маточного зева на 11 и 4-х ч регистрировалась основная полоса АФ с максимумом в области 500 нм пониженной интенсивности. В то же время, в отдельных точках этой зоны в спектрах присутствовали дополнительные интенсивные полосы флуоресценции эндогенных порфиринов с максимумами на 623, 633 и 690 нм (рис. 2). Взятие биопсии из этой зоны показало наличие CIN III на фоне цервикоза и признаков вирусной инфекции.
-
2) Пациентка В., 28 лет. Измерения были проведены в трех зонах на 4-х, 6 и 11 ч условного циферблата у маточного зева, а также на 9 ч на расстоянии от 1 см от маточного зева. Характерные пики флуоресценция эндогенных порфиринов умеренной интенсивности в красной области спектра с максимумами на 622, 633 и 690 нм присутствовали только в спектрах, измеренных на 4-х и 6 ч. Взятие биопсии из этой зоны показало наличие, на фоне цервикоза и признаков вирусной инфекции, CIN II–III.
-
3) Пациентка С., 41 г. Измерения были проведены на 12 и 6 ч у маточного зева и на 4 ч на расстоянии 1 см от маточного зева. В спектрах, измеренных на 6 и 12 ч, присутствовали характерные полосы флуоресценции эндогенных порфиринов с максимумом на 633 нм. Взятие биопсии из этих участков выявило различные морфологические диагнозы. На 6 ч морфологически был выявлен эндоцервикоз с выраженной эпидермизацией и участками CIN III, микрофокусами инвазии в основу до 1 мм (на фоне вирусной инфекции, хронического цервицита, наличием гигантских многоядерных клеток). Биопсия, взятая из участка на 12 часах, выявила эндоцервикоз с выраженной эпидермизацией, акантозом
базальноклеточной пролиферацией, резко выраженный гиперпаракератоз, койлоцитоз, хронический цервицит.
Обсуждение и выводы
В данной работе проведен предварительный анализ массива спектров нормального и патологического цервикального эпителия, при возбуждении АФ лазерным излучением с длиной волны 407 нм. Основной целью данной работы было изучение особенностей эндогенной флуоресценции эпителия шейки матки в различных спектральных диапазонах.
Спектр АФ излучения ткани является суперпозицией спектров флуоресценции отдельных эндогенных флуорофоров, поглощающих и флуоресцирующих в различных диапазонах спектра. При возбуждении с длиной волны 407 нм, которое было выбрано для разработки метода АФД ранних форм РШМ [12], суммарный спектр АФ является суперпозицией спектров флуоресценции основных эндогенных флуорофоров соединительной ткани (различные формы коллагена), дыхательной цепи (различные формы флавинов), а также порфиринов [5, 9, 13]. Показано, что при возбуждении 407 нм основным источником диагностической информации может рассматриваться только спектральный диапазон 420– 600 нм, в котором регистрируется основная полоса излучения как нормального, так и патологического эпителия шейки матки. Основной вклад в данную полосу излучения вносит, по-видимому, флуоресценция различных форм коллагена, содержащегося в подслизистом слое [13]. В очагах CIN III и раннего рака ШМ происходит падение интенсивности АФ, возможные причины которого подробно обсуждались ранее в нашей первой работе [12]. Развитие атрофических изменений и истончение слизистой оболочке в период менопаузы, напротив, приводит к возрастанию интенсивности АФ излучения во всем диапазоне (420–600 нм).
Особое внимание в нашем исследовании было уделено возможности использования флуоресценции эндогенных порфиринов в красной области для целей АФД ранних форм РШМ. Следует отметить, что флуоресценция эндогенных порфиринов наиболее эффективно возбуждается именно при длине волны в области 400 нм, поскольку она попадает в полосу их максимального поглощения (полосу Соре) [14]. Полученные результаты позволяют заключить, что излучение эндогенных порфиринов в красной области спектра не может рассматриваться в качестве диагностического признака наличия как доброкачественного патологического процесса, развивающегося на фоне инфицирования ВПЧ, так и предрака и ранних форм РШМ.
В настоящее время проводится анализ полученных массивов и изучаются корреляции особенностей спектров АФ с морфологическими диагнозами с целью выявления диагностически значимых спектрально-флуоресцентных параметров.
Настоящая работа выполнена в рамках Государственного контракта № 16.522.12.2005 от «04» июля 2011 при финансовой Министерством образования и науки Российской Федерации.
Список литературы К методу аутофлуоресцентной диагностики ранних форм рака шейки матки: особенности эндогенной флуоресценции покровного эпителия шейки матки
- Козаченко А.В. Новые направления в диагностике и лечении микрокарциномы шейки матки//Акушерство и гинекология. 2006. С. 56-59.
- Кулаков В.И., Прилепская В.И., Минкина Г.И. и соавт. Профилактика рака шейки матки. Руководство для врачей. М., 2007.
- Минкина Г. И., Манухин И.Б., Франк Г.А. Предрак шейки матки. М., 2008.
- Роговская С.И. Папилломавирусная инфекция у женщин и патология шейки матки. М.: ГЭОТАР-Медиа, 2007. 141 с.
- Оптическая биомедицинская диагностика. В 2 томах. Том 2. Под редакцией В. В. Тучина. Издательство: Физматлит, 2007.
- Соколов В.В., Булгакова И.И., Дронова О.Б. и соавт. Флуоресцентные методы в эндоскопической диагностике тяжелой дисплазии и раннего рака пищевода Барретта//Российский онкологический журнал. 2008. №3. С. 46-54.
- Русаков И.Г., Соколов В.В., Булгакова И.И. и соавт. Флуоресцентные методы диагностики и поверхностный рак мочевого пузыря: современное состояние проблемы//Урология. 2008, № 3. С. 67-71.
- Чиссов В.И., Соколов В.В., Булгакова И.И. и соавт. Исследование лазер-индуцированной аутофлуоресценции нормального и неоплазированного уротелия in vivoZ/Российский онкологический журнал. 2007. №6. С. 18-24.
- Nirmula Ramanujam "Fluorescence spectroscopy of Neoplastic and Non-Neoplastic tissues" (Review)//Neoplasia. 2002. Vol. 2, № 1-2. P. 89-117.
- K. Sierotn-Stoltnya, S. Kwiateka, W. Latosa et al. Autofluorescence-endoscopy with "real-time" digital image processing in differential diagnostics of selected benign and malignant lesions in the oesophagus//Photodiagnosis and Photodynamic Therapy. 2012. Vol. 9. P. 5-10.
- S. Lam, И. Zeng, A. McWilliams Optical Spectroscopy and Imaging for Early Lung Cancer Detection: A Review//Photodiagnosis and Photodynamic therapy. 2004. Vol. 1, Issue 2. P. 111-122.
- Булгакова И.И., Трушина О.И., Новикова Е.Г., Верещагин К.А., Фабелинский В.И., Андреева Ю.Ю., Смирнов В.В., Чиссов B. И. Разработка метода аутофлуоресцентной диагностики ранних форм рака шейки матки: оптимизация длины волны лазерного возбуждения//Московский хирургический журнал. 2011. № 6(22). C. 30-34.
- Drezek R., Sokolov K., Utzinger U. Understanding the contributions of NADH and collagen to cervical tissue fluorescence spectra: modeling, measurements and implications//J. Biomed. Opt. 2001. B. 6. S. 385-96.
- Аскаре К.А. Порфирины: спектроскопия, электрохимия, применение. М.: Наука, 1987. 384 с.


