К термодинамике взаимодействия комплексных раскислителей, содержащих барий, с кислородом в металлических расплавах
Автор: Михайлов Геннадий Георгиевич, Макровец Лариса Александровна
Журнал: Вестник Южно-Уральского государственного университета. Серия: Металлургия @vestnik-susu-metallurgy
Статья в выпуске: 39 (298), 2012 года.
Бесплатный доступ
Рассмотрены термодинамические аспекты процессов раскисления стали и модифицирования неметаллических включений в стали сплавами, содержащими барий. Построены многокомпонентные диаграммы растворимости компонентов в жидком металле. Показано, что ввиду малой растворимости бария в металле его раскисляющее действие минимально. По-видимому, модифицирующее действие бария заключается в его высокой поверхностной активности.
Барий, неметаллические включения, диаграммы, модифицирование
Короткий адрес: https://sciup.org/147156767
IDR: 147156767 | УДК: 669.15.046.516
Текст научной статьи К термодинамике взаимодействия комплексных раскислителей, содержащих барий, с кислородом в металлических расплавах
В научной и технологической литературе уже более 30 лет идет обсуждение раскислительной и модифицирующей способности бария. Получение сплавов с барием, а также с кремнием, кальцием и алюминием в настоящее время не представляет технологических сложностей [1]. Это делает привлекательным использование лигатур с барием, так как упругость пара бария при температурах сталеварения по различным определениям составляет от 0,5 до 0,8 атмосфер, тогда как упругость пара кальция при 1600 °С составляет величину около 1,7 атм. Последнее приводит к пиротермич-ности процессов раскисления стали силикокальци-ем и требует специальных технологических приемов при введении сплавов с кальцием в сталь. В литературе также отмечается, что пиротермичность процесса раскисления стали сплавами, содержащими и кальций, и барий существенно ниже, чем при раскислении стали сплавами типа СК-30. Это связано с тем, что при введении в сталь сплавов типа Si–Ca–Ba кремний быстрее растворяется в железе, нежели кальций и барий, и поэтому на какой-то стадии в металле находятся капли кальция и бария, а это снижает парциальное давление кальция над раскисляющей лигатурой.
В работе [2] было проведено сравнительное исследование раскислительной способности сплавов SiCa, SiCaBa, CaBa после предварительного введения алюминия. Было установлено, что при введении сплава SiCaBa получено несколько меньшее содержание кислорода в стали, нежели при введении сплава SiCa. Но использование сплава CaAl позволяет получить меньшее содержание кислорода в стали. В неметаллических включениях барий обнаруживался через 10 с после введения лигатуры с барием. В более ранних и поздних пробах барий во включениях не обнаруживался.
В работе [3] описываются результаты продувки трубной стали в ковше порошками силикобария и силикокальция. Общее количество включений при продувке силикокальцием и силикобарием оказалось одинаковым. В значительном количестве работ отмечается, что использование бария в лигатурах приводит к уменьшению количества крупных неметаллических включений [3]. Оставшиеся включения обычно содержат кальций, кремний, алюминий, связанные с кислородом. Содержание ВаО отмечается лишь в единичных включениях. Отмечается также отсутствие бария в твердом металле. По-видимому, эффект модифицирования структуры и повышение эксплуатационных свойств стали, отмеченные в литературе, происходят где-то на наноуровне [4]. Высокая эффективность модифицирования транспортного металла сплавами с барием убедительно подтверждается в работе [5].
Из анализа литературных данных следует, что попытки систематизировать раскислительный аспект проблемы использования сплавов с барием носят отрывочный характер и требуют упорядочения.
В настоящей работе выполнен термодинамический анализ процессов взаимодействия с кисло- родом, растворенным в стали, при введении в сталь в качестве раскислителей кальция, бария и алюминия. Предварительным анализом установлено, что в равновесии с металлом в целом могут находиться следующие оксидные фазы: оксидный расплав, содержащий FeO, CaO, BaO, Al2O3, герцинит FeAl2O4, алюминаты бария 3BaO·Al2O3, BaO·Al2O3, BaO·6Al2O3, Al2O3 и BaO, твердые растворы FeO–CaO, а также газовая фаза (СО, СО2, пары Са).
Результаты расчетов удалось обобщить в виде оксидных диаграмм состояния, сопряженных с областью существования жидкого металла и построенных поверхностей растворимости компонентов в жидком металле (ПРКМ). Зависимости констант равновесия от температуры для основных реакций раскисления приведены в табл. 1.
Активности компонентов оксидных расплавов рассчитаны по теории субрегулярных ионных растворов в варианте квадратичной зависимости энергии смешения от состава расплава [6]. Энергетические параметры теории представлены в табл. 2. Активности компонентов металлического расплава рассчитаны с использованием параметров взаимодействия первого порядка, приведенных в табл. 3.
На рис. 1 представлена высокотемпературная часть диаграммы FeO–BaO–CaO. Из нее видно, что если использовать крупку кальция и бария в порошковой проволоке для раскисления, все продукты раскисления будут твердыми. Это же следует и из рис. 2. На представленной ПРКМ (рис. 2) приведены составы жидкого металла, равновесного с указанными оксидными фазами. На жирных линиях заданы составы металла, равновесного с
Таблица 1
Зависимости констант равновесия реакций раскисления от температуры
|
Реакция |
lg K = – A / T + B |
|
|
A |
B |
|
|
(FeO) = [Fe] + [O] |
6320 |
4,734 |
|
(CaO) = [Ca] + [O] |
7220 |
–3,29 |
|
(BaO) = [Ba] + [O] |
20 384 |
7,36 |
|
(Al 2 O 3 ) = 2[Al] + 3[O] |
58 320 |
18,02 |
|
I FeO I = [Fe] + [O] |
8069 |
5,80 |
|
I CaO I = [Ca] + [O] |
9843 |
–2,377 |
|
I FeOaABO ; I = [Fe] + 2[Al] + 4[O] |
74 580 |
26,37 |
|
I CaOaABO ; I = [Ca] + 2[Al] + 4[O] |
71 047 |
15,212 |
|
I CaOAABO ; I = [Ca] + 4[Al] + 7[O] |
137 521 |
36,476 |
|
I CaOAABO ; I = [Ca] + 12[Al] + 19[O] |
401 927 |
122,115 |
|
I BaOa-ABO ; I = [Ba] + 2[Al] + 4[O] |
84 000 |
25,76 |
|
I 3BaO-Al 2 O ; I = 3[Ba] + 2[Al] + 6[O] |
127 800 |
40,95 |
|
I BaOAABO ; I = [Ba] + 12[Al] + 19[O] |
402 350 |
125,99 |
|
I BaO I = [Ba] + [O] |
23 400 |
8,73 |
|
I AL 2 O 3 1 = 2[Al] + 3[O] |
64 000 |
20,48 |
|
{CO} = [C] + [O] |
1168 |
–2,07 |
|
{CO 2 } = [C] + 2[O] |
9616 |
2,51 |
|
{Ca} = [Ca] |
–1912 |
–2,69 |
Таблица 2
Значения параметров теории субрегулярных ионных растворов для системы FeO–BaO–CaO–Al2O3
|
Системы |
Энергетические параметры, кал/моль |
||
|
Qiiij |
Qiijj |
Qikkk |
|
|
FeO–BaO |
–5000 |
–10 000 |
–5000 |
|
FeO–CaO |
–6897 |
–13 794 |
–6897 |
|
FeO–Al 2 O 3 |
661 |
–16 329 |
–4917 |
|
BaO–CaO |
0 |
0 |
0 |
|
BaO–Al 2 O 3 |
–21 194 |
–10 073 |
–32 395 |
|
CaO–Al 2 O 3 |
–12 302 |
–41 264 |
–23 342 |
|
Qiijk |
Qijjk |
Qijkk |
|
|
FeO–BaO–CaO |
–10 000 |
0 |
–10 000 |
|
FeO–BaO–Al 2 O 3 |
–10 000 |
–20 000 |
–30 000 |
|
FeO–CaO–Al 2 O 3 |
–20 000 |
–20 000 |
–40 000 |
|
BaO–CaO–Al 2 O 3 |
–45 500 |
–48 900 |
–81 400 |
Таблица 3
Параметры взаимодействия e i j , T =1600 °С, растворитель – жидкое железо
|
Элемент i |
Элемент j |
||||
|
Al |
Ca |
O |
С |
Ba |
|
|
Al |
0,045 |
–0,0515 |
–1,62 |
0,0966 |
–0,064 |
|
Ca |
0,072 |
–0,07 |
–3,507 |
–0,324 |
0 |
|
O |
–0,96 |
–1,41 |
–0,2 |
–0,45 |
–0,95 |
|
С |
0,043 |
–0,097 |
–0,34 |
0,14 |
–0,0059 |
|
Ba |
–0,325 |
0 |
–8,155 |
–0,068 |
0 |
СаО
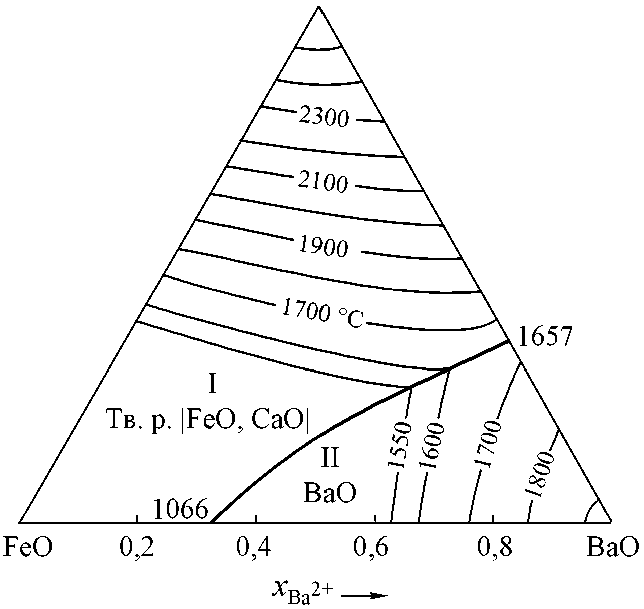
Рис. 1. Диаграмма состояния системы FeO–BaO–CaO
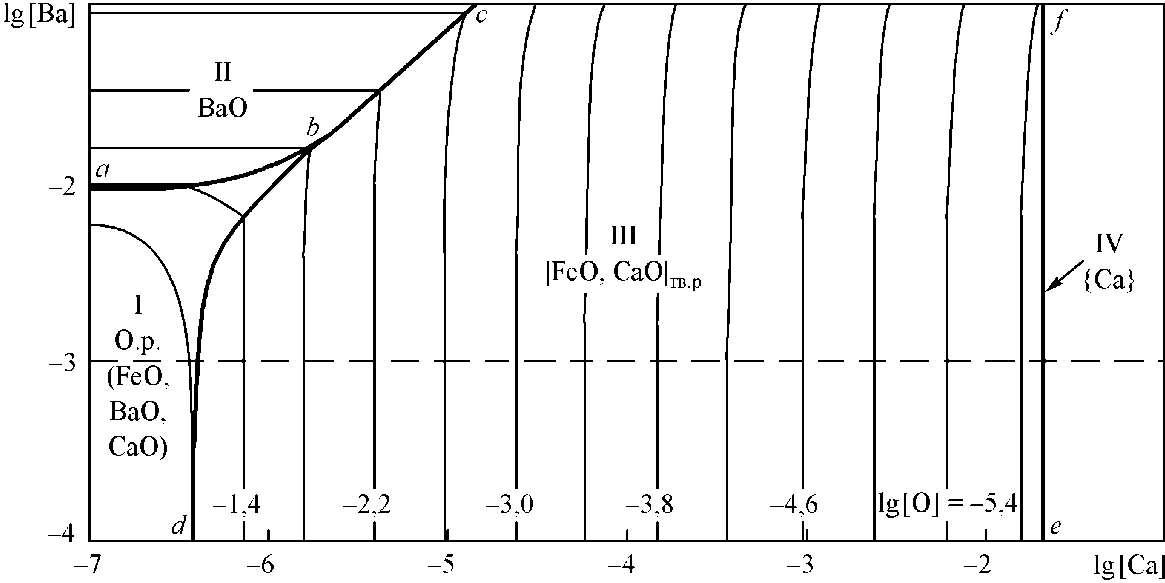
Рис. 2. ПРКМ системы Fe–Ba–Ca–O, Т = 1600 °C, Робщ = 1 атм двумя оксидными фазами. Тонкими линиями проведены изокислородные сечения поверхности. Видно, что жидкие оксидные фазы могут появиться в равновесии с металлом лишь при высокой его оксиленности и малых концентрациях кальция и бария в стали. Следует также отметить, что выше проведенной штриховой линии на рис. 2 структуру ПРКМ следует считать виртуальной.
В литературе указывается на применение при раскислении и модифицировании сплава кальция, алюминия и бария. В связи с этим были проведены расчеты диаграммы состояния ВaO–СaO–Al2O3 (рис. 3) и на основании строения этой диаграммы установлены оксидные фазы, которые могут образоваться при раскислении стали кальцием, барием и алюминием. На рис. 4 построена поверхность растворимости кальция, бария и алюминия в стали, содержащей 0,1 % углерода и кислород. Видно, что гексаалюминат бария может образоваться при введении в сталь совместно с кальцием и алюми-
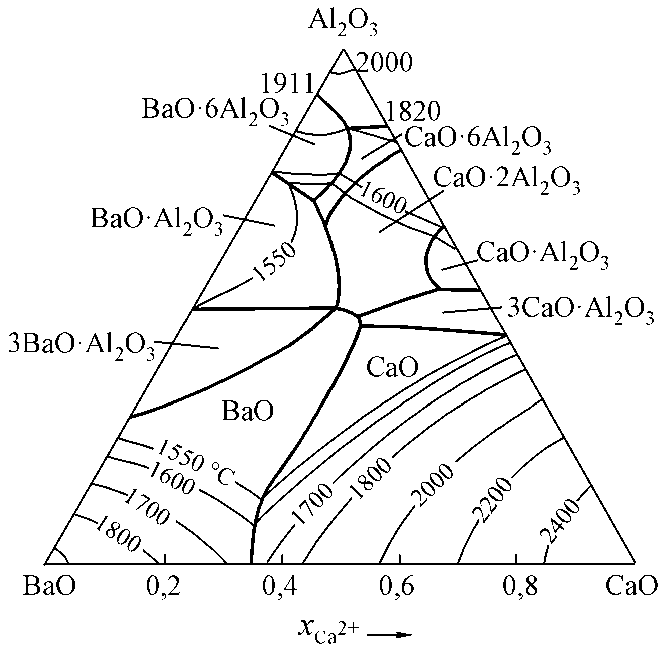
Рис. 3. Диаграмма состояния системы BaO–CaO–Al 2 O 3
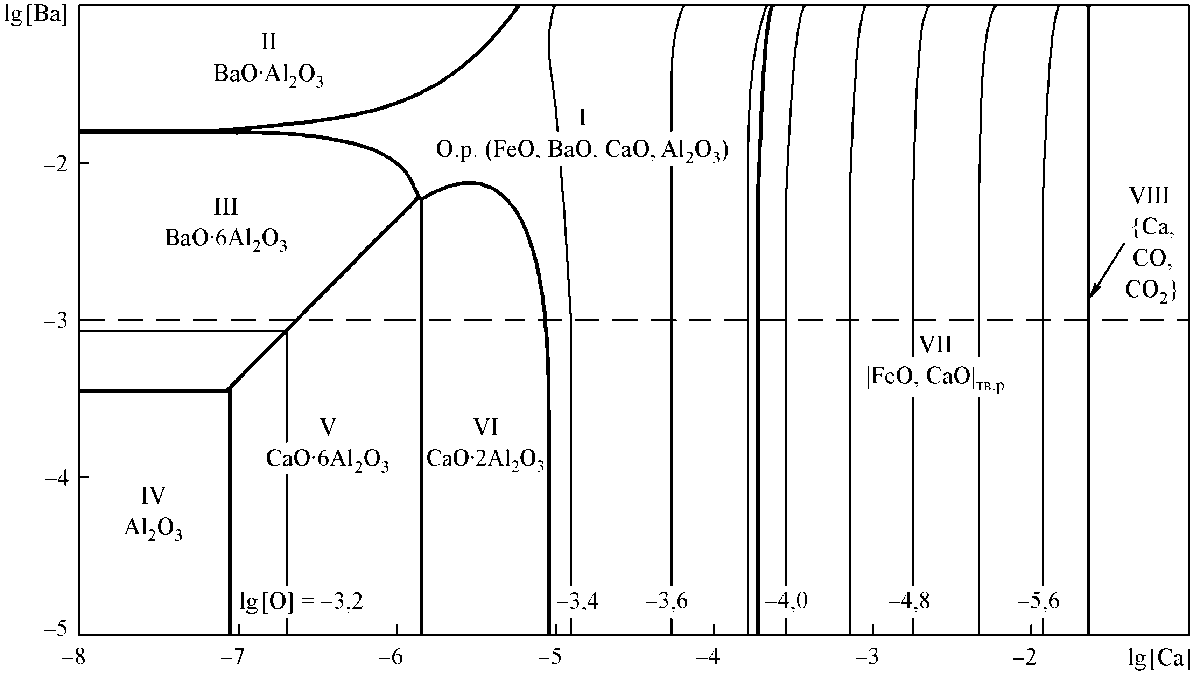
Рис. 4. ПРКМ системы Fe–Ba–Ca–Al–O–C, [Al] = 0,01, [C] = 0,1 мас. %, Т = 1600 °C, Р общ = 1 атм
нием в весьма узкой области, ниже штриховой линии при очень низких концентрациях кальция. Учитывая, что в связи с малой растворимостью в железе значительная часть бария находится в металле в виде микрокапельного состояния (своеобразной эмульсии), на границах микрокапельки может образоваться алюминат кальция. Концентрация же бария в оксидном расплаве (область I на рис. 4) не превышает тысячных атомных долей. Вид поверхности растворимости разъясняет, почему барий почти не обнаруживается в неметаллических включениях. Кальций и алюминий не дают возможности барию взаимодействовать с кислородом.
Выводы
-
1. Растворимость бария в железе, по крайней мере, на порядок меньше, чем растворимость кальция. Если считать, что содержание бария в железе достигло насыщения (0,001 %), то барий сможет связать 0,001 ⋅ 16 137 ≈ 0, 0001 мас. % кислорода. Поэтому раскисление стали барием может происходить только по механизму гетерогенного раскисления, микрокапельками бария. Этот процесс может быть организован либо интенсивным введением в металл порошковой проволоки, либо продувкой барийсодержащими лигатурами.
-
2. Барий присутствует буквально в большинстве неметаллических включений при проведении раскисления никельхромовых жаропрочных сталей. Никель повышает растворимость бария в металле и барий входит в состав неметаллических включений. Поэтому снижение содержания крупных неметаллических включений в стали, модифицированной сплавами с барием, возможно, связано не с особой скоростью удаления этих включений, а с образованием большого количества мелких включений, зарождению которых способствует высокая поверхностная активность бария.
-
3. Благоприятное влияние бария на структуру стали, уставленное на рельсовом и трубном металле несомненно, но сказать что-либо определенное о механизме этого явления пока невозможно. Содержание бария в твердом металле практически неопределимо. Его распределение по микрокристаллам и кристаллической решетке железа пока неизвестно.
Список литературы К термодинамике взаимодействия комплексных раскислителей, содержащих барий, с кислородом в металлических расплавах
- Кожевников Г.Н. Электротермия лигатур щелочноземельных металлов с кремнием/Г.Н. Кожевников, В.П. Зайко, М.А. Рысс. -М.: Наука, 1978. -224 с.
- Deoxidation and Desulphyrization of liquid iron with barium and barium bearing calcium alloys/Y. Kataura, T. Shoji, K. Topawa, T. Takahashi//Trans. Iron and Steel Inst. Japan. -1980. -Vol. 20, № 12. -P. 801.
- Перспективное применение барийсодержащих лигатур для раскисления и модифицирования транспортного металла/К.В. Григорович, К.Ю. Демин, А.И. Арсенкин и др.//Металлы. -2011. -№ 5. -С. 146-156.
- К вопросу использования карбонатита для микролегирования/О.И. Нохрина, В.И. Дмитриенко, И. Д. Рожихина и др.//Современные проблемы электрометаллургии стали. -Челябинск: Издат. центр ЮУрГУ, 2010. -Ч. 2. -С. 60-64.
- Эффективность нанотехнологий модифицирования рельсовой стали барием/А. А. Дерябин, В. В. Павлов, В. В. Могильный и др.//Сталь. -2007. -№ 11. -С. 134-141.
- Михайлов Г.Г. Термодинамика металлургических процессов и систем/Г.Г. Михайлов, Б.И. Леонович, Ю.С. Кузнецов. -М.: Издат. дом МИСиС, 2009. -520 с.


