К вертикальному распределению прокариотического фототрофного планктона в Нижнем пруду Самарского ботанического сада
Автор: Горбунов М.Ю., Уманская М.В.
Журнал: Самарская Лука: проблемы региональной и глобальной экологии @ssc-sl
Рубрика: Охрана растительного и животного мира
Статья в выпуске: 1-2 т.16, 2007 года.
Бесплатный доступ
Исследованы особенности развития прокариотического фототрофного планктона в небольшом меромиктическом пруду, расположенном на территории ботанического сада в центре крупного города. Приведены данные о составе и обилии фототрофных прокариотов; обсуждаются закономерности их распределения и смены доминирующих комплексов в зоне градиента окислительно-восстановительных условий.
Планктон, цианобактерии, меромиксис, зона хемоклина
Короткий адрес: https://sciup.org/148314691
IDR: 148314691
Текст научной статьи К вертикальному распределению прокариотического фототрофного планктона в Нижнем пруду Самарского ботанического сада
Стратификация водоемов и связанная с ней вертикальная анизотропность абиотических параметров приводит к неоднородному вертикальному распределению организмов фитопланктона. Развитие же аноксигенных фо-тотрофных организмов, требует присутствия восстановленных неоргани-
Институт экологии Волжского бассейна РАН, г. Тольятти.
ческих соединений и отсутствия кислорода, и может происходить только в анаэробных слоях стратифицированных водоемов.
Особенно резкая неоднородность в вертикальном распределении фо-тотрофных планктонных организмов характерна для меромиктических (биоанизотропных) водоемов, в которых стратификация водной толщи носит постоянный характер, а не чередуется, как в полимиктических водоемах, с периодами полного перемешивания (Кузнецов, 1970; Ляликова, 1957; Guerrero et al, 1985; Garcia-Gil et al, 1999). Состав и вертикальная структура аноксигенного фототрофного планктона в меромиктических озерах различны и зависят от сочетания многих, не вполне определенных, факторов. Как правило, в них развиваются как пурпурные (Chromatiaceae), так и зеленые серные бактерии (Chlorobiaceae), но в некоторых озерах отмечена только одна из этих групп. Значительны различия и в составе окси-генных фототрофных организмов (фитопланктона).
В данной работе представлены первые результаты исследования закономерностей вертикального распределения фототрофных микроорганизмов в Нижнем пруду Ботанического сада, небольшом водоеме с меромиктическим характером перемешивания (Горбунов и др., 2007).
МАТЕРИАЛЫ И МЕТОДЫ
Исследования проводили в период открытой воды 2004 и 2005 гг. Пробы воды отбирали ежемесячно батометром Руттнера в наиболее глубокой части пруда, через каждые 0,5 м от поверхности до глубины 4,5 м.
Общую численность бактерий определяли на мембранных фильтрах Владипор (Кузнецов, Дубинина, 1989). Биомассу бактериопланктона рассчитывали в соответствии с рекомендациями руководства Кузнецова и Дубининой (1989). Численность фототрофных бактерий (цианобактерии, зеленые серные бактерии, пурпурные серные бактерии) определяли методом прямого счета под микроскопом МБИ-6 и Люмам Р8. Видовой состав фо-тотрофных бактерий определяли по (Голлербах и др., 1953; Pfenning, True-per, 1989) с учетом современных таксономических ревизий (Garrity et al., 2004; Hoffmann et al., 2005). Эукариотический фитопланктон определяли до рода по определителям серии «Определитель пресноводных водорослей СССР» (1951-1968). Концентрацию фотосинтетических пигментов определяли, как описано ранее (Горбунов, Уманская, 2003).
РЕЗУЛЬТАТЫ
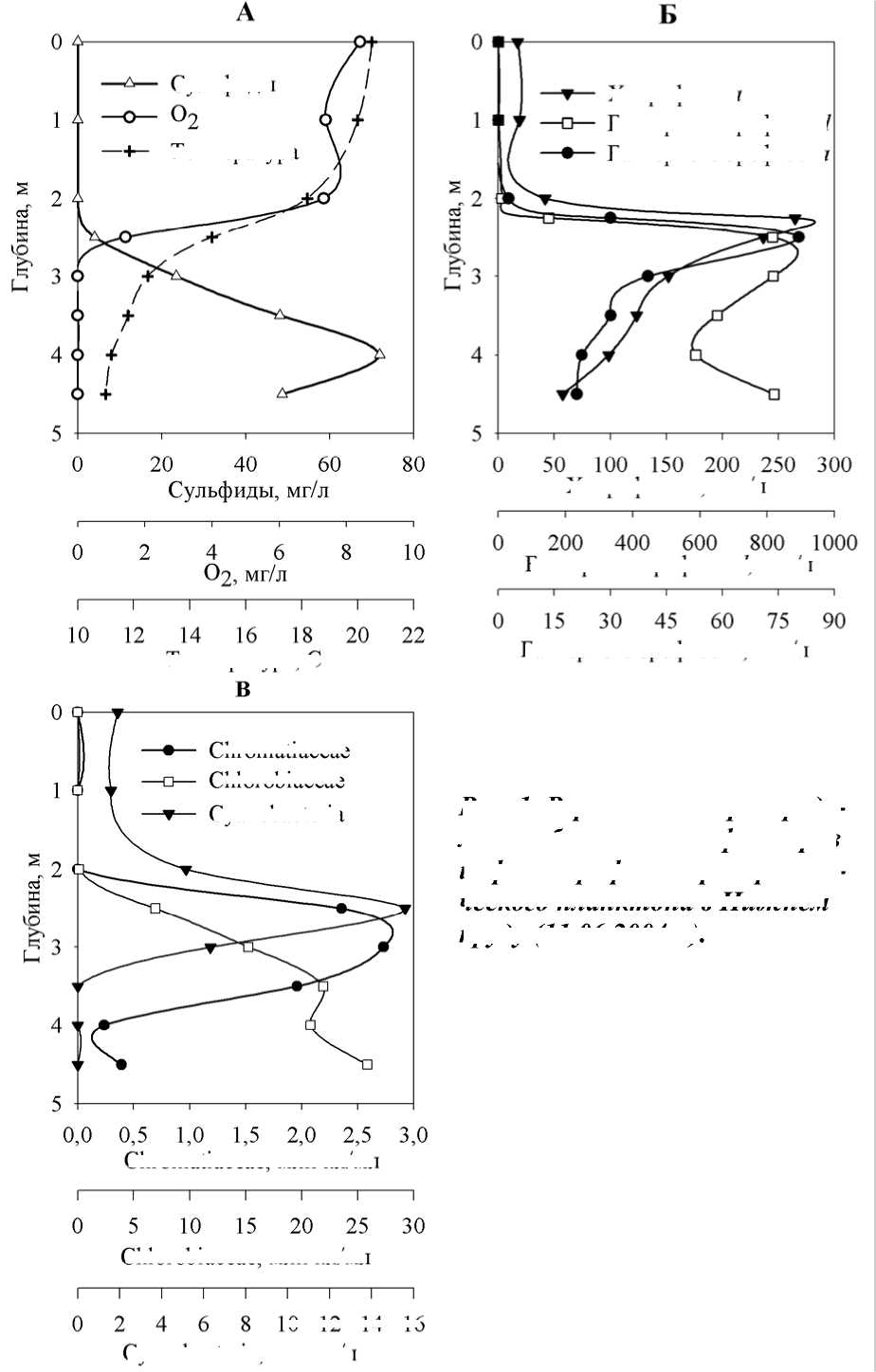
В июне 2004 г. в пруду формировался резкий термоклин на глубине 23 м. В еще более узкой зоне, 2-2,5 м располагалась область хемоклина, в пределах которой происходило изменение окислительновосстановительных условий, газового режима (рис. 1 А), увеличивалась минерализация и концентрации биогенных элементов, значительно снижалось значение pH (от 7,9 до 7,1). В этой же зоне располагались максимумы всех пигментов – хлорофилла а водорослей и бактериохлорофиллов a и d пурпурных и зеленых бактерий, (рис. 1 Б).
Chromatiaceae
Chlorobiaceae ческого планктона в Нижнем пруду (11.06.2004 г.).
10 12 14 16
Сульфиды
Температура
Температура, С
Cyanobacteria
Chromatiaceae, млн кл/мл
Chlorobiaceae, млн кл/мл
Cyanobacteria, млн кл/л
Хлорофилл а
Бактериохлорофилл d
Бактериохлорофилл а
Хлорофилл а, мкг/л
Бактериохлорофилл и, мкг/л
Бактериохлорофилл а, мкг/л
Рис. 1. Вертикальное распреде-
ление абиотических факторов
и фототрофного прокариоти-
А
Глубина, м Глубина,
О 40 80 120160
Сульфиды, мг/л
0 12 3 4 5 67
02, мг/л
I I I I I I I I
12 14 16 18 20 22 24 26
Температура, С
Б
900 1200 15001800
Минерализация, мг/л
0,0 0,5 1,0 1,52,0
Р0бЩ’ мг/л । । । । ।।
0,0 0,2 0,4 0,6 0,81,0
Аммоний, мг/л
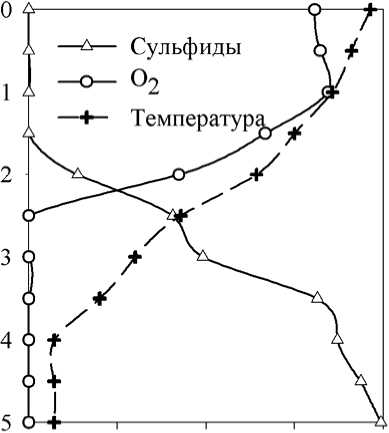
Рис. 2. Вертикальное распределение абиотических факторов и фотосинтетических пигментов в Нижнем пруду (19.07.2005г.).
О 50 100 150 200 250 300
Хлорофилл а, мкг/л
0 400 800 1200 1600
Бактериохлорофилл d, мкг/л
0 50 100 150 200 250 300 350
Бактериохлорофилл а, мкг/л
В составе фитопланктона верхнего перемешиваемого слоя воды (мик-солимниона) численность фитопланктона была невелика; доминировали эукариотические организмы: криптофитовые, эвглены и немногие золотистые и диатомовые. Прокариотический фитопланктон был представлен нитчатыми формами, причем если в поверхностных слоях (0-1 м) преобладали представители р. Anabaena, то с увеличением глубины их доля снижалась, но возрастала доля представителей отр. Oscillatoriales. В зоне хемоклина в фитопланктоне продолжали доминировать криптофитовые и эвгленовые; численность цианобактерий, в основном Planktothrix sp., была невелика. В глубоких слоях монимолимниона эукариотические организмы выпали из состава фитопланктона, и, начиная с глубины 3,5-4 м, были обнаружены только единичные трихомы цианобактерии Planktothrix sp.
Максимум пурпурных серных бактерий сем. Chromatiaceae находился на глубине 2,5-3 м, а зеленые (сем. Chlorobiaceae) образовывали два максимума, на глубине 3,5 м и в придонном слое (рис. 1 В). Таким образом, максимальные численности фототрофных бактерий не вполне совпадали с максимумами пигментов.
Cреди Chlorobiaceae доминировали Chlorobium limicola Nadson 1906; Chlorobium clathratiforme (Szafer 1911) Imhoff 2003, единично встречались колонии Chlorobium luteolum (Shmidle 1901) Imhoff 2003 и консорции Chlorochromatium . Chromatiaceae были представлены сферическими и ово-идными клетками диаметром 2-3 мкм с газовыми вакуолями, образующими небольшие сферические и более крупные колонии неправильной формы. У небольшой части колоний обнаруживалось активное движение. Судя по этим признакам, эти организмы могут принадлежать либо к Thio-capsa rosea (Winogradsky 1888) Guyoneaud 1998, либо к Lamprocystis roseopersicina (Kützing 1849) Schroeter 1886, различить которые по морфологии в фиксированных пробах невозможно (Imhoff et al, 1998). Мы предполагаем, что в пруду присутствуют две различные популяции (возможно, оба упомянутых вида), поскольку клетки в небольших плотных и более рыхлых и крупных колониях имеют несколько отличающиеся размеры.
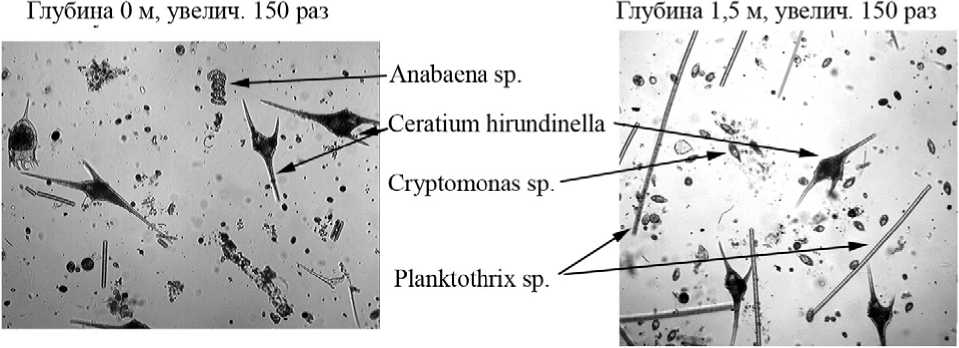
В июле 2005 г. вертикальное распределение абиотических факторов было несколько иным (рис. 2 А, Б). В частности, почти вдвое повысилась концентрация сульфидов в монимолимнионе. Характерно также большее развитие зоны, где одновременно присутствуют сероводород и кислород. В аэробном миксолимнионе (0-1,5 м) доминировали динофлагелляты ( Ceratium hirundinella ), но с увеличением глубины увеличивалась доля различных криптофитовых и нескольких видов хризофитовых. Цианобактерии в поверхностном слое были представлены почти исключительно представителями р. Anabaena . Начиная с глубины 1-1,5 м, доминирование среди цианобактерий перешло от этого рода к содержащим газовые вакуоли Planktothrix sp. (Phormidiaceae: Oscillatoriales). На глубине 1,5 м доминирующими по численности видами про- и эукариотических фототрофных организмов являлись, соответственно, Planktothrix sp. и Cryptomonas spp. (фото 1).
Глубина 2 м, увелич. 150 раз
Глубина 2 м, увелич. 600 раз
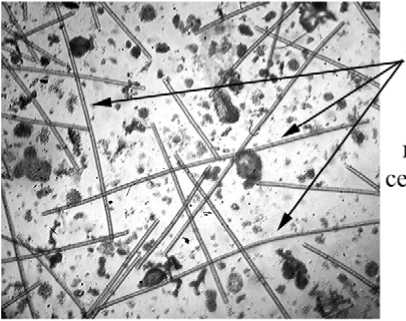
Planktothrix sp.
>лонии бактерий .Chromatiaccac
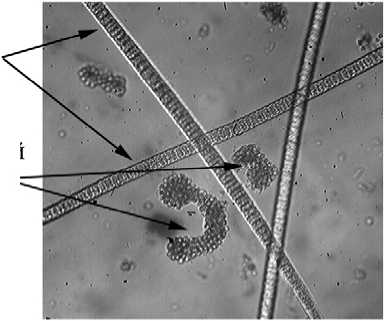
Глубина 2,5 м, увелич. 600 раз
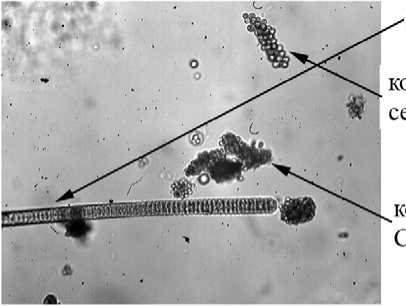
Planktothrix sp.
Глубина 4 м, увелич. 1500 раз онии бактерий
.Chromatiaceae
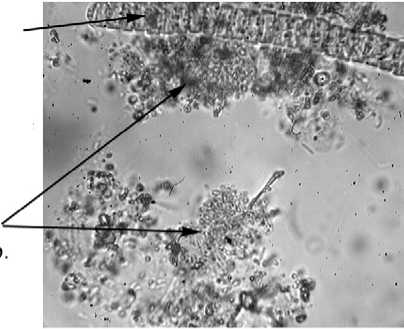
Фото 1. Микрофотографии фототрофного планктона на разных горизонтах Нижнего пруда (19.07.2005г.).
На глубине 2-2,5 м эукариотические фототрофные организмы практически полностью исчезают, а прокариотические представлены как аноксигенными фототрофными бактериями, так и цианобактериями Planktothrix sp., биомасса которых сравнима с общей биомассой пурпурных и зеленых бактерий. В нижележащем монимолимнионе доминируют зеленые серные бактерии. Кроме них, продолжают обнаруживаться цианобактерии, в то время как пурпурные серные бактерии представлены только единичными колониями (фото 1).
Пигментный анализ показал, что максимумы всех пигментов находятся на глубине 2,2-2,3 м, и практически совпадают (рис. 2 В). По-видимому, это связано с сильной конкуренцией за свет, поскольку из-за высокой плотности фототрофов в максимуме развития нижележащие слои оказываются в условиях сильного затенения.
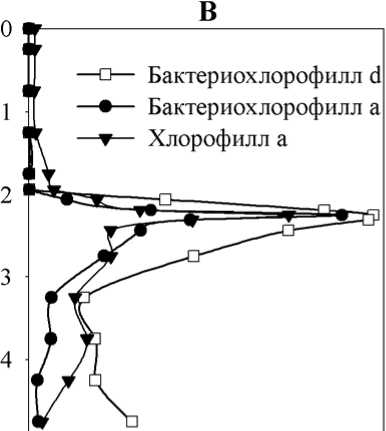
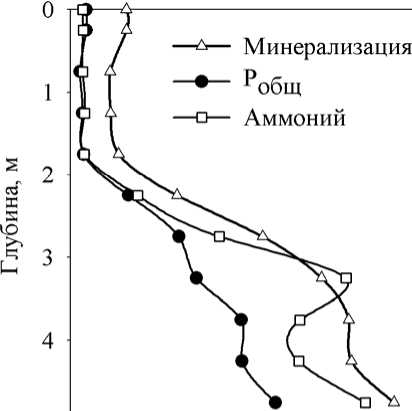
В период осенней гомотермии 2005 г. в результате ветрового воздействия произошло опускание зоны хемоклина до глубины 3-3,5 м. В результате этого в поверхностные слои воды поступили значительные количества биогенных элементов, накопленных в слоях летнего хемоклина и верхней части монимолимниона (Горбунов и др., 2007). Это привело к вспышке массового развития в миксолимнионе эукариотического фитопланктона с преобладанием жгутиковых форм: золотистых ( Synochromonas sp.), криптофитовых и зеленых ( Chlamydomonas spp.). В то же время, развитие анаэробных фототрофных бактерий в хемоклине и монимолимнионе было подавлено, и их численность и концентрации пигментов значительно понизились по сравнению с летним периодом. В ноябре концентрация хлорофилла а во всем миксолимнионе была почти постоянной, около 45 мкг/л. Максимальные концентрации бактериохлорофиллов a и d наблюдались на глубине 3,5 м (18,5 и 217 мкг/л, соответственно). Значительные количества хлорофилла a регистрировались и некоторое время после установления ледового покрова (не показ.).
В начале весны, перед таянием ледового покрова, когда анаэробная зона охватывала всю толщу воды (рис. 3 А), развитие Chlorobiaceae также регистрировалось во всей водной толще. Кроме зеленых бактерий, в зимнее время в планктоне пруда отмечены представители Chromatiaceae: Thio-pedia rosea и Thiocapsa sp. (последняя – в виде одиночных клеток). Фитопланктон был немногочисленным, преобладали Chlamydomonas spp. и Planktothrix sp . Другие виды ( Euglena sp., Cryptomonas sp., мелкие зеленые хлорококковые) были единичны.
Распределение фотосинтетических пигментов по глубине в этот период было относительно однородным. Их концентрация несколько увеличивалась ко дну, образуя небольшие промежуточные максимумы в области 1,5-2 м (рис. 3 Б).
ОБСУЖДЕНИЕ
Меромиктический характер перемешивания в пруду обуславливает резко неоднородное распределение по глубине окислительновосстановительных условий и концентраций биогенных элементов, что отражается в вертикальном распределении всех гидробионтов, и, в особенности, фототрофного планктона, как эукариотического, так и прокариотического.
Бедность верхнего перемешиваемого слоя (миксолимниона) биогенными элементами приводит к слабому развитию фитопланктона. Соотно- шение концентраций азота и фосфора в пруду указывает на лимитирование развития фитопланктона азотом (Горбунов и др., 2007). Поэтому в июле 2005 г. в миксолимнионе доминировали динофлагелляты Ceratium hirundi-nella и цианобактерии Anabaena sp., первый из которых способен получать соединения азота за счет фаготрофного питания, а второй – фиксировать атмосферный азот. Однако в более богатом биогенными элементами мо-нимолимнионе оксигенные фототрофные организмы, в подавляющем большинстве, не могут развиваться из-за низкой интенсивности света и ингибирования кислородного фотосинтеза сероводородом. Лишь немногие виды фитопланктона, в основном цианобактерии, в таких условиях могут либо осуществлять фотосинтез анаэробного типа, либо имеют механизмы защиты от действия сероводорода (Cohen et al., 1986; Camacho et al., 1996). Поэтому максимум развития организмов фитопланктона приурочен к мик-роаэробной зоне в пределах хемоклина, где им удается сбалансировать потребности в биогенных элементах и световые условия.
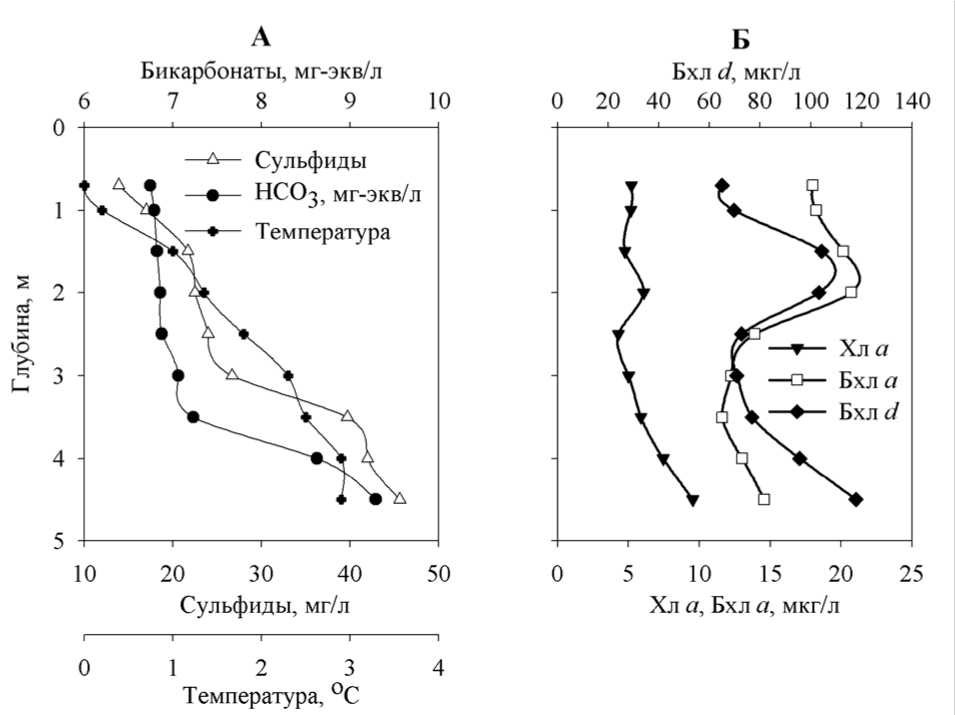
Рис. 3. Вертикальное распределение абиотических факторов и фотосинтетических пигментов в Нижнем пруду (23.03.2006 г.).
В то же время, проникновение света в слои воды, содержащие сероводород – нижнюю часть хемоклина и верхнюю часть монимолимниона – создает благоприятные условия для массового развития аноксигенных фо-тотрофных бактерий на протяжении всего года.
В итоге, в зоне хемоклина формируется ряд пересекающихся достаточно узких зон развития тех или иных видов, образующий общий максимум биомассы всех фототрофных организмов, как оксигенных (фитопланктона), так и аноксигенных. Максимумы их развития близки, и в некоторых случаях (июль 2005 г.) примененная нами схема отбора проб в зоне хемоклина (через каждые 20 см) оказалась недостаточно подробной для разделения максимумов пигментов.
Тем не менее, другие полученные данные показывают, что главные максимумы развития пурпурных бактерий в Нижнем пруду располагаются несколько ниже максимума хлорофилла а , но выше, чем максимумы зеленых бактерий, более чувствительных к молекулярному кислороду и адаптированных к развитию при более низких освещенностях. Некоторое расхождение между результатами пигментного анализа и прямого учета численности и биомассы фототрофных бактерий, объясняется, видимо, вариабельностью содержания пигментов в клетках бактерий (Garcia-Gil, Abella, 1992), а также, возможно, изменением по глубине видовой структуры фо-тотрофного сообщества.
По литературным данным, в более глубоких меромиктических водоемах фототрофные бактерии образуют узкие "бактериальные пластины" в области хемоклина (Guerrero et al., 1985; Vila et al., 1998; Garcia-Gil et al., 1999; Camacho et al., 2001). В исследованном пруду их максимумы значительно менее выражены, и высокие численности бактерий наблюдаются и в слоях воды ниже максимумов (рис. 1 Б, В, 2 В). В ранее исследованных нами малых стратифицированных озерах эти максимумы были еще более широки (Горбунов, Уманская, 2003). Возможно, что отсутствие выраженных бактериальных пластин обусловлено развитием массовых популяций инфузорий в области хемоклина пруда (Быкова, личн. сообщ.), как это отмечалось и в ранее исследованных димиктических озерах с анаэробным гиполимнионом (Горбунов и др., 2004, Быкова, 2005). Зоны максимальной численности инфузорий и аноксигенных фототрофных бактерий перекрываются, и первые вполне могут эксплуатировать многочисленные популяции аноксигенных фототрофов в области их оптимального развития.
Несмотря на постоянное существование в пруду анаэробного монимо-лимниона, количественное развитие аноксигенных фототрофных бактерий и их пигментов значительно варьирует в течение сезона. Так, в осенний период произошло значительное снижение биомассы как пурпурных, так и зеленых бактерий. Отчасти оно было связано с понижением температуры в зоне хемоклина и его затенением из-за вспышки цветения фитопланктона в миксолимнионе. Однако главной причиной снижения численности аноксигенных фототрофных бактерий послужило произошедшее в это время понижение положения хемоклина, которое привело к перемешиванию водной массы от поверхности до глубины 3 м. В результате этого значительная часть популяций фототрофных бактерий, развивавшихся на глубинах 2-3 м, погибла, оказавшись в аэробном миксолимнионе. Условия, пригодные для развития аноксигенных фототрофных бактерий, в этот период бы- ли ограничены глубинами более 3-3,5 м. В подледный период зона развития аноксигенных фототрофных бактерий расширилась и охватила всю незамерзшую часть водной толщи, но из-за низкой подледной освещенности максимальные концентрации бактериохлорофиллов (рис. 3) были более чем на порядок ниже, чем в летние месяцы.
Характерно, что несмотря на значительные колебания обилия, концентрация бактериохлорофилла а в пруду была сравнимой с концентрацией основного хлорофилла фитопланктона, хлорофилла а , а концентрация бактериохлорофилла d , как правило, почти на порядок ее превышала. Настолько высокие концентрации бактериохлорофиллов, как в пруду (более 1,6 мг/л Бхл d ), наблюдаются относительно нечасто, хотя высокое количественное развитие аноксигенных фототрофных бактерий – обычное явление в меромиктических водоемах, обусловленное их лимнологическими особенностями.
Максимальное развитие фитопланктона было приурочено к верхней части хемоклина. В составе его эукариотической части доминировали миксотрофные жгутиконосцы: криптофитовые, золотистые и эвгленовые. Криптофитовые крайне характерны для зоны оксиклина и в ряде других меромиктических и голомиктических озер (Alder et al., 2000; Camacho, Vincente, 1998; Camacho et al., 2001; Pedros-Alio et al., 1987; Gervais, 1998 и др.); развитие золотистых и динофлагеллят в этих условиях отмечается реже. В миксолимнионе фитопланктон на протяжении большей части года был малочисленным, и только в октябре-ноябре, при поступлении биогенных элементов в поверхностные слои из-за эрозии хемоклина, наблюдалась вспышка развития золотистых водорослей и криптомонад.
Цианобактерии, представленные нитчатыми безгетероцистными формами с газовыми вакуолями ( Planktothrix sp.), составляли значительную часть оксигенного фототрофного сообщества хемоклина. Близкие виды образуют массовые популяции в хемоклине многих стратифицированных озер (Gorlenko, Kuznezov, 1972; Alder et al., 2000; Camacho, Vincente, 1998; Camacho et al., 2001 и др.). Количественное развитие цианобактерий в 2004 и 2005 гг. было различным. В 2004 г. они появились в заметных количествах только в августе, а в 2005 г. присутствовали уже весной, причем область их развития в летний период охватывала весь монимолимнион, вплоть до придонных слоев. Развитию Planktothrix в анаэробных зонах, видимо, способствовали такие особенности их физиологии, как способность к фотогетеротрофному росту и аноксигенному фотосинтезу (Camacho et al., 1996) и регуляция плавучести за счет газовых вакуолей.
Причины значительных межгодовых колебаний интенсивности развития популяции Planktothrix sp. не вполне ясны, т.к. условия среды в 2004 и 2005 г. различались не очень значительно. Возможно, это явление найдет свое объяснение при анализе динамики других групп организмов.
Таким образом, вертикальное распределение отдельных групп фото-трофных организмов в пруду в общих чертах сходно с другими меромиктическими озерами. Для экосистемы Нижнего пруда Самарского Ботани- ческого сада на протяжении практически всего года характерна концентрация фототрофных организмов в области хемоклина, в зоне контакта аэробной и анаэробной водных масс, и высокое таксономическое разнообразие фототрофного сообщества этой зоны.
Список литературы К вертикальному распределению прокариотического фототрофного планктона в Нижнем пруду Самарского ботанического сада
- Быкова С.В. Фауна и экология инфузорий малых водоемов Самарской Луки и Саратовского водохранилища: Автореф. дис. … канд. биол. наук. - Тольятти, 2005. - 19 с.
- Голлербах М.М., Косинская Е.К., Полянский В.И. Синезеленые водоросли / Определитель пресноводных водорослей СССР. Вып. 2. - М., Наука, 1953. - 652 с.
- Горбунов М.Ю., Быкова С.В., Уманская М.В., Жариков В.В. Роль миксотрофных простейших и аноксигенных фотосинтезирующих бактерий в фототрофном сообществе небольших стратифицированных эвтрофных озер // Материалы Межд. конф. "Первичная продукция водных экосистем". - Ярославль, 2004. - С. 18-19.
- Горбунов М.Ю., Уманская М.В. Аноксигенные фототрофные бактерии в водоемах особо охраняемых территорий Самарской области // Экологические проблемы заповедных территорий России / Под ред. С.В. Саксонова. - Тольятти: ИЭВБ РАН, 2003. - С. 136-144.
- Горбунов М.Ю., Уманская М.В., Краснова Е.С. Характеристика абиотических условий в экосистеме Нижнего пруда Ботанического Сада Самарского университета // Самарская Лука: Бюллетень, 2007. - Вып. 19-20. (наст. издание).


