К вопросу изучения скорости растворения феррита цинка методом вращающегося диска
Автор: Реутов Д.С., Крашенинин А.Г., Гаврилов А.С., Алешин Д.С.
Журнал: Вестник Южно-Уральского государственного университета. Серия: Металлургия @vestnik-susu-metallurgy
Рубрика: Физическая химия и физика металлургических систем
Статья в выпуске: 4 т.23, 2023 года.
Бесплатный доступ
Флотационная переработка отвальных медеплавильных шлаков приводит к образованию хвостов флотации, содержащих около 0,5 % меди и 4 % цинка, которые присутствуют в основных и второстепенных минеральных соединениях. Объемы накоплений в России данных отходов составляют от 120 до 140 млн т. В хвостах медь и цинк находятся в ферритах в виде отдельных минеральных фаз. Этот материал может являться сырьем для извлечения из него меди и цинка. Исследована одна из составляющих данного сырья - феррит цинка - на предмет его скорости растворения методом вращающегося диска. Для этого был синтезирован феррит цинка (ZnFe2O4) по керамической технологии. Образец был аттестован методом РФА. Полученные ферриты были спрессованы в таблетки и закреплены в обойме из фторопласта для проведения экспериментов. Изучена кинетика растворения феррита цинка в водном растворе серной кислоты в диапазоне концентрации от 7 до 300 г/дм3, при температуре 25, 45, 65 °С (298, 318, 338 К) и гидродинамическом режиме. С использованием уравнения Аррениуса была рассчитана энергии активации, а также были определены экспериментальные константы скорости. Получен вывод о кинетическом режиме растворения феррита цинка.
Феррит цинка, синтез, скорость растворения, метод вращающегося диска, водный раствор серной кислоты
Короткий адрес: https://sciup.org/147242990
IDR: 147242990 | УДК: 669.334.8 | DOI: 10.14529/met230403
Текст научной статьи К вопросу изучения скорости растворения феррита цинка методом вращающегося диска
Вводная часть
Флотационная переработка отвальных медеплавильных шлаков способствует накоплению тонкодисперсных материалов – хвостов флотации. В хвостах содержится около 0,5 % меди и 4 % цинка, которые входят в виде изоморфной примеси в основные и второстепенные минеральные соединения, а также образуют собственные минеральные фазы, в том числе ферриты.
В последние десятилетия активно ведутся исследования по переработке шлаков, содержащих медь и цинк, с использованием гидрометаллургических методов. Данные хвосты могут являться сырьем для получения концентратов меди и цинка.
Ранее методом вращающегося диска была изучена кинетика растворения минералов меди и цинка в растворах серной кислоты [1–3], в том числе в присутствии ионов Fe (III) и The Ferro-oxidans методом вращающегося диска [4].
При разработке схемы гидрометаллургической переработки хвостов флотации [5] для исследования процесса выщелачивания минеральных медь- и цинксодержащих фаз проведено экспериментальное исследование скорости растворения ферритов меди и цинка методом вращающегося диска при низких концентрациях серной кислоты (7, 15, 40 г/дм3), однако при применении этих данных для выщелачивания реального сырья не были достигнуты высокие показатели извлечения полезных металлов, но вектор извлечения показывал на необходимость повышения концентрации серной кислоты в растворителе. Для этого первоначально потребовалось уточнение кинетики при более высоких концентрациях серной кислоты до 300 г/дм3.
Для полноты картины кинетики растворения феррита цинка в водных растворах серной кислоты в данной публикации в графиках приведены ранее полученные результаты кинетических исследований при более низких концентрациях растворителя.
Методика эксперимента
Феррит цинка синтезировали по керамической технологии, которая состоит в совместном тщательном измельчении стехиометрического количества оксидов цинка и железа с последующим спеканием в муфельной печи при Т = 1100 °С и выдержкой не менее 12 ч. Монофазность полученного ZnFe 2 O 4 подтверждена рентгенофазовыми исследованиями. Изучена кинетика растворения ферритов меди и цинка в водном растворе серной кислоты при различной концентрации (7, 15, 40 г/дм3), температуре (298, 318, 338 К) и скорости перемешивания (5, 10, 15∙с–1). Некоторые особенности методики описаны в [6, 7]. Опыты проводились в течение 5 ч с отбором проб через каждые 60 мин.
Использовали лабораторную установку, которая состоит из водяной бани, перемешивающего устройства с контролем скорости вращения вала с диском, термометра и рН-метра (рис. 1). Реакционный сосуд с водным раствором серной кислоты помещали в водяную баню, температуру в которой автоматически поддерживали с точностью ±0,2 °С. По достижении заданной температуры исследуемый образец феррита помещали в реакционный сосуд, из которого по ходу процесса растворения отбирали пробы и анализировали в них содержание элементов атомно-эмиссионным методом с индукционной плазмой
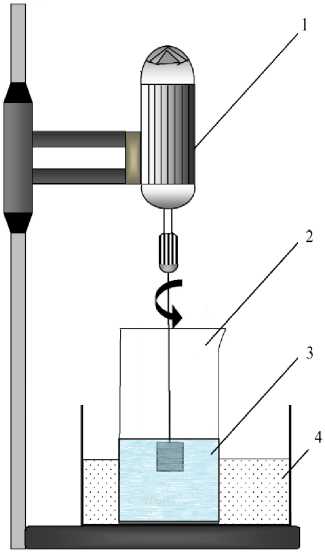
Рис. 1. Лабораторная установка: 1 – перемешивающее устройство ПЭ-8100 с блоком управления; 2 – стакан; 3 – водный раствор серной кислоты; 4 – водяная баня с терморегулятором
Fig. 1. Laboratory setup: 1 – PE-8100 mixing device with control unit; 2 – glass; 3 – aqueous solution of sulfuric acid; 4 – water bath with thermostat
(ELAN 9000, PerkinElmer, Ка н а да ) . По результатам анализа рассчитывали ск орость растворения меди и цинка.
Обработку э кс п е ри ме н т а льн ых данных проводили согласно мет од и к е обработки результатов кинетических оп ытов [8].
Растворение феррита ц ин к а в серной кислоте описывается реакцией
4H 2 SO 4 + ZnFe 2 O 4 =
= Fe 2 (SO 4 ) 3 + ZnSO 4 + 4H 2 O . (1)
Экспериментальные с к орости растворения рассчитывали по ки н ет и чес к и м кривым, выражающим зависимость коли че с тв а перешедшего в раствор цинка от п родол жи тельн ости растворения (г·мин–1) (н а п ри м е р, рис. 2). Установлено, что концентраци я цинка в растворе со временем ув е л ичи в а ет ся линейно.
Построены зависимости ск орости растворения феррита цинка от ск орости вращения диска (рис. 3) и различной конц ентр ации серной кислоты (рис. 4).
Скорость вращения дис ка изменяли от 5 до 15 с–1. Найденная з а в и с и мос ть скорости растворения феррита цинка ( v э ) от оборотов диска ( Jn ) выражается во в с е х случаях пря мой линией, проходящей ч е ре з начало коор- 38
динат (см. рис. 3), что характерно для диффузионного режима процесса растворения. Интересно, что даже при 15 оборотах диска в секунду и высокой концентрации серной кислоты не наблюдается искривления прямой, т. е. диффузионный режим, по-видимому, устойчив во всем диапазоне оборотов диска.
При изучении скорости растворения феррита цинка в концентрациях серной кислоты (7–300 г/дм3) найдено, что скорость растворения увеличивается с ростом концентрации растворителя (см. рис. 4).
При расчете экспериментальной скорости растворения феррита цинка (формула (2), табл. 1) использовали зависимости изменения концентрация цинка в растворе от времени процесса. Скорость растворения ( v , г·мин–1) численно равна тангенсу угла наклона прямой в координатах Q –τ (см. рис. 2).
v э = vI (60· A · S ), (2)
где v э – удельная скорость растворения, –2 –1 –1
моль·см ·с ; v – скорость, г·мин ; А – атомная масса элемента, г·моль–1; S – площадь поверхности образца, см2.
В связи с разрушением исследуемых образцов при высокой температуре (> 333 К) и
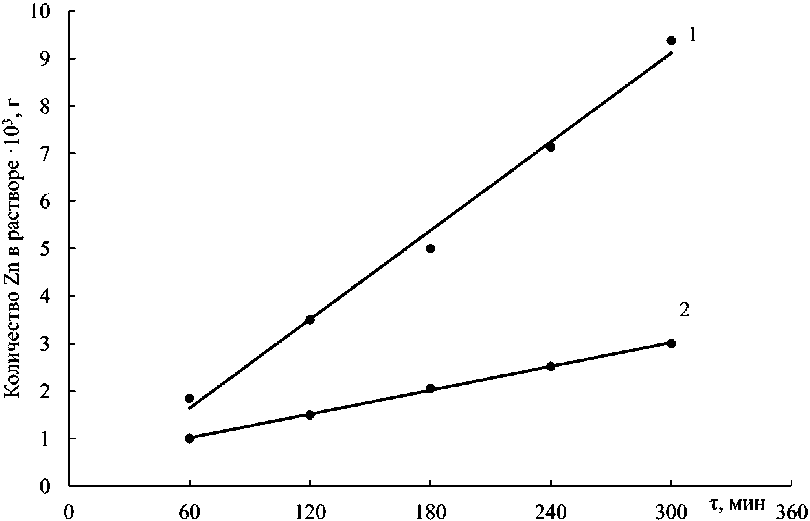
Рис. 2. Кинетические кривые растворения феррита цинка при температуре 298 К и концентрации H 2 SO 4 40 г/дм3; частота вращения диска, с–1: 1 – 5; 2 – 10 Fig. 2. Kinetic curves of zinc ferrite dissolution at a temperature of 298 K and a H 2 SO 4 concentration of 40 g/dm3; disk rotation speed, s–1: 1 – 5; 2 – 10
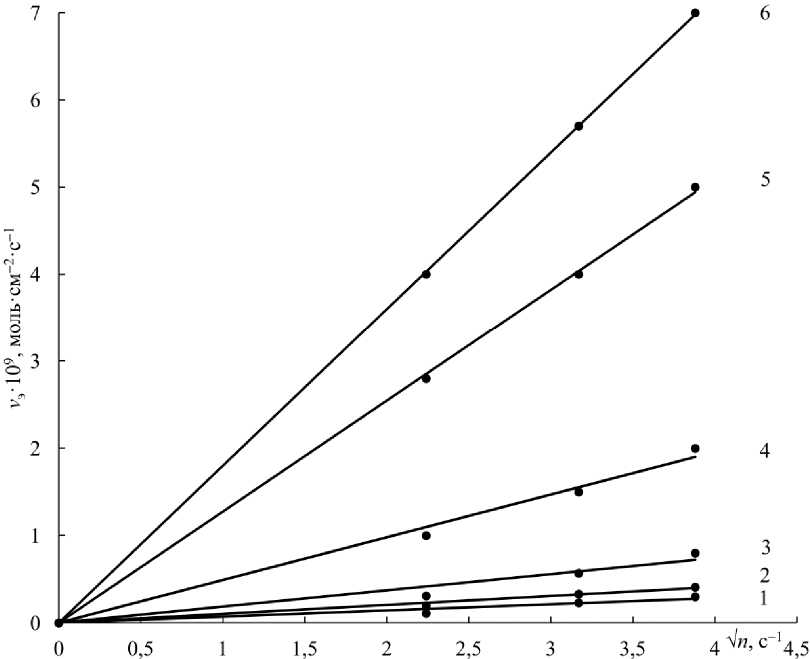
Рис. 3. Зависимость скорости растворения феррита цинка ( v э ) от оборотов диска ( V n ) при Т = 25 °С и различной концентрации серной кислоты, г/дм3: 1 – 7; 2 – 15; 3 – 40; 4 – 100; 5 – 200; 6 – 300
Fig. 3. Dependence of the dissolution rate of zinc ferrite ( vэ ) on disk revolutions ( n ) at Т = 25 °С and different concentrations of sulfuric acid, g/dm3: 1 – 7; 2 – 15; 3 – 40; 4 – 100; 5 – 200; 6 – 300
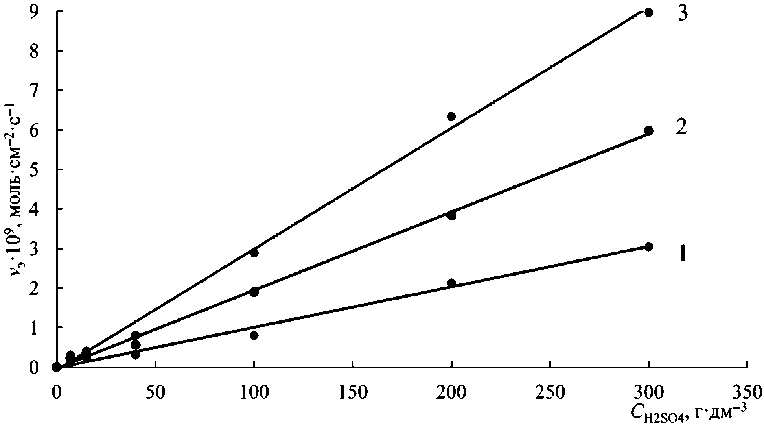
Рис. 4. Зависимость скорости растворения феррита цинка ( v э ) от концентрации серной кислоты при Т = 25 °С при различных оборотах диска, с–1: 1 – 5; 2 – 10; 3 – 15
Fig. 4. Dependence of the dissolution rate of zinc ferrite ( v э ) on the concentration of sulfuric acid at Т = 25 °С at different disk speeds, s–1: 1 – 5; 2 – 10; 3 – 15
Таблица 1
Расчет экспериментальной удельной скорости растворения феррита цинка
Table 1
Calculation of the experimental specific rate of dissolution of zinc ferrite
|
Условия эксперимента |
v ·105, –1 г·мин |
А , г·моль–1 |
Диаметр образца, см |
S , см2 |
v э ·109, моль·см–2·с–1 |
||
|
C H2SO4 , г·дм–3 |
Т , К |
n , с–1 |
|||||
|
7 |
298 |
5 |
0,16 |
65,38 |
2,2 |
3,8 |
0,11 |
|
318 |
5 |
0,79 |
0,53 |
||||
|
338 |
5 |
0,8 |
0,54 |
||||
|
298 |
10 |
0,35 |
0,23 |
||||
|
318 |
10 |
1,02 |
0,68 |
||||
|
338 |
10 |
1,1 |
0,74 |
||||
|
298 |
15 |
0,58 |
0,39 |
||||
|
318 |
15 |
1,07 |
0,72 |
||||
|
338 |
15 |
1,53 |
1,02 |
||||
|
15 |
298 |
5 |
0,35 |
0,23 |
|||
|
318 |
5 |
0,8 |
0,54 |
||||
|
338 |
5 |
0,9 |
0,6 |
||||
|
298 |
10 |
0,49 |
0,33 |
||||
|
318 |
10 |
1,3 |
0,87 |
||||
|
338 |
10 |
1,13 |
0,76 |
||||
|
298 |
15 |
0,73 |
0,49 |
||||
|
318 |
15 |
1,53 |
1,02 |
||||
|
338 |
15 |
2,07 |
1,39 |
||||
|
40 |
298 |
5 |
0,46 |
0,31 |
|||
|
318 |
5 |
1,75 |
1,17 |
||||
|
338 |
5 |
2,25 |
1,51 |
||||
|
298 |
10 |
0,85 |
0,57 |
||||
|
318 |
10 |
1,95 |
1,31 |
||||
|
338 |
10 |
2,5 |
1,68 |
||||
|
298 |
15 |
1,2 |
0,81 |
||||
|
318 |
15 |
2,4 |
1,61 |
||||
|
338 |
15 |
3,47 |
2,32 |
||||
Окончание табл. 1
Table 1 (end)
|
Условия эксперимента |
v ·105, –1 г·мин |
А , г·моль–1 |
Диаметр образца, см |
S , см2 |
v э ·109, моль·см–2·с–1 |
||
|
C H2SO4 , г·дм–3 |
Т , К |
n , с–1 |
|||||
|
100 |
298 |
5 |
0,57 |
1,5 |
1,77 |
0,81 |
|
|
298 |
10 |
1,32 |
1,9 |
||||
|
298 |
15 |
2,01 |
2,89 |
||||
|
200 |
298 |
5 |
1,48 |
2,13 |
|||
|
298 |
10 |
2,67 |
3,84 |
||||
|
298 |
15 |
4,41 |
6,34 |
||||
|
300 |
298 |
5 |
2,12 |
3,05 |
|||
|
298 |
10 |
4,15 |
5,98 |
||||
|
298 |
15 |
6,23 |
8,97 |
||||
Таблица 2
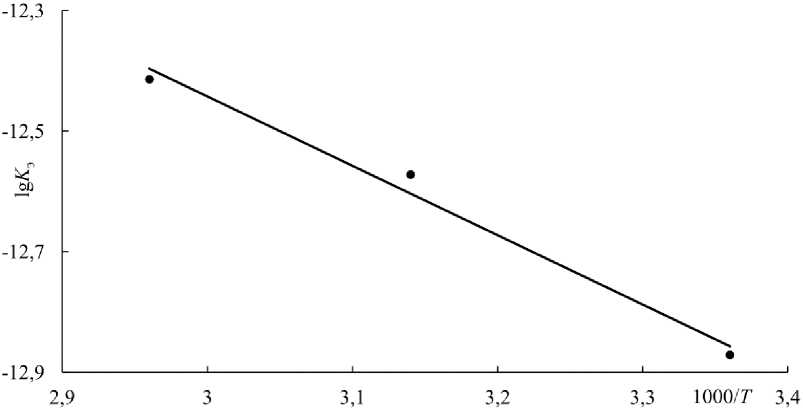
Рис. 6. Зависимость экспериментальной константы скорости ( lg K э ) от обратной температуры (1000/ Т )
Fig. 6. Dependence of the experimental rate constant ( lg K э ) on the inverse temperature (1000/ Т )
Расчет экспериментальной (кажущейся) энергии активации растворения феррита цинка
Table 2
Calculation of experimental (apparent) activation energy for dissolution of zinc ferrite
По зависимости скорости растворения феррита цинка от температуры по уравнению Аррениуса рассчитаны значения экспериментальной (кажущейся) энергии активации процесса растворения феррита цинка в водном растворе серной кислоты E a (табл. 2, рис. 6).
При расчетах приняли частоту вращения диска 15 с–1, концентрацию H 2 SO 4 40 г·дм–3.
Е а = -2,3- Л •tg ф , (3)
где Е а – кажущаяся энергия активации, кДж·моль–1; R – универсальная газовая постоянная, 8,314 Дж-моль-1трад.-1; 1д ф - численное значение тангенса угла наклона прямой зависимости lg K э –1000/ Т (см. рис. 6).
lg K э = lg ( v/ ( 5 • C • n 0,5 ) ) , (4)
где lg K э – экспериментальная константа скорости; v – экспериментальная скорость процесса, моль·см–2·с–1; С – концентрация растворителя, моль·мл–1; n – частота вращения диска, с–1.
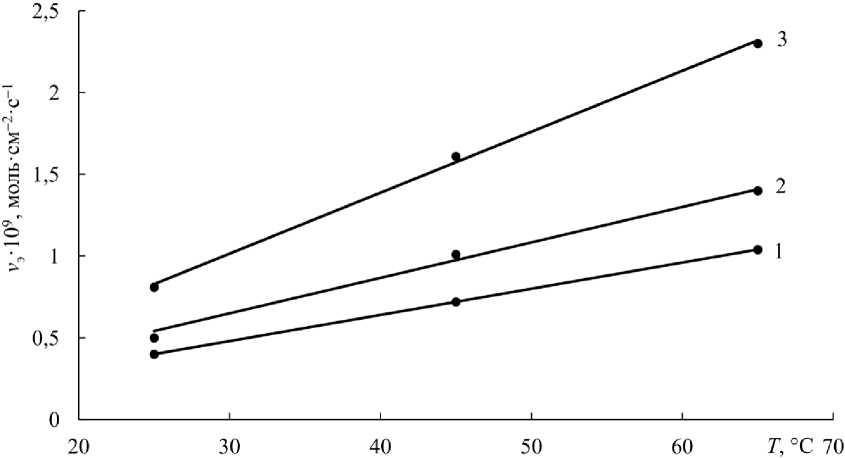
Рис. 5. Зависимость скорости растворения феррита цинка ( v э ) от температуры при n = 15 с–1 и различной С H SO , г·дм–3: 1 – 7; 2 –15; 3 – 40
Fig. 5. Dependence of the dissolution rate of zinc ferrite ( vэ ) on temperature at n = 15 s–1 and various СH SO , g·dm–3: 1 – 7; 2 –15; 3 – 40
Таблица 3
Скорость растворения феррита цинка с повышением концентрации серной кислоты, температуры и скорости вращения образца увеличивается. Экспериментальная энергия активации определена равной менее 10 кДж·моль–1 (2,39 ккал·моль–1). Из этого следует, что реакция растворения феррита цинка протекает в диффузионном режиме. Исходя из коэффициентов диффузии H 2 SO 4 и ZnSO 4 2,65 и 0,78∙10–5 см2∙с–1 соответственно, можно сделать предположение, что диффузионный про-
цесс контролируется скоростью отвода продукта реакции ZnSO 4 от поверхности диска в объем раствора. Также известно, что при увеличении концентрации цинка и железа в растворе скорость растворения феррита цинка снижается [7]. Порядок реакции по серной кислоте близок к 1 (табл. 3).
Результаты расчета экспериментальной константы скорости растворения феррита цинка по формулам (5) и (6) представлены в табл. 4.
Расчет порядка реакции растворения феррита цинка по серной кислоте, n = 15 с–1
Table 3
Calculation of the reaction order of dissolution of zinc ferrite with sulfuric acid, n = 15 s–1
|
Т , К |
C H2SO4 , г/дм3 |
v э ·109, моль·см–2·c–1 |
lg( C 2 / C 1 ) |
lg( v 2 / v 1 ) |
m |
Среднее значение m |
|
298 |
7 |
0,39 |
1,63 |
1,36 |
0,83 |
0,59 |
|
300 |
8,97 |
|||||
|
318 |
7 |
0,72 |
0,75 |
0,35 |
0,47 |
|
|
40 |
1,61 |
|||||
|
338 |
7 |
1,02 |
0,75 |
0,36 |
0,48 |
|
|
40 |
2,32 |
Таблица 4
Kэ = vэ/(SCh2so/ n 0,5),(5)
где K э – константа скорости, см·с–0,5; v э – скорость растворения феррита меди, моль∙см–2∙c–1; C H SO – концентрация растворителя, моль·дм–3;
0,5
n , – скорость вращения диска, с .
K0 = K3/exp (- Ea/ RT),(6)
где K 0 – константа скорости в кинетическом уравнении, см–2·c–0,5.
По результатам обработки опытов, проведенных в различных условиях, значения K 0 для диффузионного режима растворения феррита цинка составили (1,51 ± 0,55)·10–5 см–2·c–0,5.
Общий вид кинетического уравнения:
v = K 0 ■ C m ■ n05 ■ exp ( - E/RT ) , (7) где v – удельная скорость растворения, моль/см2·с; K 0 – константа скорости, дм3∙см–2·с–1; m – порядок реакции по раство-
Расчет экспериментальной константы скорости растворения феррита цинка
Table 4
Calculation of the experimental rate constant for the dissolution of zinc ferrite
Кинетическое уравнение процесса растворения феррита цинка:
v = 1,51 - 10 - 5 • C 1 • n 0,5 • exp ( - E/RT ) , (8)
Полученные данные о необходимости использования повышенной температуры, концентрации серной кислоты и интенсивности массообмена учтены при последующей разработке технологической схемы переработки хвостов флотации гидрометаллургическим способом.
Выводы
-
1. Растворение феррита цинка в серной кислоте протекает согласно закономерностям диффузионного режима. Экспериментальная
-
2. Растворение ферритов меди и цинка удовлетворительно описывается кинетическими уравнениями в условиях:
– температура 298–338 К;
– концентрация кислоты 7–300 г/дм3;
– частота вращения диска 5,6–9,7 рад∙с–1;
-
3. Установление режимов растворения феррита цинка позволяет выбрать направление технологических исследований по выщелачиванию хвостов флотации с повышенными температурой процесса и концентрацией серной кислоты.
энергия активации определена равной менее 8 кДж/моль. Скорость растворения феррита с повышением концентрации серной кислоты, температуры и скорости массообмена увеличивается. Среднее значение порядка реакции растворения феррита цинка по серной кислоты равно 0,59.
Список литературы К вопросу изучения скорости растворения феррита цинка методом вращающегося диска
- Изучение кинетики растворения феррита меди методом вращающегося диска / Д.С. Реутов, Б.Д. Халезов, Л.А. Овчинникова, А.С. Гаврилов // Цветные металлы. 2018. № 9. С. 29-32. DOI: 10.17580/tsm.2018.09.03 EDN: YAVFGP
- Изучение скорости растворения ферритов меди и цинка методом вращающегося диска / Д.С. Реутов, Б.Д. Халезов, Л.А. Овчинникова, А.С. Гаврилов // Бутлеровские сообщения. 2018. Т. 54. № 5. С. 56-62. EDN: XPQEGL
- Изучение кинетики растворения феррита цинка методом вращающегося диска / Д.С. Реутов, Б.Д. Халезов, Л.А. Овчинникова, А.С. Гаврилов // Цветные металлы. 2017. № 11. С. 12-15. DOI: 10.17580/tsm.2017.11.02 EDN: ZXPWEP
- Халезов Б.Д. Кучное выщелачивание медных и медно-цинковых руд. Екатеринбург: РИО УрО РАН, 2013. 332 с. EDN: YKFDEX
- К вопросу рационального использования отходов переработки медеплавильных шлаков / А.Л. Котельникова, В.Ф. Рябинин, Г.Г. Кориневская и др. // Недропользование XXI век. 2014. № 6 (50). С. 14-19. EDN: TGINEJ
- Кинетика растворения сфалерита / Б.Д. Халезов, И.А. Каковский, Ю.С Рыбаков, Е.В. Дятчина // Вопросы теории и практики геотехнологии цветных металлов: сб. науч. тр. ин-та "Гидроцветмет". Новосибирск, 1990. С. 93-102.
- Каковский И.А., Набойченко С.С. Термодинамика и кинетика гидрометаллургических процессов. Алма-Ата: Наука, 1986. 146 с.
- Набойченко С.С., Лобанов В.Г. Практикум по гидрометаллургии: учеб. пособие для вузов. М.: Металлургия, 1992. 336 с.


