К вопросу моделирования остеоартроза коленного сустава у собак для изучения патогенеза (экспериментально-морфологическое исследование)
Автор: Шевцов Владимир Иванович, Макушин Вадим Дмитриевич, Степанов Михаил Александрович, Ступина Татьяна Анатольевна
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Оригинальные статьи
Статья в выпуске: 1, 2012 года.
Бесплатный доступ
Представлены предварительные результаты экспериментального моделирования остеоартроза у собак путем иммобилиза- ции коленного сустава и пересечения бедренной артерии. Ближайшие результаты оценки морфофункционального состоя- ния суставного хряща свидетельствуют о развитии дистрофических изменений, выражающихся гибелью и деструкцией части хондроцитов, нарушением гомогенности межклеточного матрикса и снижением морфометрируемых параметров - толщины хряща, объемной и численной плотности хондроцитов. Отмеченные изменения являются следствием нарушения обменных процессов в суставном хряще, свидетельствующих о снижении синтеза и преобладании катаболических про- цессов. В данных условиях эксперимента наиболее уязвимым оказался камбий суставного хряща - промежуточная зона, клетки которой равноудалены от васкулярного и синовиального факторов питания.
Суставной хрящ, экспериментальное моделирование остеоартроза, морфология, морфометрия
Короткий адрес: https://sciup.org/142121517
IDR: 142121517
Текст научной статьи К вопросу моделирования остеоартроза коленного сустава у собак для изучения патогенеза (экспериментально-морфологическое исследование)
Под деформирующим артрозом понимают хроническое заболевание суставов дегенеративного характера с первичной дистрофией суставного хряща и последующими реактивно-дегенеративными процессами в эпифизах сочленяющихся костей. В последние годы появилась теория о том, что происходящие в субхондральной кости изменения, возможно, являются первичными и способны инициировать деградацию хряща [1]. В основе деградации хряща при остеоартрозе лежит нарушение синтетических процессов, обусловливающих снижение репарации и преобладание деградации [2].
По своей природе, деформирующий артроз — заболевание полиэтиологическое. Ведущая роль в патогенезе остеоартроза принадлежит нарушениям трофики суставного хряща. Гиалиновый хрящ аваскулярен, характеризуется диффузионным типом питания и имеет два источника кровоснабжения: первый — капилляры синовиальной оболочки, второй — капилляры субхондральной кости. Особенностью хрящевой ткани является то, что в ней относительно мало клеток, которые окружены большим количеством межклеточного матрикса. Хондроциты участвуют в регуляции синтеза и деградации компонентов хрящевого матрикса, эти процессы в норме находятся в сбалансированном состоянии. Обладая интенсивной метаболической активностью, хондроциты чрезвычайно чувствительны к нарушению кровоснабжения сустава [7, 14, 19, 20].
В настоящее время развитие дегенеративнодистрофических процессов при гонартрозе связывают с нарушением функции сустава и микроциркуляции в суставных концах с последующим развитием застойных явлений [6, 8, 10, 15 и др.].
Экспериментальное моделирование ишемии суставов путем перевязки или рассечения артерий, питающих проблемные области сустава, предпринималось издавна. Так, A. Nussbaum (1924) в экспериментальных условиях у молодой собаки, рассекая сосуды, питающие шейку бедренной кости, наблюдал структурные процессы, характеризующие дегенерацию и фрагментацию эпифиза головки [21].
Искусственно созданные сосудистые нарушения, вызывающие патологический остео- и хондрогенез, на собаках, свиньях, кроликах, крысах изучали многие исследователи [16, 17, 18, 22].
Цель исследования—на основе нарушения регионального кровоснабжения разработать модель дегенеративнодистрофических изменений в эпифизах костей коленного сустава собак и оценить морфофункциональное состояние зон суставного хряща и субхондральной кости.
МАТЕРИАЛ И МЕТОДЫ
Экспериментальное моделирование остеоартроза проводили на взрослых беспородных собаках (n = 2). Общеизвестно, что зоны гиалинового хряща коленного сустава собаки и человека сходны по расположению и строению, что важно при экстраполяции экспериментальных данных [4]. Содержание животных, оперативные вмешательства и эвтаназию осуществляли согласно приказу МЗ СССР № 755 (1977 г.).
Оперативные вмешательства проводили в условиях операционной одновременно на обоих коленных суставах экспериментальных животных. После обработки операционного поля с медиальной поверхности бедра через прямолинейный разрез мягких тканей выделяли бедренную артерию на уровне средней части бедренной кости. Артерию лигировали в двух местах и пересекали между лигатурами. Операционную рану ушивали послойно. После этого коленный сустав иммобилизировали аппаратом Илизарова, состоящим из двух дугообразных опор, соединенных шарнирными узлами с резьбовыми хвостовиками. Одна из опор располагалась в нижней трети бедра, другая — в верхней трети голени. В качестве костных фиксаторов использовали спицы Киршнера, по три на каждой опоре. После иммобилизации сустава осуществляли компрессию суставных поверхностей при помощи резьбовых стержней шарнирных узлов. На момент снятия аппарата (28 суток иммобилизации) клинически у животных наблюдалась разгибательная контрактура коленного сустава в пределах 45 градусов. Для контроля развития остеоартроза использовался рентгенологический метод. Через 28 суток после рентгенологического подтверждения развития артроза коленных суставов — сужение суставной щели, остеопороз метафиза бедра, очаговый остеосклероз субхондральной зоны (рис. 1), животных выводили из опыта.
Суставные поверхности (n = 4) оценивали макроскопически (форма, контур, цвет). Для светооптического исследования применяли парафиновые срезы, окрашенные гематоксилином и эозином, и полу-тонкие срезы, окрашенные метиленовым синим-основным фуксином. Гистоморфометрические исследования проведены по перпендикулярным суставной поверхности эпоксидным полутонким срезам большой площади (6-8 мкм2). Изображения макропрепаратов оцифровывали на аппаратнопрограммном комплексе «ДиаМорф» (Москва) и анализировали в программе «ВидеоТест-Мастер-Морфология». В качестве контроля исследовали суставной хрящ интактных собак (n = 5).
Анализ цифрового материала был проведен методами вариационной и непараметрической статистики. Достоверность различий оценивали по критерию Стьюдента и критерию Вилкоксона для независимых выборок с помощью программы AtteStat, версия 1.0 [3] в электронных таблицах Microsoft Excel 97.
б
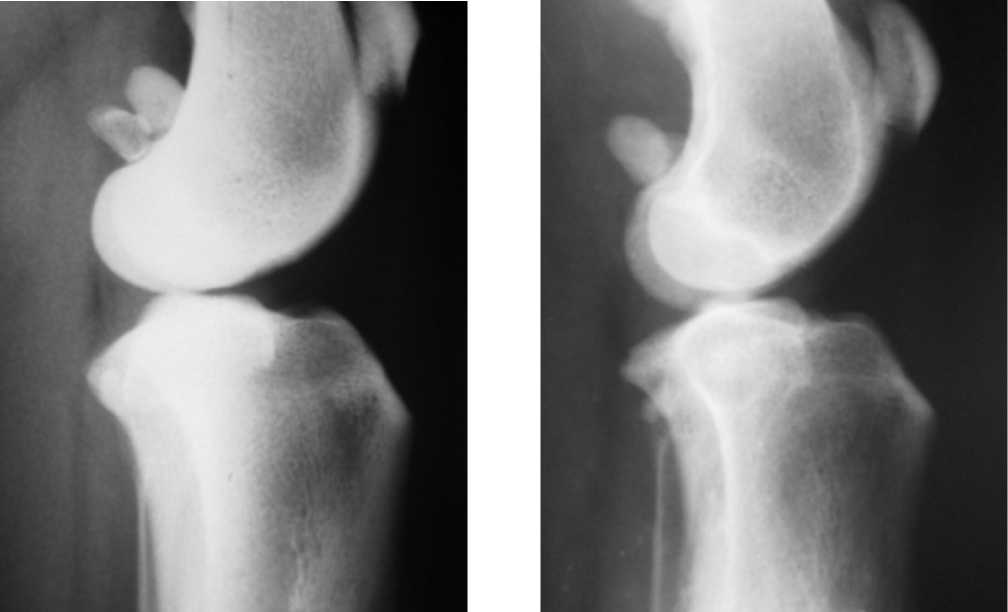
Рис. 1. Собака № 4779. Рентгенограммы коленного сустава, боковая проекция: а — до моделирования артроза; б — после создания модели деформирующего остеоартроза
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Макроскопически суставной хрящ суставов был матовый, по боковым поверхностям мыщелков истончен. Морфометрически выявлено достоверное (p < 0,001) уменьшение толщины хряща до 318,6 ± 2,7 мкм, в контроле данный параметр составлял 475,5 ± 1,3 мкм. Обнаружено достоверное (p < 0,05) снижение численной плотности клеток — 5,37± 0,3 (в контроле — 6,2± 0,56), объемная плотность хондроцитов была почти в 2 раза ниже нормы.
На полутонких срезах отчетливо снижена интенсивность окраски поверхностной зоны. Нарушена гомогенность межклеточного вещества, выявлены участки разволокнения суставной поверхности, часть хондроцитов в состоянии гибели и деструкции, наблюдалось увеличение клеточных форм с кариолизисом (рис. 2). Во всех зонах
Рис. 2. Собака № 4684, фиксация аппаратом 28 суток. Полутонкий срез, окраска метиленовым синим-основным фуксином.
Поверхностная зона. Об.40, ок. 12,5
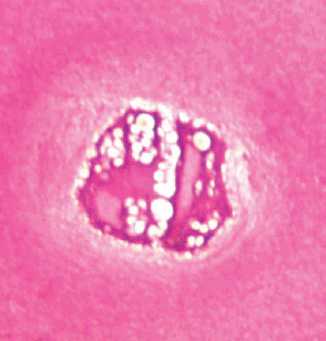
хряща резко редуцировано количество хондроцитов.
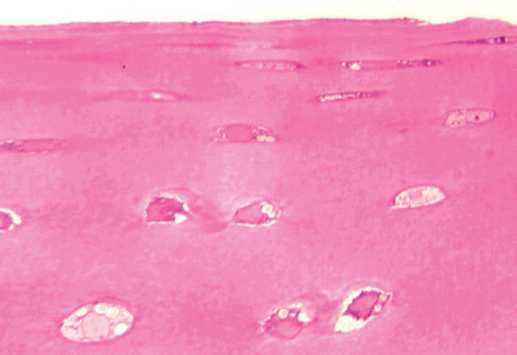
В промежуточной зоне хрящевые клетки располагались одиночно, изогенные группы отмечены единично, входящие в состав изогенных групп клетки находились на разных стадиях дегенерации (рис. 3). Основная масса хондроцитов этой зоны находилась в неактивном состоянии или в состоянии гибели и деструкции. Наблюдалось значительное количество опустошенных лакун. Процентное содержание пустых клеточных лакун составило 49,6 % от общего количества. Снижена интенсивность окраски территориального и межтерриториального матрикса.
В глубокой зоне часть хондроцитов была гипертрофированна, в них более 50 % профиля цитоплазмы было занято крупными скоплениями секреторных гранул и липидными включениями. Как и в промежуточной зоне, выявлено большое количество клеток с признаками дегенерации, пустые клеточные лакуны (рис. 4).
Были обнаружены лакуны с некротизированными клетками, клеточным детритом. Базофильная линия была неравномерно окрашена, расслоена. Выявлены участки, в которых наблюдалось увеличение толщины кальцифицированного хряща.
В субхондральной кости выявлено разрежение костных трабекул, уменьшение их толщины и увеличение межтрабекулярных промежутков (рис. 5), наблюдалась агрегация эритроцитов и «предтромбоз» кровеносных сосудов микроциркуляторного русла. В отдельных участках на границе с кальцифицированным хрящом наблюдалась активация остеобластов, которые имели интенсивно базофильную цитоплазму (рис. 6).
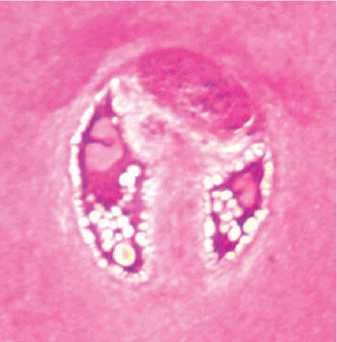
Рис. 3. Собака № 4684, фиксация аппаратом 28 суток. Полутонкий срез, окраска метиленовым синим-основным фуксином. Промежуточная зона (монтаж). Об.100, ок. 12,5
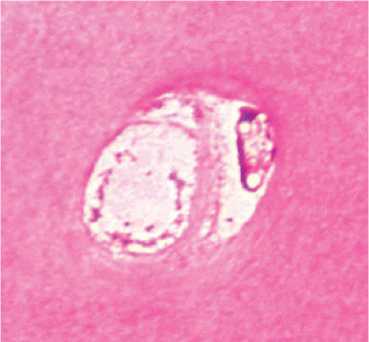
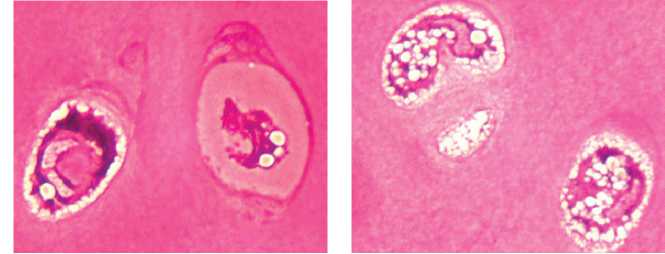
Рис. 4. Собака № 4684, фиксация аппаратом 28 суток. Полутонкий срез, окраска метиленовым синим-основным фуксином. Глубокая зона (монтаж). Об.100, ок. 12,5
Клинико-морфологическими исследованиями установлено, что остеоартроз проявляется изменениями в клетках и матриксе, которые приводят к разволокнению, изъязвлению и уменьшению толщины суставного хряща, а также к остеосклерозу с резким утолщением и уплотнением кортикального слоя субхондральной кости, формированию остеофитов и развитию субхондральных кист [5, 9]. Рядом клинических исследований подтверждено, что при остеоартрозе наблюдается увеличение скорости обеих составляющих ремоделирования костной ткани — и резорбции, и костеобразования. Преобладание какого-либо процесса зависит от стадии заболевания [1].
При данных условиях эксперимента наблюдалось разволокнение суставной поверхности, выявлены дистрофические изменения, выражающиеся гибелью и деструкцией части хондроцитов, неравномерным окрашиванием межклеточного матрикса и сопровождающиеся снижением толщины хряща. В субхондральной кости выявлено разрежение костных трабекул. Отмеченные изменения являются следствием нарушения обменных процессов (ремоделирования) суставного хряща, свидетельствующих о снижении синтеза и преобладании катаболических процессов. Известно, что при иммобилиации сустава происходит нарушение диффузионно-нагрузочного механизма снабжения его трофическими и пластическими веществами, нарушение микроциркуляции всех тканей сустава [11, 12, 13, 23]. Кроме того, в условиях эксперимента было предусмотрено создание гипоксии и ухудшение трофики субхондральной кости (пересечение бедренной артерии). Максимально дистрофические изменения были выражены в хондроцитах промежуточной зоны, которые равноудалены от васкулярного и синовиального факторов питания (около 50 % клеток в состоянии деструкции). Необходимо отметить, что в данных условиях эксперимента наиболее уязвимым оказался камбий суставного хряща, так как физиологическое самовосстановление его структуры осуществляется механизмами интерстициального роста — благодаря постоянно поддерживающейся репродукции хондроцитов в промежуточной зоне [7, 14].
Таким образом, полученная модель остеоартроза позволяет оценить морфофункциональное состояние субхондральной кости и суставного хряща и охарактеризовать его компенсаторно-приспособительные реакции в условиях нарушения регионального кровоснабжения в коленном суставе собаки. Установлено, что патологический процесс подавляет собственные регенераторные возможности суставного хряща и его восстановление невозможно без дальнейшего потенцирования внешних по отношению к хрящу механизмов.
а
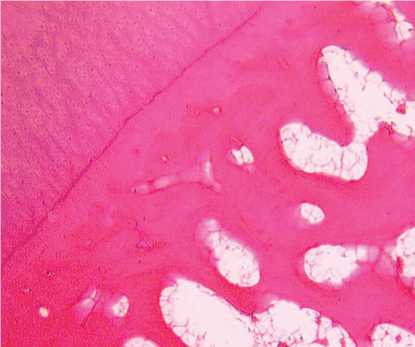
Рис. 5. Граница суставного хряща и субхондральной кости: а – контрольная серия. Собака №5009; б – опытная серия. Собака №4684, фиксация аппаратом 28 суток. Парафиновый срез, окраска, гематоксилином и эозином, ок. 12,5; об. 2,5
б
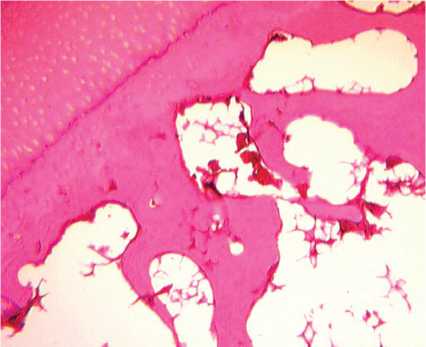
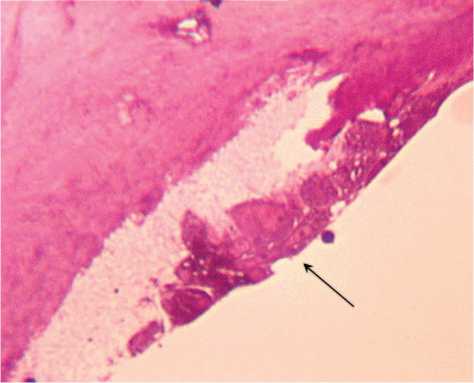
Рис. 6. Собака № 4684, фиксация аппаратом 28 суток. Полутонкий срез, окраска метиленовым синим-основным фуксином. Активированные остеобласты на границе с кальцифицированным хрящом (стрелка). Об. 40, ок. 12,5


