К вопросу о фиксации ткане-инженерных конструкций на поверхности гиалинового хряща
Автор: Жеребцова Ю.В., Трушников В.В., Нащекина Ю.А., Никонов П.О., Вчерашний Д.Б., Новосельцев С.В., Круглов В.Н.
Журнал: Вестник медицинского института "РЕАВИЗ": реабилитация, врач и здоровье @vestnik-reaviz
Рубрика: Физиология
Статья в выпуске: 6 (48), 2020 года.
Бесплатный доступ
Работа посвящена экспериментальному обоснованию методик фиксации ткане-инженерных конструкций на повержности гиалинового хряща в эксперименте.
Тканевая инженерия, экспериментальная физиология
Короткий адрес: https://sciup.org/143175583
IDR: 143175583 | УДК: 51-76:612 | DOI: 10.20340/vmi-rvz.2020.6.4
Текст научной статьи К вопросу о фиксации ткане-инженерных конструкций на поверхности гиалинового хряща
Повреждение гиалинового хряща является актуальной проблемой для миллионов пациентов. Существующая консервативная терапия не полностью решает данную задачу, а эндопротезирование крупных суставов является сложной высокоинвазивной дорогостоящей процедурой.
Одной из перспективных технологий представляется метод тканевой инженерии (ТИ), который является динамично развивающимся направлением науки [1]. Этот метод особенно актуален в травматологии и ортопедии, поскольку в этой области медицины на первое место выходят биофизические параметры трансплантированного объекта, и только во вторую очередь – характеристики его клеточной составляющей [2].
Для внедрения данной методики в клиническую практику необходима серия экспериментов по трансплантации и фиксации продукта ТИ в области повреждения с целью анализа эффективности его применения у экспериментальных животных в течение длительного времени.
Целью этой работы являлась оценка фиксации ткане-инженерной конструкции на основе полилактида (PLA) в дефектах гиалинового хряща.
Материалы и методы исследования
Приготовление биодеградируемого носителя. При изготовлении полимера в качестве основы использовали поли-L-лактид-полимер вязкостью 4.0 дл/г (Sigma, США). Полимер растворяли в диоксане («Реактив», Россия) до конечной концентрации 5 %. В этот раствор при перемешивании добавляли 5 % раствора коллагена концентрацией 0,1 мг/мл. Полученную суспензию замораживали при температуре –20 °С на 24 часа. После заморозки полученного полимера, его высушивали в лиофилизаторе при давлении 1 Торр в течение 6 часов. Далее приготовленные образцы стерилизовали в озонаторе в течение 90 мин., а непосредственно перед транс- плантацией из него получали цилиндры высотой 3,0 мм и диаметрами 3,0 и 6,0 мм.
Создание дефекта у экспериментальных животных. Исследование выполнено на 8-ми половозрелых самках кролика породы «Советская Шиншилла». Экспериментальная работа прошла все необходимые этические экспертизы и соответствовала международным рекомендациям по проведению медицинских исследований с использованием животных. Все кролики были случайным образом разделены на 2 группы (4+4).
Наружным парапателлярным способом вскрывали суставную сумку в области коленного сустава, отодвигали надколенник, обнажали мыщелки бедра. В положении сгибания коленного сустава формировали дефект в нагружаемой зоне с помощью бормашины и специально разработанного ограничителя [3] для создания повреждений заданного размера (d = 3,0 мм и d = 6,0 мм). Животным опытной группы в дефект трансплантировали полилактидный биодеградируемый носитель, в контрольной группе трансплантацию не осуществляли. Далее коленный сустав разгибали, рассасывающейся нитью 3/0 сшивали суставную сумку, окружающие ткани послойно ушивали, на кожу накладывали швы по Холстеду.
После операции животных помещали по одной особи в клетке при температуре 18–26 °C и относительной влажности 30–70 % в условиях принудительной вентиляции и искусственного освещения (по 12 часов темного и светлого времени). На седьмые сутки выполняли эвтаназию животных с помощью раствора тиопентала натрия.
Фиксация и вырезка препаратов для дальнейших гистологических исследований. С целью предотвратить разложение тканевых структур все образцы были на 72 часа помещены в 10 % забуфе-ренный формалин. После этого с помощью фрезы толщиной 0,5 мм на частоте вращения 30000 оборотов в минуту в условиях охлаждения были вырезаны фрагменты тканей. Охлаждение необходимо во избежание локального перегрева тканей в непосредственной близости от места разреза. Степерь фиксации ТИК внутри созданного повреждения гиалинового хряща оценивали визуально.
Результаты и их обсуждение
Через 7 суток с момента создания дефекта все повреждения диаметром как 3,0 мм, так и 6,0 мм, созданные на поверхности гиалинового хряща, были явно визуализированы (рис. 1). В образцах без применения полимера регенеративных изменений не отмечено в отличии от образцов с трансплантированным PLA. Полимер инте- грировался в области хирургического вмешательства только в области дефектов диаметром 3 мм. На сроке 7 суток при трансплантации полимера в область дефекта диаметром 6,0 мм он не закреплён прочно в области повреждения.
С целью уменьшения времени декальцинации, для снижения нагрева и улучшения теплоотвода была использована фреза толщиной 0,5 мм. Промежуточный этап создания таких препаратов представлен ниже на рис. 2.
В данной работе выполнено моделирование двух различных дефектов диаметрами 3,0 и 6,0 мм. В качестве экспериментального животного использовались кролики порода Шиншилла.
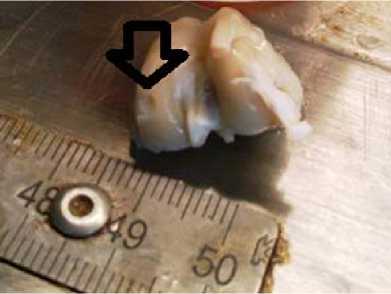
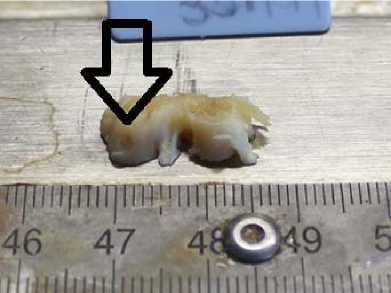
Дефект 3 мм без полимера. Визуализуется сферическое повреждение без признаков замещения дефекта регенератом
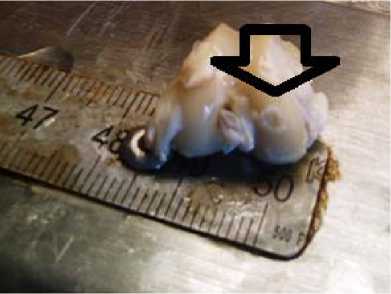
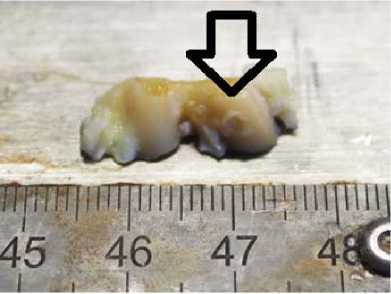
Дефект 3 мм с полимером. Область дефекта заполнена адгезированным полимерным носителем (светлый регенерат на поверхности гиалинового хряща)
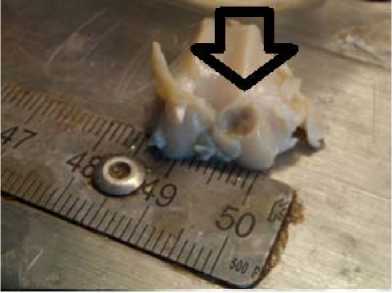
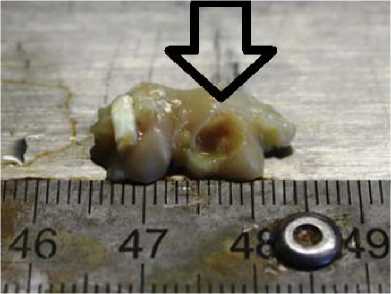
Дефект 6 мм без полимера. Визуализируется сферическое повреждение без признаков замещения дефекта регенератом
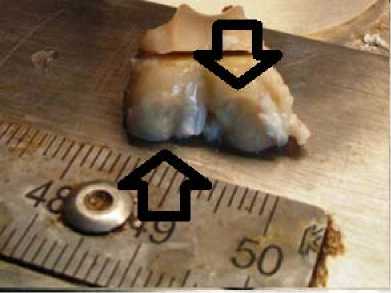
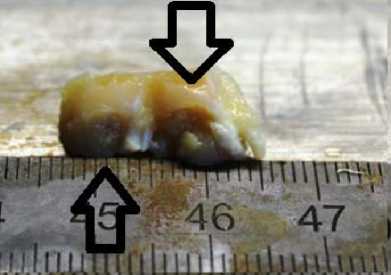
Дефект 6 мм с полимером. Область дефекта заполнена полимерным носителем, но недостаточна адгезия к зоне дефекта
Рис. 1. Фото области повреждения после 7-ми суток с момента создания дефекта
Дефект 3 мм без полимера. Визуализуется сферическое повреждение без признаков замещения дефекта регенератом
Дефект 3 мм с полимером. Область дефекта заполнена прочно адгезированным полимерным носителем (светлый регенерат на поверхности гиалинового хряща)
Дефект 6 мм без полимера. Визуализируется значительное сферическое повреждение без признаков замещения дефекта регенератом
I
Дефект 6 мм с полимером. Область дефекта заполнена полимерным носителем без достаточной адгезии к зоне дефекта
Рис. 2. Фото области повреждения после 7-ми суток с момента создания дефекта после вырезки перифокальной области дефекта
Следует обратить внимание, что помимо кролика, для эксперимента доступны мышь, крыса и овца. Мышь и крыса, в связи с доступностью, являются популярными объектами для таких исследований. Однако, геометрические размеры коленного сустава, на котором восновном и проводятся оперативные вмешательства, накладывают операционные сложности как на создание дефекта, так и анализ полученных результатов. Выбор овцы в качестве объекта для моделирования дефекта и применения ТИК наиболее предпочтителен, однако стоимость таких экспериментов значительно выше [4].
Биодеградируемым носителем являлся поли-L-лактид. В настоящее время именно
PLA является золотым стандартом для тканевой инженерии [5].
Другим важным вопросом является выбор вида, размера и формы создаваемого дефекта, а также способа фиксации ТИК конструкции на поверхности гиалинового хряща. В результате создания повреждения 6,0 мм в диаметре, граница повреждения почти достигает границ мыщелка, и велик риск получить большее повреждение в ходе операционного вмешательства. Выбор 3,0 мм в качестве диаметра повреждения позволило получить стабильные дефекты на поверхности гиалинового хряща без потери биодеградируемого носителя, в отличие от выбора дефекта в 6,0 мм, где это наблюдается.
Для создания повреждения использовано фрезерное воздействие на высоких оборотах. По мнению авторов, адгезирова-ние полилактидного носителя происходит не только за счет трения, но и за счет пролиферации клеточной культуры на границе сред (неповреждённый хрящ – полимер). Данный вопрос требует проведения дополнительных исследований. При анализе результатов на 7-е сутки наблюдения не было отмечено признаков воспалений, нагноений и (или) смертей экспериментальных животных, что согласуется с результатами, полученными другими авторами [6, 7].
После выведения животных из экспериментов, была выполнена декальцинация образцов тканей для получения гистологических срезов. С целью уменьшения зоны декальцинации было использовано фрезерное воздействие с охлаждением образцов путем периодического смачивания в растворе формалина. Область дефекта не повреждалась за счёт высокой скорости вращения фрезы и охлаждения. В результате удалось добиться снижения линейных размеров образца до 8,0 х 8,0 х 8,0 мм. Это позволило уменьшить время декальцинации до 4 недель, поскольку выведение кальция наиболее эффективно из более тонких образцов, уместить образец в стандартную гистологическую кассету для последующей проводки, одновременно сохранив зону дефекта (и регенеративных образований) для последующего анализа.
Заключение
Метод фиксации биодеградируемого носителя в области смоделированного цилиндрического поверхностного дефекта хряща коленного сустава кролика диаметром 3,0 мм является эффективным, что и было продемонстрировано в опытной группе животных.
Выводы:
-
1. Применение PLA в качестве скаф-фолда для клеточной культуры является эффективным и безопасным на экспериментальной модели поверхностного дефекта гиалинового хряща у кролика.
-
2. Использование высокооборотного фрезерного воздействия позволяет подготовить вышеописанные образцы препаратов для декальцинации и дальнейших гистологических исследований.
-
3. В проведенных экспериментах по трансплантации ТИК в область дефектов гиалинового хряща коленного сустава у кроликов оптимальным размером повреждения суставной поверхности является дефект цилиндрической формы диаметром 3,0 мм.
Список сокращений
ТИ – тканевая инженерия
ТИК – ткане-инженерная конструкция
PLA – полилактид
Список литературы К вопросу о фиксации ткане-инженерных конструкций на поверхности гиалинового хряща
- R. Langer JV. Tissue enginneging. Science (80- ). 1993;260(5110):920-926. DOI: 10.1126/science.8493529
- Божокин М., Божкова С., Нетылько Г. Возможности современных клеточных технологий для восстановления поврежденого суставного хряща (аналитический обзор литературы). Травматология и ортопедия России. Published online 2016.
- Божокин М.С., Божкова С.А. Устройство для формирования стандартизированных дефектов хрящевой поверхности суставов в эксперименте. ВАА Published online 2017.
- Nashchekina Yu., Veselova T.V., Nikonov P.O. BMI. The study of the effect of polylactide scaffold and bone marrow stromal cells on reparative bone formation of the defect in the rabbit's mandible. No Title. Hum Gene Ther. 2015;26(10):195.
- Araque-Monrós MC, García-Cruz DM, Escobar-Ivirico JL, Gil-Santos L, Monleón-Pradas M, Más-Estellés J. Regenerative and Resorbable PLA/HA Hybrid Construct for Tendon/Ligament Tissue Engineering. Ann Biomed Eng. Published online 2020. DOI: 10.1007/s10439-019-02403-0
- Nashchekina Yu., Samusenko I., Zorin I., Kukhareva L., Bilibin A. MB. Poly(D,L-lactide)/PEG blend films for keratinocyte cultivation and skin reconstructionNo Title. Biomed Mater. Published online 2019. DOI: 10.1088/1748-605X/ab3aa2
- Хоминец В.В., Михайлов С.В., Шакун Д.А., Деев Р.В., Цупкина Н.В., КомаровА Жумагазиев В.С.Е НЮА. Результаты ортотопической имплантации тканеинженерного эквивалента кости на основе полилактидного матрикса и мультипотентных мезенхимальных стромальных клеток. Вестник Российской Военно-медицинской академии. 2016;55(3):105-107.


