К вопросу о формировании полиэмбриоидов в культуре in vitro пыльников пшеницы
Автор: Сельдимирова Оксана Александровна, Галин Ильшат Рафкатович
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Биотехнология
Статья в выпуске: 5-3 т.13, 2011 года.
Бесплатный доступ
Методами световой и сканирующей электронной микроскопии получены данные, подтверждающие одноклеточное происхождение полиэмбриоидов в культуре in vitro пыльников пшеницы.
Морфогенез, культура in vitro, пыльник, полиэмбриоид, пшеница
Короткий адрес: https://sciup.org/148200442
IDR: 148200442 | УДК: 577.175.1
Текст научной статьи К вопросу о формировании полиэмбриоидов в культуре in vitro пыльников пшеницы
Метод культуры in vitro изолированных пыльников основан на использовании феномена андрок-линии (или, в другой терминологии, андрогенеза in vitro ). Андроклиния рассматривается как нетрадиционная система размножения растений, имеющая свои параллели и аналогии с другими системами размножения [2-4, 6, 10, 11, 13].
Феномен андроклинии состоит в переключении развития инициальных клеток пыльника в условиях in vitro с обычной гаметофитной программы, ведущей к образованию пыльцевого зерна, на споро-фитную программу, ведущую к образованию гаплоидного растения-регенеранта. При этом инициальные клетки реализуют свой морфогенетический потенциал различными путями морфогенеза [1, 7, 8, 10].
Установлено, что к образованию растений-регенерантов ведут два пути морфогенеза – эм-бриоидогенез (формирование эмбриоида – биполярной зародышеподобной структуры непосредственно из инициальной клетки пыльника (прямой эмбриоидогенез) или из клетки каллуса (непрямой эмбриоидогенез)) и гемморизогенез (сопряженное формирование в каллусе почек и корней) [7, 8, 10, 13].
Биотехнологически оптимальным путем регенерации растений считается прямой эмбриоидогенез, так как он не связан со сложным многоступенчатым процессом морфогенеза через каллус, требующим трудоемкой процедуры пересадок, и предполагает работу с генетически однородным материалом [3, 5, 10, 12].
Основная проблема получения гаплоидов посредством эмбриоидогенеза в культуре in vitro изолированных пыльников – низкий выход растений-регенерантов. Один из способов решения этой проблемы – индукция образования особого типа эмбриоидов, для которых характерно формирование в их апикальной части множественных точек роста. Как полагают Cistue et al . [16], что получение таких эмбриоидов позволит увеличить количество растений-регенерантов.
Однако возникает вопрос о происхождении таких эмбриоидов – формируются ли они каждый из
отдельных инициальных клеток пыльника или же образуются в результате слияния нескольких эмбриоидов, сходных по строению с зиготическими зародышами. Этот вопрос имеет принципиальное значение. Действительно, если такие эмбриоиды имеют одноклеточное происхождение, то все полученные растения-регенеранты будут представлять собой клоны. Если же такие эмбриоиды формируются в результате слияния нескольких эмбриоидов, подобных зиготическим зародышам, особенно на ранних этапах развития, возникает риск получения химерных растений-регенерантов.
В литературных источниках имеются только единичные упоминания о формировании такого типа эмбриоидов андроклинного происхождения [3, 14-18, 21, 22] и полностью отсутствуют данные об их генезисе. В то же время изучение генезиса полиэмбриоидов имеет несомненное практическое значение, поскольку при условии одноклеточного происхождения полиэмбриоидов предоставляется возможность значительно увеличить количество дигаплоидных растений-регенерантов, являющихся клонами исходных родительских форм, обладающих хозяйственно-ценными признаками.
Следует отметить, что термин, касающийся названия таких эмбриоидов, отсутствует. Некоторые авторы называют их зародышеподобными структурами [18;19,20], другие – эмбриоидами или каллусами [17]. Мы предлагаем называть эмбриоиды такого типа полиэмбриоидами.
Целью исследования был вопрос о происхождении полиэмбриоидов.
МАТЕРИАЛ И МЕТОДЫ
Объектом исследования послужил сорт яровой мягкой пшеницы Жница, характеризующийся высокой частотой образования in vitro андроклинных структур и интенсивно использующийся в селекционной практике Башкирского НИИ СХ РАСХН. Морфологические и цито-гистологические особенности формирования полиэмбриоидов изучали методами световой (СМ) (µVizo-103, ЛОМО ФОТОНИКА, г. Санкт-Петербург) и сканирующей электронной микроскопии (СЭМ) (JSM 35, Jeol, Japan и JSM-6390, Jeol, Japan, на базе БИН РАН, г. Санкт-Петербург).
Следует отметить, что изучение развития мик-роспориальных эмбриоидов в условиях in vitro со- пряжено с рядом трудностей методического харак-
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
тера, связанных, в первую очередь, со сложностью ориентации объектов при приготовлении срезов из-за их мелких размеров (особенно на ранних стадиях), частых отклонений в форме, а также отсутствия маркеров типа рубчика семени, имеющихся у зиготического зародыша. Существенную помощь в этом вопросе оказывает метод сканирующей электронной микроскопии, еще недостаточно широко используемый в исследованиях такого рода, но позволяющий получить точное представление о пространственной организации эмбриоидов в динамике их развития.
Последующий цито-гистологический анализ тех же эмбриоидов дает информацию о тонких деталях их строения в динамике развития, позволяя совместить объемное поверхностное изображение объекта с его внутренним строением.
Ранее [9, 13] было установлено, что инициальная клетка андроклинии – сильновакуолизирован-ная микроспора. В результате воздействия низкими положительными температурами in situ сильнова-куолизированные микроспоры отрываются от стенки пыльника, теряют свою полярную организацию и приобретают типичную «звездчатую» структуру. На 3-е сут от момента инокуляции пыльников на индукционную среду in vitro в таких деполяризованных микроспорах отмечены равные (симметричные) митотические деления с образованием сначала двух равных ядер, а затем двух равных клеток.
Согласно полученным нами данным, на 9-е сут от начала культивирования in vitro в результате дальнейших равных делений обеих образовавшихся клеток формируются четырехклеточный (рис. 1), а на 11-е сут – многоклеточный полиэмбриоид (рис. 2).
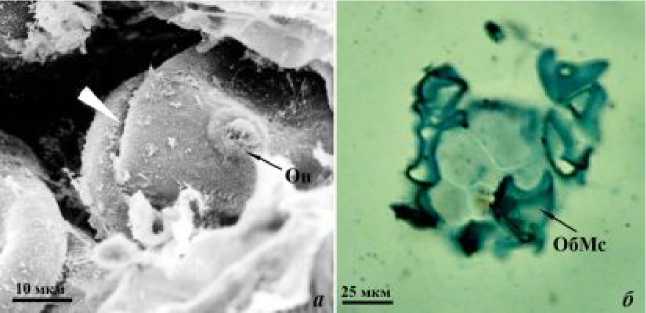
Рис. 1. Четырехклеточный полиэмбриоид (9-е сут культивирования пыльников in vitro ). а – СЭМ; б – СМ, постоянный препарат. Условные обозначения: Оп – оперкулум, ОбМс – оболочка микроспоры
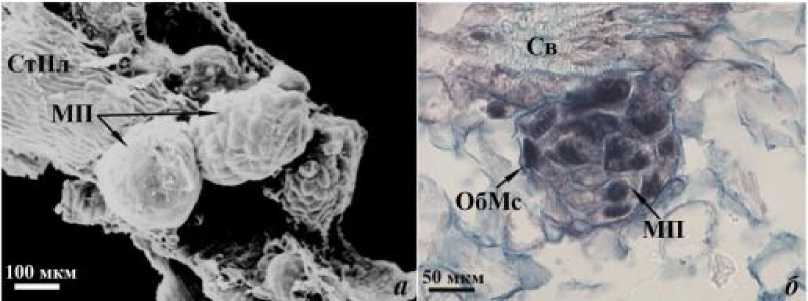
Рис. 2. Многоклеточный полиэмбриоид (11-е сут культивирования пыльников in vitro ). а – СЭМ; б – СМ, постоянный препарат. Условные обозначения: МП – многоклеточный полиэмбриоид, ОбМс – оболочка микроспоры, Св – связник, СтПл – стенка пыльника.
Все клетки полиэмбриоида на начальных этапах развития сходны по размерам и структуре (рис. 1б, 2б), а сам полиэмбриоид имеет глобулярную форму (рис. 1а, 2а).
Снаружи полиэмбриоиды окружены общей утолщенной оболочкой, наружная часть которой представляет собой оболочку микроспоры (рис. 1, 2).
В дальнейшем интенсивный рост полиэмбриоидов приводит к растяжению и механическому разрыву сначала оболочки микроспоры, а затем и стенки гнезда пыльника. На 21-24 сут культивирования in vitro полиэмбриоид появляется на поверхности пыльника.
Проведенный нами детальный анализ морфогенеза полиэмбриоидов в динамике развития позволил установить, что эти структуры, так же как и эмбриоиды, сходные по строению с зиготическими зародышами, имеют одноклеточное происхождение.
Такой вывод основан на следующих данных. Инициальными клетками и в том, и в другом случае являются сильновакуолизированные микроспоры. Дальнейшие деления приводят к формированию глобулярных многоклеточных структур. На начальных этапах развития такие многоклеточные структуры окружены единой оболочкой материнской микроспоры. Одноклеточное происхождение полиэмбриоидов также подтверждается развитием их сосудистой системы, которая с самого начала развивается как единое целое, объединяя все органы развивающегося полиэмбриоида, что было бы невозможным в случае формирования полиэмбриоидов как результата срастания нескольких эмбриоидов.
Работа выполнена при поддержке РФФИ (грант № 08-04-97045) и поддержана программой «Ведущие научные школы РФ» (грант № НШ 7637.2010.4, лидер Школы – член-корр. РАН Т.Б. Батыгина, БИН РАН, Санкт-Петербург).
Список литературы К вопросу о формировании полиэмбриоидов в культуре in vitro пыльников пшеницы
- Батыгина Т.Б., Васильева В.Е., Маметьева Т.Б. Проблемы морфогенеза in vivo и in vitro (эмбриоидогенез у покрытосеменных)//Ботан. журн. 1978. Т. 63. № 1. С. 87-111.
- Горбунова В.Ю. Андрогенез in vitro у яровой мягкой пшеницы: Автореф. дис.... д-ра биол. наук. СПб., 2000. 48 с.
- Горбунова В.Ю. Генетические предпосылки спорофитного пути развития микроспор злаков в условиях in vitro. Уфа, 1993. 101 с.
- Круглова Н.Н. Унификация терминологии при разработке инновационной биотехнологии андроклинной гаплоидии in vitro//Физиология и биохимия культурных растений. 2009. Т. 41. № 6. С. 476-486.
- Круглова Н.Н. Инновационная биотехнология андроклинной гаплоидии яровой мягкой пшеницы//Аграрная Россия. 2009. № 1. С. 34-39.
- Круглова Н.Н. Микроспора злаков как модельная система для изучения путей морфогенеза: Автореф. дис. … д-ра биол. наук. СПб., 2002. 48 с.
- Круглова Н.Н., Горбунова В.Ю. Каллусогенез как путь морфогенеза в культуре изолированных пыльников злаков//Успехи современной биологии. 1997. Т. 117. Вып. 1. С. 83-94.
- Круглова Н.Н., Горбунова В.Ю., Батыгина Т.Б. Эмбриоидогенез как путь морфогенеза в культуре изолированных пыльников злаков//Успехи современной биологии. 1995. T. 115. Bып. 6. С. 692-705.
- Круглова Н.Н., Куксо П.А. Инициальная клетка андроклинии//Физиология и биохимия культурных растений. 2006. Т. 38. № 3. С. 279-291.
- От микроспоры -к сорту/Т.Б. Батыгина, Н.Н. Круглова, В.Ю. Горбунова, Г.Е. Титова, О.А. Сельдимирова. М.: Наука, 2010. 175 с.
- Суханов В.М. Андроклиния и ее особенности у пшеницы: Автореф. дис. … канд. биол. наук. Саратов, 1983. 24 с.
- Хохлов С.С. Общие вопросы гаплоидии//Гаплоидия и селекция. М.: Наука, 1976. С. 5-14.
- Эмбриологические основы андроклинии пшеницы/Н.Н. Круглова, Т.Б. Батыгина, В.Ю. Горбунова, Г.Е. Титова, О.А. Сельдимирова. М.: Наука, 2005. 99 с.
- Aulinger I. E., Peter S. O., Schmid J. E., Stamp P. Gametic embryos of maize as a target for biolistic transformation: comparison to immature zygotic embryos//Plant Cell Repts. 2003. V. 21. № 6. Р. 123-129.
- Brisibe E.A., Gajdosova A., Olesen A., Andersen S.B. Cytodifferentiation and transformation of embryogenic callus lines derived from anther culture of wheat//J. Exp. Bot. 2000. V. 51. № 343. Р. 365-370.
- Cistue L., Soriano M., Castillo A.M. et al. Production of doubled haploids in durum wheat (Triticum turgidum L.) through isolated microspore culture//Plant Cell Rep. 2006. V. 25. № 6. P. 193-199.
- Dogramaci-Altuntepe M., Peterson T.S., Jauhar P.P. Anther culture-derived regenerants of durum wheat and their cytological characterization//J. Hered. 2001. V. 92. № 1. Р. 461-467.
- Guzman M., Zapata-Arias F.J. Increasing anther culture efficiency in rice (Oryza sativa L.) using anthers from ratooned plants//Plant Sci. 2000. V. 151. № 2. Р. 771-777.
- Hänsch K.-T., Seyring M., Schütze K. Histologische Analyse der somatischen Embryogenese bei Pfingstrosen. http://www.pflanzenbiotechnologie.de/veranstaltungen/workshop-gentechnik-und-somatische-embryogenese/abstracts
- Heß D. Biotechnologie der Pflanzen. Stuttgart,1992. 432 S.
- Konieczny R., Czaplicki A.Z., Golczyk H., Przywara L. Two pathways of plant regeneration in wheat anther culture//Plant Cell, Tiss. Org. Cult. 2003. V. 73. № 2. P. 861-867.
- Wei Z., Qiang F., Xigang D., Manzhu B. The culture of isolated microspores of ornamental kale (Brassica oleracea var. acephala) and the importance of genotype to embryo regeneration//Sci. Hort. 2008. V. 117. № 1. Р. 542-547.


