К вопросу о механизмах повреждения эндотелия кровеносных сосудов при ангиоинвазивном мукормикозе на фоне сахарного диабета
Автор: Смирнов А.В., Сасин А.Н., Ермилов В.В., Поплавский А.Э., Чернецкий О.А., Гуров Д.Ю., Самусев Р.П., Замараев В.С., Быхалов Л.С.
Журнал: Волгоградский научно-медицинский журнал @bulletin-volgmed
Статья в выпуске: 1 т.21, 2024 года.
Бесплатный доступ
Проблема микозов во время пандемии COVID-19 приобрела особое значение и остается актуальной по сегодняшний день. От 7 до 14 % пациентов с COVID-19 имеют сахарный диабет в качестве основного сопутствующего заболевания. Развитию мукормикоза у пациентов с COVID-19 способствуют применение глюкокортикостероидных препаратов, угнетающих иммунитет и повышающих уровень глюкозы в крови, декомпенсация сахарного диабета, эндотелиальная дисфункция, возраст (>65 лет), артериальная гипертензия. Представлено 2 наблюдения COVID-19-ассоциированного мукормикоза у пациентов с длительным плохо контролируемым сахарным диабетом II типа. При морфологическом исследовании в обоих случаях обнаружены несептированные ленточные гифы разного диаметра, ветвящиеся преимущественно под прямым углом. Следует предполагать, что возможными механизмами развития эндотелиальной дисфункции, приводящей к образованию тромбов, являются ангиопатические изменения вследствие сахарного диабета, прямое цитопатическое действие вируса SARS-CoV2, цитокиновый шторм, оксидативный стресс и продукты жизнедеятельности гриба. Тромбоз, в свою очередь, приводит к некрозу тканей и деструкции костей.
Коморбидная патология, сахарный диабет, мукормикоз
Короткий адрес: https://sciup.org/142242046
IDR: 142242046 | УДК: 616.1/.9
Текст научной статьи К вопросу о механизмах повреждения эндотелия кровеносных сосудов при ангиоинвазивном мукормикозе на фоне сахарного диабета
Сахарный диабет (СД) – хроническое заболевание, характеризующееся гипергликемией и приводящее к значительному нарушению обмена веществ и тяжелым осложнениям. Частота развития СД и смертность ежегодно растет. Более 10 % летальных исходов у людей с СД связаны с инфекционными заболеваниями. Было показано, что от 7 до 14 % пациентов с COVID-19 имеют СД в качестве основного сопутствующего заболевания [1]. В последнее время появилось множество сообщений о высокой распространенности инвазивных микозов как осложнений COVID-19 [1, 2].
Мукормикоз – заболевание, вызываемое условно-патогенными грибами, наиболее частыми возбудителями мукормикоза являются представители семейства Mucoraceae . В последние годы заболеваемость мукормикозом во всем мире возросла [1]. Представители му-кормикоза имеют несептированные ленточные широкие гифы разного диаметра, ветвящиеся преимущественно под прямым углом и обладающие выраженной способностью к ангиоинвазии [2]. Данный вид грибов способствует развитию эндотелиальной дисфункции, воспалительной реакции, которая может привести к гнойному артерииту, тромбозу и прогрессирующему некрозу тканей [1, 3, 4]. Основные клинические формы мукормикоза: синоназальная, риноцеребральная, риноорбитальная, легочная, гастроинтестинальная, кожная и диссеминированная. Риноцеребральный и риноорби-тальный мукормикозы значительно чаще встречались у пациентов с СД [1, 5–8]. Основные причины, способствующие развитию мукорми-коза у пациентов с СД и COVID-19, – это гипоксия, гипергликемия, метаболический ацидоз, а также снижение фагоцитарной активности лейкоцитов из-за иммуносупрессии, вызванной приемом глюкокортикостероидов (ГКС) [7]. Носоглотка является входными воротами для возбудителей мукормикоза. Инвазия гриба сопровождается повреждением носа и близлежащих тканей (пазух, костей и тканей черепа, головного мозга). Мукормикоз имеет высокие показатели смертности (70–95 %) в первую очередь из-за поздней диагностики.
ЦЕЛЬ РАБОТЫ
Представление и клинико-морфологическая характеристика 2 случаев COVID-19-ассоции-рованного ангиоинвазивного мукормикоза на фоне СД II типа с анализом возможных механизмов развития данной патологии и повреждения эндотелия кровеносных сосудов.
МЕТОДИКА ИССЛЕДОВАНИЯ
Описано 2 клинических случая COVID-19 ассоциированного ангиоинвазивного мукормико-за у пациентов с длительным плохо контролируемым СД II типа. Проанализированы медицинская документация и материалы прижизненного микробиологического и патологоанатомических исследований. Фиксация полученного материала, а также изготовление парафиновых блоков и гистологических микропрепаратов с окраской гематоксилином и эозином и ШИК-реакцией проводились по стандартной методике. Последующее изучение выполнено под световым микроскопом Axio Imager. A2 с фотодокументированием с помощью цифровой фото/видеокамеры AxioCam 305 color.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
У обоих пациентов отмечался длительный плохоконтролируемый СД II типа с кетоацидозом (в первом случае кетоацитоз подтвержден лабораторно, во втором случае присутствовал высокий риск развития кетоацидоза, так как больная отмечала подъемы уровня глюкозы крови выше 20 ммоль/л). Женщины проходили лечение в инфекционном стационаре по поводу COVID-19, включая длительную и высокодоз-ную терапию ГКС.
В первом случае был выявлен риноцере-бральный мукормикоз (подтверждено микробиологически) с летальным исходом (79 лет), во втором случае – риноорбитальная форма мукормикоза (61 год).
При патологоанатомическом исследовании в первом случае макроскопически в слизистой оболочке носовой полости и твердого нёба обнаружены язвенно-некротические участки черного цвета. В левой подглазничной и скуловой областях обнаружены два некротических очага черного цвета, границы четкие, края сухие, на разрезе плотной суховатой консистенции – язвенно-некротический очаг бледно сероватокрасного цвета. В головном мозге на разрезах определяются очаги некроза (инфаркты головного мозга) белесовато-розового цвета, кашицеобразной консистенции, без четких границ, западающие на поверхности разреза. В просветах церебральных артерий определяются красные обтурирующие тромбы.
Во втором случае у пациентки в подглазничной области справа отмечалась отечнось кожи, конъюктивы, экзофтальм и гнойное отделяемое из глаза. В правом общем носовом ходе и наружном слуховом проходе обнаруживалось гнойно-слизистое отделяемое, перфорация барабанной перепонки.
В первом случае при исследовании микропрепаратов в головном мозге отмечались участки некроза с дегенеративными изменениями нейронов, очаги просветления, гематоксилиновые шары, очаговые диапедезные кровоизлияния, эритроцитарные стазы, смешанные тромбы в сосудах микроциркуляторного русла
(МЦР), умеренно выраженная воспалительная инфильтрация полиморфно-ядерными лейкоцитами стенки сосуда с деструкцией эндотелия (рис. 1, 2), периваскулярно были выявлены широкие ленточные гифы несептированного мицелия, при окраске с использованием ШИК-реакции в стенке артерии головного мозга обнаружены структуры несептированного мицелия во всех оболочках сосуда, в просвете сосуда смешанный тромб, адгезированный к интиме, в котором определяются гифы гриба (рис. 3). Кроме того, в межклеточном веществе стенок артерий, эластических мембранах и цитоплазме гладкомышечных клеток обнаружен ШИК-позитивный материал (углеводы, гликопротеиды, мукополисахариды).
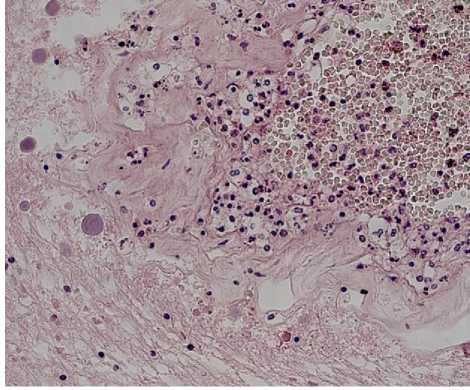
Рис. 1. Пациент № 1. Ткань головного мозга с наличием гематоксилиновых шаров, выраженным отеком и формированием микрокист. Фибриноидный некроз оболочек мозговой артерии с деструкцией эндотелия и формированием смешанного тромба. Окраска гематоксилином и эозином. Увеличение ×400
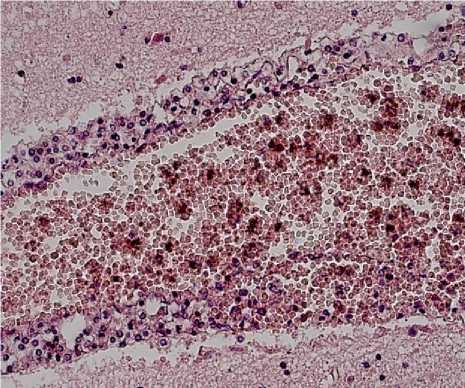
Рис. 2. Пациент № 1. Ткань головного мозга с периваскулярным отеком. Деструкция и умеренно выраженная воспалительная инфильтрация полиморфно-ядерными лейкоцитами стенки сосуда головного мозга с формированием смешанного тромба. Окраска гематоксилином и эозином. Увеличение ×400
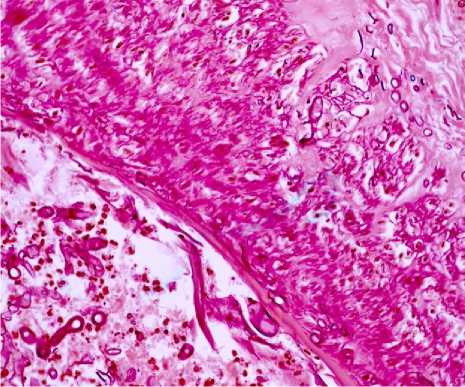
Рис. 3. Пациент № 1. Стенка сосуда с наличием несептированного мицелия в оболочках и просвете, деструкция эндотелия, структурные элементы смешанного тромба. ШИК-реакция. Увеличение ×400
В обоих случаях при микроскопическом исследовании слизистой оболочки носовой полости обнаруживаются широкие ленточные нити несептированного мицелия, часть из которых ветвится под прямым углом, некоторые гифы заканчиваются округлыми спорами (рис. 4), в просвете сосуда – смешанный тромб, в котором также определяются широкие лентовидные, не имеющие перегородок гифы, что подтверждает выраженную ангиотропность гриба и его способность к ангиоинвазии, приводящей к тромбозу с некрозом окружающих тканей [2].
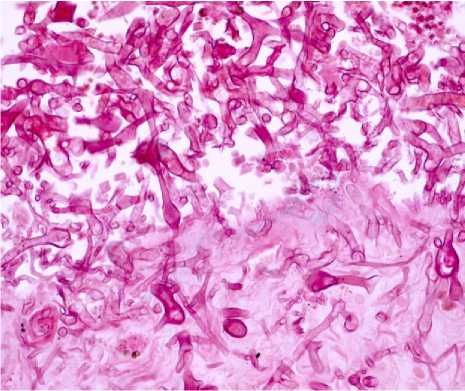
Рис. 4. Пациент № 1. Широкие лентовидные, не имеющие перегородок и ветвящиеся преимущественно под прямым углом гифы гриба в слизистой оболочке носовой полости. ШИК-реакция. Увеличение ×400
По нашему мнению, большую роль в патогенезе ангиоинвазии грибов играют морфофункциональные изменения в интиме сосудов, возникающие при СД (микроангиопатия), вызванные конечными продуктами гликирования, активными формами кислорода и оксида азота [1, 5], эндотелиальная дисфункция, развивающаяся за счет прямого цитопатического воздействия вируса SARS-CoV-2 на эндотелий, помимо этого, вирус повреждает эритроциты и, в следствие образования ферритина, происходит более выраженное повреждение внутренней оболочки сосудов микроциркуляторного русла, которое усугубляется действием оксида-тивного стресса, вазопатических влияний про-воспалительных цитокинов (цитокиновый шторм). Все вышеперечисленные механизмы способствуют ангиоинвазии гриба, продукты жизнедеятельности которого также повреждают сосудистую стенку, активации коагуляционного каскада с развитием коагулопатии и тромбоза в сосудах разного диаметра [5, 9, 10].
В обоих случаях тромбоз играл важнейшую роль в патогенезе повреждения тканей (головного мозга, глаза, слизистой носовой полости и костных структур). Важно отметить, что тромбоз возникал на фоне антикоагулянтной терапии, и это говорит о том, что, во-первых, при лечении данных состояний следует использовать большие дозы антикоагулянтов, а во-вторых, осуществлять тщательный мониторинг свертывающей и противосвертывающей систем крови, в особенности – Д-димера, который у данных больных определялся нерегулярно. Деструкция костной ткани, отмеченная в обоих случаях, развивается, по нашему мнению, в результате тромбоза, тромбоэмболии, микробной эмболии сосудов МЦР.
ЗАКЛЮЧЕНИЕ
Таким образом, у пациентов имелись предпосылки для развития микотической инфекции помимо плохо компенсированного СД, способствующего развитию иммунодефицитных состояний, COVID-19, лечение которого проводилось значительными дозами ГКС, что также могло обеспечивать угнетение иммунитета и рефрак-терность гипергликемии к терапии.
К факторам повреждения эндотелия сосудов у данных больных стоит отнести пожилой и старческий возраст больных и эссенциальную артериальную гипертензию.
Повреждение эндотелия сосудов и развитие васкулита при COVID-19 и СД возникает в результате влияния комплекса факторов атерогенной природы, ангиопатических изменений вследствие СД, вызванных конечными продуктами гликирования, кетоновыми телами, за счет влияния оксидативного стресса [1, 5], цитокино-вого воздействия, прямого цитопатического действия вируса SARS-CoV-2 на внутреннюю стенку сосуда [5, 9, 10], что способствует тромбозу, ангиоинвазии гриба и формированию микробных эмболов и, как следствие, некрозу.
Для ранней диагностики мукормикоза необходимо проводить скрининг пациентов, имеющих факторы риска развития иммунодефицитного состояния и эндотелиальной дисфункции, так как риск неблагоприятных исходов при запущенных случаях высок. Для своевременной диагностики и терапии микозов требуется высокая клиническая настороженность, что будет способствовать снижению развития осложнений и смертности от данной коморбидной патологии.
Список литературы К вопросу о механизмах повреждения эндотелия кровеносных сосудов при ангиоинвазивном мукормикозе на фоне сахарного диабета
- Morales-Franco B., Nava-Villalba M., Medina-Guerrero E. O. et al. Host-Pathogen Molecular Factors Contribute to the Pathogenesis of Rhizopus spp. in Diabetes Mellitus. Current tropical medicine reports. 2021;8(1):6-17. EDN: OMIJVK
- Ермилов В. В., Смирнов А. В., Дорофеев Н. А. и др. COVID-19-ассоциированный мукормикоз в офтальмологической практике Волгоградского региона. Архив патологии. 2022;84(5):43-49. EDN: TIKDME
- Scharf E. L., Cloft H. J., Wijdicks E. Mucor Thrombus. Neurocrit Care. 2016;24(2):268-272. EDN: PQCIKC
- Ochiai H., Iseda T., Miyahara S. et al. Rhino-cerebral mucormycosis-case report. Neurologia Medico-Chirurgica. 1993;33(6):373-376.
- Ozbek L., Topgu U., Manay M. et al. COVID-19-associated mucormycosis: a systematic review and meta-analysis of 958 cases. Clinical Microbiology and Infection. 2023;29(6):722-731. EDN: PZFJGC
- Tayabali K., Pothiwalla H., Narayanan S. Epidemiology of COVID-19-Associated Mucormycosis. Current Fungal Infection Reports. 2023;1-20.
- Gupta A., Kayarat B., Gupta N. COVID-19 associated Mucormycosis (CAM): Implications for perioperative physicians - A narrative review. Saudi J Anaesth. 2023;17(1):58-64. EDN: EQQBJQ
- Monroig V., Tarquinio K. M. Diabetic ketoacidosis and coronavirus disease 2019-associated mucormycosis: a case report. Journal of Medical Case Report. 2022;16(1 ):400.
- Пархоменко Ю. Г., Смирнов А. В., Быхалов Л. С. и др. Патоморфологические особенности поражения органов при коронавирусной инфекции, вызванной SARS-COV-2. Волгоградский научно-медицинский журнал. 2020;(2):52-57. EDN: PHFNWN
- Смирнов А. В., Бисинбекова А. И., Григорьева Н. В. и др. Патологическая анатомия коронавирусной инфекции в современных условиях. Волгоградский научно-медицинский журнал. 2021;(4):5-11. EDN: ZWUHKY


