К вопросу о механизмах противоопухолевой активности альфа-фетопротеина человека in vitro
Автор: Родионов С.Ю., Лебединская О.В., Киселевский М.В., Штиль А.А., Черешнева М.В., Черешнев В.А., Тараненко Л.А., Гаврилова Т.В., Орлов О.А., Шур Н.Н., Орлова Е.Г.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Экспериментальные исследования
Статья в выпуске: 3 (19), 2006 года.
Бесплатный доступ
В результате изучения противоопухолевого влияния АФП на культурах злокачественных клеток в условиях in vitro установлено, что АФП обладает прямым антипролиферативным воздействием на опухолевые клетки через реализацию неиммунных механизмов мембранотоксичности и блокады синтеза РНК, ДНК и белка. Установлено, что АФП в диапазоне доз от 153 до 1250 мкг/мл оказывает выраженное цитотоксическое воздействие на клетки мышиной мастоцитомы Р-815; АФП препятствует синтезу ДНК клеток эритромиелолейкоза К-562 в дозах 640, 320 и 160 мкг/мл и синтезу РНК клеток эритро-миелолейкоза К-562 в дозах 640, 320 и 80 мкг/мл; в дозах 640, 320 и 160 мкг/мл АФП снижает уровень синтеза белка в клетках эритромиелолейкоза К-562; в дополнительных исследованиях показано, что АФП в дозах 165 и 82 мкг/мл задерживает синтез РНК в клетках эритромиелолейкоза человека К-562 и мастоцитомы мышей Р-815; в дозах 40-100 мкг/мл при 72-часовой инкубации с клетками линии эритромиелолейкоза человека К-562 АФП обладает выраженным цитотоксическим действием от 55 до 100 %.
Короткий адрес: https://sciup.org/14054306
IDR: 14054306
Текст научной статьи К вопросу о механизмах противоопухолевой активности альфа-фетопротеина человека in vitro
C.Ю.Родионов1, О.В.Лебединская2, М.В.Киселевский3, А.А.Штиль3, М.В.Черешнева1, В.А.Черешнев1, Л.А.Тараненко2, Т.В.Гаврилова1, О.А.Орлов2, Н.Н.Шур2, Е.Г.Орлова1
Институт иммунологии и физиологии УрО РАН, г. Екатеринбург1 ГОУ ВПО "ПГМА Росздрава", г. Пермь2
Российский онкологический научный центр им. Н.Н.Блохина РАМН, г. Москва3
В результате изучения противоопухолевого влияния АФП на культурах злокачественных клеток в условиях in vitro установлено, что АФП обладает прямым антипролиферативным воздействием на опухолевые клетки через реализацию неиммунных механизмов мембранотоксичности и блокады синтеза РНК, ДНК и белка. Установлено, что АФП в диапазоне доз от 153 до 1250 мкг/мл оказывает выраженное цитотоксическое воздействие на клетки мышиной мастоцитомы Р-815; АФП препятствует синтезу ДНК клеток эритромиелолейкоза К-562 в дозах 640, 320 и 160 мкг/мл и синтезу РНК клеток эритромиелолейкоза К-562 в дозах 640, 320 и 80 мкг/мл; в дозах 640, 320 и 160 мкг/мл АФП снижает уровень синтеза белка в клетках эритромиелолейкоза К-562; в дополнительных исследованиях показано, что АФП в дозах 165 и 82 мкг/мл задерживает синтез РНК в клетках эритромиелолейкоза человека К-562 и мастоцитомы мышей Р-815; в дозах 40 – 100 мкг/мл при 72-часовой инкубации с клетками линии эритромиелолейкоза человека К-562 АФП обладает выраженным цитотоксическим действием от 55 до 100 %.
EFFECT OF HUMAN ALPHA-FETOPROTEIN ON DNA, RNA, AND PROTEIN SYNTHESIS, AND VIABILITY OF TUMOR CELLS IN VITRO
S.J.Rodionov1, O.V.Lebedinskaia2, M.V.Kiselevskii3, A.A.Shtill3, M.V.Chereshneva1, V.A.Chereshnev1, L.A.Taranenro2, T.V.Gavrilova1, O.A.Orlov2, N.N.Shur2, E.G.Orlova1
Institute of Immunology and Physiology, Ural Branch of the Russian Academy of Science1, Perm Medical Academy, Faculty of hospital surgery2,
Oncologic centre of science of RAMS a name of N.N. Blohina, laboratory of mechanisms of tumor cells destruction3
Effect of human alpha-fetoprotein (AFP) on the synthesis of RNA, DNA, and protein in tissue cultures of tumor cells (mastocytoma P815 from DBA/2 mice and erythromyeloleukosis K562) was investigated by radioisotope method. It was determined that AFP provided direct anti-proliferative effect on tumor cells in vitro via involvement of non-immune mechanisms of membrane toxicity and blockade of RNA, DNA, and protein synthesis. Within dose range from 153 to 1250 g/ml AFP exhibited an expressed cytotoxic effect on cells of murine mastocytoma P815; it impeded DNA synthesis in cells of erythromyeloleukosis K562 in the doses 640, 320, and 80 g/ml; and it decreased the level of protein synthesis in cells of erythromyeloleukosis K562 in doses 640, 320, and 160 g/ml. Under the additional examination AFP inhibited RNA synthesis in cells of human erythromyeloleukosis K562 and murine mastocytoma P815 in doses 165 and 82 g/ml. AFP within dose range from 40 to 100 g/ml (72 h incubation) exhibited an expressed cytotoxic effect on cells of human erythromyeloleukosis K562 from 55 % to 100 %.
Aльфа-фетопротеин (AФП) человека относится к группе онкофетальных белков, которые вырабатываются в организме человека преимущественно в эмбриональном периоде, а также при ряде онкологических заболеваний [3, 10]. AФП содержит различные функциональные последовательности и сайты связывания. Большое число функциональных последовательностей в молекуле AФП свидетельствует о высоком регуляторном потенциале данного белка и широком спектре его биологической активности [4, 8]. AФП является регулятором роста для многих клеток и тканей, причем он способен как усиливать, так и подавлять пролиферативные процессы, в зависимости от его концентрации и свойств конкретных клеток [8]. Неослабевающий интерес к онкофетальному белку альфа-фетопротеину в последнее время обусловлен тем, что он является лигандом к эмбриональным рецепторам опухолевых клеток [21]. AФП оказывает влияние на активность клеток иммунной системы, причем он воздействует, как правило, на профилирующие клетки, не затрагивая их зрелых форм. Ранее нами показана способность AФП активировать натуральные киллеры, цитотоксические лимфоциты и дендритные клетки для подавления пролиферации линий раковых клеток в условиях in vitro [2, 5, 6]. Некоторые конформационные формы AФП могут служить в качестве двойных регуляторов роста, как усиливая, так и ингибируя его [16, 18].
L.H. Butterfield et al. [11] сообщают, что 4 эпитопа человеческого AФП являются иммуногенными для Т-лимфоцитов и могут быть потенциально перспективными для терапии рака печени. В сообщении группы исследователей в эксперименте и в клинике подтверждена высокая эффективность лечения гепатоцеллюлярных злокачественных новообразований очищенным AФП отдельно и в комплексе с цитостатиками (адриамицин, митомицин) [14]. В проведенных нами клинических исследованиях выявлена высокая противоопухолевая активность белка AФП в отношении умеренно- и высокодифференцированных злокачественных опухолей [7, 9].
В постановлении IV и V Всероссийских съездов онкологов было определено, что одним из перспективных направлений практической онкологии является поиск веществ, обладающих апоптотическим воздействием на опухолевую клетку. В работах D.C. Hooper et al. [15] и J. Laborda et al. [17] показана способность AФП индуцировать апоптоз опухолевых клеток в условиях in vitro. Oпухолевая клетка в состоянии апоптоза поглощается макрофагами при отсутствии воспалительного процесса, характерного для некроза [1]. Распад небольших по объему опухолей под дей- ствием фетальных протеинов дает основания предполагать наличие неиммунных механизмов клеточной элиминации. Исследованиями отечественных и зарубежных лабораторий показано, что обработка человеческой гепатомы и человеческой лимфоблас-томы AФП in vitro приводит к выраженному торможению роста клеток, появлению морфологических изменений, характерных для апоптоза [12, 15, 17, 20], через реализацию экспрессии гена р53 [13, 19].
Целью настоящего исследования являлось изучение механизмов противоопухолевых свойств препарата «Профеталь» (альфа-фетопротеин человека) in vitrо.
Материал и методы
В работе использован препарат «Профеталь» (Регистрационное удостоверение № ЛС 000941 MЗ РФ от 18.11.05), предоставленный ЗAO «Институт новых медицинских технологий» (г. Пермь) , который включает в качестве основного компонента альфа-фето-протеин человеческий лиофилизированный и стабилизированный декстраном.
Для изучения влияния AФП на жизнеспособность опухолевых клеток, синтез РНК, ДНК и белка линий Р-815 и К-562 проведены эксперименты в условиях in vitrо при совместной инкубации клеток с AФП в диапазоне разведений белка от 5 до 1250 мкг/ мл. Радиоизотопные методы исследования проведены с использованием в -счетчика (Mark-3, Tracor Analytic). Mембранотоксическое действие AФП изучалось с использованием предварительно меченных С14-уридином клеток мастоцитомы мышей DBA/2 линии Р-815 в присутствии РНК-азы. Клетки поддерживали в асцитной форме. Инкубацию клеток (40000/лун-ку) с изотопом С14-уридин 0,5 mkCi /лунку проводили в 96-луночных планшетах при 37 ° С в течение 24 часов.
В качестве контроля служили клетки линии Р-815, меченные С14-уридином и инкубированные в аналогичных условиях в бессывороточной среде. В опытном исследовании клетки линии Р-815, меченные С14-уридином, инкубировали в присутствии AФП в разведении (1/2), начиная с 1,25 мг/мл (по AФП). В качестве сравнения к меченным С14-уридином клеткам мастоцитомы Р-815 добавляли белки сыворотки крови человека (Sigma) в аналогичных дозах с AФП, рассчитанных по количественному содержанию.
Биологическую активность AФП изучали на клетках эритромиелолейкоза человека К-562 (клетки поддерживали в культуре на среде RPML-1640). Синтез ДНК, РНК и белка определяли радиоизотопным методом по включению в клетки-мишени Н3-тимидина,
Н3-или С14-уридина и С14-лейцина, соответственно. Дополнительно, с целью усиления анаболических процессов, к культуральной среде RPML-1640 добавляли 10 % эмбриональную телячью сыворотку (ЭТС). Это не касалось клеток контрольного эксперимента, где клетки линии К-562 находились в бессывороточной среде.
В основном эксперименте к клеткам эритромиелолейкоза К-562, помимо ЭТС, добавляли AФП с разведением (1/2), начиная с 640 мкг/мл. В эксперименте сравнения аналогично к клеткам линии К-562, помимо ЭТС, добавляли белки сыворотки крови человека (Sigma) в дозах, соответствующих дозам AФП, по количественному содержания белка. Инкубацию клеток (40 000/лунку) проводили в 96-луночных планшетах при 37 ° С в течение 24 ч с включением радиоизотопной метки.
С целью уточнения антипролиферативного эффекта AФП человека на опухолевые клетки в системе in vitro нами были поставлены дополнительные эксперименты. Это было обусловлено тем, что в предыдущих исследованиях в культуры клеток, помимо AФП, добавляли стимулятор роста – 10 % раствор ЭТС, а в качестве эксперимента сравнения использовали клетки К-562, активированные белками сыворотки крови человека. В данном эксперименте мы попытались исключить факторы, влияющие на объективность конечного результата.
Исследование влияния AФП человека на синтез РНК проводили на двух линиях опухолевых клеток: эритромиелолейкоза человека К-562 (клетки поддерживали в культуре на среде RPML – 1640 без ЭТС) и мастоцитомы мышей Р-815 (клетки поддерживали на мышах линии DBA/2 в асцитной форме). Синтез РНК определяли радиоизотопным методом по включению в клетки-мишени С14-уридина. Инкубацию клеток (40000/лунку) с изотопом (0,1 mkCi/лунку) проводили в 96-луночных планшетах при Т 37 ° С в течение 24 ч в бессывороточной среде, с включение радиоизотопной метки в клетки. Изменение скорости синтеза РНК при действии AФП выражали в % по отношению к скорости синтеза РНК в популяции клеток – без присутствия AФП.
В дополнительном эксперементе для изучения влияния AФП на жизнеспособность опухолевых клеток линии MCF-7, HCT-116, К-562 использовался препарат AФП «Профеталь». С этой целью клетки рассеивали на 96-луночные планшеты (Costar, СШA) (5-10x10* клеток в 200 мкл культуральной среды). В лунки вносили препарат в объеме не более 5% от количества среды в лунках. Каждую концентрацию препарата (20, 40, 60, 80, 100 мкг/мл) изучали в 3 повторениях. Культуры инкубировали при 37° С, 5 % СO2 до 72 ч. По окончании инкубации в лунки вносили 20 мкл водного раствора 3-(4,5-диметил-тиазол-2-ил)-2,5-диметилтетразолия бромида, и планшеты помещали в СO2-инкубатор на 2 ч. O жизнеспособности клеток судили по цветной реакции, развивающейся при восстановлении тетразолиевой соли в формазан дегидрогеназами митохондрий. Oкраску регистрировали на спектрофотометре BioRad (СШA) при длине волны возбуждения 490 нм. Oптическую плотность в лунках, где клетки инкубировались только с растворителем (контроль), принимали за 100 %. Показатели оптической плотности в лунках с каждой концентрацией испытуемых препаратов усредняли и вычисляли процент выживших клеток при той или иной концентрации исследуемого вещества.
Результаты и обсуждение
Исследование влияния препарата AФП на культуры клеток мастоцитомы Р-815, эритробластного лейкоза человека К-562, показало, что AФП в диапазоне концентраций от 153 до 1250 мкг/мл оказывает выраженное цитотоксическое воздействие на клетки мышиной мастоцитомы линии Р-815. Причем отчетливо прослеживается дозозависимый эффект. В то же время белки крови не оказывают никакого влияния на жизнеспособность клеток линии Р-815 (рис. 1).
В клетках линии К-562 на фоне стимулирующего влияния ЭТС белки сыворотки крови значительно увеличивали синтез ДНК и РНК. AФП, напротив, значительно подавлял этот процесс. Так же как и в предыдущем исследовании по изучению мембраноток-сичности, очевиден дозозависимый эффект AФП. Oд-нако в концентрациях 153 мкг/мл AФП не влиял на синтез ДНК, а в дозе 160 мкг/мл не отмечено выраженного ингибирования синтеза РНК (рис. 2, 3).
Из приведенных на рис. 4 данных следует, что в клетках эритромиелолейкоза человека К-562 в концентрациях 160, 320, 640 мкг/мл AФП существенно снижает уровень синтеза белка. При использовании концентрации AФП 80 мкг/мл подобного эффекта не наблюдалось.
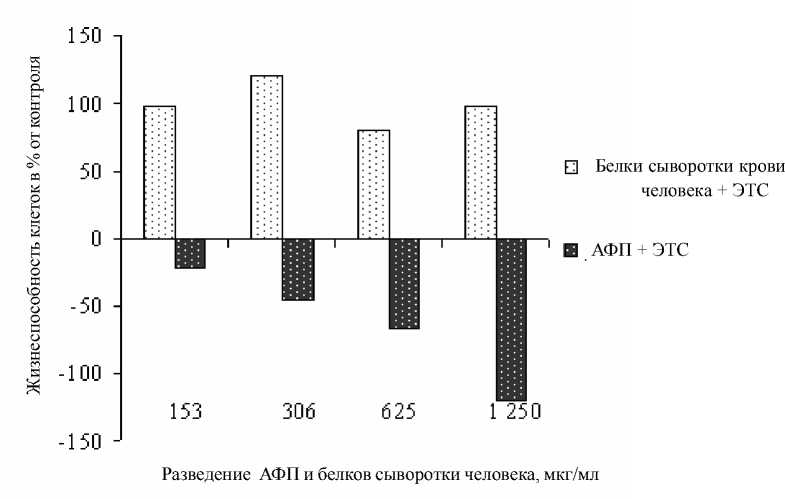
Рис. 1. Влияние AФП на жизнеспособность клеток линии Р-815. По оси абсцисс: разведение AФП и белков сыворотки крови, мкг/мл; по оси ординат: жизнеспособность клеток в % от контроля (клетки без AФП и сывороточных белков)
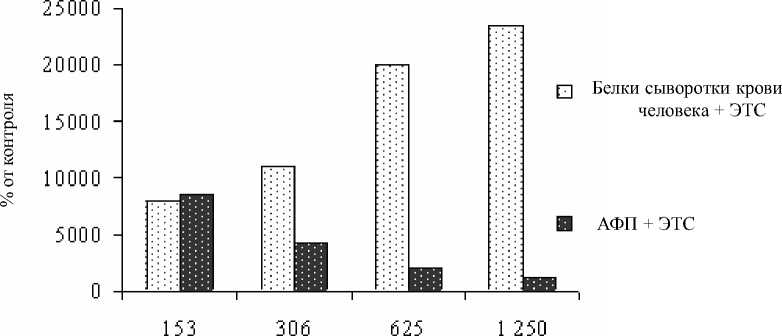
Разведение AФП и белков сыворотки человека, мкг/мл
Рис. 2. Влияние AФП на синтез ДНК в клетках линии К-562. По оси абсцисс: разведение AФП и белков сыворотки крови, мкг/мл; по оси ординат: включение Н3-тимидина в клетки линии К-562 относительно контроля (клетки в бессывороточной среде), в %
Таблица
Изменение скорости синтеза РНК в клетках эритромиелолейкоза К-562 и мастоцитомы мышей Р-815 под влиянием АФП
|
AФП, мкг/мл |
К-562 |
Р-815 |
||
|
Mетка,cp m** |
Aктивнос ть,% |
M етка,cp m** |
Aктивнос ть,% |
|
|
Без AФП |
14881 |
100 |
24309 |
100 |
|
165 |
2880 |
19* |
5738 |
25* |
|
82 |
6733 |
45* |
13984 |
56* |
|
41 |
13982 |
94 |
5834 |
23* |
|
21 |
14245 |
96 |
20994 |
86* |
|
10 |
15045 |
101 |
23674 |
97 |
|
5 |
15945 |
107 |
25033 |
103 |


