К вопросу о механизмах возникновения оксидативного стресса в эритроцитах организма-опухоленосителя
Автор: Генинг Татьяна Петровна, Федотова Антонина Юрьевна, Долгова Динара Ришатовна, Абакумова Татьяна Владимировна, Антонеева Инна Ивановна, Воронова Ольга Сергеевна
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Медико-биологические науки
Статья в выпуске: 3, 2017 года.
Бесплатный доступ
Считается установленным факт, что развитие неоплазмы в организме сопровождается активацией перекисного окисления липидов и изменением активности ферментативного звена в эритроцитах циркулирующей крови. Развитие окислительного стресса рассматривается как накопление в эритроцитах промежуточных продуктов в результате действия опухоли на организм. Таким образом, активация свободнорадикального окисления является типовым эфферентным звеном в реализации системного действия опухоли на организм. Единого мнения относительно активности ферментов антиоксидантной системы и их роли в развитии окислительного стресса в динамике развития неоплазмы не наблюдается. Цель - оценить роль ферментативного звена антиоксидантной системы и системы глутатиона в возникновении окислительного стресса в эритроцитах крыс с перевиваемой асцитной опухолью яичников. Материалы и методы. Работа выполнена на эритроцитах беспородных белых крыс с перевиваемой асцитной опухолью яичников в стационарную и терминальную фазы роста опухоли. В гемолизате эритроцитов определяли биохимически уровень малонового диальдегида, диеновых конъюгатов, кетодиенов, шиффовых оснований, активность глутатионредуктазы, глутатион-S-трансферазы, глутатионпероксидазы, уровень восстановленного и окисленного глутатиона. Результаты. Установлено значимое по сравнению с контролем повышение уровней малонового диальдегида и диеновых конъюгатов, а также активности супероксиддисмутазы, каталазы и глутатион^трансферазы. Активность глутатионпероксидазы, уровень восстановленного глутатиона и отношение восстановленного и окисленного глутатиона были снижены. Заключение. Полученные данные позволяют предполагать истощение пула восстановленного глу-татиона в эритроцитах крыс-опухоленосителей в результате снижения его образования и повышения активности глутатион^трансферазы на фоне усиления перекисного окисления липидов.
Эритроциты, перекисное окисление, антиоксидантная система
Короткий адрес: https://sciup.org/14113286
IDR: 14113286 | УДК: 612.111:616-006 | DOI: 10.23648/UMBJ.2017.27.7082
Текст научной статьи К вопросу о механизмах возникновения оксидативного стресса в эритроцитах организма-опухоленосителя
Введение. Считается установленным, что развитие неоплазмы в организме сопровождается нарушением морфофункционального состояния эритроцитов циркулирующей крови [1]. В частности, имеет место активация перекисного окисления липидов (ПОЛ) и изменение активности ферментативного звена антиоксидантной системы (АОС), что характери- зует ситуацию оксидативного стресса (ОС) [2]. При этом в качестве основного фактора, определяющего развитие ОС, рассматривается накопление в эритроцитах промежуточных продуктов ПОЛ (диеновых конъюгатов (ДК) и малонового диальдегида (МДА)) в результате системного действия опухоли на организм [3– 5]. Таким образом, активация свободноради- кального окисления является типовым эфферентным звеном в реализации системного действия опухоли на организм. Единого мнения относительно активности ферментов АОС и их роли в развитии ОС в динамике развития неоплазмы на сегодня не существует [6–10].
Цель исследования. Оценка роли ферментативного звена АОС и системы глутатиона в возникновении ОС в эритроцитах крыс с перевиваемой асцитной опухолью яичников (АОЯ).
Материалы и методы. Работа выполнена на белых беспородных крысах массой 180–200 г с перевиваемой АОЯ (штамм РЯ, РОНЦ им. Н.Н. Блохина, г. Москва) в стационарную (n=22) и терминальную (n=22) фазы роста опухоли. Контрольную группу составили здоровые половозрелые крысы (n=24). Все животные содержались в стандартных условиях вивария при естественном освещении и свободном доступе к воде и корму. Работа проводилась в соответствии с Правилами проведения работ и использования экспериментальных животных, утвержденными Приказом МЗ СССР № 755 от 12 августа 1977 г., положениями Хельсинкской декларации Всемирной медицинской ассоциации от 1964 г., дополненной в 1975, 1983 и 1989 гг., а также требованиями этического комитета Института медицины, экологии и физической культуры Ульяновского государственного университета. Животных умерщвляли путем декапитации под эфирным наркозом.
Для оценки продуктов ПОЛ в гемолизате эритроцитов (1:10) оценивали уровень ДК – при Е 232/220 нм , кетодиенов (КД) – при Е 278/220 нм , шиффовых оснований (ШО) – при Е 400/220 нм по методу И.А. Волчегорского [11]. Содержание МДА определяли в тесте с тиобарби-туровой кислотой по методу Л.И. Андреевой [12]. Для оценки ферментативного звена АОС изучали активность супероксиддисму-тазы (СОД) по методу M. Nishikimi [13], каталазы, глутатион-S-трансферазы (ГТ) и глутатионпероксидазы (ГПО) по методу А.И. Карпищенко [14]. Активность глутати-онредуктазы (ГР) устанавливали по методу В.С. Асатиани [15]. Уровень восстановленного (GSH) и окисленного глутатиона (GSSG) определяли по методу G.L. Ellman [16]. Активность ферментов и количество продуктов ПОЛ пересчитывали на 1 г гемоглобина.
Статистическую обработку полученных результатов проводили с использованием непараметрического критерия Манна–Уитни (Stata 6.0) и стандартных пакетов Microsoft Excel 2007. Различия считали статистически значимыми при p≤0,05.
Результаты и обсуждение. В результате проведенных исследований нами установлено значимое по сравнению с контролем повышение МДА и ДК. Изменение уровней КД и ШО в эритроцитах крыс в динамике развития АОЯ не было статистически значимым (рис. 1).
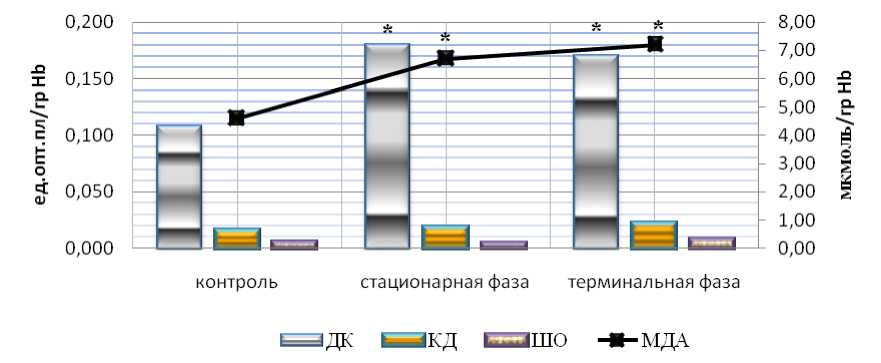
Рис. 1. Содержание продуктов ПОЛ в эритроцитах крыс с АОЯ.
* – данные, достоверно отличающиеся от аналогичных данных в контроле (р≤0,05)
Таким образом, полученные нами данные по параметрам ПОЛ в эритроцитах крыс с АОЯ укладываются в концепцию Н.П. Чесноковой с соавт. [9] и позволяют предполагать, что накопление в эритроцитах промежуточных продуктов ПОЛ (ДК и МДА) является следствием системного действия опухоли на организм.
Несколько иная ситуация имеет место при оценке активности в эритроцитах ферментативного звена АОС.
Рассмотрим схему образования и обезвреживания активных форм кислорода (АФК) в эритроцитах (рис. 2):
Глюкоза
Глюкозо-6-фосфат
Гликолиз глюкозо-6-фосфат
| N 6-фосфоглюконат
Глицеральдегид-З-фосфат
NAD+ NADH+H*
Г люкозо-6-фосфат
.метгемоглобин
ADPH+H"
NADP
Глюкозо-6-фосфа дегидрогеназа
GSSG
2GSH лутатион-редуктаза
1,3-Фосфоглицерат
редуктазная система
2,3 -бифосфоглицерат

HbFe2 оксиНЬ
HbFe3+ метНЬ
ИНгО /'Глутатион пероксидаза
3-фосфоглицерат
М1 АТР ЛаЮгат
Рис. 2. Образование и обезвреживание АФК в эритроцитах [17]
-
1. Источником супероксидного аниона (О2-) в эритроцитах является спонтанное окиcление Fe2+ в геме Hb. И поскольку кислорода в эритроцитах много, то скорость образования О 2 -, Н 2 О 2 и ОН- высокая;
-
2. СОД превращает О 2 - в Н 2 О 2 и О 2 .
-
3. Н 2 О 2 расщепляется каталазой или ГПО.
-
4. ГР восстанавливает GSSG.
-
5. На окислительном этапе пентозофос-фатного пути превращения глюкозы образуется NADPH, необходимый для восстановления глутатиона.
-
6. В глицеральдегидфосфатдегидроге-назной реакции гликолиза образуется NADH, участвующий в восстановлении железа мет-гемоглобинредуктазной системой.
Hb (Fe2+) ē + O 2 O 2 - Н 2 О 2 Н 2 О + OH-
ē, 2H+
MetHb (Fe3+)
Нами установлено повышение активности СОД и каталазы по сравнению с контролем в стационарную и терминальную фазы роста опухоли (рис. 3). На сегодня не существует единого мнения относительно активности СОД и каталазы в динамике развития опухоли. По данным одних авторов [6–8, 18], активность СОД и каталазы в эритроцитах организма-опухоленосителя снижается, при этом авторы полагают, что прогрессирующая недостаточность активности СОД определяет системную активацию процессов ПОЛ при злокачественных опухолях определенной локализации [9]. Данные других авторов [10, 19–20] свидетельствуют о повышении активности этих ферментов. При этом существует мнение, что увеличение в эритроцитах активности антиоксидантных ферментов может быть компенсаторной реакцией в ответ на усиление ОС [10].
В доступной литературе мы обнаружили данные, свидетельствующие о разнонаправленной динамике СОД и каталазы в эритроцитах опухоленосителей по сравнению с контролем [9, 21].
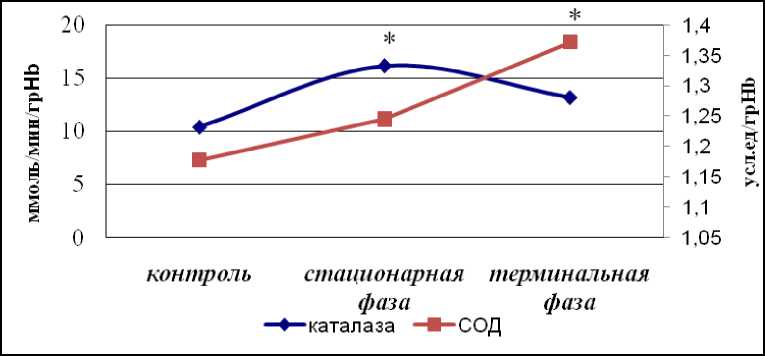
Рис. 3. Активность СОД и каталазы в эритроцитах крыс с экспериментальным АОЯ. * – данные, достоверно отличающиеся от аналогичных данных в контроле (р≤0,05)
В литературе также представлены данные о фазности изменений антиоксидантной активности крови организма-опухоленосите-ля [22]. Для объяснения Е.А. Нейфахом в 1960-е гг. было высказано предположение, что опухоль «выкачивает» антиоксиданты из других органов и тканей. При этом удаление опухоли приводит к нормализации активности ПОЛ в крови, что позволяет предполагать определяющую роль опухоли в формировании антиоксидантного статуса организма-опухоленосителя.
Образовавшийся при окислении Fe2+ О2-СОД далее превращает в Н2О2+О2, а уже каталаза расщепляет Н2О2. Расщеплять Н2О2 может также ГПО, активность которой, по нашим данным, в стационарную фазу АОЯ не отличалась от контроля, а в терминальную фазу была значимо снижена по сравнению с контролем (рис. 4). Снижение активности ГПО в эритроцитах зарегистрировано также у больных раком шейки матки [23]. GSSG восстанавливает ГР, активность которой, по нашим данным, также была снижена в эритроцитах в динамике АОЯ (рис. 4).
Анализ вышеизложенного позволяет предполагать, что активность ферментов АОС в эритроцитах организма-опухоленоси-теля, определяемая условиями гипоксии, развивающейся в организме при развитии солидной опухоли, гетерогенностью опухоли, усилением активности моноцитов, осуществляющих противоопухолевый иммунный ответ, является важной составляющей биологического портрета опухоли в динамике ее развития.
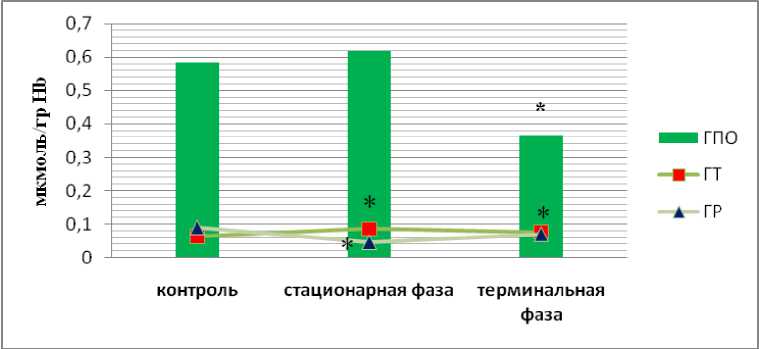
Рис. 4. Активность глутатионзависимых ферментов в эритроцитах крыс с АОЯ. * – данные, достоверно отличающиеся от аналогичных данных в контроле (р≤0,05)
Субстратом для ГПО, расщепляющей Н2О2 и пероксиды липидов, является глутатион. Глутатион – тиолсодержащий трипептид – осуществляет защиту клетки от ксенобиотиков, свободных радикалов и гидропероксидов. Он функционирует в качестве антиоксиданта, участвуя в разрушении перекиси водорода и пероксидов липидов, обеспечивая субстрат для ГПО. В эритроцитах периферической крови, наиболее страдающих от активности свободных радикалов при раз- витии в организме неоплазмы, его содержится значительное количество. При снижении потенциала глутатионовой защиты в эритроцитах повышается содержание АФК, что вызывает окисление SH-групп молекул Hb.
Образование дисульфидных связей между протомерами Hb и метHb приводит к их агрегации – образованию телец Хайнца, которые способствуют разрушению эритроцитов при попадании их в мелкие капилляры.
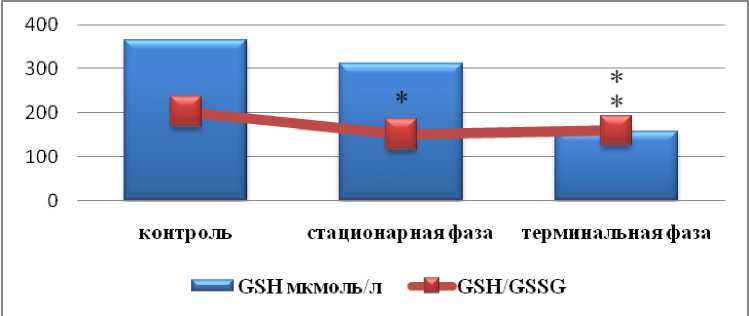
Рис. 5. Уровни GSH и отношение GSH/GSSG в эритроцитах в динамике АОЯ. * – данные, достоверно отличающиеся от аналогичных данных в контроле (р≤0,05)
Нами установлено прогрессирующие снижение уровня GSH и отношения GSH/GSSG в эритроцитах в динамике АОЯ (рис. 5). Снижение окислительно-восстановительного статуса глутатиона (GSH/GSSG) имело место в крови мышей с опухолью Эрлиха [24], в эритроцитах у пациентов со злокачественными опухолями различной локализации [25–26]. В то же время в литературе доступны данные о повышении GSH и GSSG в эритроцитах крыс на ранних стадиях развития гепатомы Морриса 5123 [27]. При этом авторы отмечали на поздних стадиях понижение уровня GSH и соотношения GSH/GSSG при сохраняемом повышенном уровне GSSG. Существует мнение, что расходование GSH в окислительных реакциях сопровождается генерацией GSSG, взаимодействующего с SH-группами белков. При этом величина отношения GSH/GSSG значительно снижалась, что свидетельствует о сокращении редокс-потенциала системы глутатиона. При снижении величины отношения
GSH/GSSG в условиях окислительного стресса тиоловые группы белков могут обратимо модифицироваться с образованием смешанных дисульфидов между белковыми SH-группами и SH-группами молекул с низкой молекулярной массой [28]. При этом GSH выступает в качестве «ловушки» для свободных радикалов [29], а патологические состояния, включая развитие неоплазмы, вызывают истощение GSH [26]. Полученные нами данные о динамике ГПО и ГР (снижение активности которых, возможно, является результатом влияния неоплазмы) позволяют предполагать не только и не столько истощение GSH, сколько снижение его образования в эритроцитах при развитии АОЯ.
GSH также используется ГТ для детоксикации ксенобиотиков и пероксидов. При этом осуществляется 4 основных типа реакций:
-
1) R+GSH=HRSG;
-
2) RX+GSH=HX+SG – нуклеофильное замещение;
-
3) восстановление органических пероксидов до спиртов:
2GSH+ROOH=ROH+GS-GS+Н 2 О;
-
4) Изомеризация (стероидов, простагландинов).
В реакциях 1-го и 2-го типов глутатион теряется. В реакциях 3-го типа образуется GS-SG (окисленный глутатион), который восстанавливается ГР.
Нами установлено увеличение активности ГТ в эритроцитах в динамике развития
АОЯ (рис. 4). Повышение активности ГТ в эритроцитах больных РЯ показано в работе [30]. Повышение активности ГТ представляется оправданным на фоне повышения концентрации АФК и усиления ПОЛ, однако это также ведет к истощению пула GSH.
Заключение. Полученные данные позволяют предполагать истощение пула GSH в эритроцитах крыс-опухоленосителей в результате снижения его образования и повышения активности ГТ на фоне усиления ПОЛ.
Список литературы К вопросу о механизмах возникновения оксидативного стресса в эритроцитах организма-опухоленосителя
- Крыжановский Г.Н. Дизрегуляционная патология. М.; 2002. 632.
- Liu F., Mizukami H., Sarnaik S., Ostafin A. Calcium-dependent human erythrocyte cytoskeleton stability analysis through atomic force microscopy. J. Struct. Biol. 2005; 150 (2): 200-210.
- Чеснокова Н.П., Моррисон В.В., Понукалина Е.В. О роли активации свободнорадикального окисления в структурной и функциональной дезорганизации биосистем в условиях патологии. Успехи современного естествознания. 2008; 3: 25-34.
- Чеснокова Н.П., Барсуков В.Ю., Зяблов Е.В. Закономерности активации свободнорадикального окисления и изменений показателей клеточного состава периферической крови при фолликулярной форме рака щитовидной железы. Научные труды SWorld. 2010; 1: 86-87.
- Чеснокова Н.П., Барсуков В.Ю., Злобнова О.А. Закономерности изменений гормонального баланса в динамике опухолевой прогрессии у больных раком молочной железы. Успехи современного естествознания. 2011; 4: 47-54.
- Шарипов Ф.К., Беленков Ю.О., Киреев Г.В. Динамика свободнорадикального окисления в ткани штамма саркома-45 как показатель взаимодействия опухоли и организма. Вопросы онкологии. 2005; 2: 227-229.
- Агабеков А.И., Барсуков В.Ю., Чеснокова Н.П. О роли активации процессов липопероксидации и недостаточности антирадикальной защиты крови в патогенезе рака ободочной кишки. Современный взгляд на будущее науки. Международная научно-практическая конференция. Уфа: Научный центр «АЭТЕРНА»; 2014: 44-47.
- Manoharan S., Klanjiappan K., Kayalvizi M. Enhanced. Lipid peroxidation and impaired enzymatic antioxidant activities in the erythrocytes of the patients with cervical carcinoma. Cell Mol. Bio Lett. 2004; 9 (4A): 699-707.
- Чеснокова Н.П., Барсуков В.Ю., Понукалина Е.В., Агабеков А.И. Закономерности изменений процессов свободнорадикальной дестабилизации биологических мембран при аденокарциноме восходящего отдела ободочной кишки, их роль в развитии опухолевой прогрессии. Фундаментальные исследования. 2015; 1: 164-168.
- Polat M.F., Taysi S., Gul M., Cikman O., Yilmaz I., Bakan E., Erdogan F. Oxidant/antioxidant status in blood of patients with malignant breast tumor and benign breast disease. Cell Biochem. Funct. 2002; 20 (4): 327.
- Волчегорский В.А., Налимов А.Г., Яровинский Б.Г. Сопоставление различных подходов к определению продуктов перекисного окисления липидов в гептан-изопропаноловых экстрактах крови. Вопросы медицинской химии. 1989; 1: 127-131.
- Андреева Л.И., Кожемякин Л.А., Кишкун А.А. Модификация метода определения перекисей липидов в тесте с тиобарбитуровой кислотой. Лабораторное дело. 1988; 11: 41-43.
- Nishikimi M., Appa N., Yagi K. The occurrence of superoxide anion in the reaction of reduced phenacinemethosulfate and molecular oxygen. Biochem. Biophys. Res. Commun. 1972; 46: 849-854.
- Карпищенко А.И. Медицинские лабораторные технологии и диагностика: справочник: в 2 т. Т. 2. СПб.: Интермедика; 1999. 656.
- Асатиани В.С. Ферментные методы анализа. М.; 1969: 607-610.
- Ellman G.L. Tissue sulfhydryl groups. Arch. Biochem. Biophys. 1959; 82 (1): 70-77.
- Северин С.Е. Биологическая химия. М.; 2011. 364.
- Dulinska I., Targosz M., Strojny W., Lekka M., Czuba P., Balwierz W., Szymonski M. Stiffness of normal and pathological erythrocytes studied by means of atomic force microscopy. J. Biochem. Biophys. Methods. 2006; 66 (1-3): 1-11.
- Арсланова Д.Р., Генинг Т.П. Динамическое равновесие в системе ПОЛ-Антиоксидант яичников крыс в процессе онтогенеза. Сибирский консилиум. 2007; 7: 157.
- Воронова О.С., Генинг Т.П., Сысолятин А.А., Светухин В.В. Влияние фемтосекундного лазерного излучения на про-антиоксидантный статус мышей с экспериментальным раком шейки матки. Ульяновский медико-биологический журнал. 2012; 3: 123-128.
- Dursun H., Bilici M., Uyanik A., Okcu N., Akyuz M. Antioxidant Enzyme Activitiesand Lipid Peroxidation Levels in Erythrocytes of Patients with Oesophageal and Gastric Cancer. J. Int. Med. Res. 2006; 34: 193-199.
- Бурлакова Е.Б., Алесенко Ф.В., Молочкина Е.М. Биоантиоксиданты в лучевом поражении и злокачественном росте. М.; 1975. 214.
- Mukundan H., Bahadur A.K., Kumar A. Glutathione level and its relation to radiation therapy in patients with cancer of uterine cervix. Indian J. Exp. Biol. 1999; 9: 859-864.
- Navarro J., Obrador E., Carretero J. Changes in glutathione status and the antioxidant system in blood and in cancer cells associate with tumour growth in vivo. Free Radic. Biol Med. 1999; 3-4: 410-418.
- Della Rovere F., Granata A., Saija A., Broccio M., Tomaino A., Zirilli A., De Caridi G., Broccio G. SH groups and glutathione in cancer patient's blood. Anticancer Res. 2000; 20 (3A): 1595-1598.
- Pastore A., Federici G., Bertini E., Piemonte F. Analysis of glutathione: implication in redox and detoxification. Clin. Chim. Acta. 2003; 333 (1): 19-39.
- Batko J. The effect of experimental neoplastic disease on malondialdehyde level and glutathione status in erythrocytes of rats. Acta Biochim. Pol. 1997; 44 (4): 767-769.
- Gilge J.L., Fisher M., Chai Y.C. The effect of oxidant and the non-oxidant alteration of cellular thiol concentration on the formation of protein mixed-disulfides in HEK 293 cells. PLoS One. 2008; 3 (12): 4015.
- Калинина Е.В., Чернов Н.Н., Новичкова М.Д. Роль глутатиона, глутатионтрансферазы и глу-таредоксина в регуляции редокс-зависимых процессов. Успехи биологической химии. 2014; 54: 299-348.
- Сурикова Е.И., Сергеева М.М., Горошинская И.А., Максимова Н.А., Шалашная Е.В. Состояние антиоксидантной системы эритроцитов и содержание гаптоглобина в крови больных раком яичников с различной васкуляризацией локальной рецидивной опухоли. Современные проблемы науки и образования. 2012; 2.


