К вопросу о подготовке амниотической мембраны в качестве скаффолда для культивируемых клеток при создании биоинженерных конструкций роговицы
Автор: Александрова О.и, Гаврилюк И.О., Машель Т.В., Черныш В.Ф., Чурашов С.В., Куликов А.Н., Блинова М.И.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Глазные болезни
Статья в выпуске: 2 т.15, 2019 года.
Бесплатный доступ
Цель: определить необходимую подготовку амниотической мембраны (АМ), позволяющую использовать ее в качестве скаффолда для культивируемых клеток при создании биоинженерных конструкций (БИК). Материал и методы. Нативную АМ иммобилизировали в специальном зажимном устройстве и подвергали дополнительной механической, термической и ферментативной обработке: удаляли остатки слизи с ее поверхности, проводили криоконсервирование АМ-скаффолдов при -80оС, -20оС и их децеллюляризацию 0,25 %-м раствором смеси Tripsin-EDTA. Прижизненную оценку морфологии культивируемых на АМ- скаффолдах клеток осуществляли под инвертированным микроскопом Nikon Eclipse TS100, оснащенным фотокамерой. Жизнеспособность и метаболическую активность клеток АМ определяли посредством МТТ-теста с помощью планшетного спектрофотометра АИФР-01 УНИПЛАН (Пикон, Россия) при длине волны 570 нм и референсной длине волны 620 нм. Результаты. Установлено, что присутствие на поверхности нативной АМ остатков слизи, не удаляющихся при стандартной механической обработке, негативно влияет на выживаемость клеточной тест-системы. Определена возможность криоконсервации АМ-скаффолдов, а также выявлено позитивное влияние процессов их криоконсервации и ферментативной децеллюляризации на жизнеспособность культивируемых на скаффолдах клеток. Заключение. Стандартная механическая обработка нативной АМ не гарантирует полную очистку ее поверхности от остатков слизи, которые мешают адгезии и равномерному распределению культивируемых клеток. Необходимо достоверно контролируемое удаление слизи поверхности АМ перед их иммобилизацией и дальнейшими манипуляциями. Криоконсервация и последующая децеллюляризация АМ-скаффолдов способствуют увеличению жизнеспособности клеточной тест-системы. Оптимальным из исследуемых субстратов для культивирования клеток оказались АМ-скаффолды, очищенные от амниотической слизи, прошедшие криоконсервацию при -80оС в смеси DMEM-F12 и DMSO (1:1) и ферментативную децеллюляризацию после размораживания.
Амниотическая мембрана, культивирование клеток, роговица
Короткий адрес: https://sciup.org/149135313
IDR: 149135313 | УДК: 57.085.25+617.7-001.17
Текст научной статьи К вопросу о подготовке амниотической мембраны в качестве скаффолда для культивируемых клеток при создании биоинженерных конструкций роговицы
1Введение. Одной из актуальных проблем современной офтальмологии является лечение пациентов с тотальным фиброваскулярным паннусом, возникшим по причине развития синдрома лимбальной недостаточности [1–3]. Зрительная реабилитация таких пациентов в настоящее время возможна только при помощи операции оптической кератопластики, которая, в свою очередь, неэффективна без удаления тотального фиброваскуллярного паннуса и восстановления нормального эпителиального покрова роговицы [4]. Наиболее перспективные для этого методики основаны на трансплантации культивированных стволовых клеток эпителия роговицы (СКЭР) или стволовых клеток эпителия полости рта (СКЭПР) на роговичную поверхность [4–6]. Успех такого способа реэпителизации роговицы напрямую зависит от использования не только эффективных факторов роста и подходящего источника клеточного материала при культивировании, но и оптимального субстрата для культивирования стволовых клеток (СК) [7].
В настоящее время «золотым стандартом» среди предложенного множества биологических и синтетических скаффолдов для культивирования считается деэпителизированная амниотическая мембрана (АМ) [7]. Она не только обладает противовоспалительными свойствами и содержит различные факторы роста и цитокины, индуцирующие эпителизацию и заживление ран, но и способна ингибировать патологическое субэпителиальное рубцевание. Кроме того, базальная мембрана амниотического эпителия гистологически напоминает боуменову мембрану роговицы и способна интегрироваться в роговичную строму [8–11]. Вероятно, именно поэтому в иностранной литературе имеется множество сообщений о создании и применении биоинженерных конструкций (БИК) в виде клеточно-тканевых трансплантатов на основе АМ с культивированными СКЭР и СКЭПР. Однако методики подготовки АМ для этих целей не детализированы или вовсе не описаны.
Отсутствие в нашей стране отработанного протокола подготовки АМ для нужд тканевой инженерии ограничивает использование АМ в качестве скаффолда для культивирования и трансплантации стволовых клеток (СК). В связи с этим назрела необходимость в проведении ряда экспериментальных исследований.
Цель: определить необходимую подготовку амниотической мембраны, позволяющую использовать ее в качестве скаффолда для культивируемых клеток при создании биоинженерных конструкций.
Материал и методы. Забор амниотической оболочки выполняли в стерильных условиях операционной после планового кесарева сечения. Перед забором АМ получали согласие рожениц. АМ выделяли путем механического отделения ее хориона. Далее полученную мембрану механически фиксировали согласно разработанному нами способу [Патент на изобретение № RU 2680471 от 06.06.2018 г.]. Подготовленные таким образом скаффолды из нативной АМ помещались в транспортный раствор (1 г цефтриаксона на 100 мл NaCl) и доставлялись в Центр клеточных технологий ИНЦ РАН.
Для определения возможности культивирования СК на исследуемых скаффолдах в качестве тест-системы использованы СКЭР кроликов, полученные из фрагментов ткани роговичного лимба кроликов породы шиншилла. Клетки культивировали в питательной среде ДМЕМ/F12 (Gibco, США), содержащей 10% FBS (HyClone, США) при 37°С в СО2-инкубаторе в атмосфере 5% СО2
Исследование сос. тояло из трех серий экспериментов, позволяющих оценить влияние механической, термической и ферментативной обработки АМ на жизнеспособность культивируемых на ней клеток.
Для оценки влияния степени механической обработки амниотической мембраны на жизнеспособность культивируемых на ней клеток АМ-скаффолды были разделены на две группы (по 20 мембран в каждой). В первую группу вошли скаффолды из нативной АМ, заготовленные стандартным способом (после смывания слизи с поверхности АМ). Вторую группу составили скаффолды из нативной АМ, механически очищенные от слизи при помощи смоченного в физиологическом растворе марлевого шарика.
Для определения возможности криобанкирования фиксированных АМ (очищенных от слизи) с целью последующего использования их для культивирования СК при создании БИК и определения влияния условий криоконсервации АМ на культивируемые на их поверхности клетки скаффолды были разделены на три группы (по 20 мембран в каждой). В первой группе криоконсервацию скаффолдов выполняли при –20°С в смеси DMEM-F12 и DMSO (1:1); во второй группе — при –80°С в такой же смеси. Контрольную группу составили скаффолды из нативной АМ.
Для определения влияния процесса децеллюля-ризации предварительно очищенных от слизи и кри-оконсервированных при -80оС в смеси DMEM-F12 и DMSO (1:1) АМ-скаффолдов на жизнеспособность культивируемых на их поверхности клеток скаффол-ды были разделены на две группы (по 20 мембран в каждой). В основной группе выполняли ферментативную децеллюляризацию АМ путем обработки

Рис. 1. СКЭР на 1-е сутки культивирования на скаффолдах из нативной АМ в экспериментальной (без слизи) и контрольной (со слизью) группах. Ув. х4 (ФКМ)

Рис. 2. СКЭР на 4-е сутки культивирования на АМ-скаффолдах экспериментальных (криоконсервация при –20°С и –80°С) и контрольной (нативная) групп. Ув. х4 (ФКМ)
их 0,25%-м раствором смеси Tripsin-EDTA (Invitrogen, США). Группу контроля составили не обработанные ферментом скаффолды из нативной АМ.
Влияние способов предподготовки АМ-скаффолдов на клеточную тест-систему оценивали по морфологии и функциональной активности посеянных на их поверхность и культивируемых в течение четырех суток СКЭР, используя метод фазовоконтрастной микроскопии (ФКМ). Жизнеспособность собственных клеток АМ оценивали методом МТТ-теста (коллориметрический тест для определения метаболической активности клеток).
Прижизненное наблюдение с фотофиксацией в процессе культивирования клеток осуществляли под инвертированным микроскопом Nikon Eclipse TS100, оснащенным фотокамерой. МТТ-тест проводили с помощью планшетного спектрофотометра АИФР-01 УНИПЛАН (Пикон, Россия) при длине волны 570 нм и референсной длине волны 620 нм.
Математическую обработку полученных данных проводили методами вариационной статистики при помощи программы Microsoft Excel 2019. Достоверность различий между группами сравнения определялась при помощи U-критерия Манн — Уитни при уровне значимости α=0,05.
Результаты.
Механическая обработка АМ. Первая серия экспериментов направлена на оценку влияния степени дополнительной механической обработки нативной АМ, на жизнеспособность высеянных на ее поверх- ность клеток. Уже на 1-е сутки культивирования выявлены различия в состоянии СКЭР, культивируемых на скаффолдах АМ первой и второй групп (рис. 1).
Как видно на представленных фотографиях, во второй группе к поверхности АМ адгезировало большее количество клеток, чем в первой, где выявлены только единичные адгезировавшие клетки. Однако большая часть адгезировавших клеток во второй группе имеет округлую форму, что свидетельствует о недостаточно плотной адгезии клеток к нативной АМ.
Термическая обработка АМ. Вторая серия экспериментов направлена на оценку влияния условий предварительной криоконсервации скаффолдов АМ на жизнеспособность культивируемых на их поверхности клеток. На 4-е сутки культивирования наибольшее количество жизнеспособных клеток выявлено на скаффолдах второй группы (криоконсервация АМ при –80°С). Клетки на поверхности скаффолдов этой группы были хорошо распластаны, формировали монослой и имели множество межклеточных контактов. На поверхности АМ в первой группе (криоконсервация при –20°С) клеток было значительно меньше. При этом морфологически они выглядели более округлыми и редко контактировали друг с другом, образуя единичные колонии. В группе контроля адгезировавших к АМ клеток на 4-е сутки культивирования выявлено не было (рис. 2).
Проверка предположения о возможном негативном влиянии собственных клеток АМ (эпителия
Результаты МТТ-теста исследуемых амниотических мембран
МТТ-тест выявил наименьшее количество собственных жизнеспособных клеток в скаффолдах АМ после криоконсервации при –80°С.
Ферментативная обработка АМ. В третьей серии экспериментов исследовалось влияние ферментативной децеллюляризации скаффолдов АМ на жизнеспособность культивируемых на их поверхности клеток. Полученные рнезультаты представлены на рис. 3.
Как видно на фотографиях, на 4-е сутки культивирования на скаффолде АМ, прошедшем ферментативную обработку 0,25%-м раствором смеси Tripsin-EDTA, клетки хорошо распластаны на поверхности АМ и образовали монослой. На поверхности скаффолда АМ без ферментативной обработки (контроль) монослой не сформирован; клетки менее распластаны; большая часть клеток имеет округлую форму, что свидетельствует об их не оптимальном функциональном состоянии.
Обсуждение. Амниотическая мембрана, широко применяющаяся в офтальмологии для лечения пациентов с роговичными патологиями, в том числе эпителиальными, имеет ряд ограничений при использовании ее для культивирования клеток. Успех использования АМ в качестве скаффолда для культивируемых клеток при создании БИК во многом зависит от ее предподготовки. Применение АМ в качестве материала для трансплантации регламентировано Законом РФ от 22.12.1992 г. №4180–1 (с изменениями от 20.06.2000 г.) «О трансплантации органов и (или) тканей человека».
При подготовке АМ для трансплантации в качестве пластического материала в лаборатории с соблюдением правил асептики и антисептики отделяют амниотическую оболочку от хориона тупым методом и 4–5-кратно промывают стерильным изотоническим физиологическим раствором от сгустков крови и слизи [12]. Полученные нами данные свидетельствуют о том, что при стандартном промывании АМ на ее поверхности остается некоторое количество слизи, которое препятствует полноценной адгезии заселяемых на АМ клеток (см. рис. 1). Поэтому при создании скаффолдов на основе АМ целесообразно проводить более интенсивную механическую очистку АМ от слизи. Однако даже очищенная механическим способом от слизи нативная АМ не способствует длительному культивировнию на ее поверхности СКЭР. Это может быть связано с жизнеспособностью собственных клеток АМ. Полученные нами данные подтверждают это предположение, так как наименьшие показатели жизнеспособности собственных клеток АМ выявлены после криоконсервации АМ при –80°С (см. таблицу), и именно на этих мембранах на 4-е сутки культивирования обнаружено наибольшее количество жизнеспособных культивируемых клеток (см. рис. 2).
Таким образом, консервация при –80°С является не только способом криокбанкирования, позволяющим длительно сохранять АМ, но и способом частичной ее деэпителизации. Считается, что консервированная АМ (без криопротекции клеток) является инертной тканью, обычно без жизнеспособных клеток. Однако есть данные, что после кратковременной криоконсервации АМ наблюдается некоторая жизнеспособность и пролиферативная способность клеток [13–14] . Установлено, что в сохранении жизнеспособности культивируемых на поверхности АМ-скаффолдов клеток важную роль играет не только отсутствие амниотической слизи, препятствующей
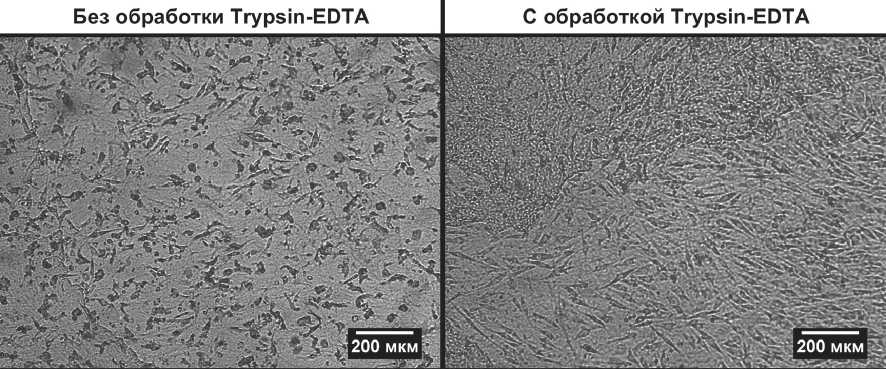
Рис. 3. СКЭР на 4-е сутки культивирования на АМ-скаффолдах экспериментальной (с обработкой ферментом) и контрольной (без обработки ферментом) групп. Ув. х10 (ФКМ)
адгезии и равномерному распространению привнесенной популяции клеток, но и качество деэпителиза-ции АМ, которая в результате криоконсервации даже при –80°С была не оптимальной. Поэтому в целях сохранения жизнеспособности заселяемых на скаф-фолд клеток необходима дополнительная децеллю-ляризация криоконсервированных АМ. Полученные данные свидетельствуют о том, что ферментативная обработка АМ 0,25%-м раствором смеси Tripsin-ED-TA способствует более высокому уровню жизнеспособности заселенных на такую АМ стволовых клеток, по сравнению с АМ без ферментативной обработки (см. рис. 3).
Таким образом, для использования АМ в качестве скаффолда для культивирования на ее поверхности стволовых клеток с последующей их трансплантацией необходима многоэтапная комплексная предпод-готовка АМ, которая должна включать ее иммобилизацию, достоверно контролируемое удаление слизи, криоконсервацию при –80°С и ферментативную де-целлюляризацию при помощи Tripsin-EDTA.
Такая многоуровневая подготовка АМ обеспечивает создание оптимальных условий для сохранения жизнеспособности засеянных на скаффолд АМ клеток и способствует их длительному культивированию на нем.
Заключение. Стандартная механическая обработка нативной АМ не гарантирует полную очистку поверхности АМ от остатков слизи. Остатки слизи на АМ мешают адгезии засеянных на ее поверхность клеток и их равномерному распределению. Необходимо достоверно контролируемое удаление слизи поверхности АМ перед их иммобилизацией и дальнейшими манипуляциями. Криоконсервация и последующая децеллюляризация АМ способствуют увеличению жизнеспособности клеточной тест-системы. Оптимальным из исследуемых субстратов для культивирования клеток оказались АМ-скаффолды, очищенные от амниотической слизи, прошедшие криоконсервацию при -80оС в смеси DMEM-F12 и DMSO (1:1) и ферментативную децеллюляризацию после размораживания.
Список литературы К вопросу о подготовке амниотической мембраны в качестве скаффолда для культивируемых клеток при создании биоинженерных конструкций роговицы
- Черныш В. Ф., Бойко Э. В. Ожоги глаз: Состояние проблемы и новые подходы. М.: ГЭОТАР-Медиа, 2017; 184 с.
- Burman S, Tejwani S, Vemuganti GK, et al. Ophthalmic applications of preserved human amniotic membrane: a review of current indications. Cell and tissue banking 2004; 5 (3): 161-75
- Lavker RM, Tseng SCG, Sun TT. Corneal epithelial stem cells at the limbus: looking at some old problems from a new angle. Experimental eye research 2004; 78 (3): 433-46
- Гаврилюк И. О., Александрова О. И., Хорольская Ю. И. и др. К вопросу о заборе, выделении и культивировании стволовых клеток эпителия слизистой полости рта. Современные технологии в офтальмологии 2018; (4): 60-3
- Дубовиков А. С., Безушко А. В., Гаврилюк И. О. и др. Исследование возможности применения культивированных на амниотической мембране лимбальных эпителиальных эпителиальных стволовых клеток для лечения лимбальной недостаточности в эксперименте. Современные технологии в офтальмологии 2017; (4): 72-5
- Дубовиков А. С., Безушко А. В., Куликов А. Н. и др. О применении культивированных на амниотической мембране стволовых клеток роговичного эпителия для устранения лимбальной недостаточности в эксперименте. Практическая медицина 2017; 2 (9 (110)): 67-71
- Nakamura T, Inatomi T, Sotozono C, et al. Ocular surface reconstruction using stem cell and tissue engineering. Progress in retinal and eye research 2016; 51: 187-207
- Ситник Г. В. Современные клеточные биотехнологии в офтальмологии: Амниотическая мембрана как субстрат для культивирования стволовых эпителиальных клеток. Медицинский журнал 2006; (4): 16-9
- Абрамова И. А., Бойко Э. В., Черныш В. Ф. Об использовании амниотической мембраны с целью конъюнктивальной пластики в эксперименте. Офтальмохирургия 2004; (3): 8-12
- Endo KI, Nakamura T, Kawasaki S, Kinoshita S. Human amniotic membrane, like corneal epithelial basement membrane, manifests the alpha-5 chain of type IV collagen. Investigative Ophthalmol 2004; 45 (6): 1771-4
- Solomon A, Rosenblatt M, Monroy D, et al. Suppression of interleukin 1alpha and interleukin 1beta in human limbal epithelial cells cultured on the amniotic membrane stromal matrix. Br J Ophthalmol 2001 85 (4): 444-9
- Мурзабекова Ф. А. Двойное кератоамниопокрытие в системе хирургического лечения язвенных процессов роговицы: автореф. дис. … канд. мед. наук. М., 2007; 25 c.
- Jirsova K, Jones GLA. Amniotic membrane in ophthalmology: properties, preparation, storage and indications for grafting: a review. Cell and tissue banking 2017, 18 (2): 193- 204
- Kubo M, Sonoda Y, Muramatsu R, Usui M. Immunogenicity of human amniotic membrane in experimental xenotransplantation. Invest Ophthalmol Vis Sci 2001; 42 (7): 1539-46.


