К вопросу о совершенствовании технологии производства фармацевтических биопрепаратов
Автор: Барсуков А.К., Бармин А.В., Нестерова О.Ю., Желтышев Е.Н., Кузнецов А.И., Кожевникова О.В., Грачева В.А., Касимов Ф.М., Панин А.Н., Смоленский В.И., Уласов В.И.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Иммунитет и ветеринария
Статья в выпуске: 6 т.40, 2005 года.
Бесплатный доступ
Оценивали соответствие качества ряда медицинских и ветеринарных биопрепаратов, действующее начало которых представлено белками или полипептидами, требованиям, отражающим достижения науки и научно-технического прогресса. Анализировали образцы экспериментальных и промышленных серий фармацевтических биопрепаратов, производство которых базируется на принципиально различных нормативно-технических и технологических документациях. Определяли концентрацию белка и активность ферментов в образцах иммуноглобулиновых, ферментного и альбуминовых биопрепаратов, а также их электрофоретическую гомогенность.
Короткий адрес: https://sciup.org/142133142
IDR: 142133142 | УДК: 619:615:658.5
Текст научной статьи К вопросу о совершенствовании технологии производства фармацевтических биопрепаратов
Фармацевтическая биотехнология как отрасль наукоемкого производства жизненно необходимых лекарственных средств, базирующаяся на использовании биологических процессов, во всех странах мира находится под усиленным государственным контролем. Национальные контролирующие органы (НКО) в процессах технологических нововведений, распределении и потреблении фармацевтической продукции всегда выполняют как минимум две обязательные функции — контроль и обеспечение качества. Контроль качества на уровне НКО представляет собой процесс, нацеленный на отделение качественной продукции от некачественной. Очевидно также и то, что обеспечение качества фармацевтического биопрепарата не может быть достигнуто раз и навсегда. Показатели качества должны совершенствоваться постоянно в соответствии с достижениями науки, научно-технического и технологического прогресса (1-4).
Спектр белков биопрепаратов отражает два принципиально различных теоретических направления, информационно обеспечивающих уровень реализуемых научно-технических и технологических нововведений. Первое направление, по сути, нацелено на расширение в неопределенных объемах нормативно-технической базы контроля качества биопрепаратов с не выявленным спектром примесных белков. Теоретическим обоснованием такого рода технологических разработок служат устаревшие представления о целесообразности присутствия примесных белков, комплекс которых используется по вторичному назначению — в качестве источника аминокислотного питания реципиента (5). Однако данные о периодах полураспада (полувыведения) физиологически активных белков свидетельствуют о том, что в момент введения биопрепарата и в ближайшей временной перспективе целевой белок, в том числе примеси белков, не могут быть экстраординарным источником аминокислот. На основании многочисленных публикаций следует признать недопустимым наличие в биопрепаратах примеси белков с гормональным или ферментативным эффектом. Применительно к обсуждаемой гетерогенности спектра белков биопрепаратов дальнейшие научно-технические и технологические нововведения должны быть направлены на идентификацию всех белков примеси, выявляемых на электрофореграммах, для подтверждения физиологической безопасности продукции. Очевидно также и то, что это направление в теоретической биотехнологии, по-видимому, можно рассматривать в отдаленном будущем в свете достижений международной фундаментальной программы «Геном человека». По мнению специалистов, после глобального секвенирования ДНК структура и функция белков, закодированных в геноме человека, могут быть расшифрованы через 20-100 лет (6). Только в отдаленном будущем и на основе фундаментальных представлений о всей совокупности физиологически активных белков организма человека можно разрабатывать методы их количественной регистрации и создавать принципиальные модели в фармацевтической биотехнологии. К сожалению, такого рода глобальные программы, касающиеся генома животных и филогенетического родства человека и животных, отражены лишь в контурах перспективных исследовательских планов фундаментального характера (6, 7). Следовательно, нет оснований ожидать в еще более отдаленной перспективе завершения научно-технических разработок, нацеленных на расширение нормативно-технической базы контроля качества фармацевтических биопрепаратов, изготовленных из сырья животного происхождения.
В связи с изложенным авторы настоящей статьи придерживаются иного концептуального направления, базирующегося на создании принципиальных технологических схем, позволяющих производить особо чистые и конформационно нативные формы целевого белка за счет стандартного воспроизводства субстанций и углубления нормативно-технической базы биологической безопасности стандартных примесей белков, присутствующих в биопрепаратах в следовых количествах. Полагаем, что достаточно общую информацию, согласно которой целевой белок биопрепарата должен быть конформационно нативным и без примесей физиологически активных белков, следует излагать в фармакопейных стандартах и технических условиях более конкретно. Предлагаемая конкретизация, по нашему мнению, должна сводиться к технологическому обеспечению производства целевого белка более чем на 95 % электрофоретически гомогенного в 5-25 % полиакриламидном геле (ПААГ). Последнее обстоятельство особенно важно для биопрепаратов, действующее начало которых представлено гетерологичным белком. Клиническая практика использования инсулина свидетельствует об индукции иммунных реакций у реципиента даже в случае высокой гомологии гормонов, различающихся только по одной аминокислоте (8).
К настоящему времени выполнены крупномасштабные исследования, по результатам которых разработан алгоритм производства инфекционно безопасной плазмы крови человека для обязательной ее переработки в еще более безопасные и эффективные иммуноглобулиновые, гемостатические, комплексные и альбуминовые биопрепараты. В частности, установлено, что инфекционную безопасность донорской плазмы крови человека невозможно гарантировать на основе клинических исследований и оптимальной комбинации скрининговых тестов с использованием самых современных молекулярно-биологических и иммунохимических диагностических наборов. Вполне понятно, что нормативно-техническая база контроля производства инфекционно безопасного сырья животного происхождения в сравнительном аспекте не исключает инфекционную опасность полуфабрикатов и конечных биотехнологических продуктов. С целью инактивации вирусных и других инфекционных агентов, присутствие которых в сырьевых заготовках потенциально возможно, в процессе производства предусматриваются специальные стадии, направленные на денатурацию целевого белка (3). В свою очередь денатурированные (агрегированные) формы целевого белка в составе биопрепарата приобретают способность вызывать негативные реакции в организме реципиента (9). Для выбраковки серий таких биопрепаратов в систему внутризаводского контроля и ОКК (отдел контроля качества) предприятий введен тест — молекулярные параметры, которые оценивают на основе эксклюзионной хроматографии при низком, умеренном или высоком давлении (10).
Целью настоящей работы было создание научно-технических предпосылок для обеспечения постоянства технологических нововведений, направленных на повышение безопасности и клинической эффективности лекарственных средств, действующее начало которых представлено белками или полипептидами, а также оценка соответствия качества ряда медицинских и ветеринарных биопрепаратов нормативно-техническим требованиям, отражающим достижения науки и научнотехнического прогресса.
Методика. Анализировали образцы экспериментальных и промышленных серий фармацевтических биопрепаратов, производство которых базируется на принципиально различных нормативно-технических и технологических документациях. В первой серии экспериментов мы оценивали концентрацию белка и активность ферментов в образцах иммуноглобулиновых, ферментного и альбуминовых биопрепаратов; во второй серии — электрофоретическую гомогенность этих же препаратов. Эффективность технико-технологических нововведений оценивали в соответствии с требованиями нормативно-технической базы контроля качества биопрепаратов с использованием современных методов аналитической биохимии: концентрацию белка определяли колориметрическим методом, цветность и мутность — спектрофотометрически (4, 10); электрофоретическую подвижность белков — в 5-25 % ПААГ (11); долю мономерной, полимерной и фрагментированных форм белка — методом эксклюзионной хроматографии (10). С целью определения селективности принципиальных технологических схем в экспериментальных и производственных образцах оценивали активность ферментов в примесях: аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (АСТ) и щелочной фосфатазы (ЩФ).
Результаты . Концентрация белка в образцах иммунобиопрепаратов (иммуноглобулины, естественные цитокины) колебалась в пределах 0,7-106 мг/мл (табл.). Концентрация общего белка во всех препаратах полностью соответствовала требованиям, предъявляемым нормативной документацией, разработанной, согласованной и утвержденной в соответствии с порядком, действующим в Российской Федерации. Аналогичное заключение сделано относительно ферментного и альбуминовых биопрепаратов (см. табл.).
Электрофореграммы иммуноглобулиновых, цитокиновых, альбуминовых биопрепаратов и ферментного препарата «Лидаза» (гиалуронидаза) представлены на рисунке 1. Под номерами А 1 -А 7 по этическим соображениям зашифрованы образцы, которые не соответствуют современным требованиям, предъявляемым к биохимической гомогенности действующего начала; образцы иммуноглобулиновых и альбуминовых биопрепаратов предприятий «Ижбиовет» и НИИ эпидемиологии и микробиологии (НИИЭМ) им. Л. Пастера приведены в их коммерческом наименовании.
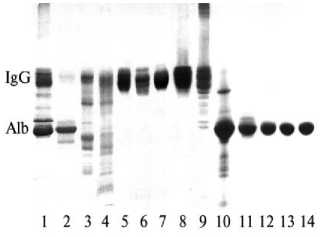
Рис. 1. Электрофореграммы иммуноглобулиновых и альбуминовых препаратов медицинского (8-11) и ветеринарного (17, 12-14) назначения: 1 – А 1 ; 2 – А 2 ; 3 – А 3 ;
4 – А 4 ; 5 — «Иммуно Н» (производитель «Ижбиовет»); 6 — «Иммуно С» («Ижбио-вет»); 7 – «Иммуновет» («Ижбиовет»); 8 — «Иммуноглобулин человека нормальный» (НИИЭМ им. Л. Пастера); 9 — медицинский иммуноглобулиновый препарат А 9 ; 10 – медицинский альбуминовый препарат А 10 ; 11 — «Альбумин 10 %» (НИИЭМ им. Л. Пастера); 12 — ветеринарный препарат «Альбумин С» («Ижбиовет»); 13 — ветеринарный препарат «Альбумин Н» («Ижбио-вет)»; 14 — ветеринарный препарат «Аль-буминат» («Ижбиовет»). Alb – альбумин; IgG – иммуноглобулин класса G.
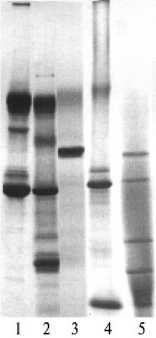
Рис. 2. Электрофореграммы медицинских ферментных и цитокиновых препаратов: 1, 2, 3, 4 и 5 — соответственно стандартизованная плазма крови, препарат «Лидаза» (действующее начало гиалуронидаза) (ФГУП «Иммунопрепарат», Уфа), очищенная гиалуронидаза, цитокино-вый препарат А 6 и цитокиновый препарат А 7 .
В составе препаратов А1-А4 помимо IgG зарегистрировано 8-15 примесных белков. Полосу, соответствующую иммуног-
лобулину в препаративных (видимых на электрофореграмме) количествах, можно было идентифицировать только для иммуноглобулиновых биопрепаратов А1, А9, «Иммуно С», «Иммуно Н», «Иммуновет» и иммуноглобулинов, произведенных предприятием при НИИЭМ им. Л. Пастера. Денситометрия полученных электрофореграмм свидетельствует о том, что в этих препаратах содержится наибольшее количество IgG. Однако в состав препарата А1 входят практически все белки плазмы (сыворотки) крови. Остальные иммуноглобулиновые биопрепараты А2-А4 содержат следовые количества IgG и разнообразные примеси белков, не способные в принципе оказать лечебно-профилактический эффект, реализуемый антителами. Медицинский альбуминовый препарат А10 имеет в своем составе как минимум восемь примесных белков, остальные альбуми- новые препараты — не более трех.
На рисунке 2 приведена электрофореграмма ферментных и цитокиновых препаратов медицинского назначения. В качестве образца для сравнения мы использовали стандартизованную плазму крови. Очевидно, что ферментный препарат «Лидаза» содержит избыточное количество примесных белков. В частности, целевой белок гиалуронидазу невозможно идентифицировать на электрофореграмме ферментного биопрепарата. По гетерогенности состава примесных белков качество иммуномодулирующих препаратов сравнимо с таковым ферментного препарата «Лидаза». Следовательно, организм реципиента получает комплекс белков с неопределенными физиологическими свойствами, на который в обязатель- ном порядке будет отвечать иммунологическими реакциями,
ОО ОО
Концентрация белка и активность примесных ферментов в составе иммуноглобулиновых, альбуминовых, ферментного и иммуномодулирующих биопрепаратов
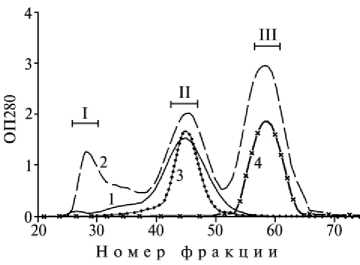
Рис. 3. Примеры стандартных профилей эксклюзионных хроматографий препарата «Иммуновет» (1), препарата А 1 (2), отраслевого стандартного образца иммуноглобулина (3) и альбумина (4) коровы; I, II и III — фракции с молекулярной массой соответственно 600 (и более), 150 и 65 кДа.
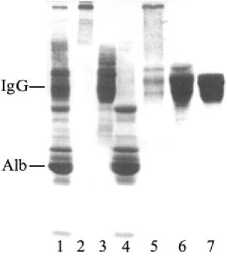
Рис. 4. Электрофореграммы пиков, полученных в эксклюзионной хроматографии препаратов А 1 , «Иммуновет» и особо чистой формы IgG коровы: 1-4 — пики препарата А 1 ; 5, 6 — пики препарата «Иммуновет»; 7 — пик особо чистой формы иммуноглобулина IgG коровы.
Эффективность технологического процесса в итоге определяется качеством готового фармацевтического биопрепарата. В частности, единое системное целое «качество и стандартность в биотехнологии» относится не к декларациям, но к реально производимой продукции, в которой критерии качества и их совершенствование обеспечиваются долгосрочной научно-технической политикой, сформированной на основе междисциплинарных и межведомственных взаимодействий. В международной терминологии фармацевтической биотехнологии исключаются всякого рода неопределенности, такие как теоретические рассуждения о целесообразности применения биопрепаратов с физиологически активными примесями для достижения комплексного лечебного эффекта.
В связи с вышеизложенным для оценки селективности принципиальных технологических схем производства мы определяли в образцах биопрепаратов крови наличие АСТ, АЛТ и ЩФ и рассчитывали удельную активность последних (см. табл.). По данным этих исследований, на предприятиях «Ижбиовет» и при НИИЭМ им. Л. Пастера эффективно удаляют АСТ и АЛТ из состава иммуноглобулиновых и альбуминовых биопрепаратов; ЩФ выявлена во всех биопрепаратах крови, однако, наименьшая удельная активность зарегистрирована в продукции предприятия «Ижбиовет».
Биохимическая гомогенность целевого белка достигается на предприятии «Ижбиовет» за счет использования хроматографических модулей очистки целевых полуфабрикатов, прошедших специализированные стадии инактивации потенциально присутствующих в их составе инфекционных агентов.
Таким образом, безопасность и эффективность фармацевтических биопрепаратов не отделима от уровня технического выполнения технологических стандартов и уровня технического освоения промышленного выпуска биологической продукции в производственных зонах категории GMP (правила организации производства и контроля качества лекарственных средств). Для обеспечения постоянства технологических нововведений в производственно-потребительскую кооперацию фармацевтических биопрепаратов Российской Федерации необходимо на основе современных технологических решений придерживаться следующих универсальных критериев стандартности:
— Субстанции естественных цитокинов, иммуноглобулиновых, альбуминовых, ферментных, гормональных биопрепаратов не менее чем на 80 % должны быть представлены целевыми белками, в том числе стандартно воспроизводимыми примесями, не вызывающими нарушений гомеостаза в организме реципиента;
— Биохимическая гомогенность целевого белка позволяет определять методом эксклюзионной хроматографии агрегированные формы, количество которых не должно превышать 5 и 15 % в препаратах соответственно для внутривенных и внутримышечных инъекций;
— Мутность и цветность биопрепаратов необходимо регистрировать на основе инструментального спектрофотометрического анализа и в объективных количественных критериях выражать удельные значения этих показателей, например для иммуноглобулиновых и альбуминовых биопрепаратов — соответственно не более 0,003 и 0,005 ед. опт. плотности/мг белка;
— Необходимо установить нормы присутствия в биопрепаратах следовых концентраций технологических примесей, реагентов (комплектующих), разрешенных к применению в РФ для производства лекарственных средств; в частности, предлагается установить предельно допустимые нормы для этанола и полиэтиленгликоля не более соответственно 2 и 0,5 %. Результаты представленных исследований и наличие в Удмуртии невостребованных производственных помещений, соответствующих стандарту GMP, обостряют и делают актуальной проблему управления качеством биопрепаратов, которая, по нашему мнению, должна опираться на междисциплинарное знание и межведомственные взаимодействия в рамках прогнозно-плановой экономики развития фармацевтической биотехнологии как кооперации производственно-потребительского характера российского масштаба.
Л И Т Е Р А Т У Р А
-
1. М и н а к о в а Л.В., Л а п т е в а Л.К. Иммуноглобулины. Нижний Новгород, 1993.
-
2. П а н и н А.Н., Т р е т ь я к о в А.Д., Г а р б у з о в А.В. Сертификация ветеринарных препаратов.
-
3. Guidelines on viral inactivation and removal procedures intended to assure the viral safety of human blood plasma products. WHO Expert Committee on Biological Standardization. Geneva, 2001.
-
4. WHO Expert Committee on Biological Standardization. Forty-three report. (Technical Report Series, ¹ 840). Geneva, 1994, 2: 34-100.
-
5. S p i e s s A., M i k a l u n a s V., C a r l s o n S. e.a. Albumin kinetics in hypoalbuminemic patients receiving total parenteral nutrition. JPEN: J. Parenter Enteral Nutr., 1996, 20(6): 424-428.
-
6. L i W.-H., G u Z., W a n g H. e.a. Evolutionary analyses of the human genome. Nature, 2001, 409 (6822): 847-849.
-
7. Б е р л и н Ю.А., И в а н о в В.Т. Молекулярная биология в 2000 году: прогнозы, реальность и снова прогнозы. Биоорганическая химия, 2000, 26, 10: 752-755.
-
8. W i l s o n R.M., D o u g l a s C.A., T a t t e r s a l l R.B. e.a. Immunogenicity of highly purified bovine insulin: a comparison with conventional bovine and highly purified human insulins. Diabetologia, 1985, 28(9): 667-670.
-
9. С т р и г и н В.А., Т е р н о в о й В.А. Неспецифические свойства препаратов иммуноглобулинов. М., 1979.
-
10. Методические указания МУК 4.1/4.2.588-96 «Методы контроля медицинских иммунобиологических препаратов, вводимых людям». М., 1996: 55-57.
-
11. Methods in Enzimology. Academic Press, 1990, 182: 425-441.
Ветеринария, 2002, 3: 13-15.
Удмуртский государственный университет,


