К вопросу об аналитической чувствительности генетического анализатора
Автор: В.Е. Курочкин, Ф.Л. Владимиров, А.С. Альдекеева, Н.А. Корнева
Журнал: Научное приборостроение @nauchnoe-priborostroenie
Рубрика: Приборостроение для биологии и медицины
Статья в выпуске: 4, 2025 года.
Бесплатный доступ
В статье рассмотрено влияние отражения и рассеяния излучения флуоресценции в линейке капилляров на аналитическую чувствительность генетического анализатора. Отраженное и рассеянное излучение создает фоновую засветку, которое в ряде случает может превышать интенсивность информативного сигнала флуоресценции. Показано, что основной вклад в фоновую засветку линейки капилляров вносит отражение излучения от соседних капилляров с высокой концентрацией флуорофоров и, соответственно, высокой интенсивностью флуоресценции. Экспериментальная проверка предложенной модели формирования фоновой засветки была проведена на стандартной линейке капилляров с 8 капиллярами, в которой один из капилляров был заполнен коллоидным раствором квантовых точек. Экспериментально полученные зависимости интенсивности отраженного капиллярами излучения флуоресценции достаточно корректно описываются предложенной моделью. Если интенсивность флуоресценции в различных капиллярах линейки отличаются незначительно, то капилляры не оказывают существенного влияния друг на друга. При разнице интенсивности флуоресценции в 1000 раз, эффективная аналитическая чувствительность падает примерно в 100 раз. Из полученных результатов следует, что для получения высокой аналитической чувствительности геномного секвенирования концентрация флуорофоров должна быть примерно одинаковой во всех капиллярах линейки. Рассматривается целесообразность использования линеек капилляров с большим количеством капилляров и меры по уменьшению взаимного влияния капилляров в линейке капилляров генетического анализатора.
Аналитическая чувствительность, генетический анализатор, линейка капилляров
Короткий адрес: https://sciup.org/142246258
IDR: 142246258 | УДК: 543.426;543.9
Текст научной статьи К вопросу об аналитической чувствительности генетического анализатора
К основным характеристикам генетических анализаторов [1, 2] относятся длина прочтения, максимальная анализируемая длина, время стандартного фрагментного анализа, количество каналов детекции флуоресценции, аналитическая чувствительность, динамический диапазон измерения сигнала в каждом спектральном диапазоне [3, 4]. Аналитическая чувствительность определяет минимальную концентрацию анализируемых реагентов, таких как флуоресцентно меченые фрагменты ДНК или красители в модельных экспериментах. Высокая чувствительность имеет большое значение, когда исследуются образцы с малым количеством ДНК, которое даже после амплификации с помощью полимеразной цепной реакции позволяет получить интенсивности флуоресценции, близкие к сигналу шумов или фонового излучения [5]. Поэтому исследования, направленные на повышение аналитической чувствительности генетического анализатора и определение ее фактического значения, являются актуальной задачей.
ФАКТОРЫ, ВЛИЯЮЩИЕ НА ЧУВСТВИТЕЛЬНОСТЬ
Обычно предполагается, что аналитическая чувствительность определяется шумами измерительного тракта, фоновой засветкой и другими паразитными эффектами.
В работе [6] изучено влияние отраженного одиночным капилляром излучения лазера на чувствительность флуоресцентных измерений. В этой работе делается вывод, что основной вклад в интенсивность фоновой засветки в детекторах для систем капиллярного электрофореза вносит отраженное от капилляра излучение лазера. В работе показано, что для стандартной оптической схемы с нормальным падением лазерного луча на капилляр и при условии, что излучение от капилляра собирается параболическим зеркалом в угле 120о, примерно 4.2% мощности лазерного излучения, падающего на капилляр, перераспределяется на фо-топриемное устройство. Световой поток флуоресценции F при тех же условиях равен [6]:
F = PKT (1 -10-£bC)» PKTsbC х ln10, (1) где F — поток флуоресценции; K — квантовый выход пробы; Т — коэффициент пропускания оптической системы; ε — молярный коэффициент экстинкции пробы; b — оптический путь (диаметр капилляра); С — концентрация флуоресцирующего вещества.
Оценки, сделанные по этой формуле при мощности лазерного излучения Р = 30 мВт, b = 75 мкм, Т = 0.5, ε = 200 000 л/моль, K = 0.15, показывают, что полное излучение флуоресценции во всем телесном угле составляет примерно F « 8 х | С | Вт. Так, при концентрации пробы С = 10–12 моль/л поток флуоресценции будет составлять F = 8 × 10–12 Вт. Этот поток равномерно распределен в полном телесном угле 4π. Зеркало при указанных выше параметрах собирает излучение в телесном угле π. Поэтому на фотоприемник попадает примерно 25% полезного сигнала, т.е. Р фп = 2 х 10 - 12 Вт. В то же время, при той же мощности лазерного излучения Р = 30 мВт в сторону фотоприемника отражается примерно Р фп = 1.3 х 10 - 3 Вт. Использование интерференционных фильтров позволяет подавить паразитное лазерное излучение, отраженное капилляром, однако при этом снижается пропускание оптического канала, что приводит к снижению чувствительности системы. Для минимизации паразитного лазерного излучения, попадающего на фотоприемник, в работе [6] было предложено использовать пространственное разделение лучей за счет наклонного падения лазерного излучения на капилляр с пробой. Такой подход используется в настоящее время в генетическом анализаторе "НАНОФОР 05".
В ряде работ [7–9] отмечается определяющее влияние шумов фотоприемника на аналитическую чувствительность систем на основе капиллярного электрофореза. Рассматриваются влияния дробового шума, флуктуации светового потока, фильт- рации сигналов. В работе [10] исследован процесс фотораспада флуоресцина под действием лазерного излучения. Показано, что фотодеградация красителя снижает чувствительность измерений и накладывает ограничения на мощность возбуждающего лазерного излучения. Полученные в [10] результаты позволяют оптимизировать мощность лазера с учетом времени деструкции красителя и времени нахождения молекулы в зоне действия лазерного излучения.
В работе [11] проведена экспериментальная оценка значений аналитической чувствительности измерения сигналов флуоресценции для генетического анализатора "НАНОФОР 05". Оценка проведена для шести спектральных диапазонов, соответствующих флуоресценции наиболее распространенных в практике генетических исследований красителей. При одной и той же концентрации красителей C = 10–9 М/л было измерено отношение сигнал/шум S / N для различных красителей. Полученные значения представлены в Табл. 1.
Различные величины сигналов и отношения сигнал/шум для различных красителей обусловлены различиями яркости люминесценции, квантового выхода, поглощения, чувствительности регистрирующей системы в различных спектральных диапазонах. Аналитическую чувствительность С пр , — минимальную концентрацию красителя, которую можно зарегистрировать, — определяют следующим образом:
( S / N )
С пр
S / N ,
(2),
где С — концентрация красителей в эксперименте; S / N — измеренное отношение сигнал/шум; ( S / N ) пр — предельное значение отношения сиг-нал/шум.
Табл. 1. Результаты измерения значений сигнал/шум и аналитической чувствительности Спр для генетических анализаторов "НАНОФОР 05" с использованием растворов красителей с концентрацией C = 10–9 М/л
|
Краситель |
6FAM |
5R6G |
6TAMRA |
6ROX |
6Sy630 |
Sy660 |
|
Длина волны излучения, нм |
520 |
550 |
580 |
610 |
626 |
658 |
|
S / N |
109 |
129 |
54 |
19 |
14 |
27 |
|
С пр , × 10–10, М/л |
0.28 |
0.23 |
0.56 |
1.58 |
2.14 |
1.11 |
Для надежной регистрации обычно за предельное значение величины сигнал/шум принимается значение ( S / N ) пр = 3. Величины аналитической чувствительности, рассчитанные для этого значения отношения сигнал/шум, приведены в табл. 1 и варьируются от 0.23 до 2.14 М/л для различных красителей. Измерения на генетическом анализаторе "НАНОФОР 05" проводились в восьми капиллярах одновременно с одной и той же концентрацией красителей C = 10–9 М/л.
Полученные в работе [11] экспериментальные значения объясняются теоретической зависимостью интенсивности флуоресценции I от параметров вещества, полученной ранее в работе [6]:
I = n A I в = nJ'Kpl , (3)
где ηλ — квантовый выход флуоресценции; A I в = IBkpl — количество излучения, поглощенного в веществе; kλ — коэффициент поглощения; ρ — плотность флуоресцирующего вещества; l — длина оптического пути (диаметр капилляра).
Различия в аналитической чувствительности для различных флуорофоров объясняются также тем, что для возбуждения флуоресценции использовалась одна и та же длина волны λ в = 488 нм, которая не совпадала с максимумами поглощения различных флуорофоров.
ПОСТРОЕНИЕ МОДЕЛИ
В настоящей работе рассматривается взаимное влияние соседних капилляров в линейке капилляров генетического анализатора "НАНОФОР 05" за счет различных механизмов перераспределения световых потоков.
Рассмотрим фрагмент капиллярной линейки в регистрирующей системе генетического анализатора "НАНОФОР 05" (рис. 1).
На рис. 1 показаны два соседних капилляра 1 и 2, на которые падает возбуждающее лазерное излучение Iв . В капиллярах возникают сигналы флуоресценции I 1 и I 2 . Излучение от капилляров попадает на камеру через объектив в пределах числовой апертуры. Рассмотрим величину фоновой засветки второго капилляра, которая обусловлена излучением первого капилляра, и ее влияние на аналитическую чувствительность системы регистрации.
Оценки будем производить в двумерной модели распространения света. Телесные углы заменим углами на плоскости, поскольку в генетическом анализаторе для возбуждения флуоресценции используется узкий лазерный пучок шириной примерно 40 мкм. Отражение и рассеяние излучения флуоресценции будет происходить в пределах этой узкой полосы. Будем считать, что излучение флуоресценции распространяется в угле 2π в плоскости, перпендикулярной направлению капилляров в линейке капилляров. Такой подход упрощает расчеты фоновой засветки и позволяет качественно оценить взаимное влияние излучения соседних капилляров в линейке капилляров.
Если полное излучение второго капилляра, для которого производится оценка аналитической чувствительности, составляет I 2, то в рамках двумерной модели в объектив системы регистрации попадает полезный сигнал I c 2 :
β с 2 2 ,
2 π
где в = 2arctg —-, D — диаметр входного зрачка 2H объектива; Н — расстояние между капиллярной линейкой и входным зрачком объектива.
От первого капилляра в объектив будет попа дать излучение
β
I C 1 1 1 ,
2 π
где I 1 — полное излучение от первого капилляра.
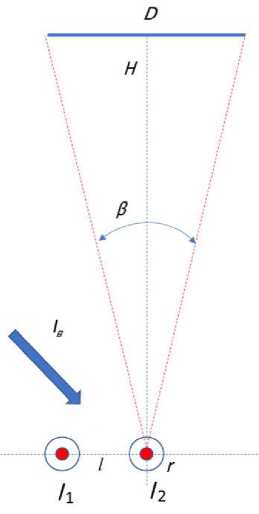
Рис. 1. Фрагмент капиллярной линейки в регистрирующей системе генетического анализатора "НАНОФОР 05".
D — диаметр входного зрачка объектива, Н — расстояние между капиллярной линейкой и входным зрачком объектива, l — расстояние между капиллярами
На второй капилляр будет падать излучение флуоресценции со стороны первого капилляра в пределах угла:
АНАЛИЗ ИНТЕНСИВНОСТИ ФАКТОРОВ, ВЛИЯЮЩИХ НА ФОНОВУЮ ЗАСВЕТКУ
r a = 2arctg—, (6)
где r — радиус капилляра; l — расстояние между капиллярами.
Поскольку излучение от первого капилляра распространяется равномерно во все стороны, то на второй капилляр будет попадать излучение
Падающий на капилляр луч под углом φ к нормали поверхности капилляра с радиусом r отражается под тем же самым углом и попадает во входной зрачок объектива системы регистрации. В объектив регистрирующей системы будут попадать лучи от соседнего капилляра при условии:
βπ
A h = h - h = 2 r sin cos ,
2 1 2 4,
I = 1 1 — .
2 π
где
Часть этого излучения отразится от поверхности капилляра I отр и рассеется на различных дефектах капилляра I рас .
Кроме этого, от второго капилляра отразится I в.отр и рассеется на дефектах I в.рас — часть возбуждающего излучения I в . Также возможна флюоресценция различных загрязнений капилляра под действием возбуждающего излучения I в.ф . Эти паразитные излучения будут попадать в объектив регистрирующей системы, создавая фоновую засветку:
h 1
= r sin
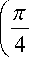
β
■ Г п В A
= r sin + .
1 4 2 J
Этому интервалу Δ h будет соответствовать
угол
h - h В = arctg 1 2 .
1ф I omp + 1 рас + I e . отр + I e . рас + I e . ф .
Рассмотрим влияние этих факторов на фоновую засветку.
Основная часть отраженного от капилляра света формируется на внешней границе капилляра, как это показано на рис. 2.
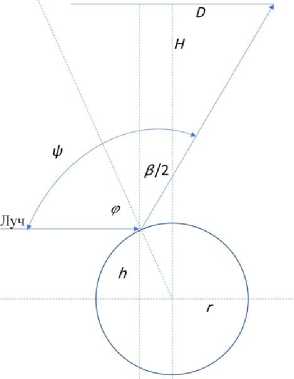
Рис. 2. Отражение света на внешней поверхности капилляра.
D — диаметр входного зрачка объектива, Н — расстояние между капиллярной линейкой и входным зрачком объектива, r — радиус капилляра
При интенсивности флуоресценции в первом и втором капиллярах I 1 и I 2 полезные сигналы, попавшие в объектив регистрирующей системы от этих капилляров, будут равны
I c 1 = 1 1 в , (11)
2 π
I c 2 = 1 2 в . (12)
2 π
Величина излучения от первого капилляра, попавшего в результате отражения от второго капилляра в объектив регистрирующей системы, будет равна
1ф 2 = Z 1 1 R =
2 π
= — R x arctg 2 π
r Гэ п . в
I 2cos sin
l
,
где l — расстояние между капиллярами, R — коэффициент отражения излучения при углах, близких к π/4.
Следует отметить, что излучение от соседнего капилляра будет отражаться не только от наружной границы капилляра, но и от его внутренней поверхности при условии заполнения капилляра гелем, показатель преломления которого примерно равен показателю преломления кварцевого капилляра. Примерный ход лучей в этом случае показан на рис. 3.
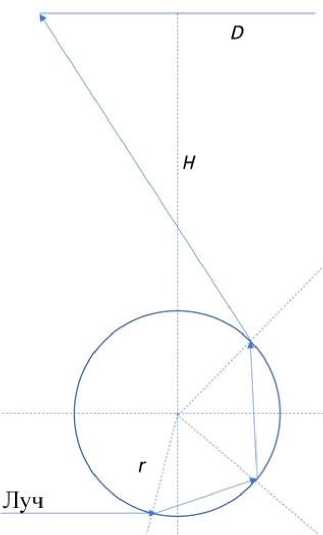
Рис. 3. Ход лучей, отраженных от внутренней поверхности капилляра.
D — диаметр входного зрачка объектива, Н — расстояние между капиллярной линейкой и входным зрачком объектива, r — радиус капилляра
Оценки, выполненные для этого случая, показывают, что диапазон высот Δ h будет значительно меньше, угол падения света на капилляр близок к скользящему, поэтому коэффициент отражения от внутренней поверхности капилляра значительно меньше, чем в случае отражения от внешней поверхности, поэтому отражение от внутренних поверхностей в оценочных расчетах учитывать не будем.
Относительная интенсивность отраженного излучения по отношению к полезному сигналу первого капилляра будет равна:
Y = -ф 2 = — arctgf — cos П sin в x R . (14) о Ic 1 в A l 4 2 )
Также можно оценить влияние отражения излучения от капилляров, оценивая величину отношения сигнал/фон
S o =
I 2 =
Iф 2
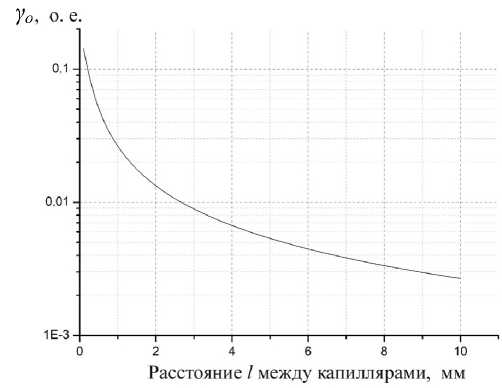
Рис. 4. Зависимость относительной интенсивности отраженного излучения γ о от расстояния между капиллярами l .
I 1 = — x — x
I 1 R
arctg
β r Г п . в \
2cos sin
1 1 4 2 )
При типичных значениях параметров оптической системы геномного секвенатора (D = 10 мм, Н = 50 мм, r = 0.09 мм) величина Δh — диапазон высот от середины капилляра, при попадании в который отраженные лучи попадают в объектив регистрирующей системы, — будет составлять Δh = 0.00634 мм, а угол β / 2 будет равен в = arctg D = 0.1рад. 2 2H
По формулам Френеля можно оценить величину коэффициента отражения света для кварцевого капилляра ( n = 1.46) при углах падения вблизи угла π/4. Для s -составляющей коэффициент отражения будет примерно равен R s = 0.1 и для p- cоставляющей R p = 0. Средний коэффициент отражения будет равен: R = 0.05.
Зависимость относительной интенсивности отраженного излучения, рассчитанная по формуле (14) для указанных параметров, показана на рис. 4.
Зависимость отношения сигнал/фон для различных значений отношения интенсивностей флуоресценции в первом и втором капиллярах k = —, рассчитанная по формуле (15), показана I 1
на рис. 5.
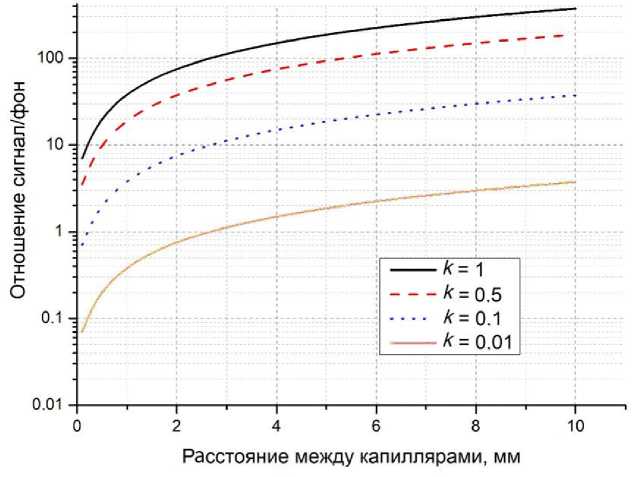
Рис. 5. Зависимость отношения сигнал/фон для различных значений отношения интенсивностей флуоресценции k первом и втором капиллярах.
При небольших расстояниях между капиллярами значительная часть излучения флуоресценции в одном из капилляров отражается соседними капиллярами. Сделанные оценки показывают, что на расстоянии l–2 мм капилляр отражает в систему регистрации более 1% полезного сигнала в первом капилляре. Отражение излучения флуоресценции будет приводить к уменьшению отношения сиг-нал/фон δ . Из рис. 5 видно, что при k = 1, т.е. при одинаковой интенсивности флуоресценции в соседних капиллярах, паразитное отражение от соседних капилляров не оказывает существенного влияния на величину δ . При увеличении интенсивности флуоресценции в одном из капилляров в 10 раз по отношению к соседним капиллярам ( k = 0.1) величина отношения сигнал/фон будет меньше 3 на расстоянии до l = 1 мм. Увеличение интенсивности флуоресценции в одном из капилляров в 100 раз ( k = 0.01) приводит к невозможности проведения измерений в линейке капилляров.
Другим фактором, влияющим на фоновую засветку, является рассеяние света на различных неоднородностях, загрязнениях, остатках полиимид-ной оболочки и т.п. Величина рассеяния характеризуется коэффициентом рассеяния ξ :
t = I4- , (17)
I 3
Ir где 13 =—arctg— — излучение, падающее на ка-πl пилляр 2 со стороны капилляра 1; I4 — излучение, рассеянное капилляром 2.
Коэффициент рассеяния является технологическим параметром, поскольку определяется количеством дефектов, качеством очистки капилляра, загрязнениями как внутри капилляра, так и снаружи. По экспериментальным данным, коэффициент рассеяния может варьироваться в широких пределах ξ = 0.01–0.0001.
Поскольку излучение рассеивается капилляром во все стороны равномерно, то в объектив регистрирующей системы будет попадать рассеянное D излучение 1Р2 в пределах угла в = 2 arctg---:
2 H
I rD
I p 2 = п^ ^ х arctg 7 х arctg 2 Я ’
Относительная интенсивность рассеянного излучения по отношению к полезному сигналу первого капилляра будет равна
ξ r
Y p = arctg у.
πl
А отношение сигнал/фон, обусловленное рассеянием света на технологических дефектах, будет равно
I I πlH
О = с2^ ^ -2 --- р Iр2 I1 ξrD
.
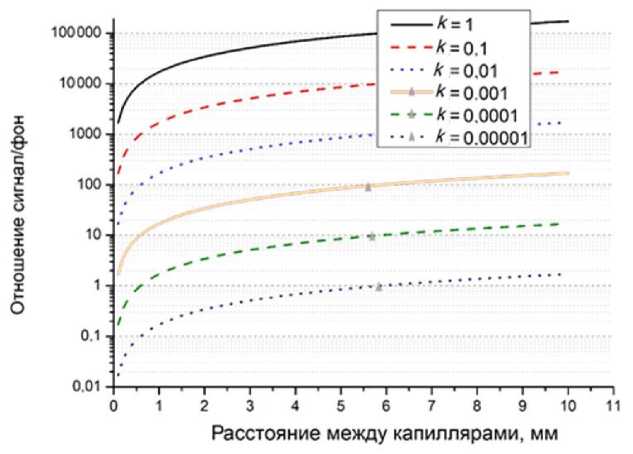
Рис. 6. Зависимость отношения сигнал/фон от расстояния между капиллярами для различных значений k относительной интенсивности излучения флуоресценции во втором капилляре.
Коэффициент рассеяния второго капилляра ξ = 0.01
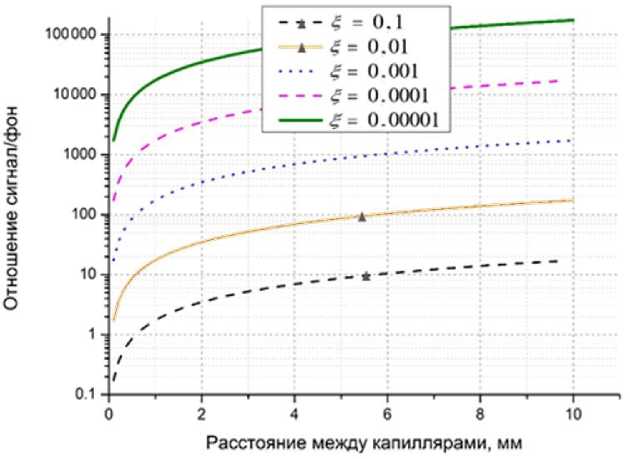
Рис. 7. Зависимость отношения сигнал/фон от расстояния l между капиллярами для различных значений ξ коэффициента рассеяния второго капилляра.
Относительная интенсивность сигнала во втором капилляре k = 0.001
Зависимости отношения сигнал/фон от расстояния между капиллярами для различных значений коэффициента рассеяния ξ и относительной интенсивности излучения флуоресценции во вто-I ром капилляре k = 2 , рассчитанные по формуле I1
(20), представлены на рис. 6, 7. Из рис. 6 и 7 видно, что рассеяние излучения от соседних капилляров начинает играть заметную роль при больших значениях коэффициента рассеяния ξ > 0.01 и при большой разнице интенсивности излучения флуоресценции соседних капилляров k < 0.001.
При отсутствии в линейке капилляров заметных технологических дефектов, влиянием рассеяния на фоновую засветку можно пренебречь, поскольку R ≫ ξ :
у R
Y^ = - x 0.71^, (21) γр ξ где γо — относительная интенсивность отраженного излучения по отношению к полезному сигналу первого капилляра; γр — относительная интенсивность рассеянного излучения по отношению к полезному сигналу первого капилляра; R — коэффициент отражения капилляра; ξ — коэффициент рассеяния капилляра.
Возбуждающее лазерное излучение при определенных условиях также может вносить свой вклад в фоновую засветку. В регистрирующую систему может попадать рассеянное возбуждающее излучение и паразитное излучение флуоресценции, возникающее на различных дефектах и загрязнениях. Для минимизации возбуждающего лазерного излучения, попадающего в систему регистрации, используются интерференционные фильтры с высоким поглощением на длине волны возбуждающего излучения λ . Если интенсивность возбуждающего излучения — I λ , то интенсивность рассеянного капилляром излучения Iрλ можно записать следующим образом:
I . = I . • t x 10 - D * , (22)
где ξ λ — коэффициент рассеяния возбуждающего излучения; D λ — оптическая плотность фильтра на длине волны возбуждающего излучения, установленного в системе регистрации.
Полезный сигнал флуоресценции в соответствии с (3) равен
I p . t x 10 — D .
^p - 1 x 10 D . . ξ λ
Численные оценки, сделанные при типичных значениях Dλ = 6.0, ξλ = 10–4, показывают, что отношение сигнал/фон, обусловленное рассеянием лазерного излучения, достаточно высокое — более 1010 и не оказывает заметного влияния на аналитическую чувствительность.
Возбуждающее лазерное излучение также может вызывать флуоресценцию центров поглощения. Интенсивность флуоресценции в этом случае можно записать следующим образом:
! ф . I B ’ n 2 ’ k 2 ’ p 2 ’ l , (25)
где η 2 — средний квантовый выход флуоресценции дефектов; k 2— коэффициент поглощения лазерного излучения на дефектах; ρ 2 — концентрация дефектов.
Отношение сигнал/фон, обусловленное флуоресценцией дефектов на капилляре под действием лазерного возбуждающего излучения, равно
I c 2 η λ k λ ρ
°ф 2 = T = 7
Iф 2 η 2 k 2 ρ 2
.
Из этой формулы следует, что даже при ηk
— = 1, — = 1 флуоресценция на технологиче- η 2 k 2
ских дефектах будет играть заметную роль, если концентрация дефектов будет сопоставима с концентрацией флуорофора в капилляре. Численные оценки показывают, что концентрация дефектов, при которой флуоресценция на них будет играть заметную роль, составляет примерно ρ 2 = 103 дефектов на отрезок капилляра длиной 50 мкм. Обычно концентрация технологических дефектов значительно меньше, поэтому этот фактор не оказывает заметного влияния на результирующее отношение сигнал/фон.
Таким образом, основной вклад в фоновую засветку линейки капилляров вносит отражение излучения от соседних капилляров с высокой концентрацией флуорофоров и, соответственно, высокой интенсивностью флуоресценции.
ЭКСПЕРИМЕНТАЛЬНАЯ ПРОВЕРКА МОДЕЛЬНЫХ ОЦЕНОК
Экспериментальная проверка рассмотренной модели формирования фоновой засветки была проведена на стандартной линейке капилляров с 8 капиллярами. Один из капилляров был заполнен 2% коллоидным раствором на основе квантовых точек CdS/ZnS (КТ-620) и фотополимера. Другие капилляры были заполнены водой. После заполнения капилляра композицией фотополимер с квантовыми точками полимеризовался при помощи УФ-осветителя с длиной волны излучения λ = 365 нм
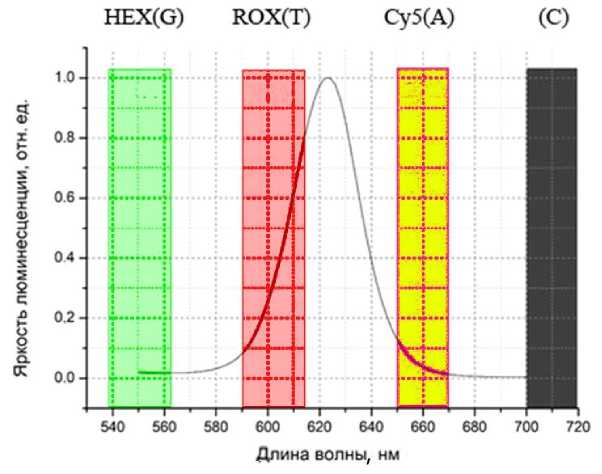
Рис. 8. Спектр люминесценции композиции с квантовыми точками КТ-620 и спектральные области флуоресценции стандартных красителей, используемых для генетических анализов.
и мощностью 3.0 Вт. Спектр люминесценции используемых квантовых точек показан на рис. 8.
Спектр люминесценции имеет максимум в районе 620 нм, полуширина спектра — примерно 30 нм. Для возбуждения использовалась длина волны 400 нм. Спектр люминесценции измерялся на спектрофлуориметре HITACHI F4010. На графике показаны спектральные области флуоресценции стандартных красителей, используемых для генетических анализов.
Использование квантовых точек вместо органических красителей было обусловлено их уникальными свойствами. Эти материалы обладают высокой яркостью флуоресценции, что определяется высокими значениями коэффициента экстинкции и квантового выхода люминесценции. Квантовые точки имеют широкую полосу возбуждения, что позволяет использовать один источник возбуждающего излучения, например, в диапазоне 400–500 нм для возбуждения люминесценции квантовых точек с различными спектрами люминесценции. Люминофоры на основе квантовых точек являются неорганическими материалами и обладают высокой фотостабильностью, что позволяет использовать мощное лазерное излучение для возбуждения люминесценции без риска деградации и выгорания люминофора. Квантовые точки имеют весьма узкий и симметричный пик флуо- ресценции без длинноволновых хвостов и других особенностей. Положение максимума флуоресценции определяется размером квантовых точек и может варьироваться в широких пределах.
Изображение линейки капилляров, в которой один капилляр заполнен квантовыми точками (справа, 1), показано на рис. 9. Остальные семь капилляров заполнены водой и не люминесциру-ют. Соседние капилляры отражают заметную часть излучения люминесценции от первого капилляра.
Для регистрации изображения линейки капилляров использовался бинокулярный микроскоп с цветной видеокамерой (5.0 Мп), диаметр входного зрачка объектива составлял D = 54 мм, рабочее расстояние Н = 70 мм. Люминесценция в капилляре возбуждалась светодиодным источником с длиной волны излучения 365 нм. В канале регистрации устанавливался светофильтр, блокирующий ультрафиолетовое излучение. В полученном изображении измерялась яркость светлых полос I i и их ширина Δ hi. Интенсивность отраженного излучения оценивалась, как
E. = I i xA h i . (27)
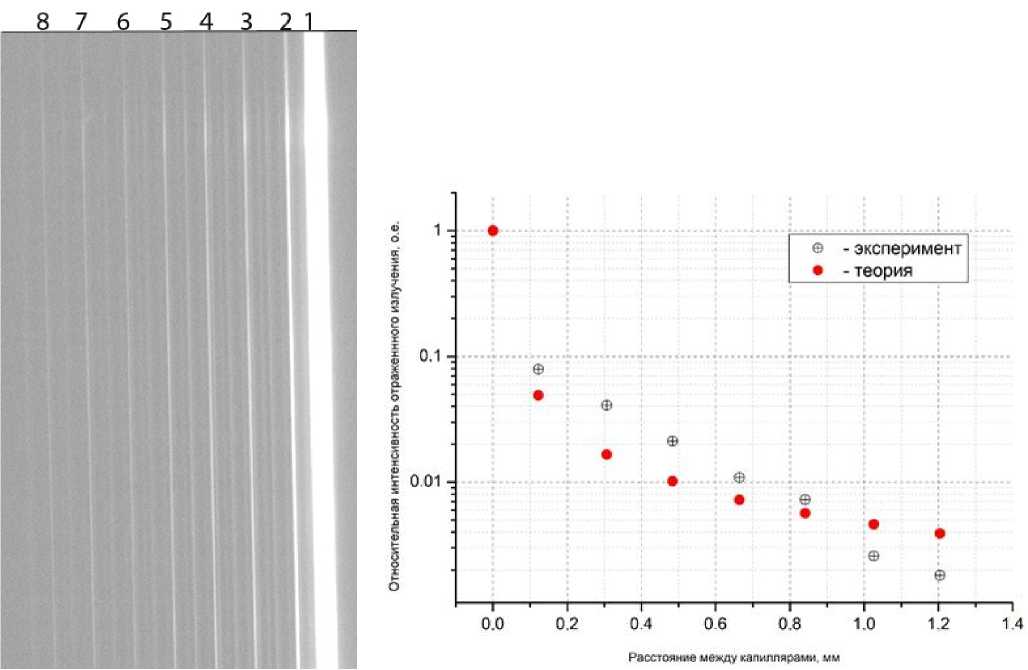
Рис. 9. Линейка из 8 капилляров.
Капилляр 1 заполнен квантовыми точками (справа). Остальные капилляры отражают заметную часть излучения люминесценции первого капилляра
Рис. 10. Экспериментально полученная зависимость интенсивности отраженного излучения от расстояния между капиллярами в сопоставлении с теоретической зависимостью (14).
Экспериментально полученная зависимость интенсивности отраженного излучения от расстояния между капиллярами в сопоставлении с теоретической зависимостью, рассчитанной по формуле (14) и учитывающей только отражение от капилляров, представлена на рис. 10.
Расчеты по формуле (14) проводились при следующих параметрах: D = 54 мм, H = 70 мм, R = 0.07, β = 0.736 рад, r = 0.09 мм. Экспериментальные и рассчитанные зависимости нормировались к излучению первого капилляра, заполненного квантовыми точками. В целом экспериментально полученная зависимость интенсивности отраженного излучения достаточно корректно описывается теоретической зависимостью. Уменьшение отраженного сигнала на больших расстояниях от люминесцирующего капилляра объясняется тем, что на эти капилляры попадает меньше излучения люминесценции из-за блокирования излучения близлежащими капиллярами. Увеличенные значе- ния относительной интенсивности отраженного излучения по сравнению с теоретической зависимостью при малых расстояниях, по-видимому, обусловлены вкладом рассеянного излучения, поскольку в модельном эксперименте линейка капилляров освещалась широким пучком возбуждающего излучения. Поэтому интенсивность излучения, падающего на второй капилляр и подвергающегося рассеянию, была значительно больше по сравнению со случаем отражения излучения, которое происходит практически в одной плоскости. Следует отметить, что в генетическом анализаторе как отражение, так и рассеяние происходят в одной плоскости, и теоретические зависимости будут корректно описывать фоновую засветку.
Поскольку излучение флуоресценции отдельного капилляра пропорционально концентрации флуорофора в этом капилляре, то для эффективной аналитической чувствительности С эф и относительной аналитической чувствительности
X =--- с учетом (15) можно записать
Cпр
С эф =^ 1 + 0.0089 х - o^ p J С пр , (28)
C
X = -ф^ = 1 + 0.0089 х -^p , (29)
где Спр — предельная аналитическая чувствительность в случае, когда концентрация флуорофора во всех капиллярах линейки одна и та же (р = 1);
p =71
I 2
C 1
C 2
отношение интенсивностей люми- несценции в первом и втором капиллярах; С1, С2 — концентрации флуорофоров в первом и втором капиллярах.
Зависимость относительной аналитической чувствительности от расстояния между капиллярами для различных значений отношения р интенсивностей люминесценции в первом и втором капиллярах представлена на рис. 11.
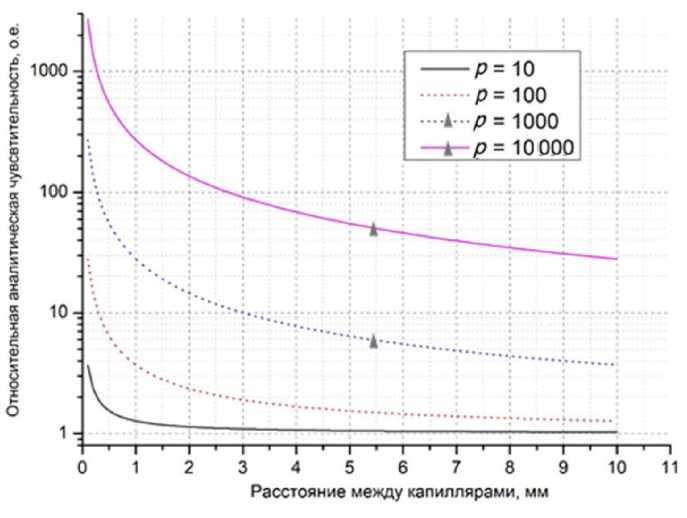
Рис. 11. Зависимость относительной аналитической чувствительности от расстояния между капиллярами для различных значений р = 10; 100; 1000; 10 000.
Рис. 12. Скрин-шот экрана программы управления прибора "НАНОФОР 05".
Из зависимости (29) и рис. 11 следует, что, если интенсивности люминесценции в различных капиллярах линейки отличаются незначительно ( p ~ 1), то капилляры не оказывают существенного влияния друг на друга. При р = 10 эффективная аналитическая чувствительность уменьшается примерно в 2 раза в соседнем капилляре. При р = = 100 эффективная аналитическая чувствительность уменьшается в 3–11 раз в пределах линейки капилляров. При р = 1000 эффективная аналитическая чувствительность падает примерно в 30– 110 раз и составляет примерно 3 × 10–9– 1.1 × 10–8 М/л. При р = 10 000 эффективная аналитическая чувствительность падает более чем в 1000 раз (10–7 М/л).
Проверка влияния интенсивного излучения флуоресценции одного из капилляров на соседние капилляры линейки проводилась также в приборе "НАНОФОР 05". Линейка капилляров, в которой один из капилляров был заполнен квантовыми точками, помещалась вместо стандартной линейки капилляров. Засветка и считывание производились в стандартном режиме. Скрин-шот экрана программы управления показан на рис. 12.
Высокоинтенсивная флуоресценция в одном из капилляров создает заметную фоновую засветку практически во всех капиллярах линейки и делает невозможным проведение корректных измерений.
Из полученных результатов следует, что для получения высокой аналитической чувствительности концентрация флуорофора должна быть примерно одинаковой во всех капиллярах линейки. Для реализации высокой чувствительности генетического анализатора использование линеек капилляров с большим количеством капилляров не имеет большого смысла. Для уменьшения взаимного влияния капилляров можно существенно увеличить расстояние между капиллярами.
ВЫВОДЫ
Таким образом, в работе рассмотрено влияние отражения и рассеяния излучения флуоресценции соседними капиллярами в линейке капилляров на аналитическую чувствительность генетического анализатора. Отраженное и рассеянное излучения создают дополнительную фоновую засветку, которая в ряде случаев может превышать информативный сигнал флуоресценции. Теоретически показано и экспериментально подтверждено, что основной вклад в фоновую засветку линейки ка- пилляров вносит отражение излучения от соседних капилляров с высокой концентрацией флуорофоров и, соответственно, высокой интенсивностью флуоресценции. Экспериментальная проверка предложенной модели формирования фоновой засветки была проведена на стандартной линейке капилляров с 8 капиллярами, в которой один из капилляров был заполнен коллоидным раствором на основе квантовых точек и фотополимера. Экспериментально полученные зависимости интенсивности отраженного излучения достаточно корректно описываются двумерной моделью оптической системы. Если интенсивности люминесценции в различных капиллярах линейки отличаются незначительно, то капилляры не оказывают заметного влияния друг на друга. При разнице интенсивности флуоресценции в 1000 раз эффективная аналитическая чувствительность падает примерно в 100 раз. Из полученных результатов следует, что для получения высокой аналитической чувствительности концентрация флуорофора должна быть примерно одинаковой во всех капиллярах линейки. При использовании линеек капилляров с большим количеством капилляров следует учитывать их взаимное влияние — отражение излучения флуоресценции как с различной интенсивностью, так и различным спектральным составом.
Список литературы К вопросу об аналитической чувствительности генетического анализатора
- 1. Курочкин В.Е., Алексеев Я.И., Петров Д.Г., Евстрапов А.А. Отечественные приборы для молекулярногенетического анализа: разработки ИАП РАН и ООО "Синтол" // Известия Российской Военномедицинской академии. 2021. Т. 40, № 3. С. 69–74.
- DOI: 10.17816/rmmar76918
- 2. Волков А.А., Волков И.А., Плугов А.Г., Кулябина Е.В., Мелкова О.Н., Лавров Г.С., Бочарова Д.В., Алексеев Я.И. Генетический анализатор Нанофор 05 в качестве средства измерений при секвенировании ДНК // Измерительная техника. 2021. № 1. С. 60–65. DOI: 10.32446/0368-1025it.2021-1-60-65
- 3. НАНОФОР 05 Методические рекомендации. [Электронный ресурс]. URL: https://www.syntol.ru/docs/Методические рекомендации/
- 4. Бородинов А.Г., Манойлов В.В., Заруцкий И.В., Петров А.И., Курочкин В.Е. Поколения методов секвенирования ДНК (обзор) // Научное приборостроение. 2020. Т. 30, № 4. С. 3–20. URL: http://iairas.ru/mag/2020/full4/Art1.pdf
- 5. Бочарова Д.В., Меркурьев А.В., Белов Д.А., Лавров Г.С., Курочкин В.Е. Изучение аналитической чувствительности измерения интенсивности флуоресценции в генетическом анализаторе НАНОФОР 05 // Приборостроение-2023: материалы 16-й Международной научно-технической конференции, 15–17 ноября 2023 г., Минск, Республика Беларусь / редкол.:
- О.К. Гусев (пред.) [и др.]. Минск: БНТУ, 2023. С. 2–-27. URL: https://rep.bntu.by/handle/data/137744?show=full
- 6. Беленький Б.Г., Евстрапов А.А., Козулин Р.А. Влияние отраженного капилляром излучения лазера на чувствительность флуориметра капиллярного электрофореза // Научное приборостроение. 2001. Т. 11, № 2. С. 21–25. URL: http://iairas.ru/mag/2001/full2/Art2.pdf
- 7. Беленький Б.Г. Высокоэффективный капиллярный электрофорез. СПб.: Наука, 2009. 320 с.
- 8. Белов Ю.В., Курочкин В.Е., Суханов В.Л. Спектрофотометрический детектор для приборов капиллярного электрофореза // Научное приборостроение. 2009. Т. 19, № 2. С. 47–51. URL: http://iairas.ru/mag/2009/full2/Art5.pdf
- 9. Белов Д.А., Белов Ю.В., Манойлов В.В., Курочкин В.Е. Способы обработки результатов генетических анализов // Научное приборостроение. 2014. Т. 24, № 3. С. 87–91. URL: http://iairas.ru/mag/2014/full3/Art11.pdf
- 10. Козулин Р.А. Оптимизация высокочувствительного лазерного флуоресцентного метода // Оптический журнал. 2008. Т. 75, № 5. C. 3–7. URL: https://elibrary.ru/item.asp?id=10293608
- 11. Козлова П.А., Чубинский-Надеждин И.В., Куликов Ю.В., Курочкин В.Е., Новиков Д.О., Алексеев Я.И. Изучение аналитической чувствительности детекторов лазер-индуцированной флуоресценции капиллярных генетических анализаторов // Тезисы докладов Третьей ежегодной всероссийской молодежной конференции по методам и приборам для анализа биологических объектов "АналитБиоПрибор-2024". СПб: Издательско-полиграфическая ассоциация высших учебных заведений, 2024. С. 108–111. URL: https://analytbiopribor.ru/%D0%A1%D0%B1%D0%BE%D1%80%D0%BD%D0%B8%D0%BA%20%D1%82%D0%B5%D0%B7%D0%B8%D1%81%D0%BE%D0%B2%20%D0%B4%D0%BE%D0%BA%D0%BB%D0%B0%D0%B4%D0%BE%D0%B2.pdf


