К вопросу об экспериментально-морфологических исследованиях заболеваний щитовидной железы, индуцированных радиогенным фактором
Автор: Ирьянов Ю.М., Филимонова Г.Н.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 6 (60), 2013 года.
Бесплатный доступ
Исследовали щитовидную железу 30 экспериментальных крыс-самцов линии Вистар в возрасте 4 мес, контроль составили 5 особей. 25 крыс подвергали тотальному ионизирующему облучению γ-квантами в сублетальной дозе посредством лучевой терапевтической установки АГАТ-Р1, животных выводили из опыта через 2, 5, 10, 15 и 30 сут (n=5) после воздействия. Осуществляли компьютерную гистоморфометрию с определением внешнего диаметра фолликулов, высоты тироцитов, диаметра и площади ядер, площади коллоида, площади фолликулярного эпителия, индекса Брауна, ядерно-цитоплазматического и фолликулярно-коллоидного индексов. Выборки площади ядер ранжировали с шагом 5,0 мкм 2, строили гистограммы распределения. Все морфометрические критерии к концу эксперимента оставались выше контрольных значений, особенно площадь ядра, что свидетельствовало о злокачественном перерождении щитовидной железы. Гистограммы распределения величин площади ядер тироцитов были куполообразными во все сроки опыта, кроме 2 сут, что характерно для фолликулярного и папиллярного рака щитовидной железы. Данная работа является перспективным направлением экспериментально-морфологического изучения радиоиндуцированных онкологических заболеваний нейро-эндокринной системы
Щитовидная железа, ионизирующее γ-излучение, острая лучевая болезнь, гистоморфометрия, папиллярный рак
Короткий адрес: https://sciup.org/14056377
IDR: 14056377 | УДК: 616.44-001.2-092.9
Текст научной статьи К вопросу об экспериментально-морфологических исследованиях заболеваний щитовидной железы, индуцированных радиогенным фактором
В настоящее время остается актуальной проблема выявления морфологических особенностей различных форм рака щитовидной железы, индуцированных ионизирующим излучением, после которого повышается функциональная активность органа [1, 5, 12, 13]. Для радиогенного рака характерно агрессивное течение, стремительное развитие, раннее метастазирование, при этом преобладает папиллярный рак, характеризующийся фолликулярно-клеточной дифференцировкой, наличием папиллярных структур и характерными изменениями ядер опухолевых клеток [9, 10, 14, 16]. Работы, раскрывающие особенности патоморфологии различных форм рака щитовидной железы, многочисленны [2, 3, 6, 11], однако многие вопросы их количественного морфологического анализа остаются нерешенными.
Цель исследования: изучить морфофункциональные характеристики щитовидной железы крыс после воздействия тотального внешнего
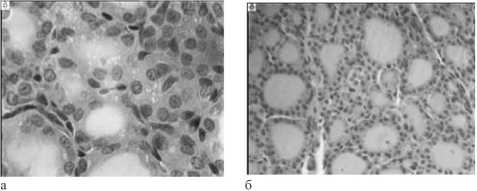
Рис. 1. Микрофото Изображения щитовидной железы крыс, подверженных тотальному воздействию γ-квантами в дозе 7,0 Гр и мощностью 0,78 Гр/мин, через: а – 10 сут; б – 15 сут после воздействия. Поперечные парафиновые срезы, окраска гематоксилином-эозином, увеличение: а – об. ×40, ок. ×12,5;
б – об. ×16, ок. ×12,5
γ-излучения в сублетальной дозе, приводящего к папиллярному раку.
Материал и методы
Крыс-самцов линии Вистар в возрасте 4 мес, массой 200–210 г подвергали однократному тотальному воздействию γ-квантов в дозе 7,0 Гр и мощностью 0,78 Гр/мин на лучевой терапевтической установке АГАТ-Р1 (Россия), с использованием источника излучения 60Со. В эксперименте использовали 30 крыс, интактными являлись 5 особей (контрольная группа), 25 животных выводили из опыта через 2, 5, 10, 15 и 30 сут (n=5), эвтаназию осуществляли посредством летальной дозы ингаляции эфира. Манипуляции, содержание и выведение животных из опыта проводили согласно приказу № 755 от 12.08.77 МЗ СССР «О гуманном обращении с экспериментальными животными».
Щитовидную железу, плотно прилежащую к трахее, извлекали вместе с фрагментом последней, фиксировали в 2 % глутар-параформальдегиде (рН 7,4) с добавлением 0,1 % пикриновой кислоты, промывали, обезвоживали, заливали в парафин. Срезы, толщиной 3–5 мкм, изготавливали на микротоме «Gistorange microtome» (LKB «Bromma-2218», Швеция), окрашивали гематоксилин-эозином, анализировали с помощью микроскопа Opton (Германия), изображения гистологических препаратов оцифровывали с помощью АПК «ДиаМорф» (Россия). В программе «VideoTest-Master» (Россия) осуществляли компьютерную гистоморфометрию. Определяли высоту тироцита (Ht, мкм), внешний диаметр фолликула (Df , мкм ), площадь коллоида (Sc, мкм2), площадь фолликулярного эпителия (Sef, мкм2), диаметр и площадь ядра 1500–2000 тироцитов на каждый срок исследования
(Dy, мкм; Sy, мкм2). Рассчитывали индекс Брауна (IBraun) по Автандилову (Dy/2Ht), ядерно-цитоплазматический индекс (Sy/Sef), фолликулярно-коллоидный индекс (Sef/Sc) [7, 8].
Статистический анализ осуществляли в электронных таблицах программы M. Excel-2000, достоверность различий оценивали на основании критерия Манна–Уитни. Строили гистограммы распределения площади ядер тироциотов, ранжировав выборки с шагом 5,0 мкм2.
Результаты исследования
В контрольной группе для щитовидной железы животных характерен низкий фолликулярный эпителий с относительно мелкими ядрами, более крупными фолликулами и незначительной долей межфолликулярного эпителия. Во всех периодах исследования в щитовидной железе наблюдалась вариабельность функциональных единиц органа: фолликулы значительных диаметров наряду с мелкими фолликулами, варьировала и высота эпителия, что свидетельствовало об «асинхронности» функционирования железы. В контроле и через 2 сут после облучения отмечена сходная картина: низкий эпителий фолликулов, их более единообразные профили, умеренное количество межфолликулярного пространства.
Через 5 сут после γ-облучения увеличивались диаметры фолликулов, к 10-м сут в железе преобладали фолликулы малых диаметров (таблица), отмечалась характерная краевая вакуолизация фолликулярного коллоида (рис. 1а), что указывало на усиленную секреторную активность. Через 15 сут эксперимента диаметр фолликулов несколько возрастал при уменьшении высоты тироцитов (рис. 1б), уменьшались диаметр и площадь ядра (р<0,05).
К 30-м сут эксперимента морфологическая картина железы изменялась несущественно по сравнению с предыдущим сроком, уменьшались площадь коллоида (р<0,05) и внешний диаметр фолликула (р<0,05). Высота тироцита к 5-м сут после облучения значительно возрастала и была максимальной (таблица), затем плавно снижалась на каждый последующий срок (р<0,05). Параметр был близок к контрольному через 2 и 10 сут опыта, в других группах он значимо превышал контроль (р<0,05). Наружный диаметр фолликула был максимальным также через 5 сут эксперимента, составив 140 % от контрольного значения (р<0,05) (таблица), во все остальные периоды параметр превышал контроль (р<0,05).
Средняя площадь ядра тироцита была достоверно выше во все исследованные периоды по сравнению с контролем (р<0,05). Максимальные значения отмечены через 5 и 10 сут опыта, которые на 177 % и 175 % соответственно были выше значений в контроле (таблица). Значения Sef и Sc увеличивались к 5-м сут, составив 178,6 % и 191,7 % от контроля соответственно (р<0,05). Через 10 сут Sef и Sc уменьшались в 1,4 и 1,6 раза (р<0,05), через 15 сут эти показатели незначительно увеличивались (р<0,05). К 30-м сут Sef и Sc уменьшались в 0,9 и 1,3 раза (р<0,05) относительно параметров предыдущего срока исследования.
Индекс Брауна возрастает при снижении секреторной активности железы [8]. По полученным данным IBraun максимален через 5 сут и минимален – через 10 сут опыта. К 15-м сут он возрастал относительно предыдущего срока, к 30-м сут – незначительно уменьшался (таблица).
Максимальное значение Sy/Sef наблюдалось к 10-м сут эксперимента, минимальное – к 5-м сут. Через 15 и 30 сут после облучения данный параметр уменьшался относительно предыдущего срока. Sef/Sc в динамике эксперимента увеличивался на каждый последующий срок, составив к 30-м сут опыта 140 % от контрольного значения (таблица).
Все гистограммы распределения площади ядер тироцитов Sy носят нормальный характер (по Гауссу). От группы контроля менее всего отличалась гистограмма через 2 сут опыта. В контрольной гистограмме максимальное количество ядер принадлежало диапазону 11–15 мкм2 (40,8 %), диапазон 16–20 мкм2– 25,5 %, 6–10 мкм2– 21,1 % ядер. Через 2 сут Sy увеличивалась, число ядер с минимальной площадью уменьшалось в 3 раза, в диапазоне 16–20 мкм2количество ядер возрастало до 31,2 %, в 2 раза увеличивалось число ядер, принадлежащих классу 21–25 мкм2 (14,7 %) и в 2,3 раза – классу 26–30 мкм2 (3,6 %).
Через 5, 10, 15 и 30 сут опыта на гистограммах число классов возрастало до 9–11, через 10 и 15 сут отмечали наибольшее количество ядер тироцитов с максимальной площадью. Через 5 сут число ядер площадью 11–15 мкм2с 36,16 % (2 сут) снижалось в 3,3 раза, а число ядер площадью более 26 мкм2 с 4,3 % увеличивалось до 43,48 %. Через 10 сут гистограмма еще более смещалась вправо: разряды 11–15 мкм2 и 16–20 мкм2 уменьшались до 10,2 % и 18,7 %, разряды 21–25 мкм2, 26–30 мкм2 и 31–35 мкм2 возрастали до 23,9, 21,1 и 13,2 % со- результаты гистоморфометрического анализа щитовидной железы крыс в условиях моделирования острой лучевой болезни (M ± m)
Таблица
|
Срок эксперимента |
Внешний диаметр фолликула (Df, мкм) |
Высота тироцита (Ht, мкм) |
Площадь ядра (Sy, мкм2) |
Площадь коллоида (Sc, мкм2) |
Площадь фол. эпителия (Sef, мкм2) |
Braun |
ЯЦИ |
ФКИ |
|
Контроль |
54,05 ± 1,58 |
3,85 ± 0,03 |
14,47 ± 0,11 |
1520,62 ± 125,59 |
1181,81 ± 69,03 |
7,02 |
0,0122 |
0,7772 |
|
2 сут после γ-облучения |
55,19 ± 1,09* |
3,94 ± 0,05 |
16,66 ± 0,12 * |
1574,49 ± 91,04 * |
1055,02 31,88 |
7,01 |
0,0157 |
0,6701 |
|
5 сут после γ-облучения |
74,75 ± 1,82 * ■ |
5,07 ± 0,03 * ■ |
25,59 ± 0,21 * ■ |
2915,37 ± 190,29 * ■ |
2110,8 ± 103,79 * ■ |
7,37 |
0,0121 |
0,724 |
|
10 сут после γ-облучения |
61,44 ± 1,28 * Δ |
4,83 ± 0,03 Δ |
25,37 ± 0,2 * |
1784,8 ± 96,94 * Δ |
1467,82 ± 50,85 * Δ |
6,36 |
0,0173 |
0,8224 |
|
15 сут после γ-облучения |
64,22 ± 1,34 * |
4,66 ± 0,04 * ▲ |
22,36 ± 0,17 * ▲ |
1967,93 ± 114,38 * |
1676,64 ± 63,92 * ▲ |
6,89 |
0,0133 |
0,852 |
|
30 сут после γ-облучения |
62,3 ± 1,71 * □ |
4,68 ± 0,03 * |
22,09 ± 0,17 * |
1508,22 ± 101,73 □ |
1622,14 ± 76,78 * □ |
6,66 |
0,0136 |
1,0755 |
Примечание: * – различия значимы между контрольной группой и через 2, 5, 10, 15, 30 сут после γ-облучения; ■ – различия значимы между 2 и 5 сут после γ-облучения; Δ – различия значимы между 5 и 10 сут после γ-облучения; ▲ – различия значимы между 10 и 15 сут после γ-облучения; □ – различия значимы между 15 и 30 сут после γ-облучения (р<0,05).
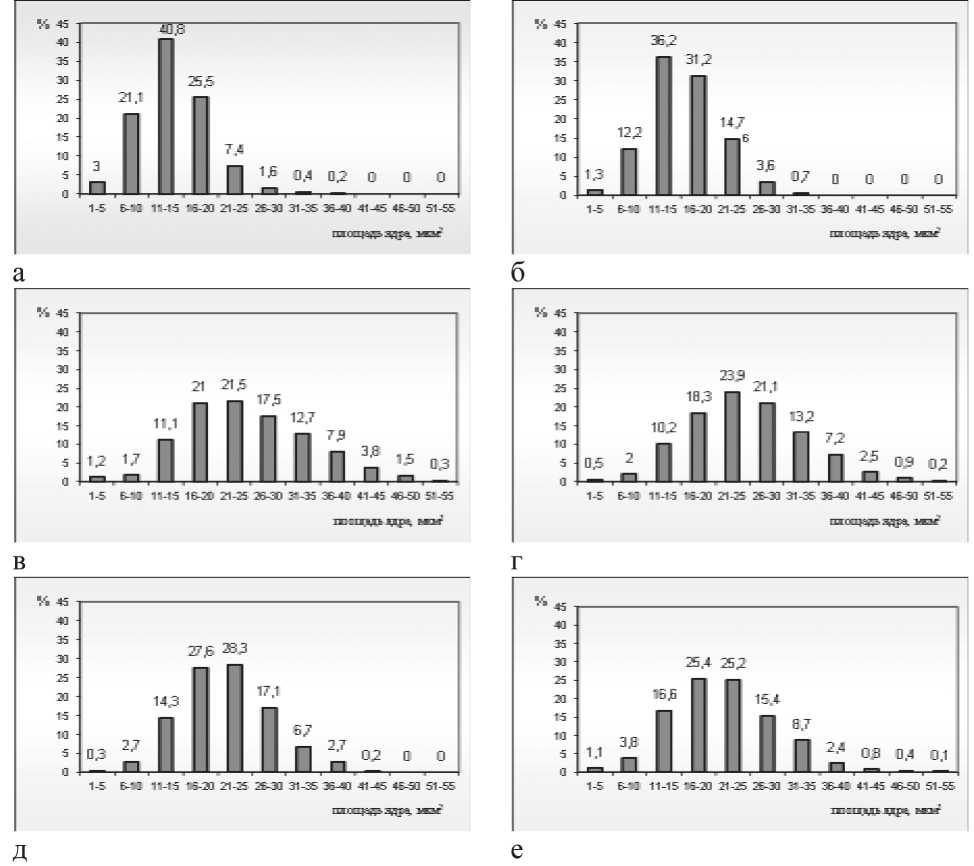
Рис. 2. Гистограммы распределения площади ядер тироцитов крыс в эксперименте с моделированием острого лучевого поражения: а – интактная группа; б – 2-е сут; в – 5 сут; г – 10 сут; д – 15 сут; е – 30 сут после воздействия
ответственно (рис. 2г). К 15-м сут число разрядов составило 9, разряды 11–15 мкм2, 16–20 мкм2 и 21–25 мкм2 увеличивались, составив 140,0, 151,3 и 118,7 % соответственно от значений, наблюдаемых через 10 сут. Количество ядер тироцитов площадью 26–30 мкм2, 31–35 мкм2, 36–40 мкм2 и 41–45 мкм2 уменьшалось и составляло 81,3, 50,7, 37,4 и 7,6 % соответственно. Через 30 сут по сравнению с предыдущим сроком гистограмма изменялась незначительно (рис. 2е).
Компьютерная кариометрия в автоматическом режиме позволяет судить о злокачественном характере заболевания, что значительно ускоряет диагностику, также установлено, что при злокачественном перерождении клеток площадь их ядер возрастает более чем в 2 раза относительно контроля [4, 15,
17]. В нашем исследовании Sy тироцита наиболее отличалась от контрольного значения на протяжении опыта и оставалась достоверно выше (в 1,5 раза) через 30 сут (р<0,05), т.е. данный параметр очень чувствителен к воздействию радиации. К 5-м сут опыта наступала острая фаза дисфункции щитовидной железы, о чем свидетельствовало увеличение Df и высоты его эпителия, возрастала Sc, что отражало снижение секреторной активности. Последний факт подтвержден значением IBraun, который максимально увеличивался к 5-м сут, что свидетельствовало о накоплении коллоида и появлении застойных явлений в органе. К 10-м сут, вероятно, активизировались компенсаторно-приспособительные и репаративные механизмы и начиналось восстановление, снижался индекс накопления коллоида с уменьшением диаметра фолликула, с увеличением Dy и Sy тироцита. Через 15 и 30 сут эксперимента снижался ядерно-цитоплазматический индекс, что связано с активной дифференцировкой тироцитов в направлении показателей в контроле. Однако параметры ядра тироцита, которое, как известно, является маркером новообразований [1, 15, 17], превышали почти вдвое контрольный уровень.
Полученные результаты согласуются с данными литературы. Так, при исследовании ядер тироцитов мазков-биоптатов от больных с различными заболеваниями щитовидной железы было выявлено, что максимальный диаметр во всех группах значимо не отличался от контроля, но минимальный и средний диаметры имели достоверные отличия. И, лишь используя в качестве количественного Sy, удалось выделить 4 группы, четко различающиеся между собой [4]. Считается, что для фолликулярного и папиллярного рака щитовидной железы характерно куполообразное распределение величин площади ядер тироцитов [4], при доброкачественных заболеваниях (фолликулярная аденома, узловой коллоидный и диффузный токсический зоб, аутоиммунный тиреоидит) наблюдается экспоненциальноподобная зависимость. Полученные гистограммы имеют куполообразную форму через 5, 10, 15 и 30 сут опыта, что позволяет сделать предположение о злокачественном перерождении щитовидной железы в эксперименте и о возможности использования данной модели для исследования щитовидной железы после тотального γ-облучения.
Таким образом, моделирование острого лучевого поражения у животных при общем воздействии γ-квантами в комплексе с компьютерной кариометрией тироцитов является перспективным направлением экспериментальных исследований заболеваний нейро-эндокринной системы, индуцированных радиогенным фактором.


