К вопросу об обязательном страховании пациентов, участвующих в клинических исследованиях
Автор: Турчаева И.Н.
Журнал: Экономика и бизнес: теория и практика @economyandbusiness
Статья в выпуске: 2-2 (72), 2021 года.
Бесплатный доступ
Лица, привлеченные к клиническим исследованиям новых лекарственных препаратов для медицинского применения, несут риски причинения вреда жизни или здоровью, что требует внедрения адекватных форм, методов и способов защиты их интересов. Одним из эффективных способов защиты от рисков в современном мире признано страхование в добровольной и обязательной формах. На субъектов, получивших разрешение на организацию проведения клинических исследований, действующее законодательство возлагает обязанность страхования жизни и здоровья пациентов, участвующих в таких исследованиях. Однако, в докладе Департамента страхового рынка ЦБР данное страхование отнесено к т. н. вмененным (т.е. квазиобязательным) видам. На основе обзора действующих нормативно-правовых актов автор приходит к выводу, что страхование жизни и здоровья пациента, участвующего в клинических исследованиях лекарственного препарата для медицинского применения, вполне обоснованно можно отнести к обязательным видам страхования. В процессе исследования также были проанализированы статистические данные, которые позволили сделать вывод о недостаточном качестве урегулирования убытков (ежегодная доля отказов страховщиков по выплатам в среднем составляет 50%) и низком уровне убыточности, что требует оптимизации тарифной политики в данном виде страхования.
Лекарственные препараты, пациенты, клинические исследования, риски, страхование
Короткий адрес: https://sciup.org/170183211
IDR: 170183211 | DOI: 10.24412/2411-0450-2021-2-2-132-136
Текст научной статьи К вопросу об обязательном страховании пациентов, участвующих в клинических исследованиях
Возрастание частоты возникновения различных заболеваний, появление новых вирусов и т. п. требует разработки новых лекарственных препаратов, появлению которых предшествует длительный цикл клинических исследований с участием пациентов и/или здоровых добровольцев, что, в свою очередь, требует обеспечения высокого уровня их рискозащищенности, в связи с чем, усиливается актуальность проблемы выбора форм, мер и способов защиты интересов личности.
Как известно, в мировой и отечественной практике неотъемлемым этапом разработки лекарственных препаратов, предшествующим их регистрации и широкому медицинскому применению, выступают клинические исследования, в ходе которых изучаются как уже известные лекарственные препараты с целью расширения показаний к их применению, так и новые лекарственные препараты для получения данных об уровне их эффективности и безопасности.
Изучение экспериментального лекарственного препарата, как правило, начинается с привлечения небольшого количества пациентов и/или здоровых добровольцев. Далее по мере накопления данных о безопасности и эффективности изучаемого препарата численность пациентов, вовлечённых в исследование, обычно возрастает. Участие в клинических исследованиях пациентов и здоровых добровольцев несомненно приносит пользу обществу в целом, но и может причинить вред жизни, здоровью указанных лиц. Последнее вызывает потребность в обеспечении защиты интересов лиц, принимающих участие в подобного рода исследованиях. Теория и практика свидетельствуют, что повышению степени защищенности имущественных интересов граждан и минимизации их потерь способствуют превентивные и репрессивные меры, реализуемые в различных формах (табл. 1).
Таблица 1. Формы и меры защиты интересов граждан [1, 2]
|
Формы и меры |
Краткая характеристика |
|
|
Формы |
правоустановительная |
установление обязательных норм и правил соответствующими законодательными и иными нормативно-правовыми актами, доведение их до всех граждан и субъектов хозяйственной деятельности, регулярный контроль за соблюдением. |
|
правоисполнительная |
претворение правовых норм в жизнь и их исполнение. |
|
|
добровольная |
самостоятельное выявление гражданами потенциальных и реальных угроз, оценка собственных рисков и заблаговременное принятие мер для их устранения и/или минимизации (самострахование, добровольное страхование). |
|
|
Меры |
превентивные (предупредительные, профилактические) |
предупреждение негативных событий, снижение вероятности их наступления и/или минимизация последствий |
|
репрессивные (компенсационные, ликвидационные) |
ликвидация последствий произошедших событий и компенсация причиненного гражданам вреда (жизни и здоровью) и/или материального ущерба (имуществу). |
|
Одним из эффективных способов защиты от рисков признано страхование, которое в соответствие с российским законодательством может проводиться в обязательной и добровольной формах. Однако, в последнее время обсуждается вопрос о так называемом вмененном страховании, под которым понимается «квазиобязательное страхование, когда обязанность по осуществлению страхования возложена на страхователя в силу закона, но такое страхование не имеет строго регламентированных формальных признаков, свойственных обязательному страхованию» [3, с. 3]. В докладе Департамента страхового рынка Центрального банка России к вмененным видам страхования отнесены введенные на уровне федеральных законов: «…31 вид страхования ответственности, 3 вида страхования имущества и 27 видов страхования жизни и здоровья отдельных категорий граждан» [3, с. 5]. Авторы доклада относят к вмененному и страхование пациентов при проведении клинического испытания препарата [3, с. 8]. Обратимся к действующим нормативно-правовым актам (табл. 2).
В докладе Департамента страхового рынка также отмечено, что «…установление обязанности по страхованию одновременно возлагает на страхо- вателя бремя дополнительных расходов, которые могут оказаться неоправданными в условиях невысокой общественной опасности» [3, с. 3]. Несмотря на справедливость данного высказывания и на так называемую «невысокую общественную опасность» рассматриваемого вида рисков (уточним, что в первой фазе испытаний препаратов принимает участие небольшая группа добровольцев, обычно 20-200 человек, а в некоторых случаях всего 15-30 человек [4], а статистические данные свидетельствуют, что в целом по РФ в среднем заключается всего порядка четырехсот подобных договоров (рис. 1)), страхование жизни и здоровья пациентов, участвующих в клинических исследованиях лекарственного препарата, все же стоит отнести к обязательным видам страхования, поскольку в законе № 61-ФЗ «Об обращении лекарственных средств» содержатся основные существенные положения обязательного страхования (см. ст. 44), которые затем детализированы и уточнены в Постановлении Правительства РФ от 13.09.2010 № 714, утверждающем типовые правила обязательного страхования жизни и здоровья пациента, участвующего в клинических исследованиях лекарственного препарата [5, 6].
Таблица 2. Нормативно-правовое регулирование обязательного страхования жизни и здоровья пациента, участвующего в клинических исследованиях лекарственного препарата
|
№ п/п |
Нормативный акт |
Краткая характеристика |
|
1 |
Гражданский кодекс Российской Федерации |
в п. 2 ст. 927 дано следующее определение обязательного страхования – «страхование в случаях, когда законом на указанных в нем лиц возлагается обязанность страховать в качестве страхователей жизнь, здоровье или имущество других лиц либо свою гражданскую ответственность перед другими лицами за свой счет или за счет заинтересованных лиц». |
|
п. 1 ст. 935 содержит указание на то, что «законом на указанных в нем лиц может быть возложена обязанность страховать: жизнь, здоровье или имущество других определенных в законе лиц на случай причинения вреда их жизни, здоровью или имуществу; риск своей гражданской ответственности, которая может наступить вследствие причинения вреда жизни, здоровью или имуществу других лиц или нарушения договоров с другими лицами». |
||
|
2 |
Закон РФ от 27.11.1992 № 4015-1 (ред. от 30.12.2020) «Об организации страхового дела в Российской Федерации» |
в п. 4 ст. 3 прописаны конкретные требования к обязательному страхованию: «…федеральный закон о конкретном виде обязательного страхования должен содержать положения, определяющие субъектов страхования; объекты, подлежащие страхованию; перечень страховых случаев; минимальный размер страховой суммы или порядок ее определения; размер, структуру или порядок определения страхового тарифа; срок и порядок уплаты страховой премии (страховых взносов); срок действия договора страхования; порядок определения размера страховой выплаты; контроль за осуществлением страхования; последствия неисполнения или ненадлежащего исполнения обязательств субъектами страхования; иные положения». |
|
4 |
Федеральный закон от 12.04.2010 № 61-ФЗ (ред. от 22.12.2020) «Об обращении лекарственных средств» |
в п. 1 ст. 44 четко определен страхователь, который обязан осуществлять страхование жизни и здоровья пациента, участвующего в клинических исследованиях лекарственного препарата; также обозначены объект и срок страхования, страховые случаи, размеры страховых выплат при наступлении страховых случаев и др. |
|
5 |
Постановление Правительства РФ от 13.09.2010 № 714 (ред. от 15.10.2014) «Об утверждении Типовых правил обязательного страхования жизни и здоровья пациента, участвующего в клинических исследованиях лекарственного препарата» |
Постановление утверждает правила обязательного страхования жизни и здоровья пациента, участвующего в клинических исследованиях лекарственного препарата, в т. ч. устанавливает страховые тарифы и порядок уплаты страховой премии; дает перечень необходимых документов для осуществления страховой выплаты; прописывает порядок реализации прав и обязанностей сторон по договору страхования и др. |
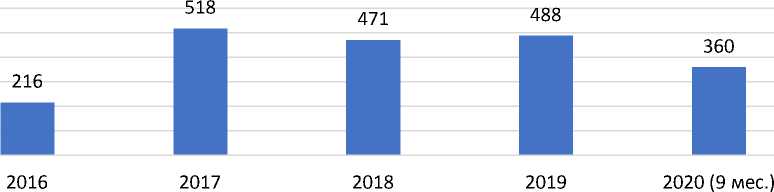
Рис. 1. Количество договоров страхования пациентов, заключенных в отчетном периоде в целом по РФ (составлено по данным ЦБР)
В качестве одного из ключевых факторов эффективности вмененного страхования в докладе Департамента страхового рынка назван «баланс интересов страхователя, на которого возлагается обязанность по заключению договора страхования, с одной стороны, и необходимость защиты общественных интересов в соответствующей сфере деятельности, с другой стороны» [3, с. 3]. Здесь согласимся, поскольку полагаем, что расходы страхователей на осуществление рассматриваемого вида страхования несколько завышены. Так, в зависимости от целей клинических исследований ставка страхового тарифа находится в диапазоне от 1445 руб. до 9811 руб. в расчете на одного пациента, а стра- ховая выплата предусмотрена законодательством в размере от 300 тыс. руб. (при ухудшении здоровья застрахованного лица, не повлекшем за собой установление инвалидности) до 2 млн. руб. (в случае смерти застрахованного лица) [5, 6]. При этом статистические данные (табл. 3) свидетельствуют о том, что на протяжении последних пяти лет убыточность страховой суммы по данному виду страхования достигала максимум 0,023 руб. со 100 рублей страховой суммы, а уровень выплат колеблется от 4,9 до 18%, что значительно ниже, чем в целом по добровольному (32,5%) и обязательному сегментам страхования (68,6%).
Таблица 3. Показатели по страхованию пациентов, участвующих в клинических иссле- дованиях клинического препарата для медицинского применения (в целом по РФ) [3]
|
Годы |
Страховая сумма по договорам, заключенным в отчетном периоде, тыс. руб. |
Страховые премии по договорам страхования, тыс. руб. |
Выплаты по договорам страхования, всего, тыс. руб. |
Уровень выплат, % |
Убыточность страховой суммы, руб. на 100 руб. страховой суммы |
|
2016 |
34186510 |
42205 |
2072 |
4,9 |
0,006 |
|
2017 |
249358000 |
97140 |
10225 |
10,5 |
0,004 |
|
2018 |
86792000 |
117332 |
9460 |
8,1 |
0,011 |
|
2019 |
96738200 |
122958 |
22148 |
18,0 |
0,023 |
|
2020 (9 мес.) |
74418000 |
109799 |
10152 |
9,2 |
0,014 |
Такой низкий уровень убыточности свидетельствует о том, что в страховых резервах страховщиков аккумулируется минимум в 5,5 раз больше денежных средств, чем выплачивается застрахованным лицам или их выгодоприобретателям. Статистические данные страховщиков также указывают на наличие высокой доли отказов в страховой выплате: в страховании жизни и здоровья пациентов при проведении кинических исследований доля отказов ежегодно превышает 50% [3, c. 1213]. В некоторых случаях страховые выплаты производятся страховщиками лишь по решению суда, например, в 2019 г. доля таких выплат составила около 20%. Считаем, что подобный порядок урегулирования страховых случаев формирует негативное отношение к данному виду страхования и требует со стороны надзорного органа бо- лее пристального внимания к страховщикам, практикующим регулярные отказы в выплатах.
Заключение. Несмотря на низкий уровень страховых выплат, все же не стоит говорить о безусловной «нефункциональ-ности» данного вида страхования, отнесенного в докладе Департамента страхового рынка к вмененным, его вполне обоснованно можно считать обязательным и целесообразным. Полагаем, что для снижения бремени расходов страхователей необходимо более детальное изучение вопроса и разработка предложений по оптимизации страховых тарифов.
Список литературы К вопросу об обязательном страховании пациентов, участвующих в клинических исследованиях
- Турчаева И.Н. Экономическая безопасность личности: понятие, формы, меры и способы обеспечения / И.Н. Турчаева, А.А. Брылев, В.А. Негода // Калужский экономический вестник. - 2020. - №4. - С. 28-34.
- Турчаева И.Н. Финансовая среда предпринимательства и предпринимательские риски: учебник и практикум для вузов / И.Н. Турчаева, Я.Ю. Таенчук. - М.: Изд-во Юрайт, 2020. - 213 с.
- Доклад. Текущее состояние страхового рынка в Российской Федерации в сегменте вмененного страхования. Февраль 2021 года. Материал подготовлен Департаментом страхового рынка Центрального банка России. - [Электронный ресурс]. - Режим доступа: https://cbr.ru/Content/Document/File/118732/report_insurance_20210219.pdf.
- Давыдов Д. Последние испытания. Как устроены клинические исследования новых лекарств. - [Электронный ресурс]. - Режим доступа: https://nplus1.ru/material/2020/07/08/clinical-trial-phases (дата обращения: 26.02.2021).
- Российская Федерация. Законы. Федеральный закон от 12.04.2010 № 61-ФЗ "Об обращении лекарственных средств": ФЗ: текст по состоянию на 22 декабря 2020 года [Принят Государственной Думой 24 марта 2010 года, одобрен Советом Федерации 31 марта 2010 года] // Доступ из справ.-правовой системы КонсультантПлюс.
- Об утверждении Типовых правил обязательного страхования жизни и здоровья пациента, участвующего в клинических исследованиях лекарственного препарата [утверждено Постановлением Правительства РФ от 13 сентября 2010 № 714, ред. от 15.10.2014] // Доступ из справ.-правовой системы КонсультантПлюс.


