К вопросу об участии вазопрессинергической системы в регуляции адаптивного поведения у крыс
Автор: Беляков Владимир Иванович, Петрова Альбина Анатольевна, Инюшкин Алексей Николаевич
Журнал: Вестник медицинского института "РЕАВИЗ": реабилитация, врач и здоровье @vestnik-reaviz
Рубрика: Физиология
Статья в выпуске: 4 (24), 2016 года.
Бесплатный доступ
В модельных экспериментах на крысах изучено влияние десмопрессина (структурного аналога аргинин-вазопрессина), активирующего V2-рецепторы, на различные компоненты адаптивного поведения. В тесте «Открытое поле» установлено, что под влиянием десмопрессина усиливается горизонтальная и вертикальная двигательная активность на фоне сравнительно низкого уровня исследовательского поведения. В тестах «Приподнятый крестообразный лабиринт» и «Черно-белая камера» показано усиление уровня тревожности при длительной активации V2-рецепторов. В тесте «Восьмирукавный радиальный лабиринт» установлено отрицательное влияние десмопрессина на обучение и пространственную память при реализации пищепоискового поведения. Предполагается, что в основе наблюдаемых эффектов лежит угнетение по механизму отрицательной обратной связи продукции эндогенного вазопрессина и снижение функциональной активности V-рецепторов мозга.
Десмопрессин, вазопрессин, v-рецепторы, поведение, крысы
Короткий адрес: https://sciup.org/14344233
IDR: 14344233 | УДК: 612.821.6
Текст научной статьи К вопросу об участии вазопрессинергической системы в регуляции адаптивного поведения у крыс
Введение. Вазопрессин (аргинин-вазопрессин, антидиуретический гормон, АДГ) является нонапептидным гормоном, синтезирующимся крупноклеточными нейронами супраопти- ческого и паравентрикулярного ядер гипоталамуса. Образование данного нейрогормона происходит в виде предшественника (препроАДГ), который на уровне гипоталамуса ферментативным образом трансформируется в проАДГ. Последний в составе нейросекреторных гранул по аксональным проекциям транспортируется в нейрогипофиз. По мере транспортировки осуществляется расщепление проАДГ на АДГ и белок нейрофизин [4].
Согласно современным представлениям вазопрессин обладает широким спектром биологической активности. Основной классический эффект вазопрессина связан с влиянием на механизм реабсорбции воды в проксимальных канальцах и собирательных трубках почечных нефронов, приводящим к уменьшению выделения мочи и, соответственно, увеличению содержания жидкости в организме. Такое антидиуретическое действие вазопрессина опосредуется V2-рецепторами и запуском аденилатциклазного пути передачи гормонального сигнала. Относительно высокий уровень вазопрессина обеспечивает повышение периферического сосудистого сопротивления на фоне возрастания объема циркулирующей крови. Сосудистый эффект вазопрессина связан с активацией преимущественно V1A-рецепторов миоцитов [4, 5]. Кроме того, вазопрессин обладает потенциалом модулирующего влияния на функционирование гипоталамо-гипофизарно-надпочечниковой системы, процессы гемостаза, клеточной пролиферации, иммунные функции, липидный обмен, болевую чувствительность, программу развития старения и др. биологические явления и процессы [1, 7].
Имеются многочисленные данные о способности компонентов вазопрессинергической системы определять уровень функциональной активности структур мозга, контролирующих эмоционально-мотивационный статус и когнитивные функции организма. В одной из первых работ, посвященных оценке психотропной активности вазопрессина, приводятся данные о том, что экстирпация нейрогипофиза сопровождается нарушением консолидации памяти при выработке условной реакции пассивного избегания электроболевого раздражения [9]. Исследования на рецепторном уровне показывают, что активация как V1-, так и V2-рецепторов позитивно влияет на формирование памятного следа при выработке условно-рефлекторной реакции избегания аверсивного сигнала, в то время как блокада V1-рецепторов – оказывает противоположный эффект. Получены данные о положительном влиянии агонистов V1A- и V1B-рецепторов на пространственную память у крыс [2, 3, 5]. Отмечается значение вазопрессина в регуляции социального поведения у грызунов, связанного с распознаванием и установлением более тесной коммуникации с особями из одной группы. Получены данные о негативном влиянии блокады V1A-рецепторов на материнское поведение у крыс. Локализация различных V-рецепторов в обонятельных структурах мозга указывает на значение вазопрессина в процессах рецепции одорантов и функционировании обонятельной памяти. Детализирована роль вазопрессина и его рецепторов в контроле эмоционального состояния. Так, внутрицентральная микроинъекция вазопрессина вызывает агрессивное поведение на фоне повышение уровня тревожности. Блокада V1A-рецепторов, напротив, сопровождается седативным действием [6–8, 10].
Весьма ценные сведения о значении вазопрессина в регуляции высших мозговых функций получены на вазопрессин-дефицитных крысах линии Brattleboro (экспериментальная модель несахарного диабета). У таких животных отмечаются нарушения условнорефлекторной деятельности и социальной памяти, которые могут отчасти купироваться центральным введением агонистов вазопрессина [2].
В клинических наблюдениях описывается связь дисфункции вазопрессинергической системы с паркинсонизмом, шизофренией, тревогой, депрессией и другими неврологическими расстройствами [1, 7].
Таким образом, вазопрессинергическая система, имея представительство в различных структурах мозга, модулирует его функции и компоненты поведения в зависимости от функционального состояния и сложившихся условий существования организма. Дальнейшее изучение данного вопроса предполагает проведение системных исследований по оценке поведенческих эффектов вазопрессина, использование новых подходов и экспериментальных моделей, изменяющих функциональное состояние элементов самой вазопрессинергической системы. В этом плане интерес представляет фармакологический способ коррекции системы обратной связи в данной системе, который, в частности, может обеспечиваться активацией V2-рецепторов почек.
Цель исследования – провести комплексный анализ влияния агониста V2-рецепторов десмопрессина (структурного аналога аргинин-вазопрессина) на особенности адаптивного поведения крыс в различных тестовых установках.
Материалы и методы исследования. Исследования проведены на 20 нелинейных крысах-самцах массой 250–300 граммов в летний период. Условия содержания лабораторных животных и методика исследования соответствовали общепринятым нормам гуманного отношения к лабораторным животным. Протокол эксперимента утвержден на заседании комиссии по биоэтике Самарского университета. Животные содержались в стандартных условиях вивария (режим освещения – 12:12; температура в помещении – 18–20 °С; влажность воздуха – 60–70 %). Крысы находились в клетках для мелких грызунов по 9 особей. Кормление крыс осуществлялось в свободном режиме смесью для грызунов, вода подавалась ad libitum при помощи автоматических поилок.
Для проведения исследования формировали две группы крыс. Крысам опытной группы (n = 10) ежедневно на протяжении 21 суток per os вводили 1 мл раствора десмопрессина ацетата (структурный аналог аргинин-вазопрессина; 0,003 мг/кг; Ferring , Швейцария), не проникающего через гематоэнцефалический барьер и активирующего V2-рецепторы дистальных канальцев и собирательных трубок почечных нефронов [4, 5]. Животные контрольной группы (n = 10) по аналогичной схеме получали воду для инъекций (Биохимик, Россия). Тестирование поведенческого статуса животных осуществляли в исходном состоянии, через 7, 14 и 21 день от начала введения веществ.
Изучение особенностей поведения крыс проводилось при помощи классических поведенческих тестов: «Открытое поле», «Черно-белая камера», «Приподнятый крестообразный лабиринт», «Восьмирукавный радиальный лабиринт» (Openscience, Россия). В тесте «Открытое поле» поведенческие реакции животных регистрировали в течение трех минут по следующим параметрам: горизонтальная активность (число пересеченных секторов), вертикальная активность (число стоек на задних лапах с опорой на стенки и самостоятельно), исследовательская активность (число обследованных отверстий), уровень тревожности (число актов незавершенного, короткого груминга). Для оптимизации процедуры оценки показателей паттерна поведения в тесте «Открытое поле» использовали программу RealTimer. В тесте «Черно-белая камера» изучали поведение животных в условиях переменной стрессогенности (при свободном выборе комфортных условий). Для этого оценивали время пребывания крыс в черном и белом отсеках камеры. В тесте «Приподнятый крестообразный лабиринт» отмечали время (с) нахождения крыс в открытых и закрытых рукавах лабиринта, установленного на высоте одного метра от пола. Предпочтение животными открытых рукавов в данном тесте и белой камеры в тесте «Черно-белая камера» расценивали как показатель низкого уровня тревожности и активного проявления ориентировочно-исследовательского поведения. Для ана- лиза функции пространственной памяти в тесте «Восьмирукавный радиальный лабиринт» определяли время нахождения (с) пищевой приманки в одном из рукавов лабиринта при первом, втором (через 1 минуту) и третьем (через 3 минуты) подсаживании животных в контрольный рукав. Сокращение времени нахождения пищевого стимула при повторных подсадках животных расценивали как проявление обучения и активизации функции пространственной памяти.
Полученные экспериментальные данные статистически обрабатывали с помощью пакетов анализа данных программы SigmaPlot 12.0 с использованием теста ANOVA , t-теста Стьюдента. Различия считались статистически значимыми при p < 0,05. Результаты исследования представлены как среднее значение ±стандартная ошибка среднего.
Результаты и их обсуждение. Анализ структуры поведенческого паттерна в исходном состоянии не выявил значимых отличий между крысами контрольной и опытной групп. Введение животным в течение 21 дня аналога аргинин-вазопрессина (десмопрессина) обеспечивало перестройку показателей поведения, тип и выраженность которых определялись сроком воздействия вещества (рис. 1).
На 7-е сутки от начала введения вещества регистрировалась тенденция усиления двигательной активности по горизонтали, связанной с освоением секторов тестовой площадки «Открытого поля». Через 14 дней отмечалось статистически значимое возрастание данного показателя в среднем на 42 % (р < 0,05). К концу наблюдения горизонтальная двигательная активность поддерживалась на повышенном уровне с тенденцией возврата к исходному значению. Совершенно иную стратегию горизонтальной локомоции демонстрировали контрольные особи, у которых на протяжении всего периода наблюдения отмечалось снижение представленности данного варианта двигательного поведения в сравнении с исходным уровнем: на 7-е сутки от момента введения десмопрессина горизонтальная активность уменьшалась на 30 % (р < 0,05), на 14-е утки – на 17 % (р > 0,05), на 21 день – на 45 % (р < 0,05). На 14-е и 21-е сутки наблюдения регистрировались значимые отличия по данному показателю между группами. При этом отмечена специфика траектории горизонтального перемещения у крыс с различным уровнем функциональной активности V2-рецепторов. Крысы, подвергавшиеся воздействию агониста V-2 рецепторов, более активно осваивали всю территорию площадки теста, совершая переходы между периферическими и центральными секторами. Контрольные животные, напротив, предпочитали перемещаться по периферии тестового задания. Определенные межгрупповые отличия были установлены и в случае вертикальной двигательной активности. Под влиянием десмопрессина отчетливо проявлялась тенденция к возрастанию данного показателя. К 14-му и 21-му дням наблюдения фиксировалось статистически значимое увеличение двигательной активности по вертикали, соответственно, на 53 % (р < 0,05) и на 57 % (р < 0,05). Контрольные крысы демонстрировали неоднозначный характер перестроек данного показателя: на 7-е сутки показатель не изменялся, на 14-е сутки увеличивался на 58 % (р < 0,05), а к 21-му дню наблюдения уменьшался до первоначального значения. Исследовательский компонент поведения в обеих группах изменялся в сторону уменьшения, но в большей степени у крыс, получавших десмопрессин. К 7-м суткам уменьшение составило в среднем 74 % (р < 0,01). В дальнейшем данный показатель поддерживался на пониженном уровне до конца наблюдения. В контрольной группе исследовательская активность максимально снижалась к 14-му дню на 28 % (р < 0,05). Реакции тревожного гру-минга также более закономерно перестраивались в случае контрольных особей. В целом у них проявлялось ослабление представленности актов смещенной активности (универсального показателя тревожности в стрессогенных условиях), которое к 14-му дню эксперимента 116
составило 33 % (р < 0,05), 21-му дню – 47 % (р < 0,05). Какой-либо отчетливой динамики в изменениях уровня тревожности под влиянием десмопрессина не установлено. На 21-е сутки наблюдения регистрировалось значимое отличие в уровне тревожности между группами.
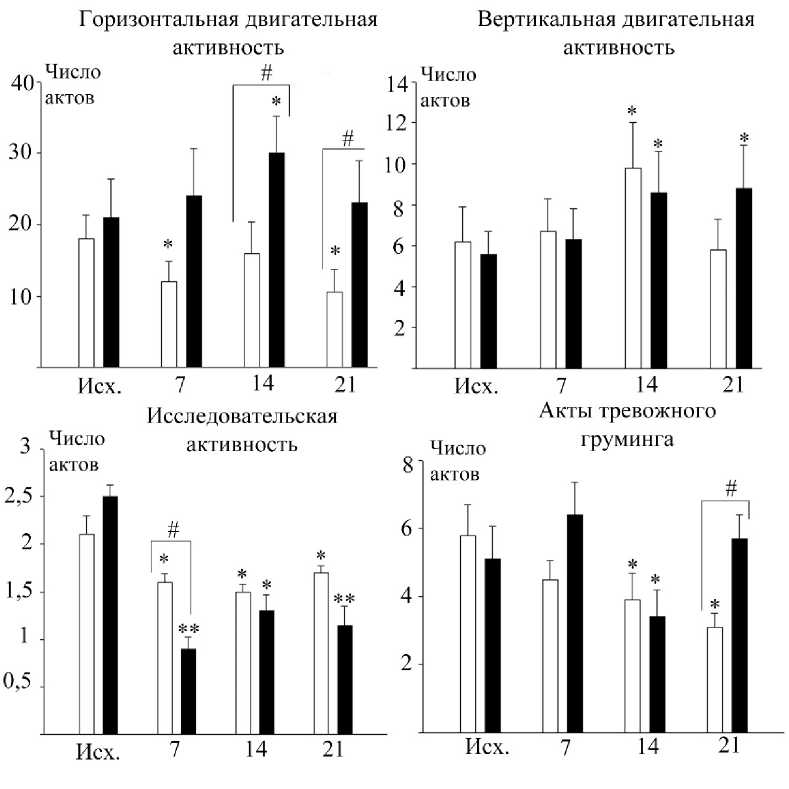
Рис. 1. Изменение показателей поведения в тесте «Открытое поле»: белые столбики – контрольная группа крыс, черные столбики – группа крыс, получавших десмопрессин; 7, 14 и 21 – дни наблюдения; *, ** – отличия по сравнению с исходным уровнем, соответственно, при р < 0,05 и р < 0,01, # – отличия между группами при р < 0,05
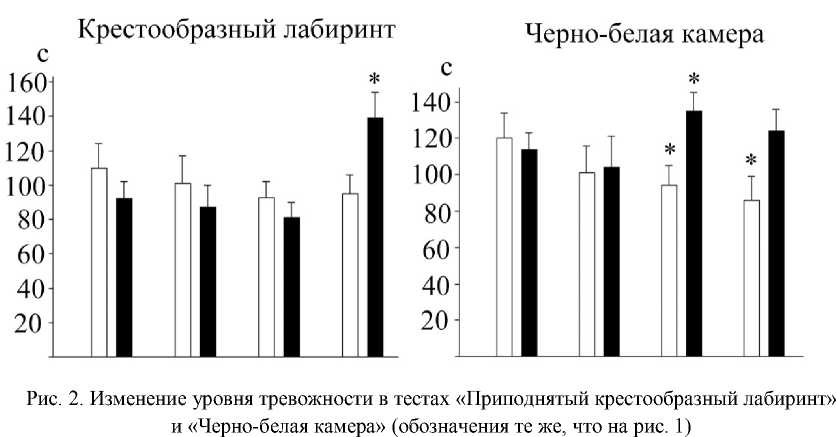
Неоднозначные результаты по идентификации уровня тревожности установлены в тестах «Приподнятый крестообразный лабиринт» и «Черно-белая камера» (рис. 2). Основным эффектом длительного воздействия вещества в первом тесте являлось увеличение времени нахождения животных в закрытых рукавах теста к 21-му дню наблюдения на 51 % (р < 0,05), что в целом указывает на возрастание уровня тревожности. Крысы из контрольной группы характеризовались более стабильным эмоциональным статусом, о чем свидетельствовало отсутствие изменений времени нахождения в закрытых рукавах теста. Однако в отличие от крыс, находившихся под влиянием десмопрессина, они чаще совершали выходы в центральный сектор тестовой площадки и более выраженно демонстрировали реакции по типу свешиваний с открытых рукавов теста. Отмеченные особенности являются поведенческим коррелятом относительно комфортного состояния в условиях оптимальной по выраженности тревожности. В тесте «Черно-белая камера» десмопрессин повышал уровень тревожности к 14-му дню наблюдения на 18 % (р < 0,05), затем данный показатель снижался, но при этом не достигал исходного значения. У крыс из контрольной группы отмечался пониженный уро- вень тревожности к 14-му и 21-му дням (уменьшение на 22 % (р < 0,05) и 29 % (р < 0,05) соответственно срокам наблюдения).
Тестирование животных в «Восьмирукавном радиальном лабиринте» позволило выявить характер влияния исследуемого вещества на пространственную память, связанную с реализацией пищепоискового поведения. В исходном состоянии крысы из контрольной и опытной групп существенным образом не отличались по времени нахождения пищевой приманки в одном из рукавов сложного лабиринта. Все они демонстрировали более успешное выполнение задания по поиску пищи при повторном подсаживании в тестовое задание. Так, в контрольной группе среднее время нахождения стимула при первом тестировании составляло 140 с, в опытной группе – 124 с. При втором подсаживании (через 1 минуту) время поиска сокращалось в контрольной группе до 94 с (р < 0,05), в опытной – до 88 с (р < 0,05). В условиях третьего подсаживания (через 3 минуты) время нахождения пищевого стимула несколько снижалось, но статистически не отличалось от времени пищепоискового поведения при втором подсаживании.
Через 21 день от начала введения десмопрессина отмечено выраженное влияние активации V2-рецепторов на пространственную ориентацию крыс в радиальном лабиринте и эффективность поиска пищевого стимула (рис. 3). Тип данного влияния можно определить в целом как отрицательный, т.к. крысы, получавшие десмопрессин, показывали увеличение времени поиска при повторных предъявлениях тестового задания: первоначальное время поиска составляло 58 с, при втором подсаживании – 65 с (увеличение на 12 %; (р > 0,05), при третьем подсаживании время возрастало почти в 2 раза (р < 0,01). У контрольных особей, напротив, наблюдалось сокращение времени нахождения стимула к третьему тестированию на 39 % (р < 0,01). На 21-е сутки при третьей подсадке регистрировалось значимое отличие пищепоискового поведения между группами.
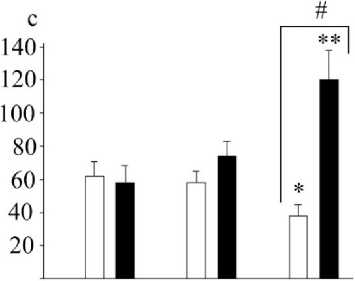
Первая Вторая Третья подсадка подсадка подсадка
Рис. 3. Изменение времени нахождения пищевого стимула в «Радиальном восьмирукавном лабиринте» (обозначения те же, что на рис. 1)
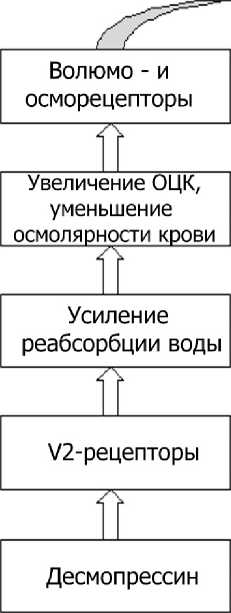
На основании полученных результатов можно заключить, что введение десмопрессина, являющегося аналогом аргинин-вазопрессина, определенным образом модулирует поведенческий фенотип крыс в различных тестовых заданиях. Сама специфика модулирующего влияния, по всей видимости, определяется повышением функциональной активности V-2 рецепторов (рис. 4). Известно, что под влиянием десмопрессина усиливается функция аквапор дистальных канальцев и собирательных трубок нефронов по обратной реабсорбции воды с закономерным изменением показателей гемодинамики и крови (увеличение объема циркулирующей крови, снижение осмолярности плазмы крови). Отмеченные перестройки улавливаются периферическими и центральными волюмо- и осморецепторами, что сопровождается угнетением потребления воды и снижением продукции вазопрессина супраоптическими и паравентрикулярными ядрами гипоталамуса. По существу в условиях действия десмопрессина запускается обратная связь в функциональной системе «V2-рецепторы – центры волю-мо- и осморегуляции гипоталамуса». Косвенным подтверждением описанного механизма может служить зарегистрированное в настоящем исследовании уменьшение потребления воды крысами, находившимися под влиянием десмопрессина. Так, к 14-му дню воздействия десмопрессина потребление воды снизилось на 19 % (р < 0,05), к 21 дню – на 20 % (р < 0,05).
Центральный механизм действия самого десмопрессина следует исключить, т.к. данный аналог аргинин-вазопрессина характеризуется измененной структурой (дезаминирование 1-цистеина, замещение 8-L-аргинина на 8-D-аргинин), обеспечивающей его периферическое действие. Угнетение продукции вазопрессина и снижение функциональной активности представленных в различных структурах центральной нервной системы V1А- и V1B-рецепторов, по всей видимости, и вызывает формирование специфического поведенческого статуса крыс. По данным литературы, V-представлены в структурах головного мозга, имеющих непосредственное отношение к контролю когнитивных процессов и эмоционального реагирования на действующие факторы среды (гиппокамп, миндалина, гипоталамус и др.) [2, 3, 6, 8, 10]. Установлено, что активация центральных V-рецепторов оказывает позитивное влияние прежде всего на функции памяти и обучения [2, 6, 7]. Получены данные о значении вазопрессина в регуляции продукции адренокортикотропного гормона (АКТГ). Вазопрессин, активируя V1B-рецепторы аденогипофиза, синергично с кортиколиберином способствует выработке АКТГ [2, 3, 7]. Дефицит эндогенного вазопрессина, снижение активности V-рецепторов мозга, напротив, нарушают процессы фиксации и консолидации информации, сопровождаются седативным эффектом. Кроме того, изменение уровня функционирования вазопрессинергической системы модулирует активность других нейромедиаторных и нейро-модуляторных систем [6, 8].
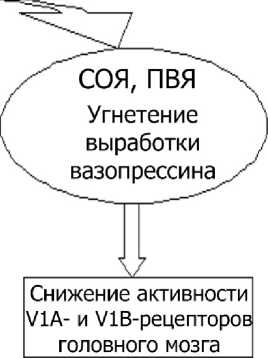
\/
Изменение поведенческого фенотипа
Рис. 4. Схема возможных функциональных перестроек в условиях активации десмопрессином V2-рецепторов: ОЦК – объем циркулирующей крови, СОЯ – супраоптическое ядро, ПВЯ – паравентрикулярное ядро
Заключение. Результаты проведенного исследования показали, что десмопрессин (структурный аналог аргинин-вазопрессина), действующий через V2-рецепторы, оказывает модулирующее влияние на различные варианты двигательного поведения, проявление исследовательской активности, уровень тревожности, а также способность к обучению при реализации пищепоискового поведения. Полученные результаты могут быть связаны с изменением продукции эндогенного вазопрессина и активности центральных V-рецепторов.
Исследование проведено при поддержке гранта РФФИ № 16-44-630632 р_а.
Список литературы К вопросу об участии вазопрессинергической системы в регуляции адаптивного поведения у крыс
- Белоскокова С.Г., Цикунов С.Г. Агонист У2-рецепторов вазопрессина, 1-дезамино-8-Э-аргинин-вазопрессин, редуцирует симптомы паркинсонизма//Обзоры по клин. и фармакол. и лекарст. терапии. -2013. -Т. 11. -№ 4. -С. 61-67.
- Белоскокова С.Г., Цикунов С.Г. Нейропептид вазопрессин и процессы памяти//Обзоры клинической фармакологии и лекарственной терапии. -2014. -Т. 12. -№ 3. -С. 3-12.
- Голубева М.Г., Калишевская Т.М., Григорьева М.Е. и др. Влияние аналога вазопрессина дезглициламид-аргинилвазопрессина при интраназальном введении на процессы обучения и состояние системы гемостаза в эксперименте//Вестник Моск. Ун-та. 1994. -Сер. 16. Биология. -№ 4. -С. 28-31.
- Иванова Л. Н. Вазопрессин: клеточные и молекулярные аспекты антидиуретического действия//Вестник РАМН. -1999. -№ 3. -С. 40-45.
- Рудиченко В. М. Клиническая и экспериментальная фармакология агонистов и антагонистов вазопрессина//Экспериментальная и клиническая фармакология. -1994. -№ 2. -С. 6-73.
- Телегди Г., Ковач Г.Л. Влияние вазопрессина и окситоцина на поведенческие процессы и метаболизм нейротрансмиттеров мозга у крыс//Проблемы эндокринологии. -1980. -Т. 26. -№ 6. -С. 37-41.
- Тюзиков И.А., Калиниченко С.Ю., Ворслов Л.О., Титова Ю.А. Вазопрессин: неклассические эффекты и роль в патогенезе ассоциированных с возрастом заболеваний//Эффективная фармакотерапия. -2015. -№ 26. -С. 38-50.
- Цикунов С.Г., Белоскокова С.Г. Роль вазопрессина в регуляции функций ЦНС//Мед. акад. журн. -2010. -Т. 10. -№ 4. -С. 218-228.
- De Wied D. The influence of the posterior and intermediate lobe of the pituitary and pituitary peptides on the maintenance of a conditioned avoidance response in rats//Int. J. Neuropharmacol. -1965. -№ 4. -Р. 157-167.
- &agg B. Ji G., Neugebauer V. Differential contributions of vasopressin V1A and oxytocin receptors in the amyg-dale to pain-related behaviors in rats//Mol. Pain. -2016. -V. 11. -P. 12.


