Кафедра факультетской педиатрии Саратовского государственного медицинского университета: история семидесятилетнего пути
Автор: Горемыкин В.И., Королва И.В., Просова Е.Е., Сидорович О.В., Елизарова С.Ю., Хижняк А.В., Кузнецова Н.А., Спиваковский Ю.М.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Научные школы и памятные даты
Статья в выпуске: 4 т.17, 2021 года.
Бесплатный доступ
В статье представлена история кафедры факультетской педиатрии Саратовского медицинского университета имени В. И. Разумовского. Прослежен путь становления научной школы педиатров начиная с периода создания кафедры в 1949 г. и до настоящего времени. Освещены основные научные направления работы кафедры за этот временной отрезок.
История кафедры, кафедра факультетской педиатрии, саратовский медицинский университет
Короткий адрес: https://sciup.org/149139778
IDR: 149139778 | УДК: 61:378.4+378.016:616-053.2:001.92
Текст научной статьи Кафедра факультетской педиатрии Саратовского государственного медицинского университета: история семидесятилетнего пути
радикалами и антиоксидантами смещается в сторону последних, что может способствовать блоку апоптоза, управляемого активными формами кислорода, и стимуляции метастазирования [4, 5]. Ранее также было показано, что N-ацетилцистеин и витамин Е ускоряют метастазирование при экспериментальных раке легких и меланоме у мышей [6]. В то же время высокие дозы витамина С увеличивают внутриклеточную концентрацию активных форм кислорода (АФК) в клетках колоректального рака человека с мутациями KRAS или BRAF с последующими биоэнергетическим кризисом и гибелью опухолевых клеток [6, 7]. Иные данные имеются при совместном использовании антиоксидантов с цитостатиками. Ряд исследований показал способность мелатонина, обладающего антиоксидантным действием, усиливать цитотоксическое действие химиотерапевтических агентов на опухолевые клетки в зависимости от дозы, а также формы и типа рака [8, 9]. Другие средства с антиоксидантной активностью, в частности Мекси-дол и Ксимедон, не влияют на противоопухолевую и антиметастатическую эффективность комбинации «доксорубицин+паклитаксел» в эксперименте [10]. Следовательно, влияние антиоксидантов на конечный эффект антибластомной химиотерапии зависит от типа опухоли и механизмов действия противоопухолевых препаратов и антиоксидантов, используемых в лечении [11]. Именно поэтому необходимы дополнительные исследования в оценке возможности применения антиоксидантных средств при противоопухолевой химиотерапии.
Цель — оценить влияние липосомальных форм Ксимедона и Мексидола на противоопухолевую и ан-тиметастатическую эффективность липосомальной комбинации «доксорубицин/циклофосфамид» у подопытных крыс с карциномой Walker-256.
Материал и методы. Экспериментальное исследование проведено на базе кафедры фармакологии и клинической фармакологии ФГБОУ ВО «МГУ им. Н. П. Огарёва» с соблюдением принципов Европейской конвенции о защите позвоночных животных, используемых для экспериментов и других научных целей (Страсбург, 1986), национальных руководств (ГОСТы 33215–2014 и 34088–2017) и правил учреждения по содержанию и использованию лабораторных животных. Животные (116 крыс-самок Вистар с массой тела 170–270 г.) находились на стандартном режиме вивария и имели свободный доступ к воде и корму. Всех крыс разделили на две большие группы: в 1-й группе ( n =56) первичный опухолевый очаг формировался внутримышечным введением (в бедро задней лапки) взвеси клеток опухолевого штамма Walker-256 (W-256) (106 клеток на изотоническом растворе натрия хлорида), во 2-й ( n =60) — метастатический процесс моделировался подкожным введением того же количества опухолевых клеток в среднюю треть хвоста. Далее в каждой группе животных разделили на 11 подгрупп по 5–7 крыс: в 1-ю подгруппу входили крысы с перевитым штаммом W-256, не получавшие лечения (контроль); во 2-ю — крысы с W-256, получавшие доксорубицин (4 мг/кг) и циклофосфамид (45 мг/кг) в свободной форме однократно в боковую хвостовую вену на 11-е сутки после перевивки штамма W-256; в 3-ю — крысы с W-256, получавшие липосомальную комбинацию «доксорубицин (4 мг/кг) + циклофосфамид (45 мг/кг)» однократно внутривенно на 11-е сутки после перевивки штамма W-256; в 4-ю — крысы с W-256, получавшие липосомальные цитостатики (как в 3-й подгруппе) и липосомальный Ксимедон (50 мг/кг) внутривенно ежедневно с начала применения цитостатиков, в течение 5 суток; в 5-ю — крысы с W-256, получавшие липосомальные цитостатики и липосомальный Ксимедон (100 мг/кг) внутривенно ежедневно с начала применения цитостатиков, в течение 5 суток; в 6-ю — крысы с W-256, получавшие липосомальные цитостатики и липосомальный Мексидол (25 мг/кг) внутривенно ежедневно с начала введения цитостатиков, в течение 5 суток; в 7-ю — крысы с W-256, получавшие липосомальные цитостатики и липосомальный Мексидол (50 мг/кг) внутривенно ежедневно с начала применения цитостатиков, в течение 5 суток; в 8-ю и 9-ю — крысы с W-256, получавшие липосомальные цитостатики и «свободный» Ксимедон в дозах 50 и 100 мг/кг соответственно внутривенно ежедневно с начала применения цитостатиков, в течение 5 суток; в 10-ю и 11-ю — крысы с W-256, получавшие липосомальные цитостатики и «свободный» Мексидол в дозах 25 и 50 мг/кг соответственно внутривенно ежедневно с начала введения цитостатиков, в течение 5 суток.
Животным вводили официнальные лекарственные формы доксорубицина гидрохлорида («Ebewe Pharma», Австрия) в виде 0,04%-го раствора и циклофосфамида («Baxter oncology», Германия) в виде 0,45%-го раствора, разведенных на изотоническом растворе натрия хлорида. Субстанцию Ксимедона (гидроксиэтилдиметилдигидропиримидина) (ФГУП НИИ «Кристалл», Россия) применяли 10%-м раствором на изотоническом растворе натрия хлорида, Мексидол (этилметилгидроксипиридина сукцината) («Фармасофт», Россия) — официнальным 5%-м водным раствором. Липосомы с антибластомными средствами приготавливали гидратированием раствором доксорубицина (2 мг/мл) липидной пленки из растворенных в хлороформе циклофосфамида (120 мг), лецитина («Lipoid», Германия, 500 мг) и холестерина («Avanti Polar Lipids Inc.», США, 50 мг) с использованием роторного испарителя («Heidolph», Германия) и экструдера (LIPEX, Канада). Очистку липосом от не включившихся в них свободных фракций веществ выполняли путем ультрафильтрации. Анализатором размеров наночастиц NANO-flex (США) оценивали диаметр липосом, который колебался от 60 до 90 нм. Липосомы с Ксимедоном и Мексидо-лом приготавливали так же, используя водные растворы этих средств в концентрациях 50 и 100мг/мл (для Ксимедона) и 25 и 50мг/мл (для Мексидо-ла) для гидратации липидной пленки, получаемой из лецитина и холестерина. Концентрация веществ в липосомах определялась с использованием спектрофотометра Shimadzu (Япония) и составила для доксорубицина и циклофосфамида 1,86мг/мл и 21 мг/мл соответственно, для Ксимедона — 50 и 100мг/мл, для Мексидола — 25 и 50мг/мл.
Объем первичной опухоли в динамике ее роста оценивали на 11, 16 и 20-е сутки опыта, перемножая длину, ширину и высоту опухолевого узла, измеренных штангенциркулем. Всех животных выводили из опыта под наркозом тиопенталом натрия (50 мг/кг) на 20-е сутки эксперимента с последующим вылущиванием первичной опухоли и измерением ее массы. Влияние исследуемых средств на метастатический процесс в легких оценивали по следующим параметрам: визуально определяемое количество поверхностно расположенных метастазов в легких, частота метастазирования, диаметр поверхностных метастатических очагов и индекс ингибирования процесса метастазирования [12]. Число легочных метастазов считали с помощью бинокулярной лупы МБС-9 (увеличение 8×2) после фиксации легких в жидкости Карнуа.
Статистическую обработку цифровых данных осуществляли с расчетом средних арифметических значений ( М ) и их ошибок ( m ) с использованием пакета прикладных программ Statistica 10.0 (StatSoft, Inc.). Проверку нормальности распределения проводили с использованием теста Шапиро — Уилка. Значимость различий в группах по количественному признаку (в показателях объема, массы первичной опухоли, общего количества метастатических узлов в легких, крупных и мелких метастатических очагов) в связи с малыми выборками определяли при помощи U -критерия Манна — Уитни. Достоверность различий в показателях частоты метастазирования определяли при помощи критерия χ2. Различия считали достоверными, если p <0,05.
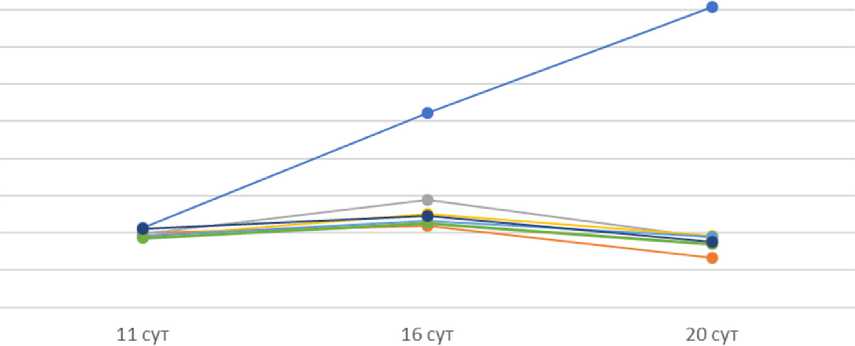
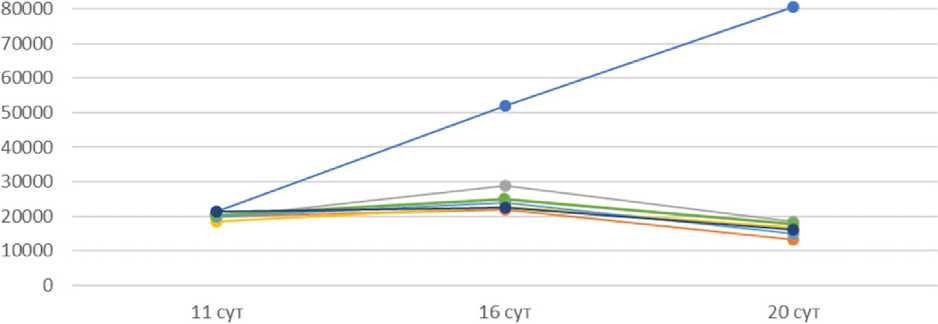
Результаты. Объем первичной опухоли среди крыс с W-256 на фоне применения медикаментозных комбинаций имел значимые изменения на протяжении всего эксперимента. Так, на 16-е сутки опыта объем первичного опухолевого узла во всех экспериментальных подгруппах был достоверно меньше, чем в контроле: во 2-й подгруппе — на 57,9%, в 3-й — на 44,5%, в 4-й — на 51,5%, в 5-й — на 55%, в 6-й — на 56%, в 7-й — на 54%, в 8-й — на 56,5%, в 9-й — на 53%, в 10-й — на 52,3%, в 11-й — на 56,7% ( р =0,001, рис. 1). К концу эксперимента, на 20-е сутки, размеры первичного опухолевого узла продолжали уменьшаться по сравнению с контролем: во 2-й подгруппе — в 6 раз, в 3-й и 5-й — в 4,3 раза, в 4-й — в 4,2 раза, в 6-й — в 4,8 раза, в 7-й — в 5,3 раза, в 8-й — в 4,7 раза, в 9-й — в 4,6 раза, в 10-й — в 4,5 раза, в 11-й — в 4,9 раза ( р <0,001, рис. 1).
мм3
-•-W-256
—♦—W-256+свободные доксорубицин/циклофосфамид
—•—W-256+липосомальные доксорубицин/циклофосфамид
-
— ♦—W-256+липосомальные доксорубицин/циклофосфамид+липосомы с ксимедоном 50 мг/кг
—♦-W-256+липосомальныедоксорубицин/циклофосфамид+липосомы с ксимедоном 100 мг/кг
-
— •—W-256+липосомальныедоксорубицин/циклофосфамид+свободный ксимедон 50 мг/кг
-
— •—W-256+липосомальныедоксорубицин/циклофосфамид+свободный ксимедон 100 мг/кг
А мм3
-e-W-256
-
— •—W-256+свободные доксорубицин/циклофосфамид
-
— •—W-256+липосомальные доксорубицин/циклофосфамид
-
— •—W-256+липосомальные доксорубицин/циклофосфамид+липосомы с мексидолом 25 мг/кг
-
— •—W-256+липосомальные доксорубицин/циклофосфамид+липосомы смексидолом 50мг/кг
-
• W-256+липосомальныедоксорубицин/циклофосфамид+свободный мексидол 25 мг/кг
-
—•—W-256+липосомальные доксорубицин/циклофосфамид+свободный мексидол 50 мг/кг
Б
Рис. 1. Динамика изменения объема первичной опухоли при совместном использовании липосомальных форм Ксимедона
(А) и Мексидола (Б) с липосомальной комбинацией «доксорубицин/циклофосфамид» у крыс с W-256
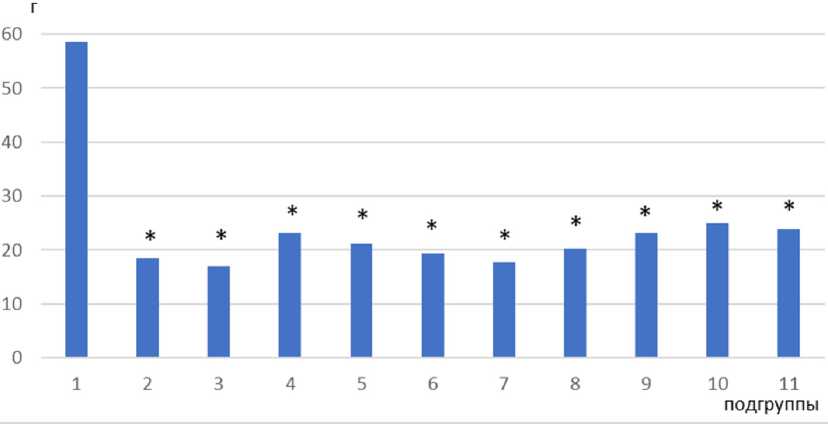
Рис. 2. Изменения массы первичной опухоли у крыс с W-256 при совместном использовании липосомальных форм Ксиме-дона и Мексидола с липосомальной комбинацией «доксорубицин/циклофосфамид»:
1 — контроль W-256 (контроль); 2 — W-256+свободные «доксорубицин/циклофосфамид»; 3 — W-256+липосомальные «доксорубицин/циклофосфамид»; 4 — W-256+липосомальные «доксорубицин/циклофосфамид»+липосомы с Ксимедоном 50 мг/кг; 5 — W-256+липосомальные «доксорубицин/циклофосфамид»+липосомы с Ксимедоном 100мг/кг; 6 — W-256+липосомальные «доксору-бицин/циклофосфамид»+липосомы с Мексидолом 25мг/кг; 7 — W-256+липосомальные «доксорубицин/циклофосфамид»+липосомы с Мексидолом 50мг/кг; 8 — W-256+липосомальные «доксорубицин/циклофосфамид»+свободный Ксимедон 50мг/кг; 9 — W-256+липосомальные «доксорубицин/циклофосфамид»+свободный Ксимедон 100мг/кг; 10 — W-256+липосомальные «доксоруби-цин/циклофосфамид»+свободный Мексидол 25мг/кг; 11 — W-256+липосомальные «доксорубицин/циклофосфамид»+свободный Мексидол 50мг/кг; ' — различия достоверны по сравнению с контролем
Масса первичного опухолевого узла после химиотерапии свободными цитостатиками (во 2-й подгруппе) к 20-м суткам опыта была в 3 раза меньше, чем в контроле ( р =0,005, рис. 2).
Химиотерапия липосомальными цитостатиками (в 3-й подгруппе) приводила к аналогичному снижению массы первичной опухоли — в 3,4 раза по сравнению с контролем ( р =0,003). Дополнительное использование липосомальной формы Ксимедона в дозах 50 и 100мг/кг (в 4-й и 5-й подгруппах) вместе с цитостатиками приводило к снижению массы первичной опухоли в 2,5 и 2,8 раза соответственно по сравнению с контролем ( р =0,01), а липосомальной формы Мексидола в дозах 25 и 50 мг/кг (в 6-й и 7-й подгруппах) — в 3 и 3,3 раза соответственно ( р =0,009, рис. 2). Использование свободной формы Ксимедона в дозах 50 и 100 мг/кг совместно с цитостатиками приводило к аналогичным результатам: масса первичной опухоли снижалась в 2,9 и 2,5 раза соответственно относительно контроля ( р =0,019). Использование свободной формы Мексидола в дозах 25 и 50 мг/кг совместно с цитостатиками приводило к снижению массы первичной опухоли в 2,3 и 2,4 раза соответственно относительно контроля ( р =0,02, рис. 2).
Частота метастазирования в подгруппах как с отдельным использованием липосомальных цитостатиков, так и в сочетании с липосомальными и свободными формами Ксимедона и Мексидола не отличалась от показателя в контроле (табл. 1).
Количество поверхностных метастазов в легких после использования свободной и липосомальной форм цитостатиков во 2-й и 3-й подгруппах одинаково эффективно уменьшалось в 9,3 и 9,2 раза соответственно относительно контроля (р=0,003, табл. 1). Аналогичные изменения были при сочетании липо сомальных цитостатиков и липосомальных форм Ксимедона и Мексидола: количество метастатических очагов в легких уменьшалось в 15-20 раз относительно контроля (р=0,016), не отличаясь при этом от показателя в подгруппе с использованием только липосомальных цитостатиков (табл. 1). Такие же изменения были в подгруппах с использованием свободной формы Ксимедона и Мексидола: число метастатических очагов в легких снижалось в 7–15 раз относительно контроля (р=0,015). При этом различий с показателем в подгруппе с отдельным введением липосомальных цитостатиков также не отмечалось.
Количество крупных метастазов (больше 1 мм в диаметре) в легких при использовании свободной формы цитостатиков достоверно снижалось до 10,3 против 28,6% в контроле ( р =0,039, рис. 3). Аналогичная тенденция была и при использовании липосомальной формы цитостатиков, однако достоверных различий с контролем не было.
Примечательно, что при сочетании липосомальных форм Ксимедона и Мексидола в исследуемых дозах и липосомальных цитостатиков полностью исчезали крупные метастазы в легких, и все метастатические очаги были менее 1 мм в диаметре (100% мелких метастатических очагов против 71,4% мелких и 28,6% крупных очагов в контроле, р =0,009, рис. 3). При сочетании свободных форм Ксимедона и Мексидола в исследуемых дозах и липосомальных цитостатиков количество крупных и мелких метастатических очагов в легких не отличалось ни от показателей в контроле, ни от показателей в подгруппе с отдельным использованием липосомальных противоопухолевых средств. Более того, при использовании свободного Мексидола в дозах 25 и 50 мг/кг было достоверное увеличение числа крупных метастазов до 29,5 и 32,6% соответственно относительно под-
Таблица 1
Влияние липосомальных форм Ксимедона и Мексидола на антиметастатический эффект липосомальной комбинации «доксорубицин/циклофосфамид»
|
Подгруппа |
Частота метастазирования, % |
Количество поверхностных метастазов в легких ( M±m ), % |
Индекс ингибирования процесса метастазирования, % |
|
1-W-256 (контроль) |
53,3±13,1 |
— |
|
|
2-W-256+свободные «доксорубицин/циклофосфамид» |
100 |
5,7±1,1 р 1=0,003 |
89,29 |
|
3-W-256+липосомальные «доксорубицин/ци-клофосфамид» |
5,9±0,9 р 1=0,003 |
89,02 |
|
|
4-W-256+липосомальные «доксорубицин/ци-клофосфамид»+ липосомы с Ксимедоном 50 мг/кг |
80 |
2,6±1,2 р 1=0,008 |
96,1 |
|
5-W-256+липосомальные «доксорубицин/ци-клофосфамид»+ липосомы с Ксимедоном 100 мг/кг |
60 |
3,0±1,7 р 1=0,008 |
96,63 |
|
6-W-256+липосомальные «доксорубицин/ци-клофосфамид»+ липосомы с Мексидолом 25 мг / кг |
3,5±0,8 р 1=0,016 |
93,44 |
|
|
/-W-256+липосомальные «доксорубицин/ци-клофосфамид»+ липосомы с Мексидолом 50 мг / кг |
100 |
3,2±0,5 р 1=0,016 |
93,91 |
|
8-W-256+липосомальные «доксорубицин/ци- клофосфамид»+ свободный Ксимедон 50 мг / кг |
3,6±1,4 р 1=0,009 |
93,25 |
|
|
9-W-256+липосомальные «доксорубицин/ци- клофосфамид»+ свободный Ксимедон 100 мг / кг |
7,8±2,7 р 1=0,013 |
88,3 |
|
|
10-W-256+липосомальные «доксорубицин/ци-клофосфамид»+ свободный Мексидол 25 мг / кг |
80 |
7,0±2,2 р 1=0,012 |
89,5 |
|
H-W-256+липосомальные «доксорубицин/ци- клофосфамид»+ свободный Мексидол 50 мг / кг |
9,0±3,1 р 1=0,015 |
86,5 |
Примечание: р 1 — достоверность различий относительно контроля.
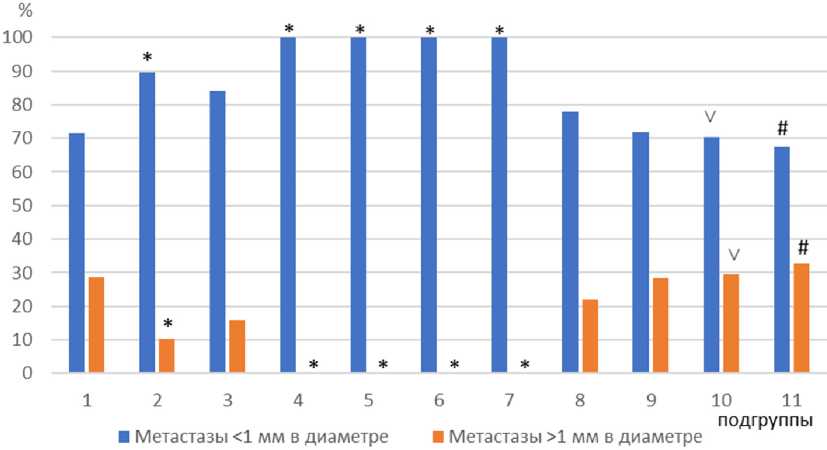
Рис. 3. Влияние сочетанного использования липосомальных форм Ксимедона и Мексидола с липосомальной комбинацией «доксорубицин/циклофосфамид» на диаметр метастатических очагов в легких у крыс с W-256:
1 — контроль W-256 (контроль); 2 — W-256+свободные «доксорубицин/циклофосфамид»; 3 — W-256+липосомальные «доксорубицин/циклофосфамид»; 4 — W-256+липосомальные «доксорубицин/циклофосфамид»+липосомы с Ксимедоном 50 мг/кг; 5 — W-256+липосомальные «доксорубицин/циклофосфамид»+липосомы с Ксимедоном 100мг/кг; 6 — W-256+липосомальные «доксору-бицин/циклофосфамид»+липосомы с Мексидолом 25мг/кг; 7 — W-256+липосомальные «доксорубицин/циклофосфамид»+липосомы с Мексидолом 50мг/кг; 8 — W-256+липосомальные «доксорубицин/циклофосфамид»+свободный Ксимедон 50мг/кг; 9 — W-256+липосомальные «доксорубицин/циклофосфамид»+свободный Ксимедон 100мг/кг; 10 — W-256+липосомальные «доксоруби-цин/циклофосфамид»+свободный Мексидол 25мг/кг; 11 — W-256+липосомальные «доксорубицин/циклофосфамид»+свободный Мексидол 50мг/кг; ' — различия достоверны по сравнению с контролем;v — различия достоверны по сравнению с подгруппой 6; • — различия достоверны по сравнению с подгруппой 7
групп с липосомальной формой Мексидола ( р =0,003), где крупные очаги полностью отсутствовали.
Обсуждение. Липосомальная комбинация «док-сорубицин/циклофосфамид» не показала преимущества перед комбинацией их свободной формы как в отношении торможения роста первичной опухоли, так и в отношении ингибирования процесса метастазирования. Липосомальная форма Ксимедона и Мексидола в обеих исследуемых дозах не влияет на реализацию противоопухолевого эффекта липосомальной комбинации «доксорубицин/циклофос-фамид», не снижая торможения роста первичной опухоли. В итоге масса первичной опухоли у животных в этих подгруппах не отличалась от массы опухоли у крыс, получавших только липосомальные цитостатики. Следует сказать, что не было различий в показателях массы первичной опухоли и между Ксимедо-ном и Мексидолом, применяемых как в липосомах, так и в свободной форме. Антиметастатический эффект липосомальной комбинации использованных цитостатиков не снижается при дополнительном применении липосомальной формы Ксимедона и Мек-сидола в исследуемых дозах. Это подтверждается отсутствием различий в количестве метастатических очагов в легких в сравниваемых подгруппах. Однако, в целом прослеживается тенденция большей эффективности сочетанного применения липосомальной комбинации «доксорубицин/циклофосфамид» с липосомальной формой Ксимедона и особенно Мексидола в сравнении со свободной формой этих средств в торможении роста метастатических очагов в легких, что требует дополнительного более глубокого отдельного изучения. Известно, что компоненты мембран липосом могут модифицировать фармакокинетические параметры лекарственных субстанций, включенных в липосомальные частицы. Комплекс «липосома — биологически активная субстанция» также может модулировать эффекты последней или приобретать иные механизмы действия на функциональные системы организма [13].
Заключение. Таким образом, липосомальная форма Ксимедона в дозах 50 и 100 мг/кг и Мекси-дола в дозах 25 и 50 мг/кг не оказывает значимого влияния на терапевтический эффект липосомальной комбинации «доксорубицин/циклофосфамид», следовательно, не снижает и не увеличивает ее противоопухолевую и антиметастатическую эффективность у крыс с карциномой Walker-256. Липосомальная форма Мексидола в обеих исследуемых дозах эффективнее его свободной формы при сочетании с цитостатиками меняет соотношение мелких и крупных легочных метастазов в сторону преобладания первых и исчезновения последних.
Список литературы Кафедра факультетской педиатрии Саратовского государственного медицинского университета: история семидесятилетнего пути
- Завьялов A.M., Андриянова E.A., Суворов В.В. Развитие педиатрии в Саратовской области: ретроспективный анализ. Бюллетень медицинских Интернет-конференций 2017; 7 (3): 642-5.
- Нуштаев И.А. Иннокентий Никандрович Быстренин (к 90-летию кафедры детских болезней Саратовского медицинского университета). Педиатрия 2003; 82 (4): 89-90.
- Попков B.M., Степанов С.А., Николенко B.H. Вклад клиник и кафедр Саратовского государственного медицинского института в подготовку кадров, медицинской помощи раненым и больным в период Великой Отечественной войны 1941-1945 гг. Саратовский научно-медицинский журнал 2010; 6 (2): 231-5.
- Профессора и заведующие кафедрами Саратовского государственного медицинского университета (1909-2009)/под. ред. П. В. Глыбочко. Саратов: Изд-во Сарат гос. мед. ун-та, 2008; 420 с.
- Людмила Евгеньевна Лагутина. Известия медицинского университета 2007; 8-9 (84-85): 3.
- Кафедра факультетской педиатрии. Медицинские кадры 1978; 4 (1063): 2.
- Свистунов А.А., Горемыкин В.И., Протопопов А.А. и др. Учебно-методический комплекс в педагогической деятельности кафедры педиатрического профиля. Саратовский научно-медицинский журнал 2009; 5 (3): 447-9.
- Саратовский ордена Трудового Красного знамени государственный медицинский институт: К 80-летию высшего медицинского образования в Саратове/под ред. В.Ф. Киричука, Л. Г. Горчакова. Саратов: Полиграфист, 1989; 190 с.
- Горемыкин В.И. Бронхиальная астма, патология билиарного тракта у детей: динамика формирования заболеваний, особенности психофизиологических и вегетативных нарушений, роль наследственности, анте- и перинатальной патологии: автореф. дис... д-ра мед. наук. СПб., 1999; 48 с.


