Калориметрическое определение энтальпии растворения тетратрифторацетата и тетраацетата димолибдена(II) в донорных растворителях. Определение состава аддуктов методом масс-спектрометрии
Автор: Слюсарева И.В., Краснов И.А., Подольская Е.П., Кондратьев Ю.В.
Журнал: Научное приборостроение @nauchnoe-priborostroenie
Рубрика: Масс-спектрометрия для биотехнологии. Интерпретация данных, методология, применение
Статья в выпуске: 4 т.18, 2008 года.
Бесплатный доступ
Выполнено калориметрическое определение энтальпий растворения тетратрифторацетата Мо2(СF3СОО)4 и тетраацетата Мо2(СН3СОО)4 димолибдена(II) в гексаметилфосфосфотриамиде (ГМФТА) и диметилформамиде (ДМФА). Методом масс-спектрометрии установлено, что состав аддуктов, образуемых при растворении тетракарбоксилатов в избытке донорных растворителей, соответствует формулам Mo2(RCOO)4·2 ГМФТА и Mo2(RCOO)4·2 ДМФА.
Короткий адрес: https://sciup.org/14264571
IDR: 14264571 | УДК: 621.384.668.8
Текст научной статьи Калориметрическое определение энтальпии растворения тетратрифторацетата и тетраацетата димолибдена(II) в донорных растворителях. Определение состава аддуктов методом масс-спектрометрии
Молекулярные тетракарбоксилаты димолибде-на(II) являются удобными модельными веществами для исследования донорно-акцепторного (ДА) взаимодействия с участием сложных кластерных молекул. На сегодняшний день структуры кристаллов тетракарбоксилатов димолибдена(II) и аддуктов, которые они образуют, достаточно изучены [1–5]. В зависимости от стерических параметров лигандов и доноров, величины донорной силы (DN) доноров, кислотности (рK) карбоновых кислот, образующих карбоксилаты, аддукты могут иметь разный состав и строение [6–8].
Однако в литературе практически отсутствуют данные по термодинамике донорно-акцепторного взаимодействия в неводных растворах с участием подобных соединений. Следует отметить, что именно ДА взаимодействие является начальным этапом всех последующих превращений с участием карбоксилатов. С тем чтобы заполнить этот пробел, настоящая работа явилась началом калориметрических определений энтальпий растворения тетракарбоксилатов в донорных растворителях и установления брутто-состава образуемых при растворении аддуктов методом масс-спектрометрии.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез образцов тетратрифторацетата и тетраацетата димолибдена(II) проводили по методике [9]. Безводные кристаллы Мо 2 (СF 3 СОО) 4 и Мо 2 (СН 3 СОО) 4 получали многократной возгонкой в вакууме при температуре 523 К.
Идентификация образцов проводилась методом рентгеноструктурного анализа на диффрактометре Nonius KappaCCD в лаборатории университета Energy Technology and Thermal Process Chemistry, Umea (Швеция).
Определение энтальпий растворения тетратрифторацетата и тетраацетата димолибдена проводилось на теплопроводящем калориметре типа Кальве при температуре 298.15 К в обескислороженных растворах в атмосфере аргона. Используемые растворители (ДМФА — диметилформа-мид и ГМФТА — гексаметилфосфотриамид) предварительно перегоняли и обезвоживали с использованием молекулярных сит. Навески карбоксилатов, перегнанные в вакууме, помещали в калориметрические стеклянные ампулы, которые отпаивали при вакуумировании. Масса веществ определялась как разница масс заполненной и пустой калориметрической ампулы. Далее ампулу с известной навеской вещества прикрепляли к бойку, ампулу с бойком помещали в калориметрический стакан, заполненный 10.0 мл растворителя; систему свинчивали и тщательно дезаэрировали. Затем всю систему помещали в калориметр. После выхода калориметра в режим работы, подключали микропроцессор и с помощью программы Power Graph 2.1 фиксировали "базовую линию" прибора. Далее раздавливали стеклянным бойком ампулу с веществом и регистрировали эффект растворения исследуемого вещества в виде зависимости мощности теплового потока (Вт) от времени (с). Площадь полученного пика рассчитывали при помощи программы Origne 6.1. Константа калориметра (k) определялась калибровкой по току. Надежность работы прибора проверяли сравнением энтальпии растворения хлорида калия (при разбавлении раствора 1 : 500) с литературными данными — 17.25 кДж/моль [10]. Для каждого растворителя проводили не менее 6 измерений.
Установление брутто-состава аддуктов Mo2(RCOO)4∙2D, образуемых при растворении тетракарбоксилатов в избытке донорных растворителей, проводили методом масс-спектрометрии с использованием прибора МХ-5310 (источник ионизации "электроспрей", времяпролетный анализатор, детектирование в режиме положительно заряженных ионов). Навески тетракарбоксилатов растворяли в десятикратном избытке (по молям) лигандов в токе азота и инкубировали в течение 30 мин при комнатной температуре. Затем к смеси добавляли обескислороженный ацетонитрил с 2 % уксусной кислотой, содержащий KCl в концентрации 10–6 моль/л, так чтобы концентрация лиганда в пересчете на исходное количество составляла 10–5 моль/л. Микрошприц, с помощью которого образец поступал в масс-спектрометр, предварительно промывали обескислороженным ацетонитрилом. Калибровку масс-спектрометра проводили по сигналам, принадлежащим резерпину (МН+ = = 609.2806 Да) и его димеру (МН+ = 1217.5540 Да). Объем пробы, вводимой в масс-спектрометр, составлял 30 мкл, скорость подачи растворителя — 3 мкл/мин. Управление настройками и регистрацию масс-спектров проводили с помощью программы TOF control. Масс-спектры записывали с помощью программы TOF+ и обрабатывали при помощи программного обеспечения TOF explorer v. 0.2. Точная моноизотопная масса и форма изотопного распределения вычислялись при помощи программы MassPro (масс-спектрометр и про- граммные продукты разработаны в Лаборатории биомедицинской масс-спектрометрии ИАнП РАН [11, 12]).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Из литературы известно, что тетракарбоксила-ты растворяются в донорных растворителях с образованием сольватированных аддуктов состава 1 к 2 соответственно [6, 7]. Для установления брут-то-составов продуктов, полученных при растворении Мо 2 (СF 3 СОО) 4 и Мо 2 (СН 3 СОО) 4 в ГМФТА и ДМФА, методом масс-спектрометрии были исследованы реакционные смеси, состав которых аналогичен составу растворов, полученных в процессе калориметрических экспериментов.
В качестве примера на рис. 1, а, представлен масс-спектр аддукта тетратрифторацетата димолибдена с ГМФТА
[Мо 2 (СF 3 СОО) 4 •2((CH 3 ) 2 N) 3 PO]K+.
В силу того что молибден обладает сложным изотопным распределением, и сигнал, соответствующий моноизотопной молекулярной массе, не является мажорным компонентом спектра, экспериментальный масс-спектр приводится в сравнении с теоретически рассчитанным (б) и списком молекулярных масс, соответствующим сигналам изотопного распределения (в). Как показано на рис. 1, экспериментальный и теоретический масс-спектры хорошо коррелируют между собой. Также для остальных исследуемых аддуктов карбоксилатов молибдена Мо 2 (СF 3 СОО) 4 и Мо 2 (СН 3 СОО) 4
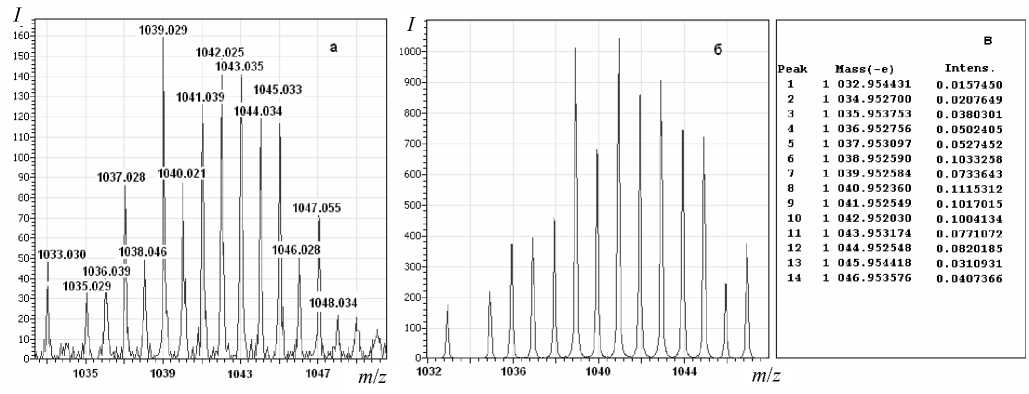
Рис. 1. Масс-спектр аддукта Мo 2 (CF 3 COO) 4 • 2ГМФТА
Табл. 1. Результаты калориметрических определений энтальпии растворения Мо 2 (СF 3 COO) 4 в ГМФТА
|
№ |
Навеска, мг |
ν, ммоль |
Q, Дж |
A H p , кДж/моль |
|
1 |
55.4 |
0.086 |
13.8 |
160.5 |
|
2 |
56.0 |
0.087 |
13.9 |
159.8 |
|
3 |
74.7 |
0.116 |
18.6 |
160.3 |
|
4 |
58.6 |
0.091 |
14.6 |
160.4 |
|
5 |
63.8 |
0.099 |
15.8 |
159.6 |
|
6 |
60.5 |
0.094 |
15.1 |
160.6 |
|
Среднее |
160.2 ± 0.4 |
|||
Табл. 2. Результаты калориметрических определений энтальпии растворения Мо2(СН3COO)4 в ДМФА
Результаты калориметрических определений энтальпий растворения тетратрифторацетата и тетраацетата димолибдена в донорных растворителях ГМФТА и ДМФА представлены в табл. 1, 2.
Тепловые эффекты растворения рассчитывали по формулам (1) и (2):
Q = k ∙ S , Дж, (1)
где k — константа калориметра (Дж/отн.ед.); S — площадь кривой (отн.ед.), соответствующая фиксируемому тепловому эффекту;
A H p = Q / v , кДж/моль, (2)
где v — количество вещества (моль); A H p — энтальпия растворения, кДж/моль.
Учитывая, что донорные числа Гутмана для растворителей ГМФТА (DN = 162.3) и ДМФА (DN = 100.4) различны, вполне естественна значительная разница в тепловых эффектах. К тому же акцепторные свойства Мо 2 (СF 3 СОО) 4


