Кандидемия у онкологических больных: фенотипические и молекулярно-генетические характеристики резистентности к противогрибковым лекарственным средствам, гены факторов патогенности Candida spp.
Автор: Багирова Н.С., Горемыкина Е.А., Слукин П.В., Хохлова О.Е., Фурсова Н.К., Петухова И.Н., Григорьевская З.В.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 3 т.21, 2022 года.
Бесплатный доступ
Актуальность. Мировая тенденция стремительного увеличения уровня резистентности к противо-грибковым препаратам, которая связана со многими факторами, диктует необходимость постоянного мониторинга таксономической структуры нозокомиальных возбудителей инвазивных грибковых инфекций и их чувствительности к антифунгальным лекарственным средствам с целью постоянной коррекции наиболее оптимальной тактики профилактики и лечения инвазивных грибковых инфекций. Цель исследования - определение чувствительности к антифунгальным препаратам основных возбудителей при кандидемии у онкологических больных, а также определение генов резистентности и факторов патогенности. Материал и методы. Проанализировано 82 штамма Candida spp., выделенных из крови онкологических больных в течение 2015-21 гг. Определение минимальных ингибирующих концентраций флуконазола, вориконазола, позаконазола, анидулафунгина и микафунгина выполняли градиентным методом (Е-тест, Biomerieux, France). Для оценки значений МИК использовали критерии eucast и clsi. Определены гены, ассоциированные с факторами патогенности и резистентности к противогрибковым лекарственным средствам. Результаты. По результатам нашего исследования (критерии eucast) в качестве эмпирической терапии инвазивного кандидоза (в т. ч. кандидемии) наименее эффективными препаратами являются триазолы, особенно флуконазол, к которому статистически значимо чаще штаммы Candida spp. резистентны по сравнению с вориконазолом (47,2 % против 23,2 %, p function show_abstract() { $('#abstract1').hide(); $('#abstract2').show(); $('#abstract_expand').hide(); }
Candida spp, кандидемия, резистентность, флуконазол, вориконазол, позаконазол, анидулафунгин, микафунгин, erg11, fks1, факторы патогенности
Короткий адрес: https://sciup.org/140295082
IDR: 140295082 | УДК: 616-006+616.992.282:615.015.8:579.61 | DOI: 10.21294/1814-4861-2022-21-3-70-80
Текст научной статьи Кандидемия у онкологических больных: фенотипические и молекулярно-генетические характеристики резистентности к противогрибковым лекарственным средствам, гены факторов патогенности Candida spp.
Кандидемия у онкологических больных – ситуация, требующая адекватной и своевременной терапии, которая предполагает раннюю диагностику вида возбудителя и определение чувствительности Candida spp . к антифунгальным препаратам (АФП), включая все доступные современные методы.
Кандидемия связана с высокой летальностью и ростом инвазивных грибковых инфекций (ИГИ) в основном у иммунокомпрометированных пациентов, в т. ч. онкологических больных [1–3]. Анализ международных данных в отношении ИГИ из отчетов по аутопсиям показывает, что, несмотря на все усилия по профилактике, диагностике и лечению,
ИГИ все еще имеют значительную распространенность и связаны с низким уровнем прижизненной диагностики [4].
Сравнительный анализ литературных данных по уровню резистентности Candida spp . к противогрибковым лекарственным средствам представляет определенные сложности, поскольку исследователи применяют различные критерии оценки минимальной ингибирующей концентрации (МИК). Следует заметить, что с некоторых пор при разработке критериев оценки МИК антифунгальных препаратов учитывается вид Candida, чего не было в ранних рекомендациях CLSI и EUCAST . Кроме того, на результаты по изучению уровня резистентности АФП влияют и другие факторы: географические; популяции пациентов; принятая политика профилактики и терапии ИГИ; особенности и методы, применяемые для лечения основного заболевания. Несмотря на это, прослеживается мировая тенденция стремительного увеличения уровня резистентности к АФП, которая связана со многими факторами: активное, порой бесконтрольное и необоснованное применение АФП; внедрение в медицинскую практику новых методов лечения; активная миграция населения, связанная с туризмом, бизнесом, научной деятельностью [5].
Влияние профилактики/терапии ИГИ на формирование таксономической структуры возбудителей кандидемии, безусловно, имеет место, что, в свою очередь, отражается на уровне резистентности к АФП. Показано, что после терапии флуконазолом доля C. albicans в структуре возбудителей канди-демии снизилась, а C. glabrata увеличилась; после лечения эхинокандинами C. albicans в структуре возбудителей кандидемии также снизилась, а C. glabrata увеличилась. Интересно, что после воздействия АФП МИК значительно повысились для C. parapsilosis и C. tropicalis, но не для видов с известной пониженной чувствительностью к флуконазолу ( C. glabrata ) [6, 7].
Основной механизм приобретения устойчивости Candida spp. к АФП – это мутации в гене, кодирующем мишень для действия антифунгального препарата [8]. Триазолы (флуконазол, вориконазол, позаконазол) активно применяют при ИГИ в течение многих лет. Мишень их действия – фермент биосинтеза эргостерола (стерол-14αдеметилаза, GYP51) клеточной мембраны грибов. Резистентность Candida spp. к азолам связана с наличием обходного шунта, который заменяет GYP51 (кодируемый генами ERG) и на который не воздействуют азолы. Наиболее распространенным считается ген ERG11 [9, 10]. Эхинокандины (каспофунгин, микафунгин, анидулафунгин) действуют как неконкурентные ингибиторы ферментного комплекса β-(1,3)-D-глюкансинтазы, специфически воздействуя на субъединицу FKS1, которая катализирует выработку глюкана, основного компонента клеточной стенки Candida spp. Устойчивость к эхи- нокандинам во многом определяется точечными мутациями в генах FKS1 [11, 12].
Детекция генов, ответственных за резистентность к АФП, точечных мутаций в этих генах, – перспективное направление поиска некультуральных маркеров резистентности Candida spp . к АФП [13]. Однако показано, что не всегда точечные мутации в генах, ответственных за резистентность к АФП, приводят к устойчивости к ним. Выявлены так называемые «молчащие мутации», при которых Candida spp . не демонстрирует устойчивости к АФП [14]. Кроме того, резистентность к этим же противогрибковым препаратам может вызываться и другими механизмами: гиперэкспрессией ферментов, биопленкообразованием и др. [12, 15]. Тем не менее предполагается, что наиболее значительную роль в развитии противогрибковой устойчивости у изолятов при кандидемии играет способность Candida spp . существовать в биопленках, которые быстро образуются на синтетических материалах и на тканях человека [15].
Метаболизм Candida spp. представляет собой сложную систему, и многие ферменты способны участвовать в процессе развития ИГИ. С. аlbicans и некоторые другие виды являются частью микробиоты здорового человека. При определенных обстоятельствах, являющихся следствием целого комплекса факторов, колонизация Candida spp. может трансформироваться в ИГИ, клинические проявления которой зависят от состояния иммунитета человека и колонизированной ткани, от целого ряда факторов патогенности микроорганизма, действия которых при развитии патологического процесса взаимосвязаны. Различают несколько групп факторов патогенности. Способность прикрепляться к поверхностям тканей и неорганических материалов (например, катетеров) обеспечивают адгезины Candida spp. (гены группы ALS) при взаимодействии с рецепторным аппаратом слизистых оболочек организма хозяина, в данном случае «хозяином» рассматривается человек. Показано, что степень адгезии связана с патогенностью [16, 17] и зависит от вида Candida, например, в отличие от С. аlbicans, С. tropicalis считается низкоадгезивным видом, а С. krusei проявляет незначительную или нулевую адгезию. Последующий этап пене-трации и инвазии Candida spp. обеспечивается их морфологическими изменениями, продукцией группы ферментов гидролаз (аспарагиновые протеазы, фосфолипазы, липазы), которые у разных видов кандид проявляются в разной степени. Продукция группы протеолитических ферментов – секреторных аспартил-протеаз (SAP) – способствует проникновению в ткани Candida spp. и их распространению. При антифунгальной терапии происходит замедление роста Candida spp., но в то же время секреция кандидами аспартат-протеиназ активизируется. В составе биопленок Candida spp. более активно секретируют аспартат-протеиназы, нежели планктонные формы, и это предполагает оценку биопленок как еще один фактор патогенности кандид [18–21]. Кандиды способны продуцировать гемолитические факторы, которые, как полагают, могут облегчать им доступ к железу. Инвазия Candida spp. в ткани происходит наряду с продукцией ферментов, благодаря морфологической трансформации дрожжевой формы в гифальную (группы генов ALS, HWP, SAP), что также является фактором патогенности, поскольку определяется только при активной ИГИ. Процесс морфологической трансформации сопровождается расширением спектра адгезинов у гифальных форм. Гифы обладают тигмотропизмом – движение, которое стимулируется чувствительным контактом, – и это усиливает процесс распространения Candida spp. Морфологическая трансформация также участвует в пенетрации возбудителя и обеспечивает ему защиту от иммунной системы хозяина. Candida spp. способны на фенотипические переключения (фенотипическая изменчивость), характерные для отдельных штаммов при изменении условий существования. Явление фенотипической пластичности ответственно за выключение одной группы генов и включение других групп, определяющих степень патогенности, активирующих процессы адгезии и пенетрации. Фенотипическое переключение способно комплексно воздействовать на активность многих потенциальных факторов вирулентности через генетический механизм, который позволяет Candida spp. приспосабливаться к изменениям среды обитания [22, 23].
Цель исследования – определение чувствительности к антифунгальным препаратам основных возбудителей при кандидемии у онкологических больных, а также определение генов резистентности и факторов патогенности.
Материал и методы
Всего за исследуемый период (январь 2015 г. – декабрь 2021 г.) исследовано 82 штамма Candida spp. (10 видов): С. parapsilosis – 50 штаммов, C. albicans – 17 штаммов, C. glabrata и C. lusitaniae – по 3 штамма каждый вид, C. krusei , C. guilliermon-dii и C. tropicalis – по 2 штамма каждый вид, C. dubliniensis, C. utilis и C. inconspicua – по одному штамму каждый вид. Посевы крови инкубировали в микробиологическом геманализаторе-инкубаторе BD BACTEC FX 400 ( Becton Dickinson, США ) в течение 5 сут и в приборе Bact/ALERT 3D ( BioMerieux, Франция ) в течение 7 сут. Идентификация осуществлялась с использованием прибора MALDI-TOF Microflex LT ( Biotyper, Bruker Dalton-ics, Германия ).
Определение МИК флуконазола, вориконазола, позаконазола, анидулафунгина и микафунгина выполняли градиентным методом (Е-тест, BioMerieux, France) на чашках Петри диаметром 140 мм с готовой агаровой средой RPMI (BioMerieux, France).
Анализ чувствительности к АФП проводили для тех видов Candida, к которым разработаны критерии оценки МИК (C. albicans, C. parapsilosis, C. glabrata, C. krusei и C. topicalis). Для оценки полученных нами значений МИК использовали клинические пограничные значения (clinical breakpoint, CBP), рекомендованные EUCAST (European Committee on Antimicrobial Susceptibility Testing, Европейский комитет по тестированию антимикробной чувствительности, Version 10.0, valid from 2020-02-04) [доступно на http://www. ] и CLSI (Clinical and Laboratory Standards Institute, M60-Ed2, 2020) [доступно на ].
В исследуемых штаммах были определены гены, ассоциированные с факторами патогенности и резистентности к АФП. Продукцию гемолизина детектировали по наличию зоны просветления вокруг колонии на плотной питательной среде Сабуро с добавлением 5 % стерильной бараньей крови. Выделение ДНК проводили комплектом реагентов для экстракции ДНК из клинического материала «АмплиПрайм ДНК-сорб-В» (Интер-ЛабСервис, Москва, Россия) согласно инструкции производителя. ПЦР проводили с использованием реактивов Thermo Fisher Scientific (Уолтем, США): 10×Taq-буфера с аммонием сернокислым ((NH4)2SO4); 25 мМ раствора хлорида магния (MgCl2); 10 мМ раствора смеси дезоксирибонуклеозидтрифосфатов (дНТФ); рекомбинантной Taq -полимеразы с концентрацией 5 ед/мкл на приборе «Терцик» (ДНК-Технология, Москва, Россия). Разделение ДНК ПЦР-продуктов осуществляли в электрофоретической камере Wide Mini-Sub Cell GT (Bio-RAD, США) в Трис-боратном буфере в 1,2 % агарозном геле при напряжении 50 В. Гены, ассоциированные с патогенностью и резистентностью, определяли методом ПЦР со специфичными праймерами (табл. 1).
При статистической обработке результатов исследования вычисляли одновыборочный t-критерий (Стъюдента). Статистически значимыми считали различия с вероятностью не менее 95 % (p<0,05). Статистические расчеты осуществляли с помощью специальной компьютерной программы, которая разработана группой медицинской кибернетики ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» МЗ РФ.
Результаты
В нашем исследовании C. albicans, C. parapsi-losis, C. glabrata, C. krusei и C. topicalis составили 90,2 % от всех штаммов, выделенных при кандиде-мии (рис. 1). По данным исследования, в качестве эмпирической терапии инвазивного кандидоза (в т. ч. кандидемии) наименее эффективными препаратами являются триазолы, особенно флуконазол, к которому статистически значимо чаще штаммы Candida spp. резистентны по сравнению с вориконазолом (47,2 % против 23,2 %,
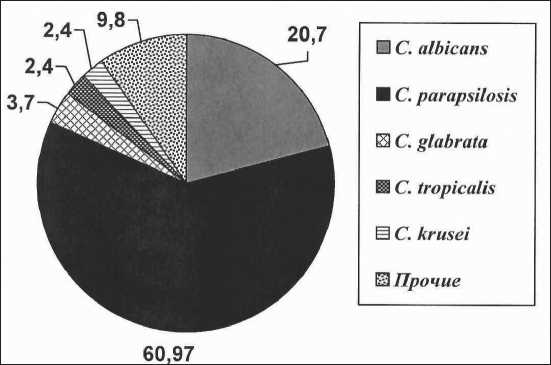
Рис. 1. Основные виды Candida spp .
(%), выделенные из крови онкологических больных
Fig. 1. The main species of Candida spp. (%) isolated from the blood of cancer patients
Таблица 1/table 1
Праймеры на гены патогенности и резистентности штаммов Candida spp.primers for pathogenicity and resistance genes of Candida spp.
|
Ген/ Gene |
Праймеры/ Primers |
Температура отжига, °C/ Annealing temperature, °C |
Ссылка/ Reference |
|
Гены резистентности/Resistance genes |
|||
|
ERG11 |
5’- ttagtgttttattggattccttggtt -3’ 5’- tctcatttcatcaccaaataaagatc -3’ |
61 |
[24] |
|
FKS1 |
5’-atgtcttacgataacaatc-3’ 5’- ttagaatgcctttgtagtatag-3’ |
40 |
[25] |
|
Гены патогенности/Pathogenicity genes |
|||
|
ALS1 |
5’-gactagtgaaccaacaaataccaga-3’ |
50 |
[26] |
|
5’-ccagaagaaacagcaggtga-3’ |
|||
|
HWP1 |
5’-atgactccagctggtt-3’ 5’-tagatcaagaatgcagc-3’ |
45 |
[26] |
|
PLB1 |
5’-atgattttgcatcattt-3’ 5’-agtatctggagctctac-3’ |
50 |
[26] |
|
LIP1 |
5'-acaaattcactgggatcaagag-3’ 5'-ataagtgacatggacgttactg-3’ |
55 |
[27] |
|
SAP4 |
5’-gctcttgctattgctttatt-3’ 5’-taggaaccgttattcttac-3' |
49 |
[26] |
|
SAP9 |
5’-atttactccacagtttatatcactgaaggt-3’ |
59 |
[28] |
|
5’-ccaccagaaccaccctcagtt-3’ |
|||
Таблица 2/table 2
Резистентность основных видов Candida к 5 противогрибковым препаратам (eucast V. 10, 2020) resistance of the main Candida species to 5 antifungal drugs (eucast V. 10, 2020)
|
Candida spp. |
Всего штаммов/ Total strains |
Флуконазол/ Fluconazole Коли |
Вориконазол/ Voriconasole чество резистент Number of re |
Позаконазол/ Posakonasole ных штаммов/ % istant strains/ % o |
Анидулафунгин/ Anidulafungin резистентных шта f resistant strains |
Микафунгин/ Micafungin ммов |
|
C. albicans |
17 |
4/23,5 |
3/17,6 |
5/29,4 |
2/11,8 |
7/41,2 |
|
C. parapsilosis |
50 |
28/56,0 |
12/24,0 |
15/30,0 |
0 |
0 |
|
C. glabrata |
3 |
1 |
Нд/No data * |
Нд/No data |
1 |
1 |
|
C. krusei |
2** |
Нд/No data |
Нд/No data |
Нд/No data |
0 |
Нд/No data |
|
C. tropicalis |
2 |
1 |
1 |
1 |
0 |
Нд/No data |
|
Всего протестированных штаммов/ Total strains tested |
74 |
72 |
69 |
69 |
74 |
70 |
|
Количество резистентных штаммов/ Number of resistant strains |
34 |
16 |
21 |
3 |
8 |
|
Примечание: * – нет данных, так как отсутствуют критерии оценки минимальной ингибирующей концентрации; ** – у C. krusei природная резистентность к флуконазолу.
Note: * – no data, since there are no criteria for assessing the minimum inhibitory concentration; ** – C. krusei has natural resistance to fluconazole.
Таблица 3/table 3
Сравнение данных резистентности штаммов к антифунгальным препаратам, оцененных по различным критериям – clsi (M60-ed2, 2020) и eucast (V. 10, 2020)
comparison of data of resistance of strains to antifungal drugs assessed with clsi (M60-ed2, 2020) and eucast (V. 10, 2020) criteria
|
Наши данные |
Наши данные |
||||||||
|
Антифунгаль- |
CLSI |
(критерии CLSI)/ Our data (CLSI |
EUCAST |
(критерии EUCAST)/ Our data (EUCAST |
|||||
|
ный препарат/ Antifungal drug |
Candida spp. |
S R МИК (мг/л)/ MIC (mg/l) |
criteria) S R Количество/Number |
S R МИК (мг/л)/ MIC (mg/l) |
criteria) S R Количество/Number |
||||
|
C. albicans |
≤2 |
≥8 |
9/52,9 % |
4/23,5 % |
≤2 |
>4 |
9/52,9 % |
4/23,5 % |
|
|
Флуконазол/ Fluconazole |
C. parapsilosis |
≤2 |
≥8 |
18/36,0 % |
28/56,0 % |
≤2 |
>4 |
18/36,0 % |
28/56,0 % |
|
C. glabrata |
нд/no data |
≥64 |
нд/no data |
1/33,3 % |
≤0,001 |
>16 |
0 |
1/33,3 % |
|
|
C. krusei |
нд/no data |
нд/no data |
нд/no data |
нд/no data |
нд/no data |
нд/no data |
нд/no data |
нд/no data |
|
|
C. tropicalis |
≤2 |
≥8 |
0 |
1/50,0 % |
≤2 |
>4 |
0 |
1/50,0 % |
|
|
C. albicans |
≤0,12 |
≥1 |
13/76,5 % |
3/17,6 % |
≤0,06 |
>0,25 |
12/70,6 % |
3/17,6 % |
|
|
Вориконазол/ Voriconazole |
C. parapsilosis |
≤0,12 |
≥1 |
7/14,0 % |
3/6,0 % |
≤0,125 |
>0,25 |
35/70,0 % |
12/24,0 % |
|
C. glabrata |
нд/no data |
нд/no data |
нд/no data |
нд/no data |
нд/no data |
нд/no data |
нд/no data |
нд/no data |
|
|
C. krusei |
≤0,5 |
≥2 |
2/100 % |
0 |
нд/no data |
нд/no data |
нд/no data |
нд/no data |
|
|
C. tropicalis |
≤0,12 |
≥1 |
1/50,0 % |
1/50,0 % |
≤0,125 |
>0,25 |
1/50,0 % |
1/50,0 % |
|
|
C. albicans |
≤0,25 |
≥1 |
17/100 % |
0 |
≤0,03 |
>0,03 |
15/88,2% |
2/11,8 % |
|
|
Анидулафун- |
C. parapsilosis |
≤2 |
≥8 |
50/100 % |
0 |
≤4 |
>4 |
50/100 % |
0 |
|
гин/ Anidula- |
C. glabrata |
≤0,12 |
≥0.5 |
2/66,7 % |
1/33,3 % |
≤0,06 |
>0,06 |
2/66,7 % |
1/33,3 % |
|
fungin |
C. krusei |
≤0,25 |
≥1 |
2/100 % |
0 |
≤0,06 |
>0,06 |
2/100 % |
0 |
|
C. tropicalis |
≤0,25 |
≥1 |
2/100 % |
0 |
≤0,06 |
>0,06 |
2/100 % |
0 |
|
|
C. albicans |
≤0,25 |
≥1 |
16/94,1 % |
0 |
≤0,016 |
>0,016 |
10/58,8 % |
7/41,2 % |
|
|
Микафунгин/ Micafungin |
C. parapsilosis |
≤2 |
≥8 |
50/100 % |
0 |
≤2 |
>2 |
50/100 % |
0 |
|
C. glabrata |
≤0,06 |
≥0,25 |
2/66,7 % |
1/33,3 % |
≤0,03 |
>0,03 |
2/66,7 % |
1/33,3 % |
|
|
C. krusei |
≤0,25 |
≥1 |
2/100 % |
0 |
нд/no data |
нд/no data |
нд/no data |
нд/no data |
|
|
C. tropicalis |
≤0,25 |
≥1 |
2/100 % |
0 |
нд/no data |
нд/no data |
нд/no data |
нд/no data |
|
Примечание: S – чувствительность; R – резистентность; нд – нет данных.
Note: S – susceptibility; R – resistance.
p<0,01) и позаконазолом (47,2 % против 30,4 %, p<0,05). Самая высокая активность in vitro отмечается у препаратов группы эхинокандинов, причем анидулафунгин в 2 раза активнее микафунгина (4,1 % резистентных штаммов против 11,4 %), но статистически значимой разницы при этом не выявлено (табл. 2).
Как уже было замечено ранее, оценка значения МИК АФП для определения категории «чувствительность/резистентность» зависит от применяемых критериев (CLSI или EUCAST) . Мы сравнили полученные нами данные, оцененные по различным критериям (табл. 3). Результаты совпадали только в отношении флуконазола. В целом, к вориконазолу, анидулафунгину и микафунгину по критериям CLSI резистентность была значительно ниже по сравнению с оценкой значений МИК по критериям EUCAST (9,9 против 23,2 %, p<0,05; 1,4 против 4,1 %; 1,4 против 11,4 %, p<0,02 соответственно).
Несмотря на то, что при подозрении на ИГИ, как правило, сначала АФП назначают эмпирически, в дальнейшем терапия корректируется с учетом результатов микробиологического исследования с данными по чувствительности возбудителя к АФП, поэтому крайне важно проводить длительный мониторинг по спектру возбудителей и их чувствительности к АФП в конкретном стационаре. В нашем исследовании наиболее часто из крови были выделены 2 вида кандид: C. albicans и C. parapsilosis, поэтому была проведена оценка МИК пяти АФП для этих видов (табл. 4). При этом резистентность штаммов C. albicans к флуконазолу статистически значимо более низкая в сравнении с C. parapsilosis (p<0,02). Статистически значимых различий в доле резистентности к вориконазолу, позаконазолу и анидулафунгину у C. albicans и C. parapsilosis не выявлено. Кроме того, среди C. parapsilosis вообще не выявлено резистентных штаммов к анидулафунгину и микафунгину, тогда как среди C. albicans регистрировались штаммы, резистентные к анидулафунгину, и значительная доля штаммов, резистентных к микафунгину.
Таким образом, наиболее активным in vitro АФП в отношении C. albicans оказался анидула-фунгин, а для C. parapsilosis – анидулафунгин и
Таблица 4/table 4
Резистентность/чувствительность C. albicans и C. parapsilosis к противогрибковым препаратам при кандидемии (eucast, V. 10, 2020)
resistance/ susceptibility of C. albicans and C. parapsilosis to antifungals in candidemia (eucast, V. 10, 2020)
|
Антифунгаль-ный препарат/ Antifungal drug |
Кол-во чувствительных штаммов/ Number of susceptible strains |
C. albicans 17 штаммов/17 strains Кол-во штаммов с чувствительностью при увеличенной экспозиции/ Number of strains with susceptibility at increased exposure |
Кол-во устойчивых штаммов/ Number of resistant strains |
Кол-во чувствительных штаммов/ Number of susceptible strains |
C. parapsilosis 50 штаммов/50 strains Кол-во штаммов с чувствительностью при увеличенной экспозиции/ Number of strains with susceptibility at increased exposure |
Кол-во устойчивых штаммов/ Number of resistant strains |
|
Флуконазол/ Fluconazole |
9/52,9 % |
4/23,5 % |
4/23,5 % |
18/36,0 % |
4/8,0 % |
28/56,0 % |
|
Вориконазол/ Voriconazole |
12/70,6 % |
2/11,8 % |
3/17,6 % |
35/70,0 % |
3/6,0 % |
12/24,0 % |
|
Позаконазол / Posaconazole |
12/70,6 % |
0 |
5/29,4 % |
35/70,0 % |
0 |
15/30,0 % |
|
Анидулафун-гин/ Anidula-fungin |
15/88,2 % |
0 |
2/11,8 % |
50/100 % |
0 |
0 |
|
Микафунгин/ Micafungin |
10/58,8 % |
0 |
7/41,2 % |
50/100 % |
0 |
0 |
Таблица 5/table 5
Гены ERG11 и FKS1, выявленные в штаммах Ñandida spp., выделенных из крови онкологических больных ERG11 and FKS1 genes detected in of Candida spp. strains isolated from blood of cancer patients
|
Candida spp. |
Всего штаммов/ Total strains |
Количество генов ERG11 |
/Number of genes FKS1 |
|
C. albicans |
11 |
6 |
0 |
|
C. parapsilosis |
46 |
0 |
12 |
|
C. glabrata |
3 |
0 |
1 |
|
C. krusei |
3 |
0 |
0 |
|
C. tropicalis |
2 |
0 |
1 |
|
C. lusitaniae |
2 |
0 |
0 |
|
C. guilliermondii |
2 |
0 |
0 |
|
C. utilis |
1 |
0 |
0 |
|
ИТОГО/TOTAL |
70 |
6 |
14 |
Таблица 6/table 6
Гены факторов патогенности, выявленные в штаммах Candida spp., выделенных из крови онкологических больных pathogenicity factor genes detected in Candida spp. strains, isolated from the blood of cancer patients
|
Candida spp . |
Всего штаммов/ Total strains |
ALS1 |
Гены факторов патогенности/Pathogenicity factor genes |
Гемолиз* |
||||
|
HWP1 |
SAP9 |
SAP4 |
PLB1 |
LIP1 |
||||
|
C. albicans |
14 |
3 |
3 |
0 |
2 |
1 |
1 |
4 |
|
C. parapsilosis |
43 |
11 |
12 |
0 |
0 |
0 |
0 |
25 |
|
C. glabrata |
3 |
0 |
0 |
0 |
0 |
0 |
0 |
2 |
|
C. krusei |
2 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
|
C. tropicalis |
2 |
0 |
0 |
0 |
0 |
0 |
0 |
2 |
|
C. lusitaniae |
3 |
0 |
0 |
0 |
0 |
0 |
0 |
3 |
|
C. guilliermondii |
2 |
0 |
0 |
0 |
0 |
0 |
0 |
2 |
|
C. utilis |
1 |
1 |
0 |
0 |
0 |
0 |
0 |
0 |
|
Итого/Total |
70 |
15 |
15 |
0 |
2 |
1 |
1 |
38 |
Примечание: * – фенотипический тест.
Note: * – phenotypic test.
микафунгин. Следует заметить, что вориконазол, несмотря на длительное применение в клинике, более чем в 70 % случаев активен in vitro против обоих наиболее распространенных видов Candida , которые составили 81,7 % (67/82) всех гемокультур при кандидемии. Уровень резистентности к позаконазолу сходен с профилем резистентности к вориконазолу.
В ходе нашей работы протестированы штаммы Candida spp. с целью определения генов, ответственных за резистентность к противогрибковым препаратам, методом ПЦР (табл. 5). В результате исследуемые гены выявлены у 20 из 70 (28,6 %) штаммов Candida spp. Ген ERG11 , который отвечает за резистентность к триазолам, детектирован только у штаммов C. albicans (8,6 %), причем внутри этого вида только 54,5 % изолятов несли ген ERG11 . Из 11 штаммов C. albicans у двух была зарегистрирована резистентность ко всем трем препаратам этого класса, и только у одного из них выявлен ген ERG11 , у двух штаммов, несущих ген ERG11, была установлена чувствительность к флуконазолу при увеличенной экспозиции противогрибкового препарата, и у 4 штаммов – чувствительность ко всем трем триазолам при стандартном режиме дозирования.
В нашем исследовании ни у одного штамма C. albicans не выявлено гена FKS1, ответственного за резистентость к эхинокандинам . Ген FKS1 определен у 14 штаммов (20,0 %): штаммы C. parap-silosis составили 85,7 %, штаммы C. tropicalis и C. glabrata – по 7,1 % каждый вид. Из всех изоля-тов, несущих ген FKS1 , только 1 штамм ( C. glabra-ta ) был in vitro резистентен к анидулафунгину и микафунгину, остальные 13 изолятов расценены как чувствительные к эхинокандинам.
Как следует из данных табл. 6, гены факторов патогенности определены у 78,6 % штаммов C. albicans и у 79,1 % изолятов C. parapsilosis . Более половины всех изолятов (54,3 %) обладали гемолитическими свойствами, в т. ч. 28,6 % – C. albicans и 58,2 % – C. parapsilosis (p<0,05). У штаммов C. albicans наблюдалась более широкая линейка генов факторов патогенности по сравнению с C. parapsilosis , у которых выявлены только ALS1, HWP1 и гемолиз. В целом, из 70 изолятов Candida spp . только у 15 (21,4 %) не выявлены те гены факторов патогенности, поиск которых мы осуществляли. C. krusei – это единственный вид, у которого не было зарегистрировано ни одного из исследуемых факторов патогенности. Штаммы C. glabrata, C. tropicalis, C. lusitaniae и C. guilliermon-dii обладали гемолитическими свойствами, и иных факторов патогенности у них обнаружено не было. У редкого вида C. utilis , помимо гемолиза, выявлен ген ALS1 , который индуцируется во время процесса филаментации и опосредует адгезию клеток Candida spp . к клеткам и тканям хозяина.
Обсуждение
Нередко терапия при подозрении на ИГИ назначается эмпирически, и в такой ситуации крайне важно опираться на данные мониторинга таксономической структуры основных возбудителей и их резистентности к АФП в конкретном стационаре. При кандидемии резистентность ведущих возбудителей к системным АФП у онкологических больных нашей клиники регистируется в основном к триазолам. Эхинокандины in vitro сохраняют высокую активность, причем в отношении C. albicans наиболее эффективен анидулафунгин, а для C. parapsilosis – анидулафунгин и микафунгин. Оценка полученных значений МИК с использованием критериев CLSI существенно отличается (за исключением флуконазола) от результатов при применении критериев EUCAST: в первом случае резистентность к АФП в несколько раз ниже, чем во втором.
По данным литературных источников, приобретенная (адаптивная) резистентность к эхино-кандинам в основном наблюдается среди Candida albicans и Candida glabrata и связана с мутациями FKS -гена. Хотя устойчивость к эхинокандинам представляет собой возрастающую проблему, на самом деле имеется немного эпидемиологических данных о степени приобретенной резистентности, подтвержденной молекулярно-генетическими методами, и о тенденциях в течение многих лет в отношении потребления эхинокандинов. A. Kritikos et al. [29] представили результаты 10-летнего общенационального исследования изолятов C. albicans и C. glabrata из крови в Швейцарии. Анализ данных показал, что резистентность к эхинокандинам оставалась на низком уровне, несмотря на значительное увеличение применения эхинокандинов, и была в основном связана с индивидуальным воздействием в течение длительного периода времени. Наше исследование также подтверждает выводы зарубежных исследователей о невысокой степени приобретенной резистентности, связанной с молекулярно-генетическими изменениями штаммов, но анализ наших данных показал, что FKS1- ген, ответственный за резистентность к эхи-нокандинам, в 85,7 % случаев выявлен у штаммов C. parapsilosis , составляющих основную долю возбудителей при кандидемии. Ген ERG11 , который отвечает за резистентность к триазолам, несли только штаммы Candida albicans (8,6 %), причем внутри этого вида только 54,5 % таких изолятов. Механизмы развития резистентности к триазолам различны, и один из основных – это изменение мишени клеточной мембраны гриба (стерол-14-α-деметилаза). Мутации в гене ERG11 , который кодирует мишень, приводят к снижению силы воздействия азолов [14, 30].
В нашем исследовании среди штаммов, несущих гены резистентности, были изоляты, in vitro чувствительные к АФП. Такие изоляты могут со- держать «слабые мутации», при этом не все генетические варианты связаны с устойчивостью к АФП [14, 31]. Резистентность к азолам может быть вызвана не только геном ERG11, но и другими аллелями этого гена. Кроме того, вероятно, в нашей клинике резистентность к АФП связана и с другими механизмами, например, с активным выведением (эффлюкс) противогрибкового препарата из внутриклеточного пространства клеток кандид или мутацией белков пориновых каналов, или с иными механизмами [32]. Кроме того, у всех штаммов, кроме C. krusei, детектированы факторы патогенности.
Список литературы Кандидемия у онкологических больных: фенотипические и молекулярно-генетические характеристики резистентности к противогрибковым лекарственным средствам, гены факторов патогенности Candida spp.
- Alves J., Palma P., Azevedo D., Rello J. Candidemia in the patient with malignancy. Hosp Pract (1995). 2018; 46(5): 246-52. doi: 10.1080/21548331.2018.1508290.
- McCarthy M.W., Walsh T.J. Candidemia in the cancer patient: diagnosis, treatment, and future directions. Expert Rev Anti Infect Ther. 2018; 16(11): 849-54. doi: 10.1080/14787210.2018.1536546.
- Colombo A.L., Agnelli C., Kontoyiannis D.P. Knowledge gaps in candidaemia/invasive candidiasis in haematological cancer patients. J Antimicrob Chemother. 2021; 76(3): 543-6. doi: 10.1093/jac/dkaa446.
- Togano T., Suzuki Y., NakamuraF., Tse W., KumeH. Epidemiology of visceral mycoses in patients with acute leukemia and myelodysplastic syndrome: Analyzing the national autopsy database in Japan. Med Mycol. 2021; 59(1): 50-7. doi: 10.1093/mmy/myaa029.
- Kotey F., Dayie N., Tetteh-Uarcoo P.B., Donkor E.S. Candida Bloodstream Infections: Changes in Epidemiology and Increase in Drug Resistance. Infect Dis (Auckl). 2021; 14: 1-5. doi: 10.1177/11786337211026927.
- 6.RisumM.,AstvadK., JohansenH.K., Sch0nheyder H.C., RosenvingeF., Knudsen J.D., Hare R.K., Datcu R., R0der B.L., Antsupova V.S., Kristen-senL., Gertsen J.B., M0ller J.K., DzajicE., S0ndergaard T.S., ArendrupM.C. Update 2016-2018 of the Nationwide Danish Fungaemia Surveillance Study: Epidemiologic Changes in a 15-Year Perspective. J Fungi (Basel). 2021; 7(6): 491. doi: 10.3390/jof7060491.
- Schroeder M., Weber T., Denker T., Winterland S., Wichmann D., Rohde H., Ozga A.K., FischerM., Kluge S. Epidemiology, clinical characteristics, and outcome of candidemia in critically ill patients in Germany: a single-center retrospective 10-year analysis. Ann Intensive Care. 2020; 10(1): 142. doi: 10.1186/s13613-020-00755-8.
- Prasad R., Nair R., Banerjee A. Emerging Mechanisms of Drug Resistance in Candida albicans. Prog Mol Subcell Biol. 2019; 58: 135-53. doi: 10.1007/978-3-030-13035-0_6.
- Xu Y., Chen L., Li C. Susceptibility of clinical isolates of Candida species to fluconazole and detection of Candida albicans ERG11 mutations. J Antimicrob Chemother. 2008; 61(4): 798-804. doi: 10.1093/jac/ dkn015.
- Chowdhary A., Prakash A., Sharma C., KordalewskaM., Kumar A., Sarma S., Tarai B., Singh A., Upadhyaya G., Upadhyay S., Yadav P., Singh P.K., Khillan V., Sachdeva N., Perlin D.S., Meis J.F. A multicentre study of antifungal susceptibility patterns among 350 Candida auris isolates (2009-17) in India: role of the ERG11 and FKS1 genes in azole and echinocandin resistance. J Antimicrob Chemother. 2018; 73(4): 891-9. doi: 10.1093/jac/dkx480.
- Pais P., Galocha M., Teixeira M.C. Genome-Wide Response to Drugs and Stress in the Pathogenic Yeast Candida glabrata. Prog Mol Subcell Biol. 2019; 58: 155-93. doi: 10.1007/978-3-030-13035-0_7.
- DavariA., Haghani I., HassanmoghadamF., NabiliM., Shokohi T., Hedayati M.T., Shabanzadeh S., Moazeni M. Echinocandin resistance in Candida parapsilosis sensu stricto: Role of alterations in CHS3, FKS1 and Rho gene expression. J Glob Antimicrob Resist. 2020; 22: 685-8. doi: 10.1016/j.jgar.2020.06.025.
- Беженар М.Б., Плахова К.И. Механизмы развития резистентности к противогрибковым препаратам грибов рода Candida при рецидивирующем течении урогенитального кандидоза. Молекулярная генетика, микробиология и вирусология. 2020; 38(1): 15-23. [Bezhenar M.B., PlakhovaK.I. Antifungal drug resistance Candida spp. mechanisms in reccurent genital candidiasis. Molecular Genetics, Microbiology and Virology. 2020; 38(1): 15-23. (in Russian)]. doi: 10.17116/ molgen20203801115.
- Пчелин И.М., Рябинин И.А., Сташук А.А., Выборнова И.В., ЧилинаГ.А., ДобродееваВ.С., НасыроваР.Ф., ШагдилееваЕ.В., Васильева Н.В., ТараскинаА.Е.. Генетический полиморфизм ERG11 клинических изолятов candida albicans: теоретические и практические аспекты. Проблемы медицинской микологии. 2020; 22(3): 36-42. [Pchelin I.M., Ryabinin I.A., StashukAA., Vybornova I.V., Chilina G.A., Dobrodeeva V.S., Nasyrova R.F., Shagdileeva E.V., Vasilyeva N.V., Taraskina A.E. ERG11 genetic polymorphism in clinical isolates of candida albicans: theoretical and practical aspects. Problems of Medical Mycology. 2020; 22(3): 36-42. (in Russian)]. doi: 10.24412/1999-6780-2020-3-36-42.
- Thomaz D.Y., Melhem M.S.C., de Almeida Júnior J.N., Benard G., Del Negro G.M.B. Lack of efficacy of echinocandins against high metabolic activity biofilms of Candida parapsilosis clinical isolates. Braz J Microbiol. 2020; 51(3): 1129-33. doi: 10.1007/s42770-019-00219-7.
- Kumari A., Tripathi A.H., Gautam P., Gahtori R., Pande A., Singh Y., Madan T., Upadhyay S.K. Adhesins in the virulence of opportunistic fungal pathogens of human. Mycology. 2021; 12(4): 296-324. doi: 10.1080/21501203.2021.1934176.
- Rosiana S., Zhang L., Kim G.H., RevtovichA. V., UthayakumarD., Sukumaran A., Geddes-McAlister J., Kirienko N.V., Shapiro R.S. Comprehensive genetic analysis of adhesin proteins and their role in virulence of Candida albicans. Genetics. 2021; 217(2). doi: 10.1093/genetics/ iyab003.
- SinghD.K., Németh T., Papp A., TóthR., Lukácsi S., Heidingsfeld O., Dostal J., Vágv0lgyi C., Bajtay Z., JózsiM., Gácser A. Functional Characterization of Secreted Aspartyl Proteases in Candida parapsilosis. mSphere. 2019; 4(4). doi: 10.1128/mSphere.00484-19.
- Rasheed M., Battu A., Kaur R. Aspartyl proteases in Candida glabrata are required for suppression of the host innate immune response. J Biol Chem. 2018; 293(17): 6410-33. doi: 10.1074/jbc.M117.813741.
- Frías-De-León M.G., Hernández-Castro R., Conde-Cuevas E., García-Coronel I.H., Vázquez-Aceituno V.A., Soriano-Ursúa M.A., Farfán-García E.D., Ocharán-Hernández E., Rodríguez-Cerdeira C., Arenas R., Robledo-Cayetano M., Ramírez-Lozada T., Meza-Meneses P., Pinto-Almazán R., Martínez-Herrera E. Candida glabrata Antifungal Resistance and Virulence Factors, a Perfect Pathogenic Combination. Pharmaceutics. 2021; 13(10): 1529. doi: 10.3390/pharmaceutics13101529.
- Maльчиковa A.O., Клясовa r.A. Продукция биоплепок среди возбудителей инвазивного кандидоза у больных опухолевыми заболеваниями системы крови и у больных без опухолевых заболеваний системы крови. Гематология и трансфузиология. 2020; 65(3): 281-90. [Malchikova A.O., Klyasova G.A. Biofilm production among candida spp. causing invasive candidiasis in patients with hematological malignancies and without hematological malignancies. Hematology and Transfusiology. 2020; 65(3): 281-90. (in Russian)]. doi: 10.35754/0234-5730-2020-65-3-281-290.
- BentzM.L., SextonD.J., WelshR.M., LitvintsevaA.P. Phenotypic switching in newly emerged multidrug-resistant pathogen Candida auris. Med Mycol. 2018. doi: 10.1093/mmy/myy100.
- de Jong A.W., Hagen F. Attack, Defend and Persist: How the Fungal Pathogen Candida auris was Able to Emerge Globally in Healthcare Environments. Mycopathologia. 2019; 184(3): 353-65. doi: 10.1007/ s11046-019-00351-w.
- Xu Y., Chen L., Li C. Susceptibility of clinical isolates of Candida species to fluconazole and detection of Candida albicans ERG11 mutations. J Antimicrob Chemother. 2008; 61(4): 798-804. doi: 10.1093/jac/ dkn015.
- Kordalewska M., Lee A., Park S., Berrio I., Chowdhary A., Zhao Y., Perlin D.S. Understanding Echinocandin Resistance in the Emerging Pathogen Candida auris. Antimicrob Agents Chemother. 2018; 62(6). doi: 10.1128/AAC.00238-18.
- Shrief R., SayedZaki M.E., El-SehsahE.M., Ghaleb S., MofrehM. Study of Antifungal Susceptibility, Virulence Genes and Biofilm Formation in Candida albicans. Open Microbiol J. 2019; 13(1): 241-8. doi: 10.2174/1874285801913010241.
- StehrF., Felk A., Gácser A., KretschmarM., MähnssB., NeuberK., Hube B., Schäfer W. Expression analysis of the Candida albicans lipase gene family during experimental infections and in patient samples. FEMS Yeast Res. 2004; 4(4-5): 401-8. doi: 10.1016/S1567-1356(03)00205-8.
- Kadry A.A., El-Ganiny A.M., El-Baz A.M. Relationship between Sap prevalence and biofilm formation among resistant clinical isolates of Candida albicans. Afr Health Sci. 2018; 18(4): 1166-74. doi: 10.4314/ ahs.v18i4.37.
- KritikosA., NeofytosD., KhannaN., SchreiberP.W., BoggianK., Bille J., Schrenzel J., Mühlethaler K., Zbinden R., Bruderer T., Golden-berger D., Pfyffer G., Conen A., Van Delden C., Zimmerli S., Sanglard D., Bachmann D., Marchetti O., Lamoth F.; Fungal Infection Network of Switzerland (FUNGINOS). Accuracy of Sensititre YeastOne echinocandins epidemiological cut-off values for identification of FKS mutant Candida albicans and Candida glabrata: a ten year national survey of the Fungal Infection Network of Switzerland (FUNGINOS). Clin Microbiol Infect. 2018; 24(11). doi: 10.1016/j.cmi.2018.05.012.
- Sheng C., Zhang W. New lead structures in antifungal drug discovery. Curr Med Chem. 2011; 18(5): 733-66. doi: 10.2174/092986711794480113.
- ArendrupM. C., FribergN., MaresM., Kahlmeter G., Meletiadis J., Guinea J.; Subcommittee on Antifungal Susceptibility Testing (AFST) of the ESCMID European Committee for Antimicrobial Susceptibility Testing (EUCAST). How to interpret MICs of antifungal compounds according to the revised clinical breakpoints v. 10.0 European committee on antimicrobial susceptibility testing (EUCAST). Clin Microbiol Infect. 2020; 26(11): 1464-72. doi: 10.1016/j.cmi.2020.06.007.
- Bhattacharya S., Sae-Tia S., Fries B.C. Candidiasis and Mechanisms of Antifungal Resistance. Antibiotics (Basel). 2020; 9(6): 312. doi: 10.3390/antibiotics9060312.


