Капсулирование семян препаратами хитозана и его производных восстанавливает фотосинтез у растений хлопчатника (Gossypium L., 1753) на фоне вилта
Автор: Акиншина Н.Г., Рашидова Д.К., Азизов А.А.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Фотосинтез и продуктивность
Статья в выпуске: 5 т.51, 2016 года.
Бесплатный доступ
Доказано, что препараты на основе хитозана обладают противовирусной, антибактериальной и антимикотической активностью, способны стимулировать иммунитет растений. В условиях полевого опыта (Ташкенская обл., Республика Узбекистан, 2015-2016 годы) мы впервые оценили влияние капсулирования семян хлопчатника (сорт Султан) препаратами, синтезированными в институте Химии и физики полимеров при Национальном университете Узбекистана (НУУз, г. Ташкент) из отходов, получаемых по авторской методике при переработке коконов тутового шелкопряда (УзХитан, аскорбат хитозана и хелатный комплекс хитозана с медью), на фотосинтетическую активность растений на фоне вилта (возбудитель - Verticillium dahliae). Показано, что при поражении вилтом возрастает удельный вес листовой пластинки, снижается скорость дыхания и фотосинтеза, уменьшается содержание фотосинтетических пигментов в листьях. Так, на фоне вилта у не обработанных производными хитозана контрольных растений количество хлорофилла уменьшалось на 10 % (в пересчете на 1 см2 поверхности листа) и на 27-30 % (в пересчете на 1 г сухой массы). При использовании биополимеров содержание хлорофилла было выше контроля (без обработки): в вариантах с аскорбатом и хелатом хитозана - соответственно на 25,5 и 17,7 % (в пересчете на 1 г сухой массы), в группах, где применяли УзХитан и аскорбат, - на 15,0 и 16,0 % (в пересчете на 1 см2). Изменения содержания хлорофилла у растений, выращенных в отсутствие инфекционного фона, были статистически недостоверны (при 5 % уровне значимости). Обнаружено, что на фоне вилта у контрольных растений скорость чистой продукции кислорода снижается с 0,245±0,028 до 0,161±0,027 мкмоль O2 · м-2 · с-1, или на 33 %. Это связано с токсическим действием патогена, проникающего через корни по сосудистой системе растений к листьям и точке роста, что приводит к нарушению водного обмена, разрушению хлорофилла и усыханию листьев. В контроле статистический анализ средних показал недостоверность различий в скорости дыхания у листьев, однако следует отметить тенденцию к снижению этого показателя под воздействием вилта (на 22 %). У растений из семян, предварительно обработанных препаратами хитозана, на фоне заражения вилтом средние показатели скорости видимого фотосинтеза (чистой продукции кислорода) превышали контрольные (в случае аскорбата и хелата хитозана максимально - соответственно на 54 и 46 %). Скорость темнового дыхания на фоне вилта по группам достоверно не различалась. Индекс кислородного баланса (ИКБ), который рассчитывается как отношение скорости видимого фотосинтеза к скорости темнового дыхания, может характеризовать физиологическое состояние взрослого растения в условиях биогенного стресса. В отсутствие патогена статистически достоверных изменений ИКБ относительно контроля не обнаружили. Однако на фоне вилта в вариантах с обработкой производными хитозана ИКБ был выше, чем без обработки (в случае аскорбата и хелата - соответственно на 36 и 52 %, Р
Производные хитозана, сhitosan derivatives, хлопчатник, вертициллез, содержание хлорофилла, фотосинтез, темновое дыхание, индекс кислородного баланса, сhitosan
Короткий адрес: https://sciup.org/142214150
IDR: 142214150 | УДК: 633.511:632.4:57.044:581.132 | DOI: 10.15389/agrobiology.2016.5.696rus
Текст научной статьи Капсулирование семян препаратами хитозана и его производных восстанавливает фотосинтез у растений хлопчатника (Gossypium L., 1753) на фоне вилта
Поли-(1-4)-2-амино-2-дезокси-β - D-глюкан (хитозан) — распространенный природный мукополисахарид. Он может быть получен деацетилированием хитина — компонента клеточной стенки некоторых грибов, экзоскелета ракообразных, насекомых и червей (1). Благодаря высокой био-696
логической активности хитин, хитозан и их производные широко используются в биомедицине и сельском хозяйстве (1, 2), в частности в растениеводстве для защиты от вредителей и болезней, для биологического контроля патогенов за счет активации действия микроорганизмов-антагонистов, для усиления благоприятных взаимодействий между растением и симбиотическим микроорганизмом, для регуляции роста и развития растений, повышения урожайности. Препараты на основе хитозана и его производных применяют при предпосевной обработке семян, вносят в почву, ими опрыскивают растения или полученный урожай (1, 3-6). Хитозан безопасен для человека, сельскохозяйственных животных и окружающей среды, поскольку в природе распадается с образованием простого моносахарида D-глюкозамина (1, 7).
Доказано, что препараты на основе хитозана обладают противовирусной, антибактериальной и антимикотической активностью, способны стимулировать иммунитет растений (1, 3, 5-8). Так, установлено повышение устойчивости к болезням у риса, табака, ямса (2), томата (9), сои (10), хлопчатника (11), пшеницы, ячменя (2, 12-15), моркови (2, 14), огурца и картофеля (8, 14). Предпосевная обработка семян и опрыскивание растений приводит к угнетению серой пятнистости листа ( Pyricularia grisea ) (1, 16), корневых гнилей, вызываемых Fusarium spp. (1, 9-11, 13, 14), Bipolaris spp. (13, 17), к подавлению фитофтороза (возбудитель Phythophtora parasitica и Phytophthora infestans [Mont.] de Bary) (14), темно-бурой и сетчатой пятнистостей ( Bipolaris sorociniana , Drechslera teres ), септориоза ( Septoria nodorum ), пыльной головни ( Ustilago nuda ), бурой ржавчины ( Puccinia re-condita ), оливковой плесени ( Cladosporium herbarum ), альтернариоза ( Alter-naria tenuis ) (12, 13, 17, 18). Противомикробное действие олигомеров хитозана связано с их способностью влиять на механизм репродукции микроорганизмов (7) и повышать антибиотикочувствительность. Наиболее активен против ряда бактерий низкомолекулярный хитозан, а самые эффективные противомикробные агенты — хитозаны с высокой степенью деацетилирования (1, 2, 7).
Хитозан относят к сильным элиситорам — веществам, которые индуцируют в растениях неспецифический иммунитет, вызывая накопление антипатогенных веществ посредством повышения экспрессии генов защиты (1, 2, 19, 20). Считается, что элиситорная активность хитозана обусловлена наличием в молекуле остатков N-ацетилглюкозамина, способных специфически взаимодействовать с рецепторами на поверхности растительной клетки, а также их неспецифическим взаимодействием с внешними и внутренними клеточными компонентами (1, 2). Поликатионная природа хитозана позволяет ему с помощью электростатических взаимодействий связываться с отрицательно заряженной цитоплазматической мембраной, проникать в цитоплазму и ядро, взаимодействовать с нуклеиновыми кислотами, нарушая нормальное связывание ДНК с гистонами и приводя к разрывам ее цепи (21). Изменения в ДНК могут послужить сигналом для активации репарационных процессов и транскрипции генов защиты. Хитозан как поликатион также предположительно способен непосредственно блокировать репликацию вирусов, взаимодействуя с отрицательно заряженной вирусной РНК (8). Хитозан и его положительно заряженные производные стимулируют в растениях продукцию противогрибных метаболитов, в частности активных форм кислорода и фитоалексинов (9, 20). Противовирусное действие хитозана тоже связывают со способностью повышать содержание активных форм кислорода, которые могут разрушать белковую оболочку или геномную РНК вируса (8). Неспецифическим характером действия глюкозаминных остатков объясняется способность хитозана подавлять инфекцию независимо от вида патогена (2). Сочетанное (специфическое и неспецифическое) действие хитозана позволяет растению надежно улавливать хитозановый сигнал и включать защитные реакции с разным механизмом активации и действия (2).
Урожайность растений, их биопродуктивность определяется комплексом сложных взаимодействий физиологических (фотосинтез, рост и дыхание) и биохимических процессов, экологическими условиями и агротехникой выращивания, при этом главная роль в формировании урожая отводится фотосинтезу.
Поскольку одно из проявлений вертициллезного поражения растения — повреждение листьев, их усыхание и опадение, нам представлялось интересным изучить некоторые показатели состояния листовой пластинки, содержание хлорофилла, интенсивность дыхания и видимого фотосинтеза на хлопчатнике на фоне вилта с использованием прибора PlantVital_5030, позволяющего достаточно быстро проводить экспресс-диагностику. Подобные исследования выполнены нами на хлопчатнике впервые. При этом мы исходили из предположения, что показатели, характеризующие такие важнейшие физиологические процессы, как фотосинтез и дыхание, объективно отражают физиологическое состояние растения и, следовательно, эффективность применения препаратов хитозана для повышения устойчивости растений к поражению этим патогенным грибом.
Целью работы было изучение влияния препаратов на основе хитозана на фотосинтетическую активность растений при поражении вилтом.
Методика . Исследования (2015-2016 годы, экспериментальные поля НИИ селекции, семеноводства и агротехнологии выращивания хлопка, Ташкентская обл.) проводили на хлопчатнике сорта Султан. Перед посевом семена обрабатывали производными хитозана по технологии капсули-рования (11). Все использованные в работе препараты синтезированы в институте Химии и физики полимеров при Национальном университете Узбекистана (НУУз, г. Ташкент) из отходов, получаемых по авторской методике при переработке коконов тутового шелкопряда. Изучали четыре группы растений: I — контрольные (без предпосевной обработки семян); II, III и IV — получены из семян, обработанных соответственно УзХита-ном (смесь раствора хитозана и натриевой соли карбоксиметилцеллюлозы), аскорбатом хитозана и хелатным комплексом хитозана с ионами меди. В каждой группе одну часть растений выращивали на искусственном инфекционном фоне ( Verticillium dahliae ), другую — на незараженной почве. В середине вегетационного периода в фазу активного цветения (вторая половина августа) верхние хорошо освещаемые листья с 3-4-го междоузлия (от верхушки) в 7 ч 30 мин отбирали в качестве образцов для исследования.
Стандартным весовым методом (высушивание при 105 °С) измеряли содержание воды в листьях (22) и рассчитывали удельную поверхностную плотность листовой пластинки (УППЛ, LMA) (23).
Количество хлорофиллов a и b определяли спектрофотометрически (Spectroquant NOVA400, «Merck», Германия) (24, 25) после быстрой гомогенизации высечки листа, высушенной при комнатной температуре, в фарфоровой ступке и экстракции 85 % водным раствором ацетона на холоду. Содержание хлорофиллов (в расчете на сырую и сухую массу, а также на 1 см2 поверхности листовой пластинки) вычисляли по Реббелену.
Скорость поглощения листьями кислорода в темноте и выделения на свету (видимого фотосинтеза) измеряли на приборе PlantVital_5030 («INNO-Concept GmbH», Германия) при помощи электрохимического сен-698
сора типа Кларка (MF 41-INN Sensortechnik Meinsberg) при температуре 27 °С. Анализируемая проба освещалась диодом, работающим в красной области спектра (X = 635-650 нм). Индекс кислородного баланса рассчитывали как отношение скорости видимого фотосинтеза к скорости дыхания в темноте (26-28).
Статистическую обработку данных выполняли в программе Ori-ginPro 7.5 («OriginLab Corp.», США). На рисунках и в таблице представлены среднеарифметические значения как минимум 20 измерений и их стандартные квадратические отклонения. Достоверность различий между средними вычисляли методом однофакторного дисперсионного анализа (ANOVA) при уровне значимости P = 0,05. В работе обсуждаются статистически значимые различия, которые соответствуют Р < 0,05.
Результаты. Многие исследователи отмечают существенное снижение фотосинтетической активности растений при поражении патогенными грибами, что может быть связано с уменьшением ассимиляционной поверхности из-за отмирания тканей листа или разрастания мицелия, разрушением хлоропластов, снижением содержания хлорофилла, нарушением оттока продуктов фотосинтеза из-за повреждения флоэмы (29-31). В то же время описано положительное воздействие хитозана на рост и развитие растений, в частности на содержание фотосинтетических пигментов. По- казано, что при внесении хитозана в почву на ранних этапах развития растений сои, фасоли, томата, риса, салата усиливается рост корней и побе- гов, увеличивается размер листа и повышается содержание хлорофилла, что приводит к росту урожайности (32, 33).
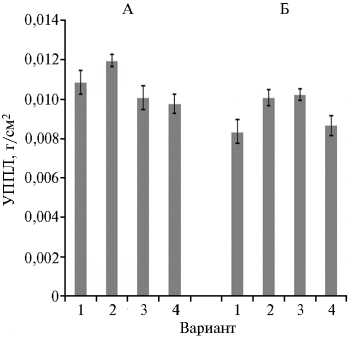
Рис. 1. Удельная поверхностная плотность листа (УППЛ) у растений хлопчатника ( Goss-ypium L., 1753) сорта Султан при предпосевной обработке семян препаратами на основе хитозана: А — на искусственном инфекционном фоне ( Verticillium dahliae ), Б — без инфицирования; 1 — контроль (без обработки), 2 — УзХитан (смесь раствора хитозана и натриевой соли карбоксиметилцеллюлозы), 3 — аскорбат хитозана, 4 — хелатный комплекс хитозана с ионами меди (экспериментальный участок, Ташкентская обл., Республика Узбекистан, 2015-2016 годы).
Отношение сухой массы листовой пластинки к ее площади — показатель чувствительный ко многим факторам (освещенность, водо-обеспеченность, патогены и др.). В нашем эксперименте при поражении вилтом листья становились более плотными, грубыми и тяжелыми, листовая пластинка утолщалась. Так, в контроле на фоне вилта удельная масса листьев (10,8 мг/см2) увеличилась примерно на 30 % относительно аналогичного показателя без инфекционного фона (8,3 мг/см2). В среднем на 1 см2 листовой пластинки у растений на фоне вилта приходилось 10,7 мг сухого вещества, что превышало на 14,5 % аналогичный показатель без инфицирования (9,4 мг/см2) (рис. 1). У растений, обработанных аскорбатом хитозана и хелатом, этот показатель был ниже, чем в контроле на фоне ви-лта. Содержание воды в листьях всех исследуемых растений при этом достоверно не различалось и составило в среднем 64,63±2,03 %.
Чем ниже удельная масса листа, тем меньше продуктов фотосинте- за растение затрачивает на формирование листового покрова и тем быст- рее растет и развивается (23). Принимая во внимание, что вилт хлопчатника поражает сосудистую систему растений, нарушает водообмен и, в конечном итоге, вызывает засыхание листьев, можно предположить, что Verticillium dahliae становится причиной повышения удельной массы листа в основном из-за замедления оттока ассимилятов и их накопления в листе.
Интересно отметить, что при обработке аскорбатом хитозана содер- жание сухого вещества в листьях было практически одинаковым у растений на «чистом» и зараженном полях (соответственно 10,2 и 10,1 мг/см2).
А
Б
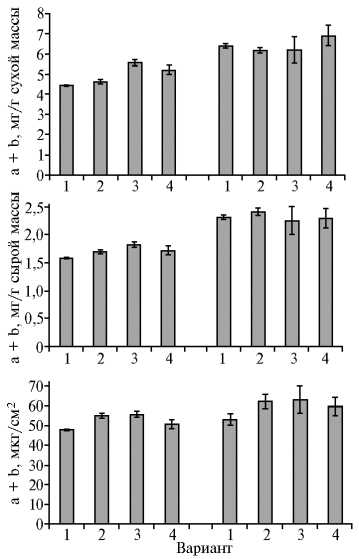
Рис. 2. Содержание хлорофиллов a и b в листьях растений хлопчатника ( Gossypium L., 1753) сорта Султан при предпосевной обработке семян препаратами на основе хитозана (в расчете на массу и единицу площади): А — на искусственном инфекционном фоне ( Verticillium da-hliae ), Б — без инфицирования; 1 — контроль (без обработки), 2 — УзХитан (смесь раствора хитозана и натриевой соли карбоксиметил-целлюлозы), 3 — аскорбат хитозана, 4 — хелатный комплекс хитозана с ионами меди (экспериментальный участок, Ташкентская обл., Республика Узбекистан, 2015-2016 годы).
Как и ожидалось, содержание пигментов хлорофилла у растений, не пораженных вертициллезом, было выше (рис. 2). На фоне вилта в контроле сумма хлорофиллов а и b снижалась на 10 % (в расчете на 1 см2 поверхности) и на 27-30 % (в расчете на 1 г сухой массы) по сравнению с контролем в отсутствие инфицирования. В среднем у растений на инфекционном фоне количество хлорофилла было ниже, чем у неинфи-цированных (на 13 %, или 52,45±2,20 против 59,31±3,05 мкг/см2, и на 27 %, или 4,90±0,46 против 6,35±0,35 мг/г сухой массы). При поражении вилтом содержание хлорофилла после предварительной обработки биополимерами было выше, чем у контрольных: в вариантах с аскорбатом и хелатом — соответственно на 25,5 и 17,7 % (в расчете на 1 г сухой массы), в группах, где применяли УзХитан и аскорбат, — на 15,0 и 16,0 % (при пересчете на единицу площади листа) (см. рис. 2).
Изменение количества хлорофилла у неинфицированных растений хлопчатника было статистически недостоверным. Это позволяет предположить, что хитозан и его производные не оказывали прямого стимулирующего воздействия на фотосинтетический аппарат, а положительный эффект при поражении вилтом связан с угнетением патогена и улучшением общего состояния растения.
Было обнаружено, что на фоне вилта у контрольных растений скорость фотосинтеза снижалась примерно на 33 % — до 0,161±0,027 против 0,245±0,028 мкмоль О2•м-2•с-1 (табл.). Это связано с токсическим действием патогена, который проникает через корни и перемещается по сосуди- стой системе растений вверх к листьям и точке роста, что приводит к нарушению водного обмена, разрушению пигментов и усыханию листьев.
Статистический анализ средних результатов измерений скорости дыхания листьев в контрольных группах показал недостоверность различий (при Р < 0,05), однако следует отметить тенденцию к снижению этого показателя при вилте (на 22 %) (см. табл.). Наблюдаемое уменьшение скорости фотосинтеза и дыхания также может быть следствием закрытия устьиц при вертицеллезном поражении.
Поглощение и выделение О2 листьями растений хлопчатника ( Gossypium L., 1753) сорта Султан при предпосевной обработке семян препаратами на основе хитозана в зависимости от инфекционного фона ( Х ±σ , экспериментальный участок, Ташкентская обл., Республика Узбекистан, 2015-2016 год)
|
Вариант обработки |
Скорость, мкмоль О 2 •м - 2•с - 1 |
Индекс кислородного баланса |
|
|
темнового дыхания |
видимого фотосинтеза |
||
|
На |
инфекционном |
ф о н е ( Verticillium dahliae ) |
|
|
Контроль (без обработки) |
- 0,148±0,036 |
0,161±0,027 |
1,092±0,209 |
|
УзХитан |
- 0,156±0,061 |
0,221±0,052 |
1,539±0,373 |
|
Аскорбат хитозана |
- 0,166±0,022 |
0,248±0,051 |
1,486±0,138 |
|
Хелат хитозана |
- 0,143±0,019 0,235±0,032 Без инфицирования |
1,660±0,211 |
|
|
Контроль (без обработки) |
- 0,190±0,041 |
0,245±0,028 |
1,331±0,301 |
|
УзХитан |
- 0,159±0,048 |
0,235±0,051 |
1,555±0,368 |
|
Аскорбат хитозана |
- 0,173±0,038 |
0,232±0,077 |
1,354±0,379 |
|
Хелат хитозана |
-0,162±0,023 |
0,253 + 0,023 |
1,576±0,221 |
У растений хлопчатника в вариантах с предпосевной обработкой семян препаратами хитозана на фоне заражения вилтом средняя скорость видимого фотосинтеза (чистой продукции кислорода) была выше относительно таковой в необработанном контроле (см. табл.). Самые высокие результаты показали растения при использовании аскорбата хитозана и хелата хитозана — соответственно +54 и +46 %. Скорость темнового дыхания по всем вариантам (контроль и опыт) на фоне вилта статистически достоверно не различалась при 5 % уровне значимости.
У растений, выращиваемых без инфицирования, различия с контролем по скорости видимого фотосинтеза и темнового дыхания не были статистически значимыми. В то же время на фоне вилта в вариантах с предварительной обработкой хитозаном и его производными те же показатели статистически достоверно не отличались от таковых для соответствующей группы без инфицирования. Можно сделать вывод о том, что предпосевная обработка биополимерами способствовала повышению иммунного статуса растений, в результате чего мы не наблюдали патологических проявлений вертициллезного поражения листа и изменений фотосинтетической активности.
Ранее показано, что отношение скорости фотосинтеза к скорости дыхания (ИКБ) может характеризовать физиологическое состояние взрослого растения в условиях биогенного стресса (27, 28). В отсутствие патогена (см. табл.) статистически достоверных изменений ИКБ относительно контроля мы не обнаружили. Однако на фоне вилта в вариантах с обработкой производными хитозана растения имели более высокие значения ИКБ, чем без обработки. Так, применение аскорбата хитозана и хелата хитозана при 5 % уровне значимости достоверно повышало ИБК относительно контроля (соответственно на 36 и 52 %), и при этом ИБК достигал значений, фиксируемых у растений без инфицирования. Это может свидетельствовать о повышении резистентности хлопчатника к вилту вследствие обработки хитозаном и его производными и снятии отрицательного эффекта патогена, который проявляется, в частности, в угнетении дыхания и фотосинтеза.
Таким образом, в полевых опытах продемонстрирована эффективность предпосевной обработки (капсулирования) семян хлопчатника хитозаном и его производными (аскорбат хитозана и хелатный комплекс хитозана с медью) для повышения иммунитета растений и приобретения ими устойчивости к Verticillium dahliae — возбудителю вилта. На фоне зараже- ния вилтом у растений наблюдали повышение массы листовой пластинки в расчете на единицу площади, снижение содержания хлорофиллов, уменьшение скорости дыхания и фотосинтеза. При предпосевной обработке семян исследованными препаратами негативное действие патогена не проявлялось и содержание хлорофилла, интенсивность дыхания и фотосинтеза достоверно не отличались от показателей у неинфицированных растений. В отсутствие патогена статистически достоверных изменений у растений при применении препаратов не выявили. Полученный эффект может быть следствием элиситорной активности хитозана и его производных и (или) стимулирования продукции активных форм кислорода и фитоалексинов, оказывающих специфическое фунгицидное действие. Наибольшую эффективность проявили аскорбат хитозана и хелатный комлекс хитозана с ионами меди.
Авторы выражают признательность фирме INNO-Concept GmbH (Strausberg, Germany) за техническую поддержку исследований и предоставленное оборудование.
Список литературы Капсулирование семян препаратами хитозана и его производных восстанавливает фотосинтез у растений хлопчатника (Gossypium L., 1753) на фоне вилта
- Ramirez M., Rodriguez A., Alfonso L., Peniche C. Chitin and its derivatives as biopolymers with potential agricultural applications. Biotecnologia Aplicada, 2010, 27: 270-276.
- Куликов С.Н. Варламов В.П. Роль структуры в элиситорной активности хитозана. Ученые записки Казанского ГУ, естественные науки, 2008, т. 150, кн. 2: 43-58.
- Герасименко Д.В., Авдиенко И.Д., Банникова Г.Е., Зуева О.Ю., Варламов В.П. Антибактериальная активность водорастворимых низкомолекулярных хитозанов в отношении различных микроорганизмов. Прикладная биохимия и микробиология, 2004, 40(3): 301-306.
- Васюкова Н.И., Зиновьева С.В., Ильинская Л.И., Переход Е.А., Чаленко Г.И., Герасимова Н.Г., Ильина А.В., Варламов В.П. Модулирование болезнеустойчивости растений с помощью водорастворимого хитозана. Прикладная биохимия и микробиология, 2001, 37(1): 115-122.
- Чирков С.Н. Противовирусная активность хитозана. Прикладная биохимия и микробиология, 2002, 38(1): 5-13.
- Rabea E., Badawy M., Stevens C., Smagghe G., Steurbaut W. Chitosan as antimicrobial agent: applications and mode of action. Biomacromolecules, 2003, 4(6): 1457-1465.
- Крыжановская Е.В., Варламов В.П., Самуйленко А.Я., Албулов А.И., Шинкарев С.М., Фролова М.А., Еремец Н.К., Бондарева Н.А., Хабаров В.Б., Гринь А.В. Антибактериальное действие форм хитозана на штаммы Mycobacterium. Сельскохозяйственная биология, 2008, 6: 119-121.
- Евстигнеева Т.А., Павлова Н.А., Тютерев С.Л. Влияние фитоактивного хитозана и салициловой кислоты на устойчивость растений картофеля к вирусу Y. Вестник защиты растений, 2012, 2: 27-33.
- Benhamou N., Lafontaine P., Nicole J. Induction of systemic resistance to Fusarium crown and root rot in tomato plants by seed treatment with chitosan. Phytopathology, 1994, 84(12): 1432-1444.
- Prapagdee B., Kotchadat K., Kumsopa A., Visarathanonth N. The role of chitosan in protection of soybean from sudden death syndrome caused by Fusarium solani f. sp. glycines. Bioresourсe Technol., 2007, 98(7): 1353-1358.
- Рашидова Д.К. Применение биологически активных полимеров на хлопчатнике. Ташкент, 2015.
- Попова Э.В. К механизму действия хитозана и возбудителя бурой ржавчины на компонентный состав белков растений пшеницы. Мат. Всерос. съезда «Защита растений в условиях реформирования агропромышленного комплекса: экономика, эффективность, экологичность». СПб, 1995: 233-234.
- Юдкин Л.Ю., Тарлаковский С.А. Биологическая эффективность хитозана против комплекса болезней на посевах ячменя. Мат. Всерос. съезда «Защита растений в условиях реформирования агропромышленного комплекса: экономика, эффективность, экологичность». СПб, 1995: 482.
- Новожилов К.В., Тютерев С.Л., Якубчик М.С., Тарлаковский С.А., Коломиец А.Ф., Панарин Е.Ф., Исмаилов Э.Я., Гамза-Заде А.И., Исмаилов В.Я., Бегунов И.И. Композиция на основе водных растворов хитозана, обладающая биологической активностью. Патент Российской Федерации № 2127056. Всероссийский НИИ защиты растений Российской академии сельскохозяйственных наук. Заявл. 23.01.1997. Опубл. 10.03.1999 DOI: https://elibrary.ru/item.asp?id=17514708
- Бойко А.П. Иммунорегулирующая роль хитозана и его биологическая эффективность в отношении комплекса болезней озимой пшеницы. В сб.: Защита и карантин растений. Ставрополь, 2000: 48-53.
- Rodriguez A., Ramirez M., Napoles M., Cardenas R. Antifungal activity of chitosan and one its hydrolysates on Pyricularia grisea Sacc fungus. Cultivos Tropicales, 2003, 24(2): 85-88.
- Максимов В.И., Крушев Л.Т., Савченков С.Н. Новый субстрат для скрининговых измерений хитинолитической активности. Биотехнология, 1992, 4: 60-62.
- Куприна Е.Э. Разработка и оценка свойств биологически активной добавки в почву на основе хитина, полученного электрохимическим способом. Микология и фитопатология, 2002, 36(4): 63-69.
- Васильев Л.А. Гибель эпидермальных клеток в листьях гороха, вызванная хитозаном. Автореф. канд. дис. М., 2009.
- Карпун Н.Н., Янушевская Э.Б., Михайлова Е.В. Механизмы формирования неспецифического индуцированного иммунитета у растений при биогенном стрессе. Сельскохозяйственная биология, 2015, 50(5): 540-549 ( ) DOI: 10.15389/agrobiology.2015.5.540rus
- Choi J.J., Klosterman S.J., Hadwiger L.A. A comparison of the effects of DNA damaging agents and biotic elicitors on the induction of plant defense genes, nuclear distortion, and cell death. Plant Physiol., 2001, 125: 752-762.
- Грязнов В.П., Сиротина Л.В. Практикум по физиологии растений. Белгород, 2000.
- Васфилов С.П. Анализ причин изменчивости отношения сухой массы листа к его площади у растений. Журнал общей биологии, 2011, 72(6): 436-454.
- Воробьев В.Н., Невмержицкая Ю.Ю., Хуснетдинова Л.З., Якушенкова Т.П. Практикум по физиологии растений. Казань, 2013.
- Методические рекомендации по определению ряда соединений в водных и растительных объектах (Адаптированные методы для Spectroquant NOVA400). INNO-Concept GmbH. Штраусберг, Германия, 2008.
- Azizov A., Tauschke M., Lentzsch P., Klose E., Akinshina N., Karasyova T., Schmidt C. Verfahren zur Bewertung der Vitalität chlorophylltragender biologischer Proben. Deutsches Patentant. DE 112006000480. IPC: G01N 33/483. INNO-Concept GmbH, Strausberg, DE. Anmeldung 06.03.2006. Veröffentlichung 30.04.2015.
- Акиншина Н.Г., Азизов А.А., Карасёва Т.А., Клозе Э. Новые возможности в оценке состояния растений. Сибирский экологический журнал, 2008, 2: 249-254.
- Акиншина Н.Г., Азизов А.А., Карасёва Т.А., Клозе Э.О. Коэффициент фотосинтетической эффективности как индикатор стресса. Мат. Межд. науч.-практ. конф. «Современная физиология растений: от молекул до экосистем». Сыктывкар, 2007: 4-5.
- Лысенко Н.Н., Чекалин Е.И., Пожарский С.М. Активность фотосинтеза и транспирация в листьях кормовых бобов при патогенезе и использовании средств защиты. Вестник Орловского государственного аграрного университета, 2013, 40(1): 70-76.
- Кушниренко М.Д., Медведева Т.Н. Влияние завядания на пигментную систему и развитие водоудерживающих сил листьев. Физиология растений, 1969, 16(3): 43-52.
- Мокроносов А.Т. Фотосинтез. Физиолого-экологические и биохимические аспекты. М., 2006.
- Sheikha S., Al-Malki F. Growth and chlorophyll responses of bean plants to the chitosan applications. European Journal of Scientific Research, 2011, 50(1): 124-134.
- Farouk S., Ramadan A. Improving growth and yield of cowpea by foliar application of chitosan under water stress. Egyptian Journal of Biology, 2012, 14: 14-26 ( ) DOI: 10.4314/ejb.v14i1.2


