Карбонилирование белков как возможный способ модуляции пролиферации клеток аденокарциномы молочной железы
Автор: Шахристова Евгения Викторовна, Степовая Елена Алексеевна, Садыкова Анна Алексеевна, Новицкий Вячеслав Викторович
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 6 т.17, 2018 года.
Бесплатный доступ
Введение. Нерешенная проблема растущей онкологической заболеваемости и смертности в мире ставит задачу разработки новых методических подходов в понимании молекулярных механизмов опухолевого роста, ассоциированного с дисбалансом редокс-регуляции внутриклеточных систем. Цель исследования - установить роль карбонилирования редокс-белков в регуляции пролиферации клеток аденокарциномы молочной железы при модуляции редокс-статуса. материал и методы. В интактных клетках аденокарциномы молочной железы и культивируемых при модуляции редокс-статуса с использованием 5 мМ N-этилмалеимида (блокатор SH-групп белков и пептидов) и 5 мМ 1,4-дитиоэритритола (протектор тиоловых групп) определяли содержание тиоредоксина и его карбонилированной формы методом вестерн-блоттинга; активность тиоредоксинредуктазы и концентрацию карбонильных производных белков определяли спектрофотометрическим методом; распределение клеток по фазам клеточного цикла оценивали методом проточной цитофлуориметрии. Результаты. При действии N-этилмалеимида остановка пролиферации опухолевых клеток в S фазе была связана c окислительной модификацией белков, в том числе карбонилированием тиоредоксина. Остановка клеточного цикла в G0/G1 фазах при культивировании клеток линии МСF-7 в присутствии 1,4-дитиоэритритола сопровождалась увеличением содержания восстановленных форм тиоредоксина и глутатиона. заключение. Редокс-зависимая модуляция пролиферации клеток аденокарциномы молочной железы осуществляется при участии системы тиоредоксина и окислительной модификации белков. Исследования в области редокс-регуляции представляются перспективными для поиска новых молекулярных мишеней опухолевой трансформации клеток молочной железы.
Окислительная модификация белков, карбонилированный тиоредоксин, аденокарцинома молочной железы, пролиферация, окислительный стресс, редокс-регуляция, внутриклеточные процессы
Короткий адрес: https://sciup.org/140254230
IDR: 140254230 | УДК: 618.19-006.66-092.4:577.112:577.2 | DOI: 10.21294/1814-4861-2018-17-6-78-83
Текст научной статьи Карбонилирование белков как возможный способ модуляции пролиферации клеток аденокарциномы молочной железы
В большинстве стран мира, в том числе и в России, проблема онкологической заболеваемости и смертности остается нерешенной. По данным Росстата, в последние годы выросло количество случаев впервые выявленных злокачественных новообразований, при этом в женской популяции лидирует рак молочной железы [1]. В этой ситуации осознается все большая необходимость исследования механизмов опухолевой прогрессии, связанной с развитием окислительного стресса (ОС), сопровождающегося изменением редокс-статуса клеток [2–5].
Редокс-регуляцию внутриклеточных процессов осуществляют системы глутатиона, тиоредоксина, глутаредоксина, функционирование которых приводит к снижению уровня активных форм кислорода (АФК), изменению активности факторов транскрипции и экспрессии ряда генов в ответ на модуляцию редокс-статуса клеток [6–10]. Необходимость ограничения продукции АФК в опухолевых клетках обусловлена их высокой реакционной способностью, приводящей к повреждению макромолекул, в частности белков, участвующих в регуляции пролиферации и программированной клеточной гибели. В поддержании редокс-статуса клеток преимущественная роль принадлежит глутатиону, поскольку этот пептид не только непосредственно участвует в обрыве цепных реакций свободно-радикального окисления, являясь коферментом ряда ферментов антиоксидантной защиты, более того, он необходим для функционирования глутаредоксина, составляя с этим редокс-белком единую систему [11, 12]. Глутатион способствует восстановлению окисленной формы тиоредоксина – низкомолекулярного редокс-протеина, выступающего кофактором ферментов, осуществляющих синтез дезоксирибонуклеотидов, репарацию ДНК, и способного сохранять дитиол/дисульфидную структуру белков – ключевых участников пролиферации клеток в условиях редокс-модуляции функционирования внутриклеточных систем [10–12].
Разработка новых методических подходов в понимании молекулярных и клеточных механизмов опухолевого роста, ассоциированного с дисбалансом в редокс-регуляции внутриклеточных систем, является актуальной задачей трансляционной медицины.
Цель исследования – установить роль карбонилирования редокс-белков в регуляции пролиферации клеток аденокарциномы молочной железы при модуляции редокс-статуса с использованием блокатора и протектора SH-групп белков и пептидов N-этилмалеимида и 1,4-дитиоэритритола.
Материал и методы
В исследовании была использована культура клеток линии МСF-7 (эпителиоподобная аденокарцинома молочной железы человека), полученная из Российской коллекции клеточных культур Института цитологии Российской академии наук (г. Санкт-Петербург). Опухолевые клетки линии МСF-7 культивировали адгезионным методом в полной питательной среде, содержащей 90 % EMEM («ПанЭко», Россия), 10 % эмбриональной телячьей сыворотки («Invitrogen», США), 1 % заменимых аминокислот («ПанЭко», Россия), 10 мкг/мл бычьего инсулина («ПанЭко», Россия), 0,3 мг/мл L-глутамина («ПанЭко», Россия) и 100 мкг/мл гентамицина («ICN», США). Жизнеспособность клеток оценивали микроскопическим методом с трипановым синим («Serva», США). Редокс-статус клеток аденокарциномы молочной железы модулировали с помощью N-этилмалеимида (NEM) («Sigma Aldrich», США), необратимо связывающего SH-группы белков и пептидов, в конечной концентрации 5 мМ [13] и 1,4-дитиоэритритола (DTE) («Sigma Aldrich», США), протектора тиоловых групп протеинов и пептидов, в конечной концентрации 5 мМ [14].
Методом вестерн-блоттинга по протоколу фирмы-производителя с использованием моноклональных антител определяли внутриклеточное содержание тиоредоксина («Thermo Scientific», США) и его карбонилированной формы [15] с использованием 2,4-динитрофенилгидразина и антител, связывающихся с 2,4-динитрофенолом («Sigma-Aldrich», США). Расчет содержания ис- следуемых форм белка проводили относительно концентрации референсного протеина β-актина. Активность тиоредоксинредуктазы (КФ 1.8.1.9) определяли спектрофотометрическим методом, основанным на способности фермента катализировать НАДФН-зависимое восстановление дисульфидных связей субстратов, реагирующих с 5,5-дитиобис-2-нитробензойной кислотой, образуя тио-2-нитробензойную кислоту, раствор которой имеет максимум поглощения при длине волны 412 нм [16]. Содержание белка в клетках определяли по взаимодействию красителя Ку-масси голубого G-250 с остатками аргинина и лизина белковых молекул [17]. Интенсивность необратимой окислительной модификации протеинов в клетках линии МСF-7 определяли по содержанию карбонильных производных белков методом, основанным на реакции взаимодействия окисленных аминокислотных остатков с 2,4-динитрофенилгидразином с образованием 2,4-динитрофенилгидразонов, которые регистрировали спектрофотометрически при длинах волн 274 и 363 нм [18].
Оценку распределения клеток линии МСF-7 по фазам клеточного цикла (G0/G1, G2/М и S) проводили методом проточной цитофлуориметрии на лазерном цитометре «FaCSCanto II» («Becton Dickinson», США) по протоколу Cycle Test Plus («Becton Dickinson», США).
Статистическую обработку проводили при помощи программы SPSS 11.0. Проверка на соответствие выборок нормальному закону распределения проводилась критерием Шапиро–Вилка. В связи с отсутствием согласия данных с нормальным распределением на уровне значимости p<0,01 и р<0,05 вычисляли средневыборочные характеристики: медиана (Ме), первый и третий квартили (Q1–Q3). Достоверность различий независимых выборок оценивали с помощью непараметрических критериев Краскала – Уолиса и Манна – Уитни для малых групп.
Результаты и обсуждение
При развитии окислительного стресса на фоне дисбаланса в системе антиоксиданты/прооксидан-ты происходит интенсификация продукции АФК и изменения редокс-статуса клеток [19, 20]. В ранних исследованиях [21] нами было выявлено, что NEM в клетках линии MCF-7 вызывает развитие ОС, сопровождающееся увеличением внутриклеточной продукции АФК и снижением концентрации восстановленного глутатиона (GSH), в то время как внесение DTE в культуральную среду опухолевых клеток способствовало снижению интенсивности свободно-радикальных процессов на фоне возрастания концентрации GSH и величины отношения восстановленной формы глутатиона к окисленной.
По результатам проведенного нами исследования было установлено, что при использовании редокс-модуляторов NEM и DTE происходила остановка пролиферации опухолевых клеток линии MCF-7 в S и G0/G1 фазах соответственно (рисунок).
Известно, что изменение редокс-статуса оказывает непосредственное воздействие на пролиферацию опухолевых клеток. Переключение фаз клеточного цикла контролируется белками – циклинами и циклинзависимыми протеинкина-зами, – функционирование которых зависит от структуры и конфигурации протеинов в условиях модуляции редокс-статуса. При развитии ОС атаке АФК подвергаются внутриклеточные биомолекулы и в первую очередь – белки. Свободные радикалы взаимодействуют с функциональными группами аминокислот в составе белков, преимущественно с остатками триптофана, тирозина, гистидина и цистеина [3, 22], что приводит к образованию аминокислотных радикалов, которые могут вступать в дальнейшие взаимодействия с соседними аминокислотными остатками полипептидной цепи. Аминокислотные радикалы, а также продукты окисления липидов способствуют образованию карбонильных групп протеинов, в результате
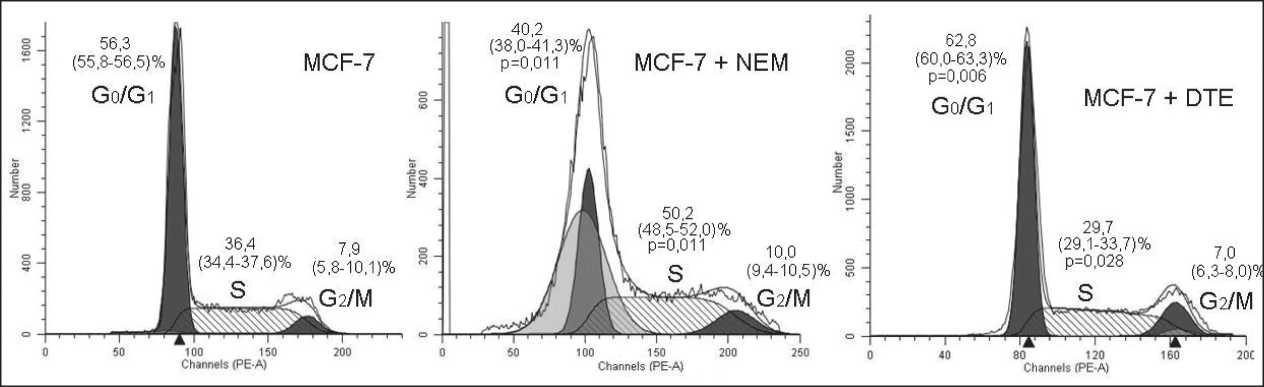
Рис. 1. Распределение клеток аденокарциномы молочной железы по фазам клеточного цикла при действии блокатора SH-групп белков N-этилмалеимида (NEM) и протектора SH-групп белков 1,4-дитиоэритритола (DTE). Примечание: р – уровень значимости различий по сравнению с интактными клетками MCF-7
таблица окислительная модификация белков и показатели системы тиоредоксина в опухолевых клетках линии MCf-7 при действии NeM и dte, Ме (Q1Q3)
|
Группы |
|||
|
Показатели |
Интактные MCF-7 |
MCF-7 + NEM (n=6) |
MCF-7 + DTE (n=6) |
|
(n=6) |
|||
|
4,52 |
20,21 |
2,48 |
|
|
λ=274 нм |
(13,76–20,61) |
(1,98–2,53) |
|
|
Карбонильные производные белков, услов- |
(3,26–7,34) |
р=0,009 26,91 |
р=0,028 3,23 |
|
ные единицы/мг белка |
5,48 |
||
|
λ=363 нм |
(5,01–6,28) |
(26,22–28,36) р=0,009 |
(2,71–3,37) р=0,009 |
|
1,73 (1,71–1,74) |
1,86 |
1,80 |
|
|
Тиоредоксин, условные единицы |
(1,83–1,87) р=0,001 |
(1,79–1,81) р=0,001 |
|
|
Карбонилированный тиоредоксин, условные единицы |
0,27 (0,19–0,29) |
0,82 (0,80–0,84) р=0,001 |
0,21 (0,19–0,23) р=0,529 |
|
Тиоредоксинредуктаза, нмоль НАДФН/мин×мг белка |
3,23 (3,17–3,26) |
2,62 (2,57–2,88) р=0,011 |
3,03 (2,43–3,52) |
Примечание: р – уровень значимости различий по сравнению с интактными клетками MCF-7; NEM – N-этилмалеимид (блокатор SH-групп белков); DTE – 1,4-дитиоэритритол (протектор SH-групп белков); Ме – медиана, Q1Q3 – первый и третий квартили.
чего белки утрачивают нативную структуру, каталитическую активность и увеличивается их чувствительность к протеолитической деградации [3, 22].
Нами установлено, что в клетках линии MCF-7 NEM, способствующий развитию ОС и остановке пролиферации клеток в S фазе, вызывает увеличение концентрации карбонильных производных белков по сравнению c интактной культурой (таблица).
В поддержании внутриклеточного редокс-гомеостаза и защите макромолекул от повреждающего действия АФК важную роль играет система тиоредоксина, включающая в себя тиоредоксин, НАДФН-зависимую тиоредоксинредуктазу, а также глутатион, используемый ферментом для восстановления окисленной формы редокс-белка [10–12].
Культивирование опухолевых клеток в присутствии NEM приводило к увеличению содержания тиоредоксина на 7,5 % по сравнению с интактной культурой (таблица), что отражало высокую потребность опухолевых клеток в антиоксидантах, необходимых для защиты макромолекул и выживания. Поддержание тиоредоксина в восстановленной форме осуществляет тиоредоксинредуктаза, активность которой в клетках линии MCF-7 в присутствии NEM снижалась (таблица), что может быть связано с недостатком НAДФH вследствие его интенсивного расхода в реакциях, катализируемых редуктазами, или уменьшением продукции кофермента в пентозофосфатном пути.
Поскольку тиоредоксин является белком, необходимым не только для редокс-регуляции внутриклеточных процессов, но и неотъемлемым компонентом репликации молекул ДНК, нами было выдвинуто предположение о возможности участия его карбонилированной формы в нарушении пролиферации опухолевых клеток. Так, нами было установлено, что при действии NEM концентрация карбонилированного тиоредоксина увеличивалась на 203,7 % по сравнению с интактной культурой клеток линии MCF-7 (таблица). Наряду с этим доля карбонилированной формы белка составила 44,1 % от общего количества тиоредоксина, в то время как в интактной культуре – 15,6 %. Полученные данные демонстрируют значительно превосходящее возрастание содержания карбони-лированного тиоредоксина по сравнению с увеличением коконцентрации немодифицированного тиоредоксина при культивировании опухолевых клеток в присутствии NEM. Карбонилированный тиоредоксин не способен выполнять свои функции, в результате чего нарушается синтез дезоксирибонуклеотидов, снижается способность редокс-белка поддерживать дитиолдисульфидную структуру внутриклеточных протеинов, что и привело к остановке пролиферации опухолевых клеток в S фазе клеточного цикла.
При культивировании клеток аденокарциномы молочной железы с DTE на фоне повышения величины отношения восстановленной формы глутатиона к окисленной установлено возрастание содержания тиоредоксина, снижение концентрации карбонильных производных белков и в то же время отсутствие статистически значимых различий в содержании карбонилированного тиоредоксина по сравнению с интактной культурой (таблица). DTE способствовал поддержанию свободных тиоловых групп белков и пептидов в восстановленном состоянии и снижению продукции АФК, в то же время пролиферация опухолевых клеток останавливалась в G0/G1 фазах (рис. 1). Для перехода клеток из G1 фазы в S необходимо активировать каскад реакций фосфорилирования белков-регуляторов пролиферации, ключевыми молекулами-модуляторами в которых являются АФК [23]. Содержание восстановленного глутатиона, редокс-белков в клетке и их проникновение в ядро могут являться одним из пусковых механизмов в смене фаз клеточного цикла.
Заключение
Редокс-зависимая модуляция пролиферации клеток аденокарциномы молочной железы осу- ществляется при участии системы тиоредоксина. Можно предположить, что изменение редокс-статуса клетки действует как триггерное звено для модуляции пролиферации. При действии NEM остановка пролиферации опухолевых клеток в S фазе была связана c окислительной модификацией белков, в том числе карбонилированием тиоредоксина. Остановка клеточного цикла в G0/G1 фазах при культивировании клеток линии МСF-7 в присутствии DTE сопровождалась увеличением содержания восстановленных форм тиоредоксина и глутатиона. Исследования в области редокс-регуляции представляются перспективными для поиска новых молекулярных мишеней опухолевой трансформации клеток молочной железы.
Список литературы Карбонилирование белков как возможный способ модуляции пролиферации клеток аденокарциномы молочной железы
- Здравоохранение в России. 2017: Статистический сборник. М.: Росстат; 2017. 170. [Healthcare in Russia. 2017: A statistical compilation. Moscow: Rosstat; 2017. 170. (in Russian)].
- Eaton P. Protein thiol oxidation in health and disease: techniques for measuring disulfides and related modifications in complex protein mixtures. Free Radic. Biol. Med. 2006; 40 (11): 1889-99. DOI: 10.1016/j.freeradbiomed.2005.12.037
- Butterfield D.A., Dalle-Donne I. Redox proteomics: from protein modifications to cellular dysfunction and disease. Mass Spectrom. Rev. 2014; 33 (1): 1-6. DOI: 10.1002/mas.21404
- Clementino M., Shi X., Zhang Z. Oxidative stress in carcinogenesis. Current Opinion in Toxicology. 2018; (7): 116-121. DOI: 10.1016/j.cotox.2017.11.014
- Меньщикова Е.Б., Зенков Н.К., Ланкин В.З., Бондарь И.А., Труфакин В.А. Окислительный стресс: Патологические состояния и заболевания. Новосибирск, 2008. 284. [Menshchikova E.B., Zenkov N.K., Lankin V.Z., Bondar I.A., Trufakin V.A. Oxidative stress: Pathological conditions and diseases. Novosibirsk, 2008. 284. (in Russian)].


