Кардиальная функция больных лимфомой Ходжкина в отдаленные сроки после химиолучевого лечения с различным фракционированием дозы при облучении средостения
Автор: Цыб А.Ф., Нестайко Т.О., Богатырева Т.И., Гусева З.А.
Рубрика: Научные статьи
Статья в выпуске: 4 т.18, 2009 года.
Бесплатный доступ
Эхокардиография проведена 69 больным лимфомой Ходжкина, не имевшим кардиальных жалоб и находившихся в стойкой ремиссии после химиолучевого лечения. Средостение было облучено в режиме ускоренного гиперфракционирования дозой 20-22 Гр (1 группа) либо традиционным фракционированием до СОД 20 Гр (2 группа) или 40 Гр (3 группа). Доксорубицин входил в схему полихимиотерапии, соответственно, у 86, 65 и 41 % больных. Эхокардиографию проводили в покое и с дозированной физической нагрузкой. При сравнении с контролем у больных 1, 2 и 3-й групп наблюдали достоверные отклонения, соответственно, 3, 4 и 7 эхокардиографических показателей. Доля больных с ФВЛЖ
Лимфома ходжкина, ускоренное гиперфракционирование, эхокардиография
Короткий адрес: https://sciup.org/170169988
IDR: 170169988
Текст научной статьи Кардиальная функция больных лимфомой Ходжкина в отдаленные сроки после химиолучевого лечения с различным фракционированием дозы при облучении средостения
Анализ отдаленных последствий ранних программ лучевого и комбинированного лечения лимфомы Ходжкина с облучением средостения показал, что заболевания сердечно-сосудистой системы внесли значительный вклад в инвалидизацию и преждевременную смерть больных с ремиссией длительностью 20 и более лет [9, 12]. Меньше известно о состоянии сердца у больных, подвергнутых облучению в рамках современных программ химиолучевого лечения с использованием кардиотоксичных антрациклиновых препаратов: сроки наблюдения невелики, данные литературы во многом противоречивы из-за вариаций состава анализируемых групп и решаемых задач [6, 8, 13].
Ранее полученные в МРНЦ РАМН результаты изучения сердечно-легочной функции у больных лимфомой Ходжкина свидетельствовали о неблагоприятных отдаленных последствиях использования суммарной очаговой дозы (СОД) 40 Гр [11, 19]. Скрыто протекающие в миокарде патологические процессы, в виде диффузных изменений по данным ЭКГ, имели место у 57 % обследованных, а нарушения сократительной функции миокарда – у 48 %, что позволяло объяснить большую частоту случаев внезапной смерти от инфаркта миокарда и острой коронарной недостаточности у подобных больных. Важно, что изменения со стороны миокарда встречались с одинаковой частотой после облучения в дозах 31-40 и 41-45 Гр независимо от площади облучения сердца.
Вышесказанное являлось основанием для разработки нового поколения программ хи-миолучевого лечения ЛХ, в которых исходно массивные и/или устойчивые образования облучались дозой 20-22 Гр, сниженной за счет подведения ее в режиме дневного дробления укрупненной суточной дозы (ускоренное гиперфракционирование, УГФ). Кроме того, у больных с поражением медиастинальных лимфатических узлов прибегали к назначению после 4-6 циклов по схемам ABVD или BEACOPP одного-двух циклов COPP, что позволяло уменьшить кумулятивную дозу доксорубицина и блеомицина, а также увеличить интервал между их применением и облучением средостения [2].
В соответствии с радиобиологическими обоснованиями, увеличение суточной дозы до 2,7-3,0 Гр повышает противоопухолевый эффект по сравнению с дозой 1,8-2,0 Гр в традиционном режиме фракционирования (ТФ), а дробление на две фракции по 1,35-1,5 Гр уменьшает разовую дозу, обеспечивая защиту здоровых тканей [4, 20]. В рандомизированных исследованиях доказана возможность эффективного применения СОД 20-22 Гр в режиме УГФ вместо традиционной СОД 40 Гр [3], как свидетельство интенсивности воздействия на опухоль. Требовалось оценить влияние изучаемого режима облучения на состояние сердечной функции у больных, получавших доксорубицин-содержащие схемы полихимиотерапии.
Целью настоящей работы являлось изучение функции сердца у больных лимфомой Ходжкина в отдаленные сроки после консолидирующей лучевой терапии (ЛТ) области средостения с использованием различных суммарных доз и режимов фракционирования.
Материалы и методы
Обследовано 69 больных лимфомой Ходжкина в состоянии ремиссии после химиолуче-вого лечения, включавшего лучевую терапию (ЛТ) на область средостения. Среди них были 41 мужчина и 28 женщин в возрасте от 21 до 66 лет (медиана 32). Все больные проходили химио-лучевое лечение в отделении лучевой и лекарственной терапии гемобластозов МРНЦ РАМН с впервые установленным диагнозом лимфома Ходжкина. Срок после окончания ЛТ составил 2-15 лет (медиана 5).
Для индукции ремиссии проводили 6-8 курсов полихимиотерапии (ПХТ) с использованием схем ABVD, BEACOPP, COPP/ABV, COPP, для ее закрепления – облучение лимфатических областей на гамма-терапевтических установках АГАТ или РОКУС. При облучении средостения применяли противолежащие поля, конфигурация которых зависела от объема поражения на момент завершения химиотерапии, а форму определяли индивидуально у каждого больного с помощью экранирующих блоков. Верхняя граница располагалась на 2 см ниже ключицы, нижняя соответствовала нижнему краю 11-го грудного позвонка. Верхушку сердца экранировали защитным свинцовым блоком с первого дня облучения, доза под ним составляла 10-15 % от дозы в центре поля.
В зависимости от режима фракционирования и суммарной очаговой дозы (СОД) на область средостения были выделены три группы больных. В 1-ю вошли 22 пациента, получавших
ЛТ в режиме ускоренного гиперфракционирования разовой дозой 1,3-1,5 Гр два раза в день с интервалом 4,5-5 часов до СОД 20-22 Гр (38-40 ед. ВДФ). Во 2-ю (n=20) и 3-ю (n=27) группы были включены больные, облученные в традиционном режиме разовой дозой 1,8-2,0 Гр в день до СОД, соответственно, 20-22 Гр (38-40 ед. ВДФ) и 36-40 Гр (60 ед. ВДФ). Дневная доза на участки сердца, попадавшие в поле облучения, при режиме УГФ составляла 2,64 Гр (две фракции по 1,32 Гр), а при традиционном фракционировании – 1,81 Гр.
Изучение систолической функции сердца проводили на этапах планового наблюдения, условием включения в анализ было отсутствие клинических проявлений сердечно-сосудистой патологии в период установления диагноза и при обследовании в отдаленные сроки.
Всем пациентам была проведена эхокардиография (ЭхоКГ) в покое, в том числе у 44 – до и после дозированной физической нагрузки с использованием двухступенчатой пробы Мастера [1]. Обследованию предшествовало заполнение опросников, в виде модифицированной комбинации QLQ – C30 [EORTC] по изучению кардиальной функции. Функциональные шкалы включали в себя 12 вопросов, оценивающих общее качество жизни с оценкой в баллах от 1 (отличное) до 7 (очень плохое). Симптоматические шкалы (3 вопроса) позволяли судить о кардиальной функции с оценкой симптомов от 1 (отсутствие симптома) до 4 (очень выраженный симптом), их заполнение повторяли после физической нагрузки. Ответы оценивали по сумме баллов функциональных и симптоматических шкал в диапазоне от 15 до 54 баллов: большее количество баллов соответствовало низкому (худшему) уровню функционирования и большему количеству патологических симптомов.
ЭхоКГ осуществляли с помощью аппарата Aloka SSD – 500 (B и М режимы). Оценивали морфо-функциональное состояние анатомических структур сердца, показатели систолической функции левого желудочка, включая скорость циркулярного укорочения волокон миокарда (Vcf). Измерения проводили в левых парастренальной и апикальной позициях по длинной и короткой осям, с использованием стандартных методик [10]. При анализе фракции выброса левого желудочка (ФВЛЖ) в покое как основного показателя систолической функции, использовали ранжирование по квартилям со следующими градациями: <60 %, 60-69 % и ≥70 %. При установлении степени кардиотоксичности опирались на опубликованные рекомендации [14].
Для получения контрольных ЭхоКГ показателей это исследование было проведено у 20 практически здоровых людей в возрасте 16-60 лет (медиана 33), проходивших профилактическое обследование. Среди них было 7 мужчин (35 %) и 13 женщин (65 %).
Статистическую обработку данных проводили с использованием компьютерных программ Microsoft Excel и БИОСТАТ. Данные представлены в виде среднего значения и стандартного отклонения (M±m). Изучаемые показатели сравнивали с помощью критерия χ2 Пирсона, точного критерия Фишера для дискретных переменных и t-критерия для непрерывных переменных. Достоверными считались различия при p≤0,05.
Результаты
Эхокардиографию провели 69 больным, находящимся в стойкой ремиссии от 2 до 15 лет. Состав групп больных, включенных в исследование, представлен в таблице 1. Группы сопоставимы по возрасту, исходным размерам опухоли средостения (медиастино-торакальный индекс, МТИ) и количеству курсов полихимиотерапии. Доксорубицин входил в схему химиотерапии, соответственно у 86, 65 и 41 % больных. Группа сравнения (3 гр.) отличалась большей долей пациентов, обследованных в сроки наблюдения свыше 5 лет, и меньшей долей получавших доксорубицин. Преобладание в 1-й группе мужчин и больных с III-IV стадиями, а также пациентов с МТИ более 0,3 указывает на включение в данную группу преимущественно больных с худшим прогнозом, поскольку программа лечения предусматривает применение режима УГФ для облучения очагов с массивным и/или устойчивым к химиотерапии поражением, тогда как традиционное фракционирование (2-я гр.) применяют при полной регрессии опухоли средостения.
Таблица 1
Клиническая характеристика больных ЛХ , обследованных в отдаленные сроки после комбинированной ( полихимиолучевой ) терапии (n=69)
|
Показатель |
1-я группа (n=22) |
2-я группа (n=20) |
3-я группа (n=27) |
|
Пол: мужской женский |
13 (59 %)1 9 (41 %) |
3 (15 %)1 17 (85 %) |
10 (37 %) 17 (63 %) |
|
Возраст при установлении диагноза, лет: медиана диапазон |
24 18-50 |
28 16-57 |
22 14-49 |
|
Стадия заболевания: I – II III – IV |
8 (36 %) 14 (64 %)2,3 |
14 (70 %) 6 (30 %)2 |
17 (63 %) 10 (37 %)3 |
|
МТИ: 0,2-0,29 0,3-0,39 ≥ 0,4 нет сведений |
8 (36 %) 10 (46 %) 3 (14 %) 1 (4 %) |
10 (50 %) 9 (45 %) 0 1 (5 %) |
9 (33 %) 9 (33 %) 1 (4 %) 8 (30 %) |
|
Количество курсов ПХТ |
6,7 ± 1,4 |
6,4 ± 1,9 |
5,2 ± 2,3 |
|
Доза доксорубицина, мг/м2: 75-299 ≥ 300 не получали |
16 (72 %)4,5 3 (14 %) 3 (14 %) |
6 (30 %)4 7 (35 %) 7 (35 %) |
6 (22 %)5 5 (19 %) 16 (59 %) |
|
Возраст при проведении ЭхоКГ, годы: медиана диапазон |
30 21-56 |
36 21-66 |
34 26-60 |
|
Время от окончания ЛТ, мес.: 25-59 ≥ 60 |
16 (73 %) 6 (27 %)6 |
14 (70 %) 6 (30 %) |
3 (11 %) 24 (89 %)6 |
Примечание: МТИ – медиастино-торакальный индекс; ПХТ – полихимиотерапия; ЛТ – лучевая терапия. 1 р=0,01; 2 р=0,031; 3 р=0,088; 4 р=0,018; 5 р=0,001; 6 р=0,0001 (уровень достоверности различий между одинаково пронумерованными показателями).
В таблице 2 представлены эхокардиографические показатели больных, включенных в исследование. При сравнении с контролем у больных 1, 2 и 3-й групп наблюдались достоверные различия в, соответственно, 3, 4 и 7 показателях. Во всех анализируемых группах отмечено увеличение частоты сердечных сокращений (ЧСС) в среднем на 20-27 %; этому сопутствовало снижение ФВЛЖ на 4-11 % и фракции укорочения (ФУ) на 6-17 %. Кроме упомянутых девиаций, у больных 3-й группы (СОД 40 Гр) наблюдали достоверное увеличение конечного систолического размера (КСР) в среднем на 10 %, что сопровождалось нарастанием конечного систолического объема (КСО) на 16 % и снижением ударного объема (УО) на 17 %. При меньших дозах облучения (1-я и 2-я группы), достоверных отличий от контроля со стороны показателей КСР и КСО не установлено, однако в группе с традиционным фракционированием заметна тенденция к снижению средней величины УО. Последнее наблюдение подтверждено сравнением медианы УО, которая у больных 2 и 3-й групп составила 49 и 46 мл против 58 и 60 мл у больных 1-й группы и в контроле. Достоверных различий со стороны конечного диастолического размера (КДР) и конечного диастолического объема (КДО) не было найдено, хотя в 3-й группе медиана величины КДО была заметно ниже (83 мл против 88 мл в контроле и у больных 1-2-й групп).
Таблица 2
Показатели эхокардиографии в покое в отдаленные сроки после комбинированной терапии больных лимфомой Ходжкина в зависимости от способа облучения медиастинальных лимфатических узлов ( М ±m)
|
Показатели ЭхоКГ |
Контроль (n=20) |
1-я группа (n=22) |
2-я группа (n=20) |
3-я группа (n=27) |
|
КДР (мм) |
43,1 ± 5,5 |
42,9 ± 5,7 |
42,8 ± 5,7 |
43,6 ± 6,2 |
|
КСР (мм) |
28,0 ± 2,9 |
28,1 ± 4,0 |
28,7 ± 4,8 |
30,7 ± 5,0 *p=0,022 |
|
ЧСС (в мин) |
70,9 ± 8,7 |
90,1 ± 16,3 *p=0,000 |
86,3 ± 16,0 *р=0,000 |
83,7 ± 14,4 *р=0,000 |
|
ФВЛЖ (%) |
66,0 ± 3,7 |
63,2 ± 4,31 *р=0,02 |
62,4 ± 6,0 *р=0,018 |
58,7 ± 5,91 *p=0,000 |
|
ФУ (%) |
36,4 ± 2,8 |
34,1 ± 3,2 *р=0,037 |
33,4 ± 4,5 *р=0,011 |
30,0 ± 4,2 *р=0,000 |
|
КДО (мл) |
89,3 ± 18,7 |
84,4 ± 24,2 |
89,1 ± 23,2 |
86,7 ± 28,6 |
|
КСО (мл) |
30,7 ± 8,0 |
32,3 ± 10,7 |
32,9 ± 12,7 |
35,8 ± 13,5 *р=0,136 |
|
УО (мл) |
59,2 ± 13,0 |
58,2 ± 16,62 |
52,4 ± 14,8 *р=0,123 |
49,0 ± 16,32 *p=0,027 |
|
Vcf с -1 |
0,88 ± 0,14 |
0,92 ± 0,233,4 |
0,75 ± 0,204 *р=0,022 |
0,68 ± 0,093 *р=0,0001 |
Примечание: СОД – суммарная очаговая доза; ТФ – традиционное фракционирование; УГФ – ускоренное гиперфракционирование; КДР – конечный диастолический размер, КСР – конечный систолический размер, ЧСС – частота сердечных сокращений; ФВЛЖ – фракция выброса левого желудочка; ФУ – фракция укорочения; КДО – конечный диастолический объем; КСО – конечный систолический объем; УО – ударный объем; Vcf – скорость циркулярного укорочения волокон миокарда.
Звездочки (*) – различие достоверно в сравнении с контролем; 1 р=0,01; 2 р=0,056; 3 р=0,0001; 4 р=0,015 (достоверность различий между группами для одинаково поименованных показателей).
Оценка систолической функции сердца показала, что у больных 1-й группы, получавших ЛТ в интенсивном режиме фракционирования, средняя величина ФВЛЖ составила 63 %, что не отличалось от аналогичного показателя во 2-й группе (62 %) и достоверно превышало ФВЛЖ в 3-й группе (59 %). Другой показатель сократительной функции ЛЖ – скорость циркулярного укорочения волокон миокарда (Vcf) – у больных 1 группы также был в пределах нормы, тогда как у больных 2-й и 3-й групп он был достоверно снижен (табл. 2). Таким образом, использование интенсивного режима фракционирования не ухудшало систолическую функцию в отдаленные сроки наблюдения, если сравнивать с СОД 20 Гр в режиме ТФ, а с учетом последствий применения СОД 40 Гр ТФ - обеспечивало терапевтический выигрыш. Все вышесказанное можно расценивать как подтверждение сберегающего эффекта режима УГФ для сердечной мышцы.
Анализ распределения величины ФВЛЖ по принятым нами градациям (таблица 3) показал, что в отдаленные сроки после конвенциональной лучевой терапии в дозе 20 и 40 Гр у больных, не предъявлявших жалоб, наблюдалось достоверное снижение сократительной функции сердца как в сравнении с контролем (р=0,025 и р=0,0001, соответственно), так и в сравнении с больными, облученными до 20 Гр в режиме УГФ (р=0,144 и р=0,007, соответственно), по обобщенному критерию х2. Бессимптомное снижение ФВЛЖ <55 %, которое относят к нарушению кардиальной функции I-II степени, было отмечено только у пациентов 2-й и 3-й групп (6,2 % и 29,6 %, соответственно).
Таблица 3
Распределение показателя фракции выброса левого желудочка в отдаленные сроки после химиолучевого лечения в зависимости от способа облучения медиастинальных лимфатических узлов
|
Показатель |
Контроль (n=20) |
1 -я группа (n=22) |
2-я группа (n=20) |
3-я группа (n=27) |
|
ФВЛЖ (%) < 60 |
1 (5,0 %) |
3 (13,6 %)1,2 *р=0,362 |
8 (40,0 %)1 *р=0,025 |
15 (55,6 %)2 *р=0,0001 |
|
60-69 |
16 (80,0 %) |
18 (81,8 %) |
11 (55,0 %) |
12 (44,4 %) |
|
> 70 |
3 (15,0 %) |
1 (4,5 %) |
1 (5 %) |
0 |
|
Медиана |
67 |
62 |
61 |
58 |
|
I-II степень снижения ФВ |
0 |
0 |
1 (6,2 %)3 |
8 (29,6 %)3 |
Примечание: * - достоверность различий в сравнении с контролем; 1 р=0,144;2 р=0,007;3 р=0,059 (различия между одинаково поименованными показателями).
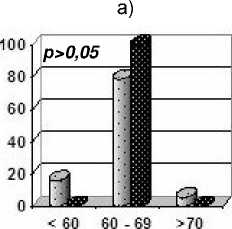
Распределение ФВЛЖ по градациям с учетом возраста на момент обследования представлено на рис. 1. Можно видеть, что при традиционном режиме фракционирования среди лиц в возрасте свыше 40 лет доля больных с ФВЛЖ<60 % была достоверно большей не только после 40 Гр (рис. 1 в), но и после 20 Гр (рис. 1 б), чего не наблюдалось при использовании режима УГФ. Более того, облучение средостения в СОД 40 Гр отрицательно сказывалось на систолической функции сердца не только у лиц старше 40 лет на момент обследования, но и у более молодых пациентов: доля больных с ФВ<60 % в 3 группе составила 41,2 % против 15,8 % и 9,1 % в 1-й и 2-й группах (р=0,067). Бессимптомное снижение ФВЛЖ <55 % среди пациентов 2-й группы наблюдали лишь у лиц старше 40 лет (11,1 %), тогда как в 3-й группе кардиальные нарушения I-II степени присутствовали с одинаковой частотой 30 % в обеих возрастных категориях.
б)
в)
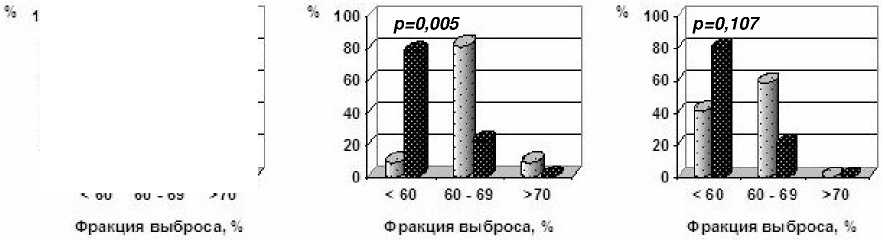
Рис . 1. Распределение показателя фракции выброса левого желудочка в отдаленные сроки после химиолучевого лечения в зависимости от возраста на момент обследования и способа облучения медиастинальных лимфоузлов. Светлым обозначен возраст менее 40 лет, темным – ≥ 40 лет.
а) 1 гр., ускоренное гиперфракционирование 20-22 Гр; б) 2 гр., традиционное фракционирование (20-22 Гр; в) 3 гр., традиционное фракционирование 40 Гр.
Методика эхокардиографического исследования позволяет оценивать состояние сердечной сумки. У обследованных нами пациентов выпота в перикард не наблюдалось, но часто встречалось уплотнение и/или утолщение его листков. Доля подобных случаев после СОД 20-22 Гр была меньшей и составила в 1-2-й группах суммарно 55 % против 74 % в 3-й группе (p=0,173) (рис. 2). Развитие фиброза перикарда, по-видимому, больше определялось разовой дозой облучения, чем суммарной дозой или характером химиотерапии. Среди больных, получавших доксорубицин, частота утолщения перикарда после облучения с дневным дроблением дозы была заметно, хотя и недостоверно меньшей, чем при традиционном фракционировании. Наибольшая частота изменений перикарда – 81 % – была обнаружена у больных 3-й группы, не получавших доксорубицина, но облученных с применением режима ТФ до СОД 40 Гр. У больных с фиброзом перикарда его толщина варьировалась от 3,5 до 7 мм, но медиана была заметно меньшей у больных 1 гр. (3,7 мм против 5 мм во 2-й и 3-й группах), что дополнительно может подтверждать благоприятный эффект снижения разовой дозы облучения при сохранении укрупненной суточной дозы.
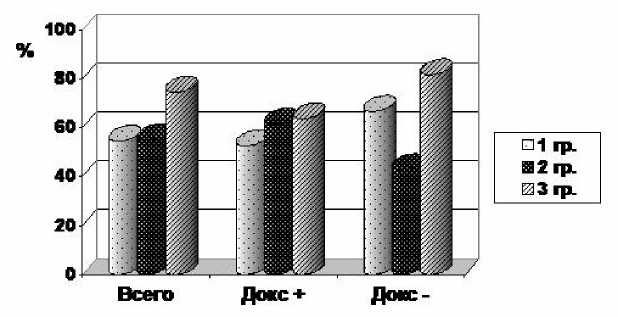
Рис . 2. Частота утолщения листков перикарда в отдаленные сроки после химиолучевого лечения в зависимости от способа облучения средостения и наличия в схеме доксорубицина (докс.+/-). По вертикали – доля больных с утолщением перикарда.
Дозированную физическую нагрузку выполняли 44 больных ЛХ под контролем опросников. В таблице 4 представлены сводные результаты (в баллах), полученные при оценке их качества жизни, из которых следует, что по исходным параметрам группы были сопоставимы. Субъективная оценка больными реакции на физическую нагрузку в сравниваемых группах также существенно не различалась, ухудшение по симптоматической шкале составило в среднем 1,7-1,8 балла для 1-2-й групп и 2,1 балла в 3-й группе.
Таблица 4
Показатели качества жизни больных лимфомой Ходжкина в отдаленные сроки в зависимости от способа облучения медиастинальных лимфатических узлов в баллах (M±m)
|
Показатели качества жизни |
1-я группа (n=14) |
2-я группа (n=13) |
3-я группа (n=17) |
|||
|
До ФН |
После ФН |
До ФН |
После ФН |
До ФН |
После ФН |
|
|
Симптоматические шкалы |
4,6 ± 0,16 |
6,3 ± 0,19 |
5,6 ± 0,28 |
7,4 ± 0,34 |
5,2 ± 0,31 |
7,3 ± 0,36 |
|
Функциональные шкалы разброс медиана |
21,3 ± 0,75 18 – 26 21 |
20,9 ± 1,14 14 – 29 22 |
22,1 ± 1,56 14 – 31 19 |
|||
|
Интегральный показатель |
25,9 ± 0,91 |
26,5 ± 1,43 |
27,3 ± 1,86 |
|||
На рис. 3 представлены изменения ФВЛЖ после дозированной физической нагрузки в зависимости от способа облучения средостения. Нормальная физиологическая реакция, т.е. увеличение ФВЛЖ, несколько чаще наблюдалась у больных 1-2 групп (71-77 % случаев против 59 % в 3-й группе, p>0,05). Отсутствие ответа либо снижение величины ФВ после нагрузки позволяло заподозрить наличие субклинической кардиопатии, соответственно, у 29, 23 и 41 % больных. По результатам однофакторного анализа нами не обнаружено влияния пола, возраста, дозы доксорубицина и градаций исходной величины ФВ (<60 % против 60-69 %) на характер ответной реакции. Однако из 8 пациентов, у которых при проведении ЭхоКГ в покое было обнаружено бессимптомное снижение ФВЛЖ <55 % (2 гр. – 1 чел., 3 гр. – 7 чел.), ответили на нагрузку лишь трое (38 %), причем в одном из трех случаев ФВ достигла лишь 48 %. При этом у них наблюдалось увеличение конечного систолического объема и уменьшение ударного объема, что указывало на ослабление насосной функции левого желудочка.
Представляется важным тот факт, что субклиническая кардиопатия, к проявлениям которой относят отсутствие прироста ФВЛЖ в ответ на физическую нагрузку, была обнаружена не только у больных с невысокими исходными показателями ФВЛЖ, но и в 17-27 % случаев, когда ФВЛЖ в покое составляла 60-69 % (рис. 4).
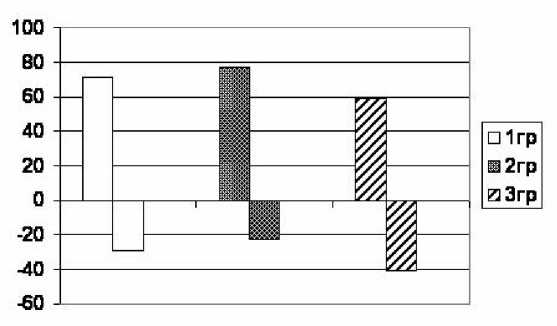
Рис . 3. Изменение величины ФВЛЖ после дозированной физической нагрузки в зависимости от способа облучения медиастинальных лимфатических узлов. По оси ординат - доля обследованных больных (%).
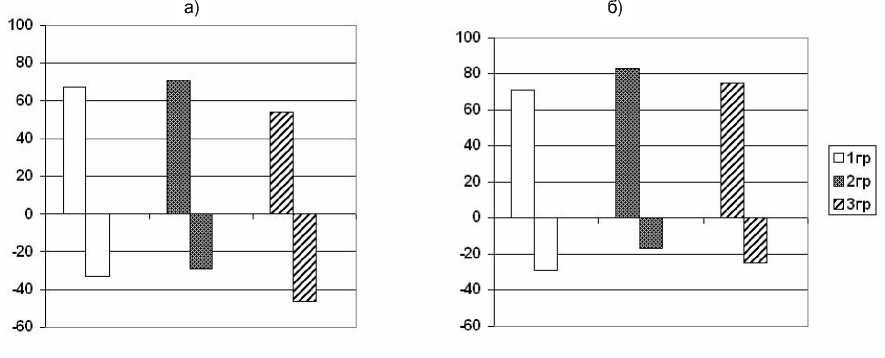
Рис . 4. Ответ на дозированную физическую нагрузку в зависимости от величины ФВЛЖ в покое: а) ФВ в покое <60 %; б) ФВ в покое 60-69 %. По оси ординат - доля обследованных больных (%).
Таким образом, проведение функционального исследования с физической нагрузкой способно на раннем этапе выделить пациентов, имеющих бессимптомную сердечную дисфункцию и нуждающихся в кардиальной терапии.
Обсуждение
Наше исследование позволило установить, что у больных лимфомой Ходжкина, получавших доксорубицин-содержащую полихимиотерапию, закрепление ремиссии путем облучения средостения до СОД 20-22 Гр в интенсивном режиме фракционирования (две фракции по 1,35-1,5 Гр с интервалом 4,5-5 часа) успешно реализует сберегающий потенциал дневного дробления дозы для здоровых тканей в проекции поля облучения и, в частности, для сердечной мышцы и перикарда. Ранее это положение, имеющее радиобиологические обоснования, было клинически нами подтверждено для легочной ткани в аналогичных группах больных [3]. Необ- ходимость клинической верификации диктуется тем, что существующие радиобиологические модели (ВДФ, линейно-квадратичная), будучи приемлемыми для соединительной ткани, не позволяют адекватно оценить биологическую эффективность режима УГФ для таких критических органов, как сердце и легкие. При проведении химиолучевого лечения дополнительной проблемой становится учет вклада лекарственной токсичности.
Нами были обследованы больные, в лечении которых использовались приемы, направленные на максимально возможное убавление кумулятивной кардиальной токсичности лекарственной и лучевой терапии: назначение доксорубицин-содержащих схем только в начале курса индукционной химиотерапии, облучение средостения сниженной дозой 20-22 Гр (при полной регрессии опухоли – в традиционном режиме фракционирования, при неполной регрессии – в режиме дневного дробления укрупненной суточной дозы). Условием включения в настоящее исследование было отсутствие осложнений со стороны сердечно-легочной системы на фоне лечения, а при обследовании в отдаленные сроки – отсутствие активных кардиальных жалоб. Сопоставимость групп контролировалась путем заполнения опросников. Таким образом создавались предпосылки для объективного сравнения сердечной функции после использования интенсивного и традиционного фракционирования дозы облучения по критерию наличия субклинической кардиотоксичности, поскольку по критерию ВДФ способы облучения больных 1-й и 2-й групп до СОД 20-22 Гр не отличались и в обоих случаях соответствовали 38-40 ед. ВДФ.
Наличие субклинической кардиотоксичности принято выявлять путем использования ЭхоКГ в покое по таким критериям, как снижение показателей фракции укорочения, фракции выброса и скорости циркулярного укорочения волокон миокарда Vcf [15, 16]. К ее проявлениям относят также снижение ФВ после физической нагрузки [14]. Известно, что объективность эхокардиографических измерений зависит от их воспроизводимости, которая существенно возрастает, если их производит один исследователь. К преимуществам нашей работы следует отнести то обстоятельство, что всех пациентов направляли на обследование к одному и тому же специалисту без предоставления ему информации относительно возможных факторов риска (характер химиотерапии, дозы облучения и т.п.).
Согласно данным литературы, пик поздней кардиотоксичности антрациклиновых антибиотиков приходится на 7-10 лет после окончания лечения, а клинические последствия облучения сердца проявляются спустя 15-20 лет [12]. Частота нарушений сократимости сердца варьирует от 4 % после кумулятивной дозы 500-550 мг/м2 до 36 % и более после 600 мг/м2 [7]. Большая часть наших наблюдений относится к несколько более раннему периоду, причем в используемых программах лечения общая кумулятивная доза антрациклинов не достигает кардиоток-сичной величины 550 мг/м2 площади поверхности тела. Тем не менее, при сравнении с контролем у больных 1, 2 и 3-й групп были выявлены нарушения, соответственно, 3, 4 и 7 эхокардиографических показателей, свидетельствующие в пользу кардиальной дисфункции.
Наиболее часто по данным эхокардиографии выявляли: увеличение ЧСС, а также уменьшение ФВ и ФУ. Эти изменения присутствовали во всех трех группах обследованных. Помимо перечисленного, у больных 2-й и 3-й групп наблюдали снижение ударного объема и ско- рости циркулярного укорочения волокон миокарда (Vcf) и только в 3-й группе – увеличение КСР и КСО. Таким образом, благодаря режиму УГФ, неблагоприятное влияние лучевой терапии на кардиальную функцию было менее выраженным в сравнении с подведением той же (20-22 Гр) или большей (40 Гр) суммарной дозы в классическом режиме фракционирования. Все сказанное можно расценивать как свидетельство сберегающего эффекта уменьшения разовых доз облучения, что находит подтверждение в материалах других авторов, использовавших мультифракционирование [5].
Величина ФВЛЖ признана интегральным показателем сократительной функции миокарда согласно рекомендациям RTOG/EORTC [17]. Относительно чувствительности различных методов ее оценки единого мнения нет, по мнению одних авторов, ЭхоКГ более чувствительна в определении ФВ, чем радиовентрикулография [8], другие высказывают противоположное мнение [9]. По нашим данным, суммарная доля пациентов с ФВЛЖ <60 % в 1-й группе составила 13,6 % против 40 % и 55,6 % у больных 2 и 3-й групп (р<0,05). Необходимо отметить, что режим УГФ, в отличие от традиционного фракционирования, применялся в группе больных с большим числом факторов риска: 85 % из них получали доксорубицин, у 60 % опухоль исходно занимала более трети поперечного размера грудной клетки на рентгенограммах и у всех пациентов имелись остаточные опухолевые образования, что увеличивало размеры поля облучения. Тем не менее, в этой группе проявлений субклинической кардиотоксичности (ФВЛЖ <55 %) не обнаружено, в отличие от больных 2-й и 3-й групп, у которых кардиотоксичность I-II степени зарегистрирована, соответственно, в 6,2 % и 29,6 % случаев, что подтверждало преимущества использования данного способа лучевой консолидации как эффективной альтернативы СОД 40 Гр.
Действительно, средняя величина ФВЛЖ в отдаленные сроки после радикальной дозы облучения 40 Гр, даже при минимальном использовании доксорубицина, достоверно снижена и составляет, по данным различных авторов, 55-57 % [8, 9], а доля случаев, соответствующих кардиотоксичности I-II степени – достигает 36 % [8]. Неблагоприятным последствием радикальных доз облучения является формирование лучевого фиброза в прикорневых и парамедиасти-нальных отделах легких, который способен повышать сопротивление сосудистого русла легких и дополнительно ухудшать условия сердечной деятельности [11]. Как нами было ранее показано, при облучении средостения дозой 20-24 Гр в режиме УГФ подобной степени фиброза легких не развивается [3] и, следовательно, не создается дополнительных препятствий к нормальному функционированию сердца. Отсюда понятно, почему одним из результатов новой программы стало достоверное уменьшение доли больных с ФВЛЖ <60 % в 1-й группе, особенно среди лиц старше 40 лет.
Сравнение полученных нами данных с работами других исследовательских групп затрудняется тем, что в доступной литературе нам не встретились публикации, в которых терапевтический потенциал режима УГФ был бы использован для уменьшения суммарной дозы облучения, как это делается в МРНЦ РАМН. Определенный интерес представляют исследования, посвященные оценке последствий комбинированной терапии ЛХ у детей и подростков, поскольку в подобных случаях обычно используют половинные дозы облучения, хотя фракционирование остается традиционным. Из обзора литературы по отдаленным последствиям лечения детей [16] видно, что сообщаемая частота субклинической кардиотоксичности широко варьируется – от 0 до 57 %, во многом ввиду различий методологических подходов. Возможный вклад в разбросы вносит использование различных типов антрациклинов, недоучет кумулятивной дозы и интенсивности дозы при проведении химиотерапии, различия в длительности наблюдения.
Тем не менее, исследование Pihkala et al. [18] позволило продемонстрировать аддитивность эффекта при использовании антрациклинов и облучения средостения сниженной дозой. Сравнивали результаты обследования трех групп пациентов в отдаленные сроки после лечения: первая группа получала антрациклин в средней кумулятивной дозе 410 мг/м2, вторая – ан-трациклин в дозе 360 мг/м2 и облучение средостения, а третья только облучение; систолическую дисфункцию наблюдали, соответственно, у 32 %, 50 % и 8 % пациентов.
Заключение
Благодаря высокой эффективности, сохранению фертильности и меньшему риску развития вторых опухолей антрациклины заняли важные позиции в лечении лимфомы Ходжкина. По данным литературы частота нарушений сократимости сердца существенно варьирует: от 4 % после кумулятивной дозы 500-550 мг/м2 до 36 % и более после 600 мг/м2. Анализ частоты кардиальной дисфункции в зависимости от кумулятивной дозы антрациклина свидетельствует о наличии нелинейной корреляции. Существует значительная индивидуальная вариабельность и резкий прирост с возрастом. Использование доксорубицина в комбинации с другими эффективными препаратами позволяет при ЛХ ограничиваться кумулятивными дозами менее 500-550 мг/м2, когда риск повреждения сердечной мышцы считается небольшим. Тем не менее, несмотря на большой интерес к проблеме субклинической кардиотоксичности, до сих пор нет ясности относительно ее связи с сердечной недостаточностью, которую обычно регистрируют в более поздние сроки наблюдения. Очевидно лишь то, что подобные пациенты должны в первую очередь подлежать длительному наблюдению, раннему выявлению и коррекции проявлений кардиотоксичности на доклиническом этапе.
Проведенное нами исследование показывает, что ЭхоКГ является чувствительным, неинвазивным (в сравнении с биопсией миокарда) и экономичным инструментальным методом, позволяющим эффективно мониторировать последствия химиолучевого (с облучением средостения) лечения ЛХ в отдаленные (2-15 лет) сроки наблюдения и выявлять нарушения сократительной функции сердца на доклиническом этапе.
Список литературы Кардиальная функция больных лимфомой Ходжкина в отдаленные сроки после химиолучевого лечения с различным фракционированием дозы при облучении средостения
- Бова А.А. Функциональная диагностика в практике врача-терапевта. МИА, 2007. 240 с.
- Богатырева Т.И. Комбинированное и лучевое лечение первичной и рецидивной лимфомы Ходжкина на основе интенсивных режимов фракционирования дозы: Автореф. дис.... докт. мед. наук. Обнинск, 2006. 40 с.
- Богатырева Т.И., Кравченко Т.В., Афанасова Н.В. и др. Снижение суммарной дозы при облучении химиорезистентных очагов лимфомы Ходжкина в режиме ускоренного гиперфракционирования (проспективное рандомизированное исследование)//Вопросы онкологии. 2006. Т. 52, № 5. С. 544-549.
- Дарьялова С.Л., Бойко А.В., Черниченко А.В. Современные возможности лучевой терапии злокачественных опухолей//Российский онкологический журнал. 2000. № 1. С. 48-55.
- Ильин Н.В., Виноградова Ю.Н., Николаева Е.Н. и др. Значение мультифракционирования дозы радиации при первичном лучевом лечении больных лимфомой Ходжкина//Онкогематология. 2007. № 4. С. 47-52.
- Лосева М.П., Пуртова Л.А., Гавалова Р.Ф. и др. Морфофункциональное состояние сердца при лимфогранулематозе в отдаленные сроки после химиолучевой терапии//Тер. архив. 2000. № 10. С. 64-67.
- Матяш М.Г., Кравчук Т.Л., Высоцкая В.В. и др. Индуцированная антрациклинами кардиотоксичность: механизмы развития и клинические проявления//Сибирский онкологический журнал. 2008. № 6 (30). С. 66-75.
- Минько Б.А., Ванжула О.Р., Симонова О.Н. и др. Кардиоваскулярные нарушения у больных злокачественными лимфомами в различные сроки после специфического лечения//Вопросы онкологии. 2006. Т. 52, № 3. С. 357-360.
- Насибов О.М., Пивник А.В., Паша С.П. и др. Состояние сердечно-сосудистой системы у больных лимфогранулематозом в стадии длительной ремиссии//Тер. архив. 2002. № 12. С. 68-71.
- Шиллер Н., Осипов М.А. Клиническая эхокардиография. М., 1993.
- Шишкин И.П., Барабанова А.В., Метлеева Н.А. Состояние сердечно-сосудистой системы в отдаленные сроки после лучевой терапии//Мед. радиология. 1984. № 9. С. 46-50.
- Adams M.J., Lipsitz S.R., Colan S.D. et al. Cardiovascular status in long-term survivors of Hodgkin's disease treated with chest radiotherapy//J. Clin. Oncol. 2004. V. 22. P. 3139-3148.
- Elbl l., Vasova I., Tomaskova I. et al. Cardiopulmonary exercise testing in the evaluation of functional capacity after treatment of lymphomas in adults//Leuk. Lymphoma. 2006. V. 47, N 5. P. 843-851.
- Glanzmann C., Kaufmann P., Jenni R. et al. Cardiac risk after mediastinal irradiation for Hodgkin´s disease//Radiother. and Oncol. 1998. V. 46. P. 51-62.
- Hequet O., Le Q.H., Moullet I. et al. Subclinical late cardiomyopathy after doxorubicin therapy for lymphoma in adults//J. Clin. Oncol. 2004. V. 22. P. 1864-1871.
- Kremer L.C.M., van der Pal H.J.H., Offringa M. et al. Frequency and risk factors of subclinical cardiotoxicity after anthracycline therapy in children: a systematic review//Ann. Oncol. 2002. V. 13. P. 819-829.
- LENT SOMA Tables//Radiother. Oncol. 1995. V. 35. P. 17-60.
- Pihkala J., Saarinen U.M., Lundstrom U. et al. Myocardial function in children and adolescent after therapy with antracyclines and chest irradiation//Eur. J. Cancer. 1996. V. 32. P. 97-103.
- Tsyb A.F., Korobchenko Z.A., Sobol Yu.S. et al. Impairment of left ventricular kinetics in lymphogranulomatosis with involvement of lymphatic mediastinal nodes//Cor et Vasa. 1986. V. 28, N 5. Р. 369-372.
- Withers H.R. Biological basis for altered fractionation schemes//Cancer. 1985. V. 55. P. 2086-2095.


