Кардио- и нейропротекция ингаляционными анестетиками в кардиохирургии
Автор: Борисов Кирилл Юрьевич, Шайбакова Вероника Леонидовна, Черпаков Ростислав Александрович, Левиков Дмитрий Ильич, Гребенчиков Олег Александрович, Лихванцев Валерий Владимирович
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Органопротекция
Статья в выпуске: 3 т.18, 2014 года.
Бесплатный доступ
Мнения исследователей относительно эффективности анестетического прекондиционирования миокарда и головного мозга до сих пор противоречивы. Последний феномен к тому же остается малоизученным. В настоящем исследовании предпринята попытка оценки эффективности модифицированной методики ингаляционной индукции и поддержания анестезии (ИИПА) на основе «импульсного» дозирования севофлурана и исключающей использование пропофола для защиты миокарда и центральной нервной системы (ЦНС) в процессе выполнения аортокоронарного шунтирования (АКШ) в условиях искусственного кровообращения (ИК) у 90 больных в возрасте от 45 до 75 лет. В группе исследования (ИИПА) осуществляли индукцию севофлураном и моделировали прекондиционирование за 10 мин до пережатия аорты (2 МАК анестетика). На этапе ИК применяли атаралгезию. В группе сравнения (тотальная внутривенная анестезия, ТВА) индукцию и поддержание анестезии осуществляли пропофолом и фентанилом, ингаляционные анестетики не применяли. Результаты обработаны методами вариационной статистики и представлены как M±σ. Межгрупповое сравнение производили с помощью t-критерия Стьюдента или U-критерия Манна - Уитни. Статистически значимыми считали различия при p
Кардиопротекция, нейропротекция, анестетическое прекондиционирование, севофлуран, искусственное кровообращение
Короткий адрес: https://sciup.org/142140622
IDR: 142140622 | УДК: 616
Текст научной статьи Кардио- и нейропротекция ингаляционными анестетиками в кардиохирургии
Многочисленные экспериментальные [1, 2] и клинические [3, 4] данные свидетельствуют в пользу эффективности анестетического пре- и посткондиционирования миокарда. Менее исследован нейропротек-торный эффект ингаляционных анестетиков [5, 6]. Однако и в первом и особенно во втором случаях велика доля скептиков, считающих недоказанным клиническую эффективность обсуждаемого феномена (органопротекции) [7].
Литературные данные [8, 9] и проведенные нами экспериментальные исследования [10, 11] показали, что выраженность эффекта пре- и посткондиционирования во многом зависит от состава адъювантных препаратов и дозы ингаляционного анестетика, в нашем случае севофлурана. Так, в эксперименте получены убедительные доказательства того, что пропофол блокирует эффект анестетического прекондиционирования, по крайней мере, в течение 30–40 мин после введения [10]. Ранее в работах коллектива под руководством Ю.И. Гороховатского [8] был предложен «импульсный» режим дозирования севофлурана, позже показавший свою эффективность для прекондиционирования миокарда и в некардиальной хирургии [12].
В ходе выполнения настоящего исследования предполагалось проверить эффективность модифицированной методики ингаляционной индукции и поддержания анестезии на основе «импульсного» дозирования сево-флурана и исключающей использование пропофола для защиты миокарда и ЦНС в процессе выполнения аортокоронарного шунтирования в условиях искусственного кровообращения.
Материал и методы
Эффекты анестетического прекондиционирования миокарда и головного мозга севофлураном были изучены у 90 больных в возрасте 63,5±8,5 года в период с 2011 по 2012 г. Критерии включения в исследование: 1. Информированное согласие на участие в исследовании; 2. Возраст от 45 до 75 лет; 3. Фракция изгнания левого желудочка более 40%; 4. Плановый характер вмешательства; 5. Необходимость реваскуляризации миокарда в условиях искусственного кровообращения; 6. Изолированное аортокоронарное шунтирование; 7. Количество шунтов не менее 2; 8. Суммарный клинический балл по шкале MMSE 26 и более.
В исследование не вошли больные: 1. Перенесшие острый инфаркт миокарда или инсульт за 6 и менее месяцев до операции; 2. С психиатрическими заболеваниями; 3. Со стенозами брахиоцефальных артерий (БЦА) более 70%; 4. С исходно низкими абсолютными значениями церебральной оксигенации (40% и ниже).
Критерии исключения: 1. Деменция и наличие других психических заболеваний в анамнезе; 2. Превышение продолжительности искусственного кровообращения свыше 120 мин; 3. Хирургические осложнения .
Всем больным в непрерывном и/или постоянном режиме осуществляли мониторинг следующих параметров: 1) ЭКГ в 5 отведениях с подсчетом частоты сердечных сокращений (ЧСС), анализом характера ритма, аритмий и девиаций сегмента ST; 2) Артериальное давление неинвазивным и инвазивным методом через катетер, установленный в лучевой артерии; 3) Плетизмография с пульсок-симетрией; 4) Показатели внешнего дыхания и легочной механики; 5) Состав газонаркотической смеси; 6) Биспект-ральный индекс; 7) Активированное время свертывания на этапе искусственного кровообращения каждые 30 минут; 8) Общий анализ крови и газовый состав артериальной и венозной крови каждые 30 минут.
В зависимости от методики анестезиологического обеспечения все больные (табл. 1) были разделены на две группы:
Исследуемая группа (ИИПА) – анестезия на основе севофлурана с прекондиционированием в предперфузи-онном периоде и атаралгезией на этапе искусственного кровообращения. Ингаляционная индукция применялась с использованием максимальной концентрации анестетика с первым вдохом без предварительного заполнения дыхательного контура [13]. После интубации трахеи и замыкания дыхательного контура поток газовой смеси снижали до
0,5 л/мин, FiO2 устанавливали равным 60%, а дозу севофлу-рана поддерживали не менее 1 МАК. С целью адекватного обезболивания дополнительно вводили фентанил по 0,1– 0,2 мг каждые 60 минут или при необходимости. На протяжении всего оперативного вмешательства BIS удерживали в пределах 40–55. За 10 мин до наложения зажима на аорту дозу севофлурана увеличивали до 2 МАК на потоке свежих газов 2 л/мин – моделирование АПК. На этом этапе старались удерживать среднее АД выше 70 мм рт. ст. посредством увеличения темпа инфузии кристаллоидных растворов или степени кардиотонической и/или вазопрессорной поддержки, снижение BIS ниже 20 было принято допустимым. Перед началом искусственного кровообращения вводили фентанил 0,003 мг/кг, пипекурония бромид 0,01 мг/кг, мидазолам 0,1 мг/кг. После пережатия аорты ИВЛ прекращали. На этапе ИК при повышении BIS более 55 анестезию поддерживали введением фентанила 0,1 мг и мидазолама 0,1 мг/кг. После снятия зажима с аорты возобновляли ингаляцию севофлурана на потоке свежих газов 0,5 л/мин и FiO2 60%, дозу анестетика регулировали в зависимости от показателей гемодинамики, в целом стараясь поддерживать концентрацию на выдохе не менее 1 МАК.
Группа сравнения (ТВА) – анестезия на основе пропофола и фентанила без использования ингаляционных анестетиков. В группе сравнения после замыкания дыхательного контура устанавливали поток газовой смеси 2 л/мин и FiO2 50%, начинали постоянную инфузию пропофола в дозе 50–80 мкг/(кг/мин). Ингаляционные анестетики не применяли, инфузия пропофола продолжалась на протяжении всего оперативного вмешательства, а дозу корригировали в соответствии с показателями BIS, стараясь удерживать этот параметр в пределах 40–55. Для поддержания адекватной анальгезии каждые 30–40 минут вводили фентанил 0,1 мг. Перед началом ИК вводили фентанил 0,003 мг/кг и пипекурония бромид 0,01 мг/кг.
В каждой группе до индукции анестезии из центрального венозного катетера забирали 8,0 мл цельной крови, центрифугировали со скоростью 3 000 об./мин в течение 3 мин, после чего по 1,0 мл надосадочной плазмы переливали в чистые пробирки и замораживали при температуре –18 °С для последующей оценки исходных уровней NTpro-BNP и белка S100В – маркера повреждения нервной ткани – иммуноферментным методом. Для определения концентрации S100В пробы подобным образом забирали на этапах: после интубации трахеи, после сведения грудины, в конце операции, через 24 и 48 ч после оперативного вмешательства. Концентрацию NTpro-BNP определяли в динамике через 24 и 48 ч после окончания операции. Перед операцией и через 24 после ее окончания забирали кровь на анализ уровня тропонина T иммунохи-мическим методом.
Мониторинг церебральной оксигенации (rSO2) осуществляли монитором Invos Oximeter 5100B (Somanetics, США), датчики наклеивали на кожу правой и левой половины лба после обработки ее спиртом. После стабилизации показателей фиксировался базовый уровень. Мониторинг проводился интраоперационно непрерывно. В случае
|
Таблица 1 Общая характеристика |
Параметр |
ТВА, n = 45 |
ИИПА, n = 45 |
р |
|
Пол, n |
||||
|
пациентов в группах |
мужской |
41 |
40 |
>0,05 |
|
женский |
4 |
5 |
>0,05 |
|
|
Возраст, лет |
62,42±8,02 |
63,46±7,68 |
>0,05 |
|
|
Вес, кг |
77,5±7,67 |
77,8±9,61 |
>0,05 |
|
|
Функциональный класс стенокардии, n |
||||
|
II |
15 |
17 |
>0,05 |
|
|
III |
24 |
20 |
>0,05 |
|
|
IV |
6 |
8 |
>0,05 |
|
|
Постинфарктный кардиосклероз, n |
18 |
17 |
>0,05 |
|
|
Фракция выброса, %, n |
||||
|
40–45 |
10 |
12 |
>0,05 |
|
|
>45 |
35 |
33 |
>0,05 |
|
|
Артериальная гипертензия, n |
26 |
24 |
>0,05 |
|
|
Стеноз брахицефальных артерий, %, n |
||||
|
30–40 |
5 |
9 |
>0,05 |
|
|
40–50 |
3 |
5 |
>0,05 |
|
|
50–70 |
2 |
1 |
>0,05 |
|
|
Сахарный диабет, n |
3 |
5 |
>0,05 |
|
|
Аритмия, n |
2 |
5 |
>0,05 |
|
|
Аутоиммунный тиреоидит, n |
1 |
0 |
>0,05 |
|
|
Заболевание легких, n |
2 |
6 |
>0,05 |
|
|
Заболевание почек, n |
3 |
3 |
>0,05 |
|
|
EuroScore II, % |
1,75±0,79 |
1,79±0,73 |
>0,05 |
|
|
Суммарный клинический балл по шкале MMSE |
28,28±1,06 |
28,04±1,36 |
>0,05 |
снижения показателей rSO2 ниже 25% от исходного значения проверяли положение головы, увеличивали объемную скорость перфузии, при снижении среднего артериального давления ниже 60 мм рт. ст. начинали инфузию норэпинефрина, регулировали поток свежих газов, при необходимости добавляли в оксигенатор эритроцитарную массу, углубляли анестезию.
В обеих группах пациенты со снижением rSO2 были выделены в отдельную подгруппу «десатурированных» пациентов. Церебральная десатурация была определена как снижение уровня насыщения кислородом ткани мозга ниже 25% от исходного уровня в течение 1 мин и более.
О межгрупповых различиях по частоте развития сердечной недостаточности судили по количеству больных, требовавших инфузии дофамина в раннем послеоперационном периоде.
Оценку когнитивного статуса проводили у пациентов за 3-4 дня до операции и на 2-е сутки после нее. Данные, предоставленные нам, – часть исследования, проводимого аспирантом-неврологом Н.И. Шрадер на кафедре неврологии ГОУ ДПО «РМА ПДО» Минздрава России. Комплексное обследование включало нейропсихологическое тестирование. Применяли краткую шкалу исследования психического статуса – Mini-Mental State Examination (MMSE) [14].
В соответствии с критериями National Clinic Guideline Centre (NCGC) диагноз послеоперационный делирий выставлялся в результате комплексного исследования (осмотр + оценка по шкале MMSE) при балльной оценке по шкале MMSE менее 20% от исхода.
Результаты исследования проанализированы и обработаны методами вариационной статистики с помощью программы Statistica 6.0. Результаты представлены как среднее и стандартное отклонение (M±σ). Для оценки характера распределения в совокупности использовали тест Колмогорова – Смирнова. Межгрупповое сравнение признаков с симметричным распределением проводили с помощью t-критерия Стьюдента, при несимметричном распределении использовали U-критерий Манна – Уитни. Для определения значимости межгрупповых различий по частоте встречаемости признака использовали точный критерий Фишера. Статистически значимыми считали различия при p <0,05.
Результаты и обсуждение
В обеих исследуемых группах (табл. 2) использовали одинаковую тактику проведения анестезии, перфузии и инфузионной терапии. Также не отличалась и тактика ведения больных в отделении реанимации.
|
Таблица 2 |
Параметр |
ТВА, n = 45 |
ИИПА, n = 45 |
р |
|
Характеристика групп |
Кол-во шунтов |
2,71±0,56 |
2,74±0,63 |
>0,05 |
|
по интра- и послеопера- |
Длительность ИК, мин |
69,71±17,86 |
70,53±15,66 |
>0,05 |
|
ционным показателям |
Длительность пережатия аорты, мин |
42,97±11,12 |
43,38±11,47 |
>0,05 |
|
Характер восстановления сердечного ритма (кол-во больных – кол-во дефибрилляций) |
||||
|
фибрилляция желудочков |
2 – 1 |
1 – 1 |
>0,05 |
|
|
спонтанно, синусовый |
43 – 0 |
44 – 0 |
>0,05 |
|
|
Объем кровопотери, мл |
520±75 |
490±50 |
>0,05 |
|
|
Кол-во больных, нуждавшихся в инфузии дофамина в первые 24 часа после операции, n (%) |
23 (57,5) |
13 (32,5) |
<0,05 |
|
|
Длительность ИВЛ, мин |
685±112 |
671±134 |
>0,05 |
|
|
Креатинин после операции через |
||||
|
24 ч |
115,34±42,00 |
126,44±51,28 |
>0,05 |
|
|
48 ч |
121,89±48,98 |
135,06±74,52 |
>0,05 |
|
|
Длительность пребывания в ОРИТ, ч |
20±2 |
19±3 |
>0,05 |
В настоящее время существует обоснованное мнение, что повышенный уровень натрийуретического пептида В-типа (BNP) и концевого фрагмента его предшественника (NTpro-BNP) в послеоперационном периоде является предиктором развития сердечной недостаточности, повышенной потребности в использовании кардиотонических препаратов, а также коррелирует с частотой развития инфарктов миокарда и «сердечной» смерти в течение нескольких лет после кардиохирургических вмешательств и некардиальных операций [15–20].
Больные обеих групп были сопоставимы по предоперационным концентрациям NTpro-BNP, которые, однако, оказались несколько выше так называемой точки ветвления [15] (353,11±335,93 пг/мл в группе ИИПА и 287,27±222,12 пг/мл в группе ТВА, р >0,05).
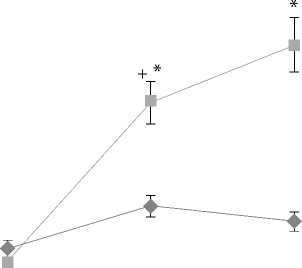
На всех этапах исследования в группе ИИПА не отмечено значимых колебаний концентрации NTpro-BNP (рис. 1). И, хотя его уровень в этой группе несколько возрос к исходу первых суток после операции (567,11±500,97 пг/мл, р >0,05), через 48 ч после вмешательства он приблизился к дооперационным значениям (484,61±391,45 пг/мл; р >0,05). Напротив, в группе ТВА прогрессивно нарастала концентрация NTpro-BNP на всех этапах исследования. Так, через 24 ч его уровень повысился до 1 105,45±661,42 пг/мл (р <0,05), а через 48 ч составлял уже 1 402,91±1 139,71 пг/мл (р <0,05). Как видно, уровень NTpro-BNP в группе ТВА превосходил таковой в группе ИИПА в 2 раза к исходу первых (р <0,05) и в 2,9 раза к исходу вторых суток (р <0,05) после операции. Описанное можно объяснить предотвращением нарушений сократимости миокарда после искусственного кровообращения вследствие АПК севофлураном и отсутствием такого эффекта при ТВА на основе пропофола и фентанила.
Сходные данные представлены коллективом во главе с К. Julier [21], которые инсуффлировали севофлуран в дозе 4 об.% в оксигенатор аппарата искусственного кровообра- щения за 10 мин до пережатия аорты. Даже несмотря на то что в этой работе в группе исследования индукцию и поддержание анестезии осуществляли пропофолом, авторы продемонстрировали значительно меньшую, по сравнению с контрольной группой, концентрацию NTpro-BNP через 24 и 48 ч после операции.
Подтвердить эту мысль можно на основании сравнения групп по количеству больных, которым в послеоперационном периоде потребовалось введение кардиотонических препаратов. Несмотря на то что потребность в кардиотонической поддержке в первые сутки после операции отмечалась у больных обеих групп, таковых было почти в 2 раза больше в группе ТВА (р <0,05) (табл. 2). Таким образом, ИИПА на основе севофлурана, вероятно вследствие феномена АПК, сохраняет функциональные резервы миокарда после искусственного кровообращения в значительно большей степени, чем ТВА на основе пропофола и фентанила. Аналогичные данные приводят S.G. De’Hert и коллеги [3]. В отличие от нашей работы, авторы этого исследования поддерживали одинаковую концентрацию севофлурана на протяжении всей операции, даже на этапе перфузии. Несмотря на то что в обеих группах индукцию анестезии осуществляли пропофолом, такая методика анестезии привела к снижению в 3 раза числа больных, требовавших инотропной поддержки в послеоперационном периоде, по сравнению с контрольной группой. Вполне вероятно, что, если бы в нашей работе помимо моделирования АПК перед наложением зажима на аорту севоф-луран в составе газовой смеси подавался в оксигенатор АИК на этапе перфузии, результаты были бы еще более впечатляющими.
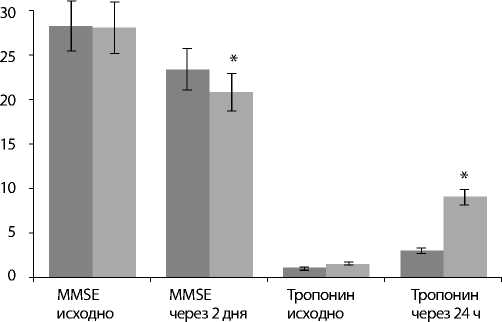
У всех больных в нашем исследовании предоперационная концентрация тропонина Т находилась в пределах нормы (<0,1 нг/мл). Через сутки после операции уровень этого белка значимо повысился в обеих группах (рис. 2), причем его уровень в группе ТВА в 2 раза превосходил
Рис. 1.
Динамика концентрации NTpro-BNP в группах больных в послеоперационном периоде. р <0,05 значимые различия в сравнении с: * группой ИИПА; + предыдущим этапом в той же группе.

ИИПА
ТВА
Рис. 2.
Mежгрупповые различия по суммарному клиническому баллу по шкале MMSE и концентрации тропонина Т до и после операции. * р <0,01 значимые различия в сравнении с группой ИИПА.
Интубация 24 ч 48 ч
■ ИИПА
■ ТВА
таковой в группе ИИПА (0,61 и 0,29 нг/мл, р <0,05). Таким образом, АПК севофлураном обеспечивает более выраженную защиту миокарда от ишемического и реперфузионного повреждения, чем ТВА на основе пропофола и фентанила. Сходные данные представлены в уже упомянутом исследовании S.G. De’Hert и коллег [3]. Авторы определяли концентрацию тропонина I через 36 ч после операции и обнаружили, что его уровень был значительно больше в группе, где севофлуран не применялся.
Согласно литературным данным, глиальный белок S100B является маркером повреждения нервной ткани и на основании динамики его концентрации можно оценить эффективность анестетической защиты центральной нервной системы, а также прогнозировать риск развития послеоперационного делирия [22].
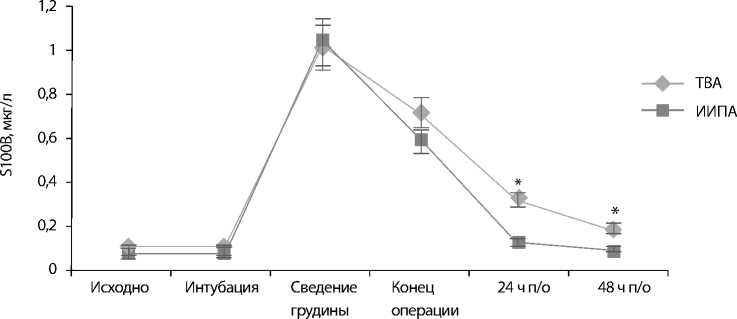
Значимых различий между группами по концентрациям белка S100В до операции в нашем исследовании не было (рис. 3). Отмечено значительное повышение концентрации белка к моменту сведения грудины, также сопоставимое между группами (1,03±0,72 мкг/л в группе ИИПА и 1,01±0,42 мкг/л в группе ТВА, р >0,05). В дальнейшем на всех этапах исследования уровень белка в обеих группах прогрессивно снижался, но достоверные различия обнару- жены лишь в послеоперационном периоде. Так, через 24 ч после вмешательства концентрация S100В в группе ТВА была 2,5 раза больше, чем в группе ИИПА (р <0,05), а через 48 ч – в 2 раза (р <0,05).
Высокая плазменная концентрация белка S100B на этапе сведения грудины не отражает поражение только нейронов и астроглии. По данным H. Jonsson и коллег [23], а также коллектива во главе с R. Anderson [24], очень высокая концентрация этого белка определяется в крови, взятой из операционной раны, а его источниками, вероятнее всего, служат жир, кожа и костный мозг. В то же время повышенная концентрация S100В в плазме крови через 24 и 48 ч после операции является, по-видимому, следствием повреждения нейронов ЦНС [25].
Быстрое снижение плазменной концентрации белка S100B в обеих группах нашего исследования к концу операции и через 24 ч после нее вызвано, вероятно, коротким периодом его полураспада – всего 25 мин. В свою очередь, описанные межгрупповые различия по концентрации белка в первые и вторые послеоперационные сутки, вполне возможно, отражают именно нейропротекторные эффекты анестезии и АПК севофлураном.
Таблица 3
Концентрация белка S100B и показатели церебральной оксигенации в группах
Рис. 3.
Динамика концентрации белка S100B в группах.
* р <0,05 значимые различия в сравнении с группой ИИПА.
|
Концентрация белка S100В, мкг/л |
ИИПА |
ТВА |
||
|
без снижения церебральной оксигенации (n = 33) |
«десатурированные» (n = 12) |
без снижения церебральной оксигенации (n = 34) |
«десатурированные» (n = 11) |
|
|
Через 24 ч |
0,13±0,05* |
0,13±0,04** |
0,33±0,32 |
0,29±0,12 |
|
Через 48 ч |
0,10±0,02* |
0,10±0,02** |
0,18±0,08 |
0,21±0,08 |
* р <0,05 между подгруппами без снижения церебральной оксигенации на одном этапе исследования в группах ИИПА и ТВА; ** р <0,05 между подгруппами «десатурированных» больных на одном этапе исследования в группах ИИПА и ТВА
В обеих группах нашего исследования наблюдалось сопоставимое количество пациентов с эпизодами снижения rSO2 во время искусственного кровообращения (табл. 3). В то же время при сопоставлении данных церебральной оксигенации и динамики белка S100B в каждой из исследуемых групп становится очевидно, что снижение rSO2 в группе ИИПА никак не повлияло на концентрацию белка в послеоперационном периоде – она все равно была меньше, чем в группе ТВА, даже при сравнении подгрупп «десатурированных» больных. По-видимому, это также отражает эффективность АПК севофлураном в отношении центральной нервной системы.
Согласно существующему мнению, во время обратимой гипоксии поражение глии наступает раньше и проявляется в большей степени, чем в нейронах коры. Кроме того, клеток глии значительно больше, они занимают весь объем между сосудами и нейронами, образуя третий слой гематоэнцефалического барьера (ГЭБ) и первыми принимают на себя удар во время искусственного кровообращения (системный воспалительный ответ, нейтрофильная инфильтрация) [26–28]. Гипоксия же становится неизбежным спутником ИК и также вносит вклад в развитие повреждения клеток глии и нейронов [29]. Таким образом, реакция астроцитов, вероятно, является не только более выраженной, но и длительной, поскольку постгипоксические репаративные процессы, связанные с ликвидацией лишней жидкости из паренхимы мозга и восстановлением целостности ГЭБ, протекают длительно и зависят от многих факторов. Этим, на наш взгляд, и объясняется более дли- тельное повышение концентрации белка S100B в группе тотальной внутривенной анестезии.
Несмотря на то что тест MMSE дает общую ориентировочную оценку состояния высших мозговых функций, он широко используется в клинических исследованиях эффективности нейропротективных методов. Исследование когнитивных функций пациентов групп ИИПА и ТВА не выявило значимых различий до операции, но на вторые сутки после вмешательства показало значимое снижение суммарного клинического балла (СКБ) по шкале MMSE в обеих группах, что говорит о возникновении нейропсихологического дефицита у этих больных после операции. В то же время СКБ в группе ТВА был значительно меньше, чем в группе ИИПА (20,84±3,73 и 23,36±4,34 балла, р <0,05), т. е. степень ухудшения когнитивных функций в группе ТВА была достоверно больше, что также, вероятно, подтверждает нейропротекторный эффект АПК севофлураном.
Полученная разница между группами по СКБ также подтверждает более благоприятный исход кардиохирургического вмешательства у пациентов группы ИИПА еще и по причине равного количества больных с эпизодами значительного снижения rSO2. Другими словами, несмотря на все интенсивные лечебные мероприятия, факт гипоксии был зарегистрирован у сопоставимого количества больных в обеих группах, но он оказался менее значим с точки зрения нейропсихических функций для больных группы ИИПА. На наш взгляд, это вполне можно обосновать ней-ропротекторными свойствами севофлурана при моделировании АПК.
Использованная нами методика ИИПА севофлу-раном способствует более выраженному сохранению функциональных резервов миокарда и его структурной целостности у больных после АКШ в условиях ИК, о чем свидетельствуют более низкие концентрации NTpro-BNP, тропонина Т и потребность в кардиотонической поддержке, чем у больных, которым выполнена ТВА на основе пропофола и фентанила. Примененный в данном исследовании способ дозирования севофлурана не влияет на частоту снижения церебральной оксигенации во время ИК, но в большей степени препятствует повышению концентрации белка S100B и снижению СКБ по шкале MMSE в послеоперационном периоде, чем анестезия на основе пропофола и фентанила.


