Кардиологические аспекты периоперационного ведения больных хронической тромбоэмболической легочной гипертензией при тромбэндартерэктомии из ветвей легочной артерии
Автор: Цыренов Д.Д., Акчурин Р.С., Мершин К.В., Табакьян Е.А., Власова Э.Е., Газизов В.В., Курбанов С.К., Старостин И.В.
Журнал: Евразийский кардиологический журнал @eurasian-cardiology-journal
Рубрика: Оригинальные статьи
Статья в выпуске: 1, 2021 года.
Бесплатный доступ
Цель исследования: провести анализ факторов, ассоциированных с неблагоприятным исходом тромбэндартерэктомии из ветвей легочной артерии и осложнениями госпитального послеоперационного периода; на основании этого анализа оптимизировать терапевтическое сопровождение операции. Материал и методы исследования. В исследование было включено 47 больных с операбельной ХТЭЛГ, которым в период с 2010 г. по 2018 г. в отделе сердечно-сосудистой хирургии НМИЦ кардиологии выполнена тромбэндартерэктомия из ветвей легочной артерии. Больные наблюдались в течение внутригоспитального периода, всем проводилась оценка клинических, инструментальных, гемодинамических, лабораторных параметров и их взаимосвязь с развитием осложнений. Результаты. При комплексной оценке параметров выявлено, что возраст старше 50 лет, наличие доказанного антифосфолипидного синдрома (АФС) независимо ассоциированы с большей частотой развития неблагоприятных исходов операций и осложнений в госпитальном периоде. С большей вероятностью развития реперфузионного отека легких независимо ассоциированы больший возраст, курение в анамнезе. С вероятностью развития преходящих неврологических осложнений независимо ассоциированы большая продолжительность глубоких гипотермических циркуляторных арестов и повышенный уровень д-димера. С вероятностью развития острого повреждения почек независимо ассоциированы больший возраст и большая длительность ИВЛ. С вероятностью потребности в продленной ИВЛ независимо ассоциированы больший уровень антитромбина III и наличие АФС. Заключение. При отборе кандидатов на операцию помимо общепринятых клинико-инструментальных параметров необходимо учитывать курение в анамнезе, повышение Д-димера, наличие АФС. Пациенты с АФС нуждаются в более тщательной оценке риска, коррекции целевых уровней АЧТВ, АВС и в дальнейшей разработке стандартов периоперационного сопровождения. Основным принципом кардиологического сопровождения операции является максимально ранняя диагностика всех известных периоперационных осложнений и быстрое начало их лечения. В послеоперационном периоде показан ранний переход с ИВЛ на самостоятельное дыхание для профилактики ассоциированных осложнений, в том числе ОПП.
Легочная тромбэндартерэктомия, реперфузионный отек легких, острое повреждение почек, антифосфолипидный синдром
Короткий адрес: https://sciup.org/143176199
IDR: 143176199 | DOI: 10.38109/2225-1685-2020-3-94-104
Текст научной статьи Кардиологические аспекты периоперационного ведения больных хронической тромбоэмболической легочной гипертензией при тромбэндартерэктомии из ветвей легочной артерии
Damba D. Tsyrenov, postgraduate of the department of cardiovascular surgery of the Institute of Clinical Cardiology named after A.L. Myasnikov in 20152018; cardiologist of the functional diagnostics department of the Institute of Clinical Oncology named after N.N. Trapeznikov, Moscow, Kashirskoe highway 24, 115478, ,
Renat S. Akchurin, Academician of the RAS, Dr. of Sci. (Med.), Prof., Deputy General Director for Surgery, Head of the Department of Cardiovascular Surgery of the Institute of Clinical Cardiology named after A.L. Myasnikov, ,
Kirill V. Mershin, Cand. of Sci. (Med.), surgeon of the Department of Cardiovascular Surgery of the Institute of Clinical Cardiology named after A.L. Myasnikov, ,
Evgeny A. Tabakyan, Cand. of Sci. (Med.), researcher of artificial and circulatory support laboratory of the Department of Cardiovascular Surgery of the Institute of Clinical Cardiology named after A.L. Myasnikov, ,
Elina E. Vlasova, Cand. of Sci. (Med.), cardiologist, senior researcher of the Department of Cardiovascular Surgery of the Institute of Clinical Cardiology named after A.L. Myasnikov, ,
Vilnur V. Gazizоv, surgeon of the Department of Cardiovascular Surgery of the Institute of Clinical Cardiology named after A.L. Myasnikov, gaz-is-off@ ,
Said K. Kurbanov, cardiologist, junior researcher of the Department of Cardiovascular Surgery of the Institute of Clinical Cardiology named after A.L. Myasnikov, ,
Ivan V. Starostin, Cand. of Sci. (Med.), cardiologist, Deputy Chief Physician for outpatient, ,
For quotation: Damba D. Tsyrenov, Renat S. Akchurin, Kirill V. Mershin, Evgeny A. Tabakyan, Elina E. Vlasova, Vilnur V. Gazizоv, Said K. Kurbanov, Ivan V. Starostin. Cardiological aspects of the perioperative management of patients with chronic thromboembolic pulmonary hypertension for pulmonary thromboendarterectomy. Eurasian heart journal. 2021;(1):94-104 (In Russ.)].
Методом выбора в лечении больных хронической тромбоэмболической легочной гипертензией является легочная тромбэндартерэктомия (ТЭЭ) [1]. Вместе с тем, как и при любой операции, после ТЭЭ возможно развитие некоторых осложнений, в том числе специфических для данного вмешательства: реперфузионный отек легких (РОЛ), резидуальная легочная гипертензия (РЛГ), правожелудочковая сердечная недостаточность (ПЖСН), легочное кровотечение, преходящие неврологические нарушения. Следует обратить внимание, что под резидуальной ЛГ авторы понимают повышение ЛСС более 400-500 дин•с•см-5 [2-4].
В нашей стране метод ТЭЭ внедрен относительно недавно [5-8]. В некоторых зарубежных и российских источниках выделены предикторы госпитальной и отдаленной смертности, в то время как, попытки прогнозирования конкретных осложнений встречаются в единичных исследованиях [3,9-11]. Актуальны вопросы поиска факторов, ассоциированных с вероятностью развития как неблагоприятного исхода в целом, так и отдельных патологических состояний, а также пути оптимизации пе-риоперационного ведения.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
С 2010 по 2018 гг. на базе ИКК им. А.Л. Мясникова 52 пациентам с ХТЭЛГ выполнена ТЭЭ, в 5 случаях в сочетании с коронарным шунтированием, что явилось критерием исключения по причине возможного влияния на функцию левого желудочка и посткапиллярную легочную гипертензию.
В исследование было включено 47 больных. Больные наблюдались в течение внутригоспитального периода, всем проводилась оценка клинических, инструментальных, гемодинамических, лабораторных параметров.
Общая группа (n=47) представлена 29 мужчинами (61,7%), 18 женщинами (38,3%). Средний возраст больных составил 50,7±13,3 лет, минимальный-26, максимальный – 74. Количество больных со 2 ф.к. составило 9 (19,1%), 3 ф.к. – 26 (55,4%), 4 ф.к. – 12 (25,5%). Подробная характеристика клинико-инструментальных и лабораторных параметров больных представлена в таблице 1.
МЕТОДЫ ИССЛЕДОВАНИЯ
Для определения функционального класса всем пациентам проводился тест 6-минутной ходьбы (Т6МХ) по стандартному
Таблица 1. Исходные клинико-инструментальные и лабораторные параметры общей группы больных
Table 1. Initial clinical, instrumental and laboratory parameters of the general group of patients
|
параметр |
µ± s |
М [p25: p75] |
min |
max |
n |
|
возраст, лет |
50,7 ±13,3 |
54 [37:59] |
26 |
74 |
47 |
|
имт, кг/м2 |
27,5 ±4,4 |
27 [24:31] |
20 |
36 |
47 |
|
ппт, м2 |
2,0 ±0,2 |
1,99 [1,82: 2,07] |
1,56 |
2,33 |
47 |
|
анамнез лг до операции, лет |
5,5±5,2 |
5 [2:6] |
0,5 |
30 |
47 |
|
фк_воз |
3,1 ±0,7 |
3 [3:4] |
2 |
4 |
47 |
|
т6мх, м |
267,0 ±123,5 |
250 [163: 346] |
94 |
554 |
47 |
|
одышка_Борг, балл |
5,4 ±1,8 |
6 [4:7] |
0,5 |
8 |
47 |
|
BNP, пг/мл |
347,0±294,0 |
357 [112: 448] |
11 |
1574 |
47 |
|
жел_вдох, % от должного |
100,5±15,6 |
98 [90:109] |
67 |
144 |
47 |
|
офв1/фжел |
3,8±14,8 |
0,77 [0,74: 0,81] |
0,59 |
80 |
47 |
|
офв1, % от должного |
99,0±15,7 |
97 [89:110] |
62 |
138 |
47 |
|
пор_сегм_артер_прав |
6,8±1,5 |
7 [6:8] |
3 |
9 |
47 |
|
пор_сегм_артер_лев |
5,4±1,4 |
5 [5:6] |
3 |
8 |
47 |
|
сдла_эхо, мм рт.ст. |
86,7±20,6 |
86 [73:100] |
35 |
130 |
47 |
|
размер ла, мм |
32,4±4,1 |
32 [30:34] |
25 |
42 |
47 |
|
площадь пп, см2 |
27,7±8,9 |
26 [20:33] |
13 |
54 |
47 |
|
кдр_лж, мм |
44,8±5,1 |
46 [41:48] |
30 |
52 |
47 |
|
баз.р. пж, мм |
49,8±7,9 |
48 [45:53] |
30 |
68 |
47 |
|
TAPSE, см |
1,4±0,4 |
1,4 [1,1:1,5] |
0,7 |
2,5 |
47 |
|
сатур_арт.крови, % |
92,9±3,7 |
93 [90:96] |
86 |
99 |
47 |
|
сатур_вен.крови, % |
56,7±7,8 |
58 [53:62] |
35 |
68 |
47 |
|
сдла кпос, мм рт.ст. |
85,8±17,4 |
85 [72:99] |
48 |
128 |
47 |
|
ср.дла кпос, мм рт.ст. |
48,8±9,8 |
47 [41:55] |
31 |
80 |
47 |
|
ср.дпп, мм рт.ст. |
9,1±5,1 |
8 [6:11] |
2 |
27 |
47 |
|
св, л/мин |
3,7±0,9 |
3,5 [3:4,3] |
1,9 |
6,1 |
47 |
|
си, л/мин/м2 |
1,9±0,5 |
1,8 [1,6:2,2] |
0,9 |
3,8 |
47 |
|
лсс, дин*сек/см5 |
958,4±317,9 |
889 [742:1188] |
388 |
1642 |
47 |
Примечание: µ – среднее значение, s – стандартное отклонение, М – медиана, p25 – 25-й процентиль; p75 – 75-й процентиль, min – минимальное значение, max – максимальное значение, n – количество наблюдений.
Note: µ – mean, s – standard deviation, M – median, p25 is the 25th percentile; p75 – 75th percentile, min –minimum value, max – maximum value, n is the number of cases.
96 ЕВРАЗИЙСКИЙ КАРДИОЛОГИЧЕСКИЙ ЖУРНАЛ, 1, 2021
протоколу с оценкой выраженности одышки по 10-балльной шкале Борга, насыщения артериальной крови кислородом (SpO2) с помощью пульсоксиметра.
Электрокардиографическое, рентгенологическое исследования, спирометрия проводились по стандартным протоколам. Трансторакальная комплексная эхокардиография (ЭхоКГ) проводилась с оценкой следующих показателей: конечно-диастолический размер левого желудочка (КДР ЛЖ), фракция выброса ЛЖ (ФВ ЛЖ) по Симпсону; базальный переднезадний размер правого желудочка (ПЗР ПЖ), диаметр ствола ЛА; площадь правого предсердия, степень трикуспидальной регургитации, систолическое давление легочной артерии (СДЛА). Оценка сократительной функции правого желудочка выполнялась с помощью показателя систолической экскурсии кольца трикуспидального клапана (TAPSE).
Всем пациентам проводилась катетеризация правых отделов сердца (КПОС) с целью определения гемодинамических и расчетных показателей (систолическое, диастолическое, среднее давление в легочной артерии (срДЛА), давление в правом предсердии, правом желудочке, давление заклинивания легочной артерии (ДЗЛА), сердечный выброс (СВ), сердечный индекс (СИ), легочное сосудистое сопротивление (ЛСС), сатурация кислорода в артериальной и смешанной венозной крови).
ЛСС рассчитывалось по формуле: ЛСС = (СрДЛА – ДЗЛА) х 80/СВ. При необходимости проводился расчет отношения системного кровотока к легочному для определения наличия и направления сброса крови.
Одномоментно выполнялась инвазивная ангиопульмоногра-фия в режиме субтракции в прямой и боковой проекциях для выявления поражения легочного сосудистого русла.
Мультиспиральная компьютерная томография в режиме ан-гиопульмонографии (МСКТ-АПГ). Исследование проводилось на мультиспиральном (64-срезовом) компьютерном томографе «Aquilion» (Toshiba, Япония) с контрастированием, ЭКГ-синхронизацией.
С целью детальной топографической оценки обструктивного поражения, выполнялось сопоставление данных инвазивной ангиопульмонграфии и МСКТ-АПГ. При МСКТ-АПГ также проводился поиск значимой патологии легких.
Пациентам старше 45 лет выполнялась коронарография с целью исключения гемодинамически значимых стенозов коронарных артерий.
Всем больным проводились исследования клинического и биохимического анализов крови, коагулограммы: в том числе МНО, АЧТВ, Д-димера, фибриногена (ACL TOP IL, USA), активированного времени свертывания (ACT Plus Medtronic, США), BNP (Architect i1000 Abbot), антифосфолипидных антител (наборы для ИФА Anti-Cardiolipin IgG/IgM Orgentec, Germany), антитромбина III (STA-compact Diagnostica Stago, Франция), мутаций протромбина и фактора свертывания V и других врожденных тромбофилий. Оценка риска госпитальной смерти также проводилась по общепризнанной шкале Euroscore II [12].
Перед операцией большинство пациентов получали ЛАГ-специфическую терапию, диуретические препараты, антикоагулянты.
Операция ТЭЭ проводилась в отделе сердечно-сосудистой хирургии (Руководитель: д.м.н. профессор, академик РАН Акчурин Р.С.). Для обеспечения «сухого» операционного поля выполнялись глубокие гипотермические циркуляторные аресты (ГГЦА) со снижением температуры тела до 19-220С. Между ГГЦА проводилась реперфузия от 12 до 20 минут.
Критерии выявления осложнений
Для выявления реперфузионного отека легких (РОЛ) использованы следующие критерии: появление новых альвеолярных/ интерстициальных инфильтратов на рентгенограмме органов грудной клетки и/или гипоксемии, которую невозможно было объяснить другими причинами. Критерий гипоксемии: сатурация крови кислородом (SрO2) ≤ 90 % и/или парциальное давление кислорода в артериальной крови РаО2 ≤ 60 мм рт. ст.
Критерием резидуальной ЛГ явилось повышение ЛСС более 400 дин•с•см-5 в раннем послеоперационном периоде. Для выявления таких осложнений, как ПЖСН, кровотечение из послеоперационной раны, использованы общепризнанные критерии. ПЖСН выставлялась в случаях повышения центрального венозного давления (ЦВД) более 14 мм рт.ст. при ДЗЛА менее 15 мм рт.ст. в сочетании со снижением сократительной способности ПЖ по Эхо-КГ, требующего применения допамина/добутамина или адреналина для компенсации состояния.
Критерий хирургического кровотечения: скорость отделяемого по дренажам, равная 200 мл в час в течении 3 часов или 300 мл в час в течение 2 часов, либо более 1000 мл кровопотери в сутки. Критерий продленной ИВЛ – продолжительность более 48 часов. ОПП выставлялось согласно международной классификации RIFLE.
Неврологические осложнения подтверждались специалистом неврологом, выставлявшим собственное заключение после осмотра, при необходимости назначались КТ, МРТ головного мозга.
Лечение в отделении реанимации
Лечение в отделении реанимации проводилось не менее двух суток. Осуществлялся контроль параметров гемодинамики до стабилизации состояния пациентов с помощью катетера Свана-Ганца, особое внимание уделялось контролю наполнения ПЖ. Осуществлялся контроль газового состава артериальной и венозной крови, клинического и биохимического анализов крови, АЧТВ, АВС, ЭКГ. Проводился контроль рентгенограмм органов грудной. После прекращения оттока геморрагического отделяемого по дренажам, начиналась постоянная внутривенная инфузия НФГ с исходной скоростью 100 ед/час, далее осуществлялось ее постепенное увеличение до 500-800 ед/час под контролем АЧТВ, АВС.
ИВЛ продолжалась до стабилизации состояния больных, показателей гемодинамики, газового состава артериальной и венозной крови. При неосложненном течении экстубация проводилась к 16-24 часу после операции.
Лечение в отделении ССХ в раннем послеоперационном периоде
В отделении сердечно-сосудистой хирургии продолжалась антикоагулянтная терапия, для достижения целевого уровня АЧТВ 60-80 с проводилось постепенное увеличение скорости инфузии НФГ до 1000 ед/час (24000 ед/сутки) и более. К 4-5 суткам выполнялся переход с НФГ на НМГ, контроль рентгенографии ОГК и Эхо-КГ для исключения наличия воздуха, патологического количества жидкости в перикардиальной и плевральных полостях. В дальнейшем начиналась терапия Варфарином. При достижении нижней границы целевого для данной категории больных уровня МНО, равного 2,5, прекращались инъекции НМГ.
Также проводилась антибактериальная терапия, по показаниям назначались диуретические, ЛАГ-специфические препараты. Выполнялась дыхательная гимнастика, активизация больных с ежедневным увеличением объема движений, дистанции ходьбы. Проводился контроль клинического, биохимического анализов крови, коагулограммы, BNP, клинического анализа мочи, рентгенографии ОГК, ЭКГ, ЭхоКГ в динамике, в некоторых случаях МСКТ-ангиопульмонография.
Статистическая обработка полученных результатов
Анализ проводился с использованием компьютерного статистического пакета «Stata, версия 15» (StataCorporation, США) с дополнительными модулями. При нормальном типе распределения количественные переменные из двух независимых групп сравнивались методом t-критерия для независимых выборок (и t-тест для зависимых выборок, соответственно). При ненормальном распределении использованы критерии Манна-Уитни для двух групп, Краскелла-Уоллиса для трех и более групп. Качественные переменные сравнивали с помощью критерия хи-квадрат ( χ 2), точного теста Фишера (при n ≤ 5 в одной из подгрупп). Корреляции между переменными анализировались по методу Пирсона (при нормальном распределении) и по методу Спирмэна в иных случаях. В однофакторном анализе за уровень статистической значимости тестов принято α = 5% (р <0.05).
Все факторы в многофакторных моделях проверены на возможную нелинейность связи с зависимой переменной. Результаты множественных логистических регрессионных моделей представлены в виде отношений шансов, 95% доверительного интервала, уровня статистической значимости р. Общая оценка согласия модели и реальных данных оценивалась с использованием теста согласия Хосмера-Лемешова. Использован стандартный анализ ROC-кривых, поиск порогового значения диагностического показателя. В многофакторных логистических моделях за уровень статистической значимости принято α = 0.05 (р <0.05).
Многофакторный анализ взаимосвязи параметров с развитием осложнений
В многофакторном анализе использованы следующие доопе-рационные параметры пациентов: возраст, пол, рост, вес, площадь поверхности тела (ППТ), анамнез ХТЭЛГ до ТЭЭ, курение в анамнезе, дистанция в т6мх, класс одышки по боргу, фк ХТЭЛГ согласно ВОЗ, уровень мозгового натрийуретического пептида (BNP), креатинина, наличие ХБП, ЖЕЛ вдоха, ОФВ1 сек/ФЖЕЛ, ОФВ1 сек, количество пораженных сегментарных артерий в каждом легком, эхокардиографические параметры (СДЛА, диаметр ЛА, площадь ПП, степень трикуспидальной регургитации, КДР ЛЖ, базальный размер ПЖ, выраженность систолической экскурсии кольца ТК, наличие перикардиального выпота, ФВ ЛЖ по Симпсону, гемодинамические параметры (среднее давление в правом предсердии, среднее давление в легочной артерии, сердечный выброс, сердечный индекс, ЛСС, индекс ЛСС), сатурация артериальной крови, сатурация венозной крови, продолжительность искусственного кровообращения, пережатия аорты, ГГЦА, количество ГГЦА, прием терапии до госпитализации (ЛАГ-специфической терапии, петлевых диуретиков, антагонистов ми-нералкортикоидных рецепторов, антагонистов кальция).
РЕЗУЛЬТАТЫ
В группу 1 (n=20) внесены пациенты, у которых развилось одно или несколько из перечисленных осложнений: реперфу-
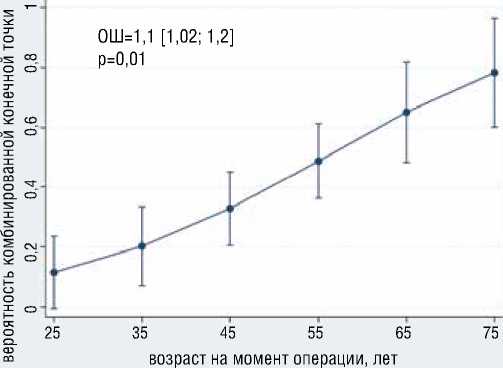
Рисунок 1. Ассоциация возраста и АФС с вероятностью развития ККТ
Figure 1. Association of age and AFS with the probability of developing a composite endpoint
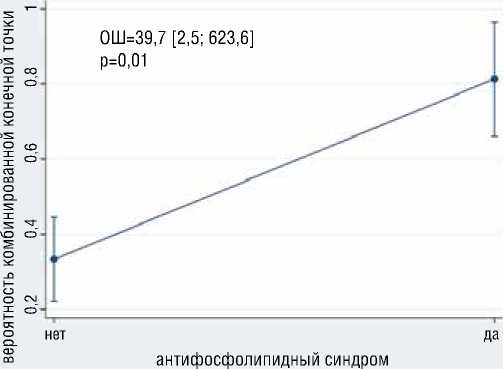
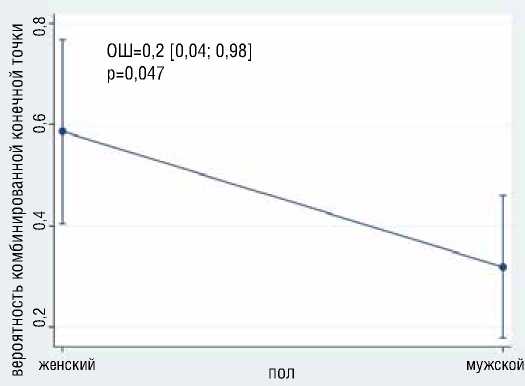
Рисунок 2. Ассоциация пола и уровня фибриногена с вероятностью развития ККТ
Figure 2. Association of gender and fibrinogen level with the probability of developing a composite endpoint
98 ЕВРАЗИЙСКИЙ КАРДИОЛОГИЧЕСКИЙ ЖУРНАЛ, 1, 2021
зионный отек легких (n=8 или 17%), резидуальная легочная гипертензия (n=3 или 6,4%), правожелудочковая сердечная недостаточность (n=1 или 2,1%), острое повреждение почек (n=10 или 21,2%), неврологические осложнения (n=8 или 17%), кровотечения из послеоперационной раны (n=3 или 6,4%), случаи внутригоспитальной смерти (n=2 или 4,2%). Пациенты с данными осложнениями (n=20), в том числе 2 случая (4,2%) вну-тригоспитальной смерти объединены нами в комбинированную конечную точку (ККТ).
Следует отметить, что 2 случая внутригоспитальной смерти развились в первой выборке пяти пациентов. В одном случае летальный исход наступил в результате интраоперационного легочного кровотечения, во втором – в связи с развитием катастрофического антифосфолипидного синдрома (КАФС) в виде массивного тромбоза артерий внутренних органов и прогрессирующей полиорганной недостаточности.
У 8 пациентов было выявлено одновременное развитие нескольких осложнений. Следует подчеркнуть, что степень выраженности каждого патологического состояния варьировалась от легкой до тяжелой. Несколько случаев РОЛ были представлены лишь рентгенологическими изменениями, без значимого влияния на гемодинамические и показатели газового состава крови. Продленная ИВЛ потребовалась в 14 случаях (29,8%).
В группу 2 (n=27) вошли пациенты с неосложненным «гладким» послеоперационным течением.
В результате многофакторного логистического анализа выявлено, что с большей вероятностью развития ККТ независимо ассоциированы больший возраст (ОШ=1.1, 95% ДИ [1,02-1,2], р=0,01) и наличие у больного АФС (ОШ=39.7, 95% ДИ [2,5-623,6], р=0,01) (рис. 1); с меньшей вероятностью развития ККТ независимо ассоциированы мужской пол (ОШ=0,19, 95% ДИ [0,04-0,98], р=0,047), больший уровень фибриногена (ОШ=0,13, 95% ДИ [0,03-0,61], р=0,01) (рис. 2). Общая статистика анализа хи-квадрат (4) = 18,0, р=0,001, псевдокоэффициент детерминации R2 = 0,281.
На графике представлена кривая ROC для данного анализа, площадь под кривой = 0,8389 (рис. 3), отражающая качество классификации. Наибольшая корректность анализа (72,3%) достигнута при значении отрезной точки, равной 0,4, при этом чувствительность составила 70%, специфичность – 74%, положительная предсказательная способность - 66.67%, отрицательная предсказательная способность – 76,9%.
В результате анализа выявлено, что с большей вероятностью развития реперфузионного отека легких (РОЛ) независимо ассоциированы больший возраст (ОШ=1.2, 95% ДИ [1,05-1,4], р=0,009), курение в анамнезе (ОШ= 16.5, 95% ДИ [0,94-289], р=0,05) (рис. 4).
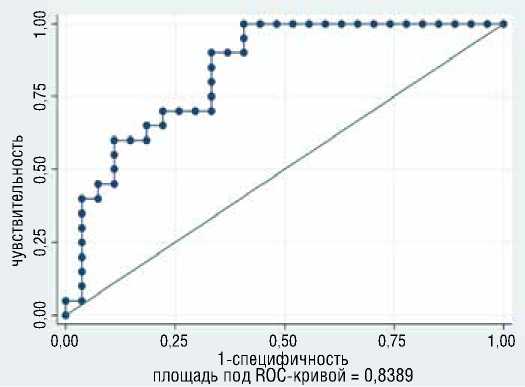
Рисунок 3. Кривая ROC анализа ККТ, чувствительность и специфичность для разных величин отрезной точки анализа ККТ Figure 3. ROC curve of analysis, sensitivity and specificity for different values of the cut-off point of the composite endpoint analysis
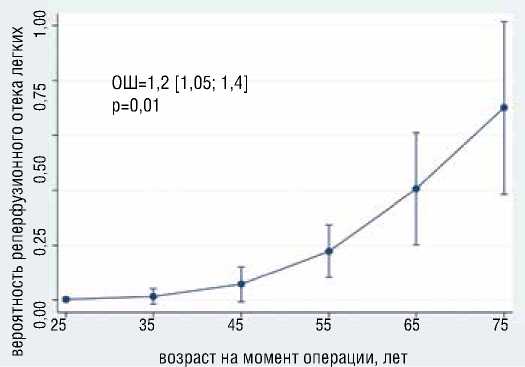
Рисунок 4. Ассоциация возраста и курения с вероятностью развития реперфузионного отека легких Figure 4. Association of age and smoking with the probability of developing reperfusion pulmonary edema
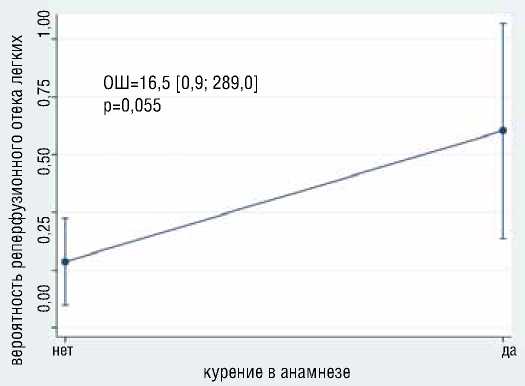
ОШ=16,5 [0,9; 289,0] p=0,055
нет курение в анамнезе да
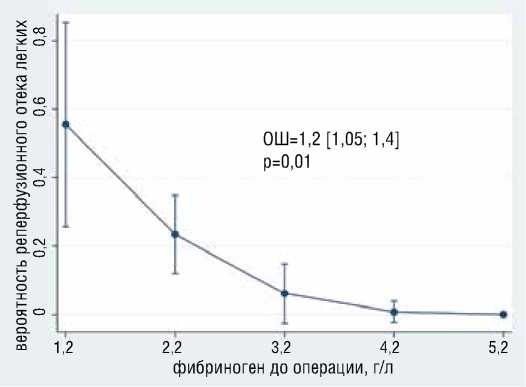
Рисунок 5. Ассоциация уровня фибриногена с вероятностью развития реперфузионного отека легких
Figure 5. Association of fibrinogen levels with the probability of developing reperfusion pulmonary edema
Площадь под ROC-кривой = 0,923. Наибольшая корректность анализа (89,4%) достигнута при значении отрезной точки большей или равной 0,3; при этом чувствительность составила – 70%, специфичность – 74%, положительная предсказательная способность – 66.67%, отрицательная предсказательная способность – 76,9%.
В результате многофакторного логистического анализа выявлено, что с большей вероятностью развития ОПП независимо ассоциированы больший возраст (ОШ=1.27, 95% ДИ [1,04-1,65], р=0,018) и большая длительность ИВЛ (ОШ=1.03, 95% ДИ [1,002-1,05], р=0,032) (рис. 6). Общая статистика модели хи-квадрат = 28,55, р<0,0005, псевдокоэффициент детерминации R2 = 0,5927. Наибольшая корректность анализа (86,9%) достигнута при значении отрезной точки большей или равной 0,35; при этом чувствительность составила – 80%, специфичность – 88,9%, положительная предсказательная способность – 66,7%, отрицательная предсказательная способность – 94,1%.
В результате многофакторного логистического моделирования выявлено, что с большей вероятностью развития преходящих неврологических осложнений независимо ассоциированы большее общее время ГГЦА (ОШ=1.2, 95% ДИ [1,03-1,32], р=0,02), больший уровень д-димера (ОШ=6.64, 95% ДИ [1,1239,37], р=0,037) (рис. 7), больший уровень ОФВ1 (ОШ=1.2, 95% ДИ [1,03-1,3], р=0,01) (рис. 8); с меньшей вероятностью раз-
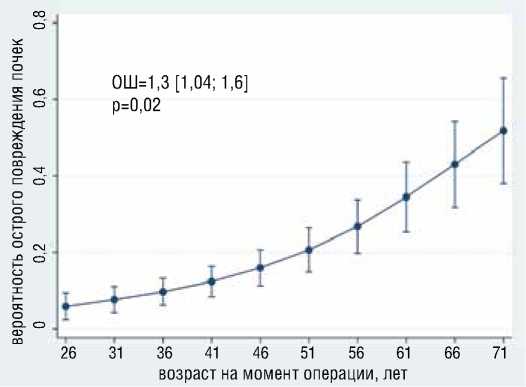
Рисунок 6. Ассоциация возраста и продленной ИВЛ с вероятностью развития ОПП
Figure 6. Association of age and prolonged mechanical ventilation with the probability of AKI development
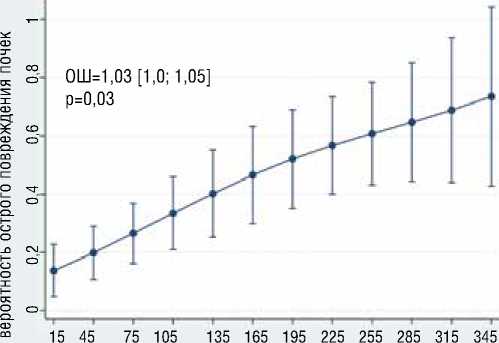
продолжительность искусственной вентиляции легких, час
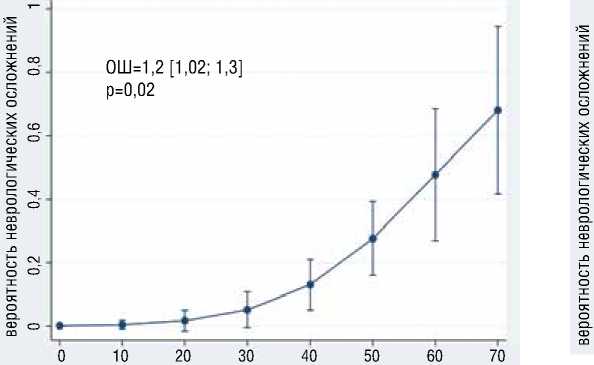
общее время глубоких гипотермических арестов, мин
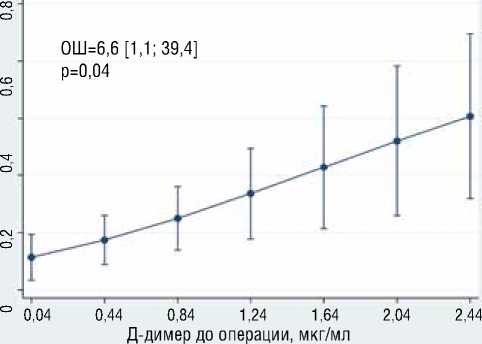
Рисунок 7. Ассоциация общего времени ГГЦА и д-димера с вероятностью развития преходящих неврологических осложнений Figure 7. Association of the total time of deep hypothermic circulatory arrest and d-dimer with the probability of developing transient neurological complications
100 ЕВРАЗИЙСКИЙ КАРДИОЛОГИЧЕСКИЙ ЖУРНАЛ, 1, 2021
вития преходящих неврологических осложнений независимо ассоциирован больший возраст (ОШ=0.9, 95% ДИ [0,8-0,99], р=0,03) (рис. 8).
Общая статистика модели хи-квадрат = 14,83, р<0,0005, псевдокоэффициент детерминации R2 = 0,3458. С увеличением возраста, согласно анализу, наблюдается заметное снижение вероятности развития преходящих неврологических осложне- ний. Наибольшая корректность анализа (83%) достигнута при значении отрезной точки большей или равной 0,37; при этом чувствительность составила – 75%, специфичность – 84,6%, положительная предсказательная способность–50%, отрицательная предсказательная способность – 94,3%.
В результате многофакторного логистического моделирования выявлено, что с большей вероятностью развития продленной (бо-
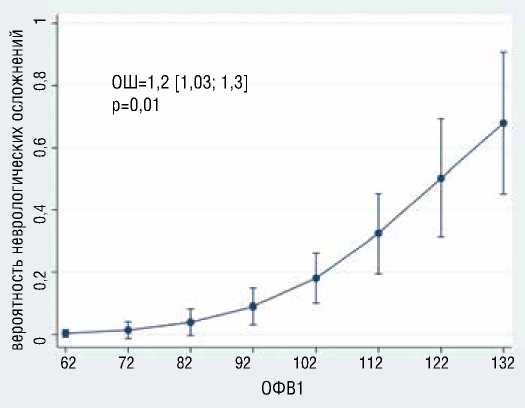
Рисунок 8. Ассоциация ОФВ1 и возраста с вероятностью развития преходящих неврологических осложнений Figure 8. Association of FEV1 and age with the probability of developing transient neurological complications
Примечание: ОФВ1 отражено в процентах от должного, Note: FEV1 is reflected as a percentage of due
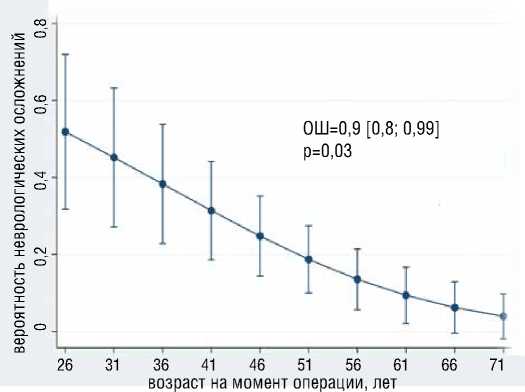
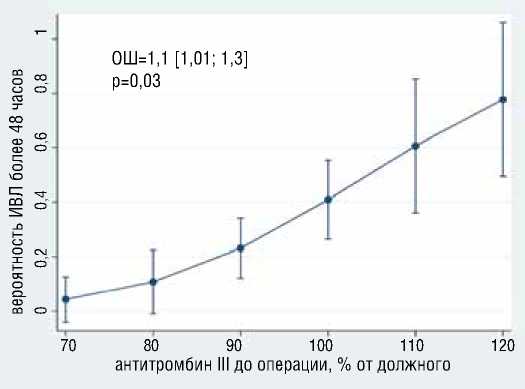
Рисунок 9. Ассоциация антитромбина III и АФС с вероятностью продленной ИВЛ
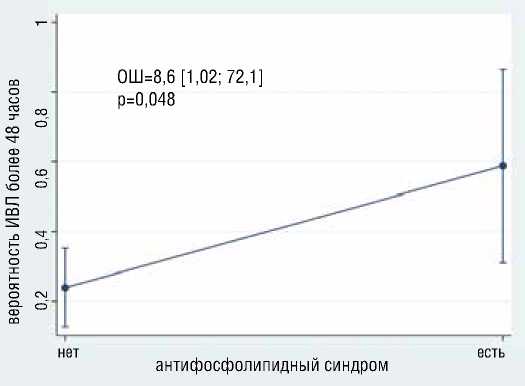
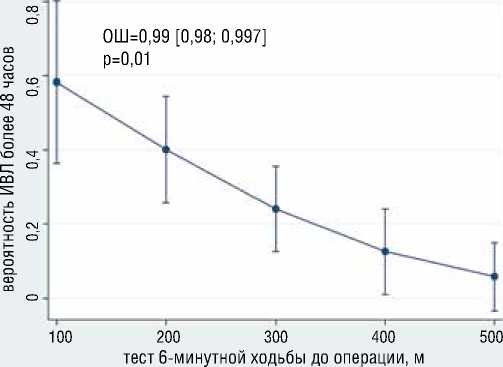
Рисунок 10. Ассоциация дистанции Т6МХ и уровня фибриногена с вероятностью продленной ИВЛ
Figure 10. Association of Six Minute Walk Test distance and fibrinogen level with probability of prolonged mechanical ventilation
EURASIAN HEART JOURNAL, 1, 2021 101
prolon
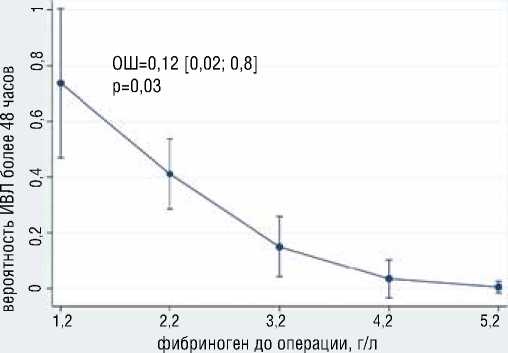
лее 48 часов) ИВЛ независимо ассоциированы больший уровень антитромбина 3 (ОШ=1.13, 95% ДИ [1,01-1,25], р=0,0026), наличие антифосфолипидного синдрома (ОШ=8.5, 95% ДИ [1,01-72], р=0,048) (рис. 9); с меньшей вероятностью развития продленной ИВЛ независимо ассоциированы большая дистанция в Т6МХ (ОШ=0.98, 95% ДИ [0,98-0,99], р=0,014), больший уровень фибриногена (ОШ=0.11, 95% ДИ [0,018-0,78], р=0,027) (рис. 10). Общая статистика анализа хи-квадрат (4) = 14,59, р=0,0056, псевдокоэффициент детерминации R2 = 0,2549.
Оценка эффективности операции
ТЭЭ у больных обеих групп
В задачи данного исследования не входила количественная и качественная оценка изменений легочного сосудистого русла у пациентов после ТЭЭ в раннем послеоперационном периоде, селективная ангиопульмонография или МСКТ-ангиопульмонография рутинно не проводились. В собственном исследовании оценка результата ТЭЭ выполнялась по гемодинамическим (табл. 2), эхокардиографическим (табл. 3), клиническим параметрам и по лабораторным показателям.
В группе с неосложненным послеоперационным течением к окончанию 1 суток наблюдалась нормализация значений ср.ДЛА, СВ (рис. 11) и СИ. ЛСС и индекс ЛСС приблизились к норме (рис. 11).
В обеих группах по результатам Эхо-КГ наблюдалось значительное снижение СДЛА, обратное ремоделирование правых камер сердца, улучшение сократимости ПЖ.
Во внутригоспитальном периоде к 9-12 суткам зарегистрировано значительное снижение концентрации BNP в обеих груп-
Таблица 2. Изменение гемодинамических показателей к окончанию первых послеоперационных суток по сравнению с дооперационными
Table 2. Changes in hemodynamic parameters by the end of the first postoperative day compared to preoperative ones
|
Параметр |
Группа 1 (n=19)* |
Группа 2 (n=27) |
р |
|
∆ Ср.ДЛА, мм рт.ст. |
-19,1 ± 9,1 |
- 24,07 ± 9, |
0,06 |
|
∆ СВ, л/мин |
1,07 ± 1,04 |
1,9 ± 1,35 |
0,03 |
|
∆ СИ, л/мин/м2 |
0,63 ± 0,56 |
1,0 ± 0,74 |
0,06 |
|
∆ ЛСС, дин*сек/см5 |
-571,9 ± 225,9 |
-721,2 ± 345 |
0,08 |
Примечание: * – один случай интраоперационной смерти исключен из анализа Note: * – one case of intraoperative death was excluded from the analysis
Динамика СВ в группе 1 и группе 2 до и после операции
Группа 1 Группа 2
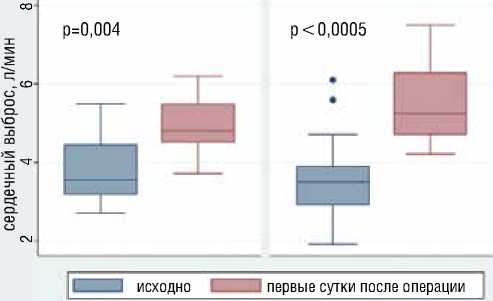
Рисунок 11. Динамика сердечного выброса и ЛСС в обеих группах
Figure 11. Dynamics of cardiac output and pulmonary vascular ressistance in both groups
Динамика ЛСС в группе 1 и группе 2 до и после операции
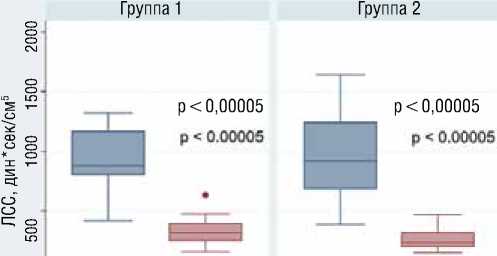
исходно первые сутки после операции
Таблица 3. Сравнение динамики эхокардиографических показателей в обеих группах
Table 3. Comparison of the dynamics of echocardiographic parameters in both groups
|
Параметры ЭхоКГ |
Группа 1 (n=18)* |
Группа 2 (n=27) |
р |
|
∆ СДЛА, мм рт.ст. |
-39,8 ± 17,7 |
-54,8±5,3 |
<0,05 |
|
∆ Размер ЛА, мм |
-4,1 ± 3,1 |
-3,3±2,2 |
>0,05 |
|
∆ S ПП, см2 |
-7,1 ± 6,3 |
-6,8 ± 4,4 |
>0,05 |
|
∆ БР ПЖ, мм |
-8 ± 5,9 |
-7,2 ±7,0 |
>0,05 |
|
∆ TAPSE, см |
0,21 ± 0,18 |
0,24 ± 0,21 |
>0,05 |
* – два летальных случая исключены из анализа динамики
* – two fatal cases were excluded from the analysis of the dynamics 102 ЕВРАЗИЙСКИЙ КАРДИОЛОГИЧЕСКИЙ ЖУРНАЛ, 1, 2021
пах: с 372 [111:568] до 85 [68:152] (p=0,06) и c 361[151:412] до 78 [46:97] пг/мл (p<0,00005) соответственно, что указывает на уменьшение выраженности или на регрессирование сердечной недостаточности после ТЭЭ (рис. 12). При межгрупповом анализе исходного значения BNP уровень статистической значимости составил p=0,89.
Ко дню выписки из стационара у пациентов обеих групп отмечалось выраженное, статистически значимое увеличение дистанции в Т6МХ с 209 [166:324] до 472 [407:538] и c 293[173:345] до 480 [456:529] метров соответственно. При межгрупповом анализе исходной дистанции Т6МХ уровень статистической значимости составил p=0,767, для послеоперационной дистанции Т6МХ p=0,381, при внутригрупповом анализе p<0,001.
ОБСУЖДЕНИЕ
Реперфузионный отек легких или реперфузионное повреждение легких является одним из наиболее частых (от 10 до 40%) послеоперационных осложнений, повышающих риск смерти [13]. Тяжесть РОЛ варьирует от легкого и кратковременного до тяжелого и продолжительного. Наличие гипоксемии, связанной с образованием инфильтрата в легочной паренхиме, служит признаком выраженного РОЛ [13]. По собственным результатам РОЛ зарегистрирован в 8 случаях (17%), однако, в 7 из них осложнение носило легкое течение, выявленное только рентгенологически, без значимого изменения газового состава крови. Все случаи РОЛ были купированы в течение 1-2 суток.
В настоящем исследовании с повышением возраста более 55 лет значимо возрастала ассоциация с вероятностью развития РОЛ в раннем послеоперационном периоде, что может быть обусловлено снижением компенсаторных резервов у данной категории пациентов. Курение, вероятно, увеличивает риск проницаемости стенки легочных артерий, что создает предпосылки для РОЛ. Связь большего уровня фибриногена со сниженным риском развития РОЛ, возможно, обусловлена лучшей синтетической способностью печени без застойной ПЖСН по сравнению с таковой на фоне застойной ПЖСН. Данный вопрос требует дальнейшего изучения на более широкой выборке пациентов.
Резидуальная легочная гипертензия (РЛГ), по данным одних авторов развивается у 5%-35%, по результатам других – у 10-14% пациентов, является одной из наиболее частых причин смертности [2-5,10]. Основным фактором, влияющим на развитие данного осложнения, является полноценность тромбэндартерэктомии. Вместе с тем, в поддержание РЛГ может вносить вклад патология микрососудистого русла [2-5,10]. В собственном исследовании РЛГ была выявлена в 6,4% случаев, Данным пациентам проводилась ЛАГ-специфическая терапия ингаляционным илопростом, продленная ИВЛ, диуретическая терапия. При выписке состояние пациентов расценено как удовлетворительное, были даны рекомендации продолжить ЛАГ-специфическую терапию (илопрост, риоцигуат), выполнить контрольную КПОС через 3-6 месяцев. В связи с небольшим количеством наблюдений многофакторный анализ отдельно для РЛГ, ПЖСН провести не удалось, однако данные состояния наряду с другими осложнениями и летальными исходами внесены в комбинированную конечную точку.
Особенностями операции ТЭЭ являются длительное ИК, ГГЦА, продолжительный этап согревания, что может повышать риск развития ОПП и неврологических осложнений. На рисунке 28 отражено заметное нарастание вероятности развития последних при превышении 40 минут ГГЦА. Полученные результаты анализа факторов, независимо ассоциированных с развитием ОПП, вероятно, можно объяснить ухудшением фильтрационной функции почек с возрастом. Продленная ИВЛ нередко требуется пациентам со сниженным сердечным выбросом, соответствующей сниженной перфузией почек, что, в свою очередь, обуславливает повышение риска ОПП. Однако в собственной работе не удалось получить статистически значимой взаимосвязи между СВ, СИ, продолжительностью ГГЦА и риском развития ОПП.
Согласно результатам международного регистра ХТЭЛГ (n=679), в когорте оперированных больных (n=386) неврологические осложнения разной тяжести зарегистрированы в 11% случаев [3]. В рандомизированном контролируемом исследовании PEACOG при сравнении группы антеградной перфузии головного мозга (n=39) с группой ГГЦА (n=35) частота развития неврологической патологии после ТЭЭ соответственно составила: тремор 12,8% и 11,4%, спутанное сознание и изменение настроения – у 10,2% и 14,2%, транзиторная ишемическая атака – 2% и 2,8% [14]. В собственном исследовании зарегистрировано 8 случаев (17%) преходящих неврологических осложнений. Характер осложнений включал постгипоксическую энцефалопатию, проявляющуюся преимущественно развитием экстрапирамидных хорееподобных гиперкинезов. С помощью визуализирующих методов диагностики (мультиспиральная компьютерная и магнитно-резонансная томография) были исключены ишемические и геморрагические инсульты.
D’Armini с соавт. в проспективном исследовании (n=184) выявили влияние высокого титра антифосфолипидных антител на более частое развитие транзиторных неврологических осложнений (хорея, делирий, когнитивные дефекты) после ТЭЭ, без такого влияния на другие значимые осложнения и конечные точки [15]. В собственном исследовании подобных изменений при МРТ не выявлено, среди 8 пациентов c неврологическими нарушениями у 2 (25%) был ранее диагностирован АФС, тем не менее, получить статистической значимой взаимосвязи наличия АФС с вероятностью развития постгипоксической энцефалопатии не удалось.
Наличие АФС у пациента может быть ассоциировано с более частым развитием осложнений в раннем послеоперационном периоде, среди таких патологий: РОЛ, ОПП, полиор-ганная недостаточность, тромбоцитопения, неврологические осложнения. Указанный факт может вызвать у некоторых врачей мысль о внесении АФС в список противопоказаний к операции ТЭЭ. Такое утверждение, на наш взгляд, ошибочно. Собственный опыт и данные литературы доказывают, что у указанной категории больных можно добиться успешных результатов хирургического лечения при грамотном периопера-ционном ведении.
В нашем отделе осуществлялся тщательный контроль параметров свертывающей системы крови, особенно у пациентов с АФС. Известно, что при АФС часто показатели АЧТВ и АВС нередко оказываются ложно-повышенными. Также с АФС нередко ассоциирована тромбоцитопения. После плазмофильтрации во время ИК в сосудистом русле снижается уровень белков, в том числе антифосфолипидных антител. Кроме того, всем пациентам во время ИК вводился дексаметазон с целью профилактики аллергических реакций, что также снижает уровень антител.
Пациентам с ХТЭЛГ показано назначение лечебных доз антикоагулянтных препаратов, что повышает риск потенциальных кровотечений, особенно при тромбоцитопении. Грозное патологическое состояние, значительно ограничивающее выбор антикоагулянтных препаратов - это гепарин-индуцированная тромбоцитопения (ГИТ). В собственном исследовании наблюдалось 2 случая ГИТ. При развитии данной патологии у паци- EURASIAN HEART JOURNAL, 1, 2021 103
ентов проводилась замена в/в инфузии НФГ препаратом би-валирудин, НМГ – на фондапаринукс натрия в лечебной дозе, соответствующей массе тела.
С целью снижения риска развития ОПП исключалось проведение контрастных исследований за 3-4 суток до операции, строго соблюдался общепринятый протокол перфузии во время ИК, выполнялся контроль СИ, водного баланса и доз диуретических препаратов в периоперационном периоде.
Все пациенты с неврологическими осложнениями курировались совместно с врачами-неврологами. Нарушения были купированы применением малых нейролептиков, в частности, хлорпротиксеном, блокирующим дофаминовые рецепторы ЦНС, а также M-холиноблокатором бипериденом, блокирующим центральные н-холинорецепторы и периферическую м-холинергическую передачу возбуждения.
Несмотря на отягощенное течение раннего послеоперационного периода у пациентов в 1 группе (n=20), у 18 пациентов удалось стабилизировать состояние и добиться успешных результатов во внутригоспитальном периоде. Данный факт указывает на возможности медикаментозной периоперационной терапии, позволяющей купировать возможные осложнения.
В настоящем исследовании развилось 2 случая (4,2%) госпитальной смерти, что соответствует общемировым показателям госпитальной летальности, приближающимся к 5% [2-4,10,11].
Таким образом, несмотря на достаточно тяжелое исходное состояние кандидатов на ТЭЭ в собственном исследовании, удалось достичь удовлетворительных клинико-гемодинамических результатов лечения и снижения госпитальной летальности до значений, сопоставимых с таковыми в ведущих экспертных центрах мира.
ЗАКЛЮЧЕНИЕ
При отборе кандидатов на операцию помимо общепринятых клинико-инструментальных параметров необходимо учитывать курение в анамнезе, повышение д-димера, наличие АФС. Пациенты с АФС нуждаются в более тщательной оценке риска, коррекции целевых уровней АЧТВ, АВС и в дальнейшей разработке стандартов периоперационного сопровождения. Основным принципом кардиологического сопровождения операции является максимально ранняя диагностика всех известных периоперационных осложнений и быстрое начало их лечения. В послеоперационном периоде показан ранний переход с ИВЛ на самостоятельное дыхание для профилактики ассоциированных осложнений, в том числе ОПП.
Коллектив авторов благодарит руководителей и всех сотрудников диагностических подразделений ФГБУ «НМИЦ кардиологии» Минздрава России
Список литературы Кардиологические аспекты периоперационного ведения больных хронической тромбоэмболической легочной гипертензией при тромбэндартерэктомии из ветвей легочной артерии
- Чазова И.Е., Мартынюк Т.В. Клинические рекомендации по диагностике и лечению хронической тромбоэмболической легочной гипер-тензии (I часть). (I часть). Терапевтический архив 2016; 9:90 -101. [Chazova I.E., Martynyuk T.V. Clinical guidelines for the diagnosis and treatment of chronic thromboembolic pulmonary hypertension (Part 1). Terapevticheskii arkhiv. 2016;88(9):90-101 (in Russ.)] D0l:10.17116/ terarkh201688990-101
- Jenkins D., Madani M., Fadel E. et al. Pulmonary endarterectomy in the management of chronic thromboembolic pulmonary hypertension. EurRespir Rev 2017; 26: 1601-1611. https://doi. org/10.1183/16000617.0111-2016
- Mayer E., Jenkins D., Lindner J. et al. Surgical management and outcome of patients with chronic thromboembolic pulmonary hypertension: Results from an international prospective registry. J Thorac Cardiovasc Surg 2011;141:702-710. D0I:10.1016/j.jtcvs2010.11.024
- Kramm T., Eberle B, Guth S., Mayer E. Inhaled iloprost to control residual pulmonary hypertension following pulmonary endarterectomy. Eur J Cardiothorac Surg 2005; 28(6):882-888. D0l:10.1016/j. ejcts.2005.09.007
- Акчурин Р.С., Мершин К.В., Лепилин М.Г. и соавт. Операции тромбэндартерэктомии из легочной артерии: состояние проблемы. Consilium medicum 2016; 5:62-66. [Akchurin R.S., Mershin K.V, Lepilin M.G. et al. Pulmonary thromboendarterectomy: state of the problem. Consilium medicum 2016; 5: 62-66 (in Russ.)] DOI:10.26442/2075-1753_2016.5.62-66
- Чернявский А.М., Едемский А.Г., Чернявский М.А. и соавт. Хирургические технологии в лечении больных с хронической постэмболической легочной гипертензией. Кардиология и сердечно-сосудистая хирургия. 2016; 6:38-43. [Chernyavsky A.M., Edemsky, A.G., Chernyavsky MA. et al. Surgical techniques in treatment of patients with chronic postembolic pulmonary hypertension. Russian Journal of Cardiology and Cardiovascular Surgery 2016; 6:38-43(in Russ.)] D0I:10.17116/kardio20169638-43
- Горбачевский С.В., Шмальц АА, Рахмонов К.Х. и соавт. Достижения и новые направления в хирургии легочной гипертензии. Грудная и сердечно-сосудистая хирургия. 2018; 60 (5): 384-389. [Gorbachevsky S.V., Shmalts AA, Rakhmonov K.H. et al. Achievements and new directions in the surgery of pulmonary hypertension. Thoracic and cardiovascular surgery. 2018; 60 (5): 384-389 (in Russ.)] DOI: 10.24022/0236-2791-2018-60-5-384-389
- Симакова МА, Карпова Д.В, Моисеева О.М. и соавт. Тромбэндартерэктомия из ветвей легочной артерии у пациента с хронической тромбоэмболической легочной гипертензией в условиях длительного циркуляторного ареста. Кардиология и сердечно-сосудистая хирургия. 2018;3:63-69. [Simakova MA, Karpova D.V., Moiseeva O.M. et al. Pulmonary endarterectomy under prolonged circulatory arrest in patient with chronic thromboembolic pulmonary hypertension. Russian Journal of Cardiology and Cardiovascular Surgery 2018;3:63-69 (in Russ.)] https://doi.org/10.17116/kardio201811363
- Delcroix M, Lang I., Pepke-Zaba J. et al. Long-term outcome of patients with chronic thromboembolic pulmonary hypertension (CTEPH): results from an international prospective registry. Circulation 2016; 133: 859871. DOI: 10.1161/CIRCULATI0NAHA.115.016522
- Madani M, Auger W.R., Pretorius V. et al. Pulmonary endarterectomy: recent changes in a single institution's experience of more than 2,700 patients. Ann Thorac Surg 2012;94:97-103. http://dx.doi.org/10.1016/j. athoracsur.2012.04.004
- Kunihara Т., Gerdts J., Groesdonk Н. et al. Predictors of postoperative outcome after pulmonary endarterectomy from a 14-year experience with 279 patients. Eur J of Cardiothorac Surg. 2011; 40: 154-161. D0I:10.1016/j.ejcts.2010.10.043
- Nashef S.A., Roquesb F, Sharplesc L.D. et al. EuroSCORE II. Eur J of Cardiothorac Surg.2012;41:734-745. DOI: 10.1093/ejcts/ezs043.
- Kerr K.M., Auger W.R., Marsh J. et al. Efficacy of Methylprednisolone in Preventing Lung Injury Following Pulmonary Thromboendarterectomy. Chest. 2012 Jan; 141(1): 27-35. DOI: 10.1378/chest.10-2639
- Vuylsteke A., Sharples L, Charman G. et al. Circulatory arrest versus cerebral perfusion during pulmonary endarterectomy surgery (PEACOG): a randomized controlled trial. Lancet. 2011. № 378. Р. 1379-1387. DOI: 10.1016/S0140-6736(11)61144-6.
- D'Armini A.M., Totaro P, Nicolardi S. et al. Impact of high titre of antiphospholipid antibodies on postoperative outcome following pulmonary endarterectomy. Interact Cardiovasc Thorac Surg 2010;10: 418-22. DOI: 10.1510/icvts2009.221630


