Каротиноиды в растительных пищевых системах
Автор: Нилова Людмила Павловна, Потороко Ирина Юрьевна
Рубрика: Пищевые ингредиенты, сырье и материалы
Статья в выпуске: 4 т.9, 2021 года.
Бесплатный доступ
Каротиноиды пищевых продуктов растительного происхождения - растительные пигменты, обладающие биологической активностью и антиоксидантными свойствами, биодоступность которых зависит от механической и термической обработки и присутствия жиров. Из 40 каротиноидов, поступающих с пищей, главными являются каротины - β- и α-каротины, ликопин и ксантофиллы - лютеин, зеаксантин, β-криптоксантин. В статье представлены данные о содержании различных каротиноидов в свежих овощах, плодах и ягодах, опубликованные за последние годы. Свежие овощи содержат каротиноидов больше, чем плоды и ягоды, но обладают низкой биодоступностью. Основными источниками картиноидов среди овощей являются морковь, плодовые и салатно-шпинатные овощи. Морковь является источником каротинов (β-и α-каротин до 58,4 и 40,4 %, соответственно) с максимальным количеством в оранжевой моркови. Среди плодовых овощей томаты являются источником ликопина (86 %), тыква - β-каротина (50-80 %), сладкий и острый красные перцы - капсантина (70 %) и капсорубина (10 %), оранжевые перцы - зеаксантина (85 %). Методами генной инженерии созданы сорта томатов, содержащих ликопин преимущественно в транс-форме (96 %), а также с повышенным содержанием зеаксантина (50 %). Среди салатно-шпинатных овощей каротиноиды преобладают в шпинате, руколе и кресс-салате преимущественно в виде ксантофиллов. В большинстве плодов и ягод преобладает β-каротин независимо от их окраски, который может маскироваться антоцианами (боярышник, рябина, вишня, шиповник, черника) или хлорофиллом (зеленые яблоки). Наибольшее количество каротиноидов содержат облепиха, шиповник, морошка. Они могут служить источником β-каротина, а также ликопина (облепиха, шиповник), рубиксантина (шиповник).
Каротиноиды, биологическая активность, антиоксидантные свойства, плоды и овощи, пищевые продукты растительного происхождения
Короткий адрес: https://sciup.org/147236418
IDR: 147236418 | УДК: 613.26:577.161.19 | DOI: 10.14529/food210407
Текст научной статьи Каротиноиды в растительных пищевых системах
Каротиноиды - группа биологически активных соединений, которая всегда привлекала внимание как диетологов за счет их пользы для здоровья и безопасного источника природного витамина А, который образуется при ферментативном метаболизме, так и работников пищевой промышленности - для формирования оптимальных цветовых характеристик и пищевой ценности пищевых продуктов.
Химическая природа каротиноидов определяет их множественные свойства: так, наличие системы сопряженных двойных связей обуславливает их окраску, количество двойных связей - антиоксидантную активность, наличие ионовых колец - провитаминные свойства [1-3]. В природе обнаружено около 750 каротиноидов, в большей степени они имеют растительную природу, но также содержатся в рыбе и морепродуктах (астаксантин) и водорослях (фукоксантин) [1, 4, 5]. В организм человека вместе с пищевыми про- дуктами поступает только 40 каротиноидов, из них 10 % проявляют А-витаминную активность [1, 6-8].
Знание природы, химических свойств ка-ратиноидов, присутствие и устойчивость в сложных пищевых системах позволит правильно регулировать технологические процессы с целью сохранения биоактивноси.
Целью данного исследования стал аналитический обзор данных, опубликованных международным научным сообществом в последние десятилетия в области исследований каратиноидов как биологически активных соединений в составе пищевых систем.
В качестве основных информационных модулей, наиболее значимых для формирования пищевых систем нового формата, были определены польза для здоровья (биологическая активность, провитаминные и антиоксидантные свойства), природные источники, факторы, влияющие на содержание каротиноидов в пищевых продуктах растительного происхождения.
Химическая природа каротиноидов
Каротиноиды представляют собой соединения, содержащие 40 углеродных атомов, построенных из 8 изопреновых фрагментов и образующих полипреноидную цепь с сопряженной системой двойных связей. Эта цепь может циклизироваться на концах, образуя несколько типов иононовых колец [1, 2, 5]. Длина цепи оказывает влияние на окраску каротиноидов (от желтого и оранжевого до глубокого красного), а наличие иононовых колец - на витаминную активность. При наличии в структуре каротиноидов 9 и более сопряженных связей они проявляют максимальное защитное действие от синглетного кислорода 1 О2.
Каротиноиды делят на каротины, состоящие из атомов углерода и водорода, и ксантофиллы, имеющие в своем составе дополнительно атомы кислорода в виде гидрокси-, метокси-, эпокси- или кетогрупп.
Представители каротинов обычно оранжевого цвета (а- и в-каротины), ликопин - яркокрасный. Более разнообразны по цвету ксантофиллы: астаксантин - ярко-алый, капсантин - темно-красный, лютеин, зеаксантин и вио-лаксантин - желтые. При включении в цепь сопряжения кето-групп, например, при окислении зеаксантина до капсантина и капсоруби-на в перцах ( Capsicum annuum ) происходит замена оранжевой окраски на красную [7, 9]. Довольно часто оранжевая окраска каротиноидов маскируется другими пигментами, например хлорофиллом или антоцианами. Это наблюдается в листовых овощах, зеленых плодах, сине-окрашенных ягодах и др. [10-13].
Из 40 каротиноидов, поступающих с пищей, основными являются три каротина (а- и в- каротин, ликопин) и три ксантофилла (в-криптоксантин, зеаксантин и лютеин) [1, 2, 5], имеющие типичное строение для соответствующей группы каротиноидов (см. рисунок).
В растительных объектах каротиноиды представлены в транс-, транс-цис- и цисформах, а также этерифицированы жирными кислотами. Более стабильной и энергетически выгодной считается транс-форма, но теоретически цис-транс-изомеризация может происходить по каждой двойной связи, что частично или полностью происходит при приготовлении пищи. Цис-изомеры обладают большей биологической активностью, более легко встраиваясь в биомембраны и липопротеины, чем транс-изомеры [1, 2, 6, 8].
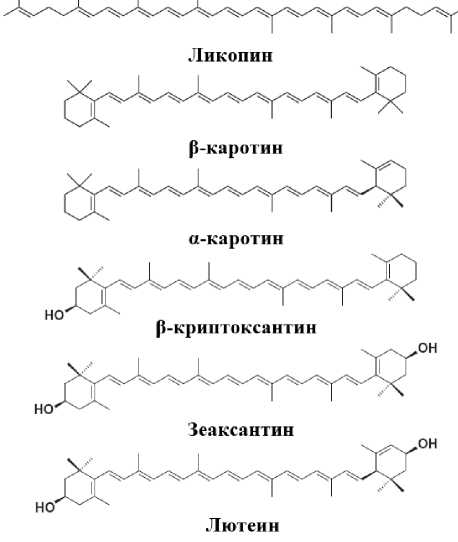
Химическая структура каротиноидов, наиболее часто встречающихся в свежих плодах и овощах и пищевых продуктах с их использованием
А-витаминные свойства . Каротиноиды являются безопасным и единственным источником природного витамина А, который образуется при ферментативном метаболизме каротиноидов в организме человека и животных. Однако не все каротиноиды обладают А-витаминной активностью. Из 40 каротиноидов, регулярно потребляемых человеком вместе с пищевыми продуктами, только некоторые из них (10 %) с в-кольцом без кислородсодержащих функциональных групп и полиеновой цепью не менее 11 атомов углерода, проявляют А-витаминные свойства [14]. К ним относятся транс- и транс-цис-изомеры а-, в-, Y-каротинов и в-криптоксантина (табл. 1) [3, 14]. Среди них в-каротин является наиболее мощным каротиноидом провитамина А, у которого каждая молекула расщепляется на два ретинола витамина А [2, 5].
Биоконверсия в-каротина в витамин А происходит путем окислительного метаболизма молекулы по центральной 15-15 п-связи под влиянием фермента в-каротин-15-15 диоксигеназы. В растениях этого фермента нет, поэтому растительные объекты витамина А не содержат. Из 1 молекулы в-каротина образуется 2 молекулы витамина А, а из а- и у-каротинов - только одна. 6 мкг в-каротина эквивалентны 1 мкг витамина А. Ликопин и δ-каротин витаминной активностью не обладают [2, 3, 5, 14].
Таблица 1 Каротиноиды с активностью провитамина А [3, 14]
|
Каротиноиды (изомеры) |
Активность провитамина А, % |
|
Транс-β-каротин |
100 |
|
9-цис-β-каротин |
38 |
|
13-цис-β-каротин |
53 |
|
Транс-α-каротин |
53 |
|
9-цис-α-каротин |
13 |
|
13-цис-α-каротин |
16 |
|
Транс-β-криптоксантин |
57 |
|
9-цис-β-криптоксантин |
27 |
|
15-цис-β-криптоксантин |
42 |
|
β‐Carotene‐5,6‐эпоксид |
21 |
|
γ‐каротин |
42–50 |
Каротиноиды сами нетоксичны, а образование из них витамина А энзиматически лимитировано. Поэтому при потреблении пищевых продуктов, содержащих каротиноиды, передозировки витамина А не происходит и верхний допустимый уровень потребления не установлен. Среднее потребление β-каротина в разных странах колеблется в пределах 1,8– 5,0 мг/сутки. Для населения России установлена физиологическая потребность β-каро-тина для взрослых, которая составляет 5 мг/сутки (МР 2.3.1.2432-08).
Антиоксидантные свойства
Количество сопряженных двойных связей полиеновой цепи в структуре каротиноидов за счет обобщения π-электронов обуславливает их роль липофильных антиоксидантов. Каротиноид может взаимодействовать со свободными радикалами, передавая электроны, с образованием аддукта или отдавая водород с образованием относительно стабильных каротиноидных радикалов. С увеличением окислительного потенциала каротиноидов их антиоксидантная активность возрастает [1, 8, 15, 16].
Каротиноиды являются наиболее эффективной «ловушкой» синглетного кислорода 1О2, переводя его в нормальное триплетное состояние, при этом рассеивая избыток энергии возбуждения. Каротиноиды принимают энергию возбуждения «триплетного» хлорофилла или реагируют непосредственно с 1О2. Каждая молекула β-каротина способна разрушить до 300 молекул синглентного кислоро- да. По сравнению с витамином Е каротиноиды улавливают 1О2 более активно: β-каротин в 25 раз, ликопин в 100 раз, астаксантин в 500 раз. Наибольшее защитное действие от УФ-излучения за счет кетогруппы с обоих концов системы сопряженных двойных связей проявляет астаксантин. Его требуется в 100 раз меньше, чем β-каротина и в 1000 раз меньше, чем лютеина. Совместное присутствие ликопина, лютеина и β-каротина способно подавлять 40–50 % индуцированное УФ перекисное окисление липидов, но максимальную активность проявляет ликопин. На моделях in vitro установлен ряд антиоксидантной активности каротиноидов: ликопин > α-токоферол > α-каротин > β-криптоксантин > зеаксантин > β-каротин > лютеин. Цис-изомеры каротиноидов обладают большей антиоксидантной активностью, чем их транс-изомеры [1, 6, 15].
Обнаружен синергизм антиоксидантного действия каротиноидов с другими жирорастворимыми антиоксидантами – α- токоферолом и коэнзимом Q10. Каротиноиды защищают токоферолы от окисления, в первую очередь, синглентным кислородом, а токоферолы улавливают пероксильные радикалы каротиноидов, способные инициировать развитие цепей свободно радикального окисления. Синергизм β-каротина с α-токоферолом проявляется лишь при соотношении 1:4, а для более ненасыщенного астаксантина с α-токоферо-лом в соотношении 1:12. Увеличение концентрации каротиноидов приводит к антогониз-му. Включение в систему фосфолипидов увеличивает эффективность антиоксидантного действия даже при высоких концентрациях каротиноидов [1, 6, 8].
Биодоступность
Каротиноиды обладают многими биологическими свойствами, и их высвобождение из пищевой матрицы наиболее важно для усвоения человеком. Усвояемость каротиноидов зависит от пищевых источников. Из свежего (необработанного) растительного сырья в 3 раза большей биодоступностью обладают фрукты и ягоды, чем овощи. Причем биодоступность β-каротина сырой моркови составляет 17–25 %, а шпината – 5–10 %, так как в последнем он находится в связанном состоянии с хлоропластами [1, 17, 18]. Биодоступность каротиноидов оценивается в в следующем порядке: желтый перец > морковь > сладкий картофель > соцветия брокколи. Повышает биодоступность каротиноидов в растительном сы- рье или пищевом рационе присутствие жиров в среднем в 2 раза, термическая и механическая обработка - в 3 раза [19-22].
Измельчение растительного сырья приводит к разрыву клеточных стенок, и с уменьшением размера частиц, например, моркови скорость высвобождения каротиноидов увеличивается [19]. Добавление липидов значительно улучшает биодоступность каротиноидов как из свежих, так и из сушеных овощей [17]. Так, при использовании наноэмульсий из пасты шпината и кукурузного масла биодоступность каротиноидов шпината увеличивается от 3,1 до 19,2 %, возрастая с увеличением в наноэмульсиях количества масла, что объясняют более высокой эффективностью переноса каротиноидов от шпината к каплям жира и смешанным мицеллам в повышении содержания липидов [21]. Эмульсия, приготовленная из вареных томатов и оливкового масла, повышала биодоступность каротиноидов на 10 % по сравнению с эмульсией без термической обработки томатов, а эмульсия из термически обработанных томатов вместе с оливковым маслом - на 23,4 %. Такой эффект объясняют способностью нагретого оливкового масла образовывать смешанные мицеллы в тонком кишечнике, который растворяет каротиноиды; и способностью природных антиоксидантов (фенолов) оливкового масла защищать каротиноиды от окисления [21].
Использование ферментации для разрушения клеточной структуры томатов и усиленное образование смешанных мицелл повысило биодоступность ликопина в томатном соке, увеличиваясь в следующем порядке: неферментированный (8,5 %) < ферментированный (11,4 %) < неферментированный-эмуль-гированный (13,6 %) < ферментированный-эмульгированный (22,7 %) [20].
С другой стороны, импульсные электрические поля и нагрев не привели к изменению биодоступности в-каротина и ликопина томатов, а при комбинировании импульсных электрических полей и нагревающего и импульсного электрических полей биодоступность в-каротина и ликопина в хромопластах только уменьшалась. Снижение биодоступность каротиноидов связывали с модификацией мембран хромопластов и каротиноид-белковых комплеков. Различия во влиянии импульсных электрических полей на биодоступность разных фракций томатов были связаны со сложностью структуры томата [22].
Природные каротиноиды (каротины и ксантофиллы). Растительные источники
Свежие овощи. Основными источниками природных каротиноидов в питании человека являются свежие овощи. Их количество варьирует в широких пределах в зависимости от вида овощей и ботанических сортов. Важными источниками каротиноидов являются: томаты (ликопин), морковь (в-каротин), тыква (в-каротин и лютеин). В табл. 2 представлено содержание основных шести каротиноидов в некоторых овощах.
Морковь является основным источником провитамина А и накапливает высокие уровни в- и а-каротина. При общем содержании каротиноидов 268,64 мг/100 г СВ, количество в-каротина составляет 156,91; а-каротин -108,53 мг/100 г СВ или 58,4 и 40,4 %, соответственно [32]. В зависимости от окраски моркови содержание каротинов изменяется и может составлять, мг/кг СВ,: желтая - 2-6; оранжевая - 98; темно-оранжевая - 160; красная - 73; фиолетово-желтая - 92; фиолетовооранжевая - 40. Существуют желтые и красные разновидности, которые богаты лютеином и ликопином соответственно [24, 33].
В спелых плодах красных томатов в основном накапливается ликопин (около 85 %), хотя различные коммерческие сорта демонстрируют различную окраску и каротиноидные профили [25, 26, 34, 35]. Сумма каротиноидов может колебаться от 24,07 и 261,86 мкг/г СВ, что было установлено при исследовании 20 сортов томатов. В составе каротиноидов преобладал ликопин (всего транс- и цис-изомеров) в диапазоне от 9,61 до 227,11 мкг/г СВ, а количество в-каротина и лютеина составляло, мкг/100 г СВ: 6,89-110,40 2,85-9,23, соответственно [25]. Влияние степени зрелости и окраски томатов на содержание ликопина демо-стрируют исследования корейских ученых, которые установили в томатах черри (Sugar Cherry, Sugar Red) в оптимальной зрелости содержание ликопина 64,4 и 76,7 мг/100 г. В тоже время в зеленых томатах ликопин отсутствовал [26].
Ликопин неравномерно распределяется в плодах томатов, преобладая в кожице, чем в других тканях томатов, особенно в стадии полного созревания. На стадии спелости содержание ликопина в томатах составляло, мкг/100 г: в кожице 2644-7020; в мякоти -1843 и 3302; в семенах - 597-1695. Содержание ликопина в кожице было выше, чем в мя-
Таблица 2
Содержание основных каротиноидов в некоторых овощах, мг/100 г [1–5, 9, 12, 17, 22–32, 35]
С помощью методов генной инженерии постоянно создаются новые сорта томатов. В некоторых сортах и гибридах томатов, выращенных в Канаде, удалось увеличить содержание ликопина до 227,11 мкг/г СВ с преобладанием транс-ликопинов в количестве 218,64 мкг/г СВ. При этом сумма β-каротинов всех транс- и цис-форм снижалась [25]. Сорт томатов «Xantomato» обогащен зеаксантином, количество которого составляет 39 мкг/г (или 577 мкг/г СВ), что доходит до 50 % от общего количества каротиноидов в плодах [34, 35].
Основным каротиноидом тыквы является β-каротин. При суммарном содержании каротиноидов в пределах 2,5–8,6 мг/100 г, на долю
β-каротина приходится от 50 до 80 %, α-ка-ротина – всего около 10 % [37]. В тыкве, выращенной в тропиках, содержание каротиноидов может доходить до 9,3 мг/100 г, а в тыкве Cucurbita moschata Duch, выращенной в Бразилии, до 40 мг/100 г [38–40]. На суммарное содержание каротиноидов тыквы оказывают влияние вид и ботанический сорт, но содержание β-каротина сильно варьирует в зависимости от ботанического сорта, чем от вида. Так, в тыкве Cucurbita maxima сумма каротиноидов колеблется от 0,47 до 7,09 мг/100 г в зависимости от сорта, а в тыкве C. Pepo и C. Moschata различия несущественны. Все они содержат β-каротин, но α-каротин найден только в тыкве C. Moschata, зеаксантин – только в тыкве Cucurbita maxima [28]. Различия между сортами одного вида в суммарном содержании каротиноидов и β-каротина могут доходить до 2,5 раз и более, оказывая существенное влияние на окраску мякоти [37, 39, 40].
Как источник каротиноидов интерес представляют плоды перца, включая сладкие и острые сорта, состав которых сильно отличается от основных овощей, используемых в питании, а также влияет на окраску плодов. Суммарное содержание каротиноидов колеблется от 23,21–34,94 мг/100 г, но максимальное их количество накапливают оранжевые сорта. В красных сортах их количество в 4–5 раз меньше, а в белых – в 10 раз меньше [9]. Каротиноиды красного перца представлены в основном капсантином (70 %) и капсоруби-ном (10 %). β-каротин и β-криптоксантин составляют не более 20 %. В некоторых сортах обнаружен зеаксантин, а лютеин, антераксантина и виолаксантин не обнаружены. В оранжевых сортах перца преобладает зеаксантин с количеством, доходящим до 85 %, затем лютеин (до 16 %), β-каротин, β-криптоксантин, антероксантин не превышают 1–2 % каждый, а капсантин и капсорубин не обнаружены. В белых сортах перца преобладает лютеин до 70 %, хотя общее содержание каротиноидов в них всего составляет 11,38–29,7 мг/100 г СВ. Остальные каротиноиды, характерные для плодов перца, присутствуют, за исключением капсантина и капсорубина. В белом болгарском перце также преобладает лютеин, но с меньшей долей – 44,6 %, у белого перца сорта Хабанеро – 48,3 % [9, 17, 35].
В капустных и листовых овощах суммарное содержание каротиноидов невелико – от 41 мкг/г СВ в цветной капусте до 215 в брокколи с преобладанием ксантофиллов, из которых идентифицированы не только лютеин, зеаксантин и β-криптоксантин (см. табл. 2), но и виолаксантин, неоксантин и антаксантин [31]. Преобладает лютеин, например, в брокколи его количество может составлять от 25 до 50 % общего количества каротиноидов [17, 31]. Но больше, чем капустные, каротиноидов содержат шпинат, руккола и кресс-салат также с преобладанием лютеина до 50 % и в целом ксантофиллов до 75 % [12, 31, 38, 41, 43]. В руколе содержится неоксантин и виолак-сантин – 1,81 и 1,47 мг/100 г, соответственно, а в кресс-салате – 1,77 и 2,61, соответственно [12]. В шпинате суммарное количество каротиноидов может составлять 7,6–12,5 мг/100 г, из которых на долю ксантофиллов может приходиться 75 %. В составе ксантофиллов идентифицированы: лютеин > виолаксантин ≥ неоксантин [29].
Из клубнеплодов источником каротиноидов могут быть только сорта батата с оранжевой мякотью с суммарным количеством каротиноидов 25,94 мг/100 г СВ [17]. Сорта батата с оранжевой мякотью могут содержать β-ка-ротина от 0,37 до 6,7 мг/100 г, после варки в них остается от 22 до 78 %. Ликопин в них при варке разрушается в большей степени и его может сохраниться от 4 до 62 %. Причем в сыром батате его содержание меньше, чем β-каротина, и составляет от 0,04 до 0,31 мг/100 г. β-криптоксантин обнаружен только в некоторых сорта батата в количестве 0,013–0,037 мг/100 г, который почти полностью разрушается при варке [42]. В картофеле каротиноидов очень мало, найдены в основном ксантофиллы, а β-каротин отсутствует или находится в количестве до 0,65 мкг/г СВ. При термической обработке картофеля (варке или запекании) каротиноиды почти полностью разрушаются. Наиболее термостабилен лютеин [43].
Плоды и ягоды. Суммарное содержание каротиноидов в плодах значительно ниже, чем в овощах, составляя 0,02–6,2 мг/100 г, но зато они обладают лучшей биодоступностью [11, 12, 27, 28, 38] и могут стать в питании источниками прежде всего β-каротина и лютеина (табл. 3).
Часто оранжевая окраска плодов свидетельствует о преобладании β-каротина, например, в абрикосах, манго, мандаринах [12, 28, 38]. Так, в абрикосах содержание β-ка-ротина составляет от 1,44 до 39,07 мкг/г, а лютеина и зеаксантина не превышает 0,5 мкг/100 г, α-каротин и антероксантин не обнаружены [28]. Но окраска плодов с высоким содержанием β-каротина может маскироваться антоцианами, как в плодах вишни, боярышника и рябины [1, 5, 27] или хлорофиллом, как в зеленых яблоках, манго [11]. Так, в яблоках сумма каротиноидов составляет 29,48–49,17 мкг/г СВ, которые преимущественно сосредоточены в кожуре, и практически не зависят от их окраски. В зеленых яблоках содержание β-каротина и лютеина может быть такое же, как в красных или больше до 10 раз. В составе каротиноидов обнаружены лютеин, виолаксантин, неоксантин, β-каротин и этерифицированные каротиноиды (в основном виолаксантин и неоксантин). В желтых и красных яблоках количественно преобладают транс-неоксантин и транс-виолаксантин, в
Таблица 3
Содержание основных каротиноидов в некоторых плодах, мг/100 г [1, 2, 3, 5, 11, 12, 28, 38, 44]
Из субтропических плодов состав каротиноидов наиболее изучен в апельсинах. Содержание каротиноидов в мякоти апельсин может колебаться от 0,8 до 2,4 мг/100 г, а в мякоти красных апельсин – 2,8 мг/100 г. У большинства сортов каротиноидный профиль характеризуется преобладанием 5,6-эпоксикаротиноидов (виолаксантин и антераксантин геометрические изомеры), за которыми следуют 5,8-эпоксикаротиноиды (лютеоксантин и мутатоксантин), β-криптоксантин, зеинок- сантин (моногидроксикаротиноиды), зеаксан-тин, лютеин (дигидроксикаротиноиды) и α- и β-каротины). В целом мякоть оранжевых апельсин характеризуется преобладанием ксантофиллов (82,7–93,0 %), за исключением красных апельсин, с более высокой долей каротинов (около 70,0 %). β-криптоксантин был преобладающим каротиноидом в апельсинах рода Лате и Амберсвите [44].
Из тропических фруктов много каротиноидов в манго – 3,8 мг/100 г с преобладанием β-картина, в папайе – с преобладанием ликопина [12, 38].
Из ягод с высоким содержанием суммарных каротиноидов можно выделить облепиху (до 15 мг/100 г), шиповник (до 30 мг/100 г), морошку (до 3 мг/100 г) с преобладанием каротинов (табл. 4) [47, 48, 50, 51].
Общее содержание каротиноидов в облепихе сильно варьирует от ботанического сорта и места произрастания и может находиться в диапазоне от 53 до 97 мг/100 г СВ. Большинство каротиноидов находятся в связанном состоянии в виде диэфиров (около 50 %) и моноэфиров (около 17 %). Свободные каротины представлены: транс-β-каротин > цис-β-каротин [46, 47].
Вариации содержания каротиноидов в шиповнике зависят от экотипа и условий выращивания. Наибольшая общая сумма каротиноидов (1590,4 мкг/ г СВ) были обнаружены в конце сезона сбора урожая в гибриде R. dumalis, а самые низкие количества – у видов R. spinosissima (684,5 мкг/ г СВ) [49]. В составе каротиноидов преобладают каротины, из которых наиболее высокая доля приходится на β-каротин и ликопин, но обнаружены также γ- и ζ-формы каротина. Содержание ксантофиллов порядка 10-ти раз меньше, чем ка- ротинов. Ксантофиллы представлены нексан-тином, зеаксантином, лютеином, виолаксан-тином и рубиксантином с преобладанием последнего (около 70 %) [48, 49].
В дикорастущих северных ягодах содержание каротиноидов незначительно. Среди них выделяется морошка с общим содержанием каротиноидов 2,84 мг/100 г СВ с выраженным преобладанием β-каротина (83 %), количество которого доходит до 2,32 мг/100 г СВ. Зеаксан-тина содержится в 5 раз меньше, а количество остальных идентифицированных каротиноидов (лютеин, неоксантин, виолаксантин, анте-роксантин) не превышает 0,05 мг/100 г. В чернике общее содержание каротиноидов 2,14 мг 100 /г СВ с преобладанием лютеина около 70 %. Клюква болотная и брусника содержат только 0,2 и 0,14 мг/100 г каротиноидов, но в бруснике преобладает лютеин (38 %), в клюкве – β-каротин (40 %) [50, 51].
В остальных ягодах самый высокий уровень каротиноидов был у ежевики, а у клубники самое низкое содержание каротиноидов. По данным [13] ежевика имела самое высокое содержание β-каротина (101,4 мкг/100 г), за ней следовала черная смородина (61,6 мкг/100 г).
Таблица 4
Содержание основных каротиноидов в некоторых ягодах, мг/100 г [1, 2, 13, 38, 45, 48–51]
|
Плоды |
Каротины |
Ксантофиллы |
||||
|
β-каротин |
α-каротин |
ликопин |
лютеин |
зеаксантин |
β-крипто-ксантин |
|
|
Н |
астоящие ягоды |
|||||
|
Облепиха |
5,69–9,67 |
– |
3–5 |
0,8 |
5 |
0,2 |
|
Красная смородина |
0,013 |
– |
– |
0,028 |
0,0038 |
– |
|
Черная смородина |
0,062 |
– |
– |
0,21 |
0,0057 |
– |
|
Виноград |
0,603 |
0,005 |
0,012 |
0,013 |
||
|
Черника |
0,049–0,36 |
0,23–1,5 |
0,014–0,02 |
0,005 |
||
|
Брусника |
0,027 |
– |
– |
0,076 |
0,009 |
– |
|
Клюква болотная |
0,056 |
– |
– |
0,048 |
0,031 |
– |
|
Сложные ягоды |
||||||
|
Морошка |
2,3 |
– |
– |
0,05 |
0,41 |
– |
|
Ежевика |
0,1–1,0 |
0,009 |
– |
0,27 |
0,03 |
0,03–0,3 |
|
Малина |
0,009 |
0,024 |
– |
0,32 |
0,011 |
0,006 |
|
Ложные ягоды |
||||||
|
Клубника |
0,0049 |
– |
– |
0,021 |
н/о |
– |
|
Шиповник |
2,0–5,9 |
– |
16,3 |
0,1–0,7 |
0,3–2,7 |
0,06–1,2 |
Наибольшее количество α-каротина было в малине (23,7 мкг/100 г). Лютеин присутствовал в малине в более высоких количествах (317,0 мкг/100 г), а затем в ежевике (270,1 мкг/100 г). Самый высокий уровень зеаксантина был обнаружен в ежевике (29,0 мкг/100 г), за которой следует черника (14,0 мкг/100 г). Ежевика имела самое высокое значение β-крипто-ксантина (30,1 мкг/100 г).
Заключение
В последние годы международным научным сообществом опубликован ряд исследований о суммарном содержании каротиноидов и их составе в свежих овощах, плодах и ягодах, биологической активности, антиокси- дантных свойствах и факторах, способствующих повышению биодоступности. Методами генной инженерии создаются новые сорта томатов с повышенным содержанием трансликопина и зеаксантина.
Основными источниками картиноидов в питании человека являются свежие овощи: морковь, плодовые (томаты, тыква, перец) и салатно-шпинатные овощи (шпинат, рукола, кресс-салат) не смотря на низкую биодоступность. Плоды и ягоды, уступая овощам в суммарном содержании каротиноидов, обладая более высокой биодоступностью, являются источниками преимущественно каротинов с провитаминной активностью.
Список литературы Каротиноиды в растительных пищевых системах
- Дадали В.А., Каротиноиды: биодоступность, биотрансформация, антиоксидантные свойства / В.А. Дадали, В.А. Тутельян, Ю.В. Дадали, Л.В. Кравченко // Вопросы питания. – 2010. – Т. 79, № 2. – С. 4–18.
- Дейнека, В.И. Каротиноиды: строение, биологические функции и перспективы применения / В.И. Дейнеко, А.А. Шапошников, Л.А. Дейнеко и др. // Научные ведомости. – 2008. – № 6. – С. 19–25.
- Saini, R. K. Carotenoids from fruits and vegetables: Chemistry, analysis, occurrence, bioavail-ability and biological activities / R. K. Saini, Sh. H. Nile, S. Park // Food Research International. – 2015. – № 76. – Р. 735–750. http://dx.doi.org/10.1016/j.foodres.2015.07.047
- Fernández-García, E. Carotenoids bioavailability from foods: From plant pigments to efficient biological activities / E. Fernández-García, I. Carvajal-Lérida, M.l Jarén-Galán, Ju. Garrido-Fernández, A. Pérez-Gálvez, D. Hornero-Méndez // Food Research International. – 2012. – № 46. – Р. 438–450. DOI: 10.1016/j.foodres.2011.06.007
- Britton, G. Carotenoids in food. / G. Britton, F. Khachik // Carotenoids. Nutrition and health. – 2009. – V. 5. – Р. 45–66.
- Завьялова, А.Н. Физиологическая роль природных каротиноидов / А.Н. Завьялова, А.В. Суржик // Вопросы современной педиатрии. – 2008. – Т. 7, № 6. – С. 145–149.
- Кричковская, Л.В. Природные антиоксиданты (биотехнологические, биологические и медицинские аспекты): монография / Л.В. Кричковская, Г.В. Донченко, С.И. Чернышов и др. – Харьков: ОАО «Модель Вселенной», 2001. – 376 с.
- Дадали, В.А. Каротиноиды. Биологическая активность / В.А. Дадали, В.А. Тутельян, Ю.В. Дадали, Л.В. Кравченко // Вопросы питания, 2011. – Т. 80, № 4. – С. 4–17.
- Hassan, N.M. Carotenoids of Capsicum fruits: pigment profile and health-promoting functional attributes / N.M. Hassan, N.A. Yusof, A.F. Yahaya, N.N. Mohd Rozali, R. Othman // Antioxidants (Basel). – 2019. – № 8. – Р. 469. DOI: 10.3390/antiox8100469
- Frede, K. Light quality-induced changes of carotenoid composition in pak choi Brassica rapa ssp. chinensis/ K. Fredea, M. Schreinera, S. Baldermanna // Journal of Photochemistry & Photobiolo-gy, B: Biology. – 2019. – № 193. – Р. 18–30. https://doi.org/10.1016/j.jphotobiol. 2019.02.001
- Delgado-Pelayo, R. Chlorophyll and carotenoid pigments in the peel and flesh of commercial apple fruit varieties / R. Delgado-Pelayo, L. Gallardo-Guerrero, D. Hornero-Méndez // Food Research International. – 2014. – № 65. – Р. 272–281. http://dx.doi.org/10.1016/j.foodres.2014.03.025
- Vargas-Murga, L. Fruits and vegetables in the Brazilian Household Budget Survey (2008–2009): carotenoid content and assessment of individual carotenoid intake / L. Vargas-Murgaa, V.V. de Rosso, A. Z. Mercadante, B. Olmedilla-Alonso // Journal of Food Composition and Analysis. – 2016. – № 50. – Р. 88–96. http://dx.doi.org/10.1016/j.jfca.2016.05.012
- Marinova, D. HPLC determination of carotenoids in Bulgarian berries / D. Marinova, F. Ribarova // Journal of Food Composition and Analysis. – 2007. – № 20. – Р. 370–374. DOI: 10.1016/j.jfca.2006.09.007
- Schulz, H. Carotenoid Bioavailability from the Food Matrix: Toward Efficient Extraction Procedures / H. Schulz // In book: Carotenoids: Nutrition, Analysis, and Technology Chapter: Carote-noid bioavailability from the food matrix: toward efficient extraction procedures. – 2016. – Р. 191–216. DOI: 10.1002/9781118622223.ch11
- Поляков, Н.Э. Некоторые аспекты реакционной способности каротиноидов. Окисли-тельно-восстановительные процессы и комплексообразование / Н.Э. Поляков, Т.В. Лешина // Успехи химии, 2006. – Т. 75, № 12. – С. 1175–1192.
- Gao, Yu. The effect of polarity of environment on the antioxidant activity of carotenoids / Yu. Gao, A.L. Focsan, L.D. Kispert // Chemical Physics Letters. – 2020 – № 761. – 138098. https://doi.org/10.1016/j.cplett.2020.138098
- Zhang, Zh. Microstructure and bioaccessibility of different carotenoid species as affected by hot air drying: Study on carrot, sweet potato, yellow bell pepper and broccoli / Zh. Zhang, Qi. Wei, M. Nie, N. Jiang, Ch. Liu, Ch. Liu, D. Li, L. Xu // LWT – Food Science and Technology. – 2018. – № 96. – Р. 357–363. https://doi.org/10.1016/j.lwt.2018.05.061
- Feng, L. Effect of particle size distribution on the carotenoids release, physicochemical prop-erties and 3D printing characteristics of carrot pulp / L. Feng, Ji. Wu, Ji. Song, D. Li, Zh. Zhang, Ya. Xu, R. Yang, Ch. Liu, M. Zhang // LWT – Food Science and Technology. – 2021. – № 139. – 110576. https://doi.org/10.1016/j.lwt.2020.110576
- Yao, K. In vitro and in vivo study of the enhancement of carotenoid bioavailability in vegeta-bles using excipient nanoemulsions: Impact of lipid content / K. Yao, D. Ju. McClements, Ch. Yan, Jie Xiao, H. Liu, Zh. Chen, X. Hou, Yo. Cao, H. Xiao, X. Liu // Food Research International. – 2021. – № 141. – 110162. https://doi.org/10.1016/j.foodres.2021.110162
- Lu, Yu. Fermentation of tomato juice improves in vitro bioaccessibility of lycopene / Yu. Lu, K. Mu, D. Ju. McClements, X. Liang, Xu. Liu, F. Liu // Journal of Functional Foods. – 2020. – № 71. – 104020. https://doi.org/10.1016/j.jff.2020.104020
- Li, Q. Potential physicochemical basis of Mediterranean diet effect: Ability of emulsified ol-ive oil to increase carotenoid bioaccessibility in raw and cooked tomatoes / Q. Li, T. Li, Ch. Liu, Ju. Chen, R. Zhang, Z. Zhang, T. Dai, D. Ju. McClements // Food Research International. – 2016. –№ 89. – Р. 320–329. http://dx.doi.org/10.1016/j.foodres.2016.08.014
- Bot, F. The effect of pulsed electric fields on carotenoids bioaccessibility: The role of tomato matrix / F. Bot, R. Verkerk, H. Mastwijk, M. Anese, V. Fogliano, E. Capuano // Food Chemistry. – 2018. – № 240. – Р. 415–421. http://dx.doi.org/10.1016/j.foodchem.2017.07.102
- Arscott, S.A. Carrots of Many Colors Provide Basic Nutrition and Bioavailable Phytochemicals Acting as a Functional Food / S.A. Arscott, S.A. Tanumihardjo // Comprehensive reviews in food sci-ence and food safety, 2010. – V. 9. – Р. 223–239. DOI: 10.1111/j.1541-4337.2009.00103.x
- Pace, B. Evaluation of quality, phenolic and carotenoid composition of fresh-cut purple Polignano carrots stored in modified atmosphere / B. Pace, I. Capotortoa, M. Cefola, P. Minasi, N. Montemurro, V. Carbone // Journal of Food Composition and Analysis. – 2020. – № 86. – 103363. https://doi.org/10.1016/j.jfca.2019.103363
- Li, H. Ultra-performance liquid chromatographic separation of geometric isomers of carote-noids and antioxidant activities of 20 tomato cultivars and breeding lines / H. Li, Z. Deng, R. Liu, S. Loewen, R. Tsao // Food Chemistry. – 2012. – № 132. – Р. 508–517. doi:10.1016/j.foodchem. 2011.10.017
- Choi, S. H. Protein, free amino acid, phenolic, β-carotene, and lycopene content, and antioxidative and cancer cell inhibitory effects of 12 greenhouse-grown commercial cherry tomato varieties / S. H. Choi, D.-S. Kim, N. Kozukue, H.-Je. Kim, Yo. Nishitani, M. Mizuno, C. E. Levin, M. Friedman // Journal of Food Composition and Analysis. – 2014. – № 34. – Р. 115–127. http://dx.doi.org/10.1016/j.jfca.2014.03.005
- Delia, B. Rodriguez-Amaya. A guide to carotenoid analysis in foods: Doctoral Thesis / B. De-lia Brasil, 2001. – 64 р.
- Kurz, Ch. HPLC-DAD-MSn characterisation of carotenoids from apricots and pumpkins for the evaluation of fruit product authenticity / Ch. Kurz, R. Carle, A. Schieber // Food Chemistry. – 2008. – № 110. – Р. 522–530. doi:10.1016/j.foodchem.2008.02.022
- Bunea, A. Total and individual carotenoids and phenolic acids content in fresh, refrigerated and processed spinach (Spinacia oleracea L.) / A. Bunea, M. Andjelkovic, C. Socaciu, O. Bobis, M. Neacsu, R. Verher, Jo. V. Camp // Food Chemistry. – 2008. – № 108. – Р. 649–656. DOI: 10.1016/j.foodchem.2007.11.056
- Zhang, W. High pressure homogenization versus ultrasound treatment of tomato juice: Ef-fects on stability and in vitro bioaccessibility of carotenoids / W. Zhang, Yi. Yu, F. Xie, X. Gu, Ji. Wu, Zh. Wang // LWT – Food Science and Technology. – 2019. – № 116. – 108597. https://doi.org/10.1016/j.lwt.2019.108597
- Lee, Hu. W. Simultaneous determination of carotenoids, tocopherols and phylloquinone in 12 Brassicaceae vegetables / Hu. W. Lee, Hu. Zhang, Xu Liang, Ch. N. Ong // LWT – Food Science and Technology. – 2020. – № 130. – 109649. https://doi.org/10.1016/j.lwt.2020.109649
- Wang, Y.H., Transcript profiling of genes involved in carotenoid biosynthesis among three carrot cultivars with various taproot colors / Y.H. Wang, T. Li, R.R. Zhang, A. Khadr, Y.S. Tian, Z.S. Xu, A.S. Xiong // Protoplasma. – 2020. – № 257. – Р. 949–963 . DOI: 10.1007/s00709-020-01482-4
- Gajewski, M. Some aspects of nutritive and biological value of carrot cultivars with orange, yellow, and purple colored roots / M. Gajewski, P. Szymczak, K. Elkner, A. Dabrowska, A. Kret, Danilcenko H. // Veg Crop Res Bull. – 2007. – № 61. – Р. 67–149.
- Karniel, U., Development of zeaxanthin-rich tomato fruit through genetic manipulations of carotenoid biosynthesis / U. Karniel, A. Koch, D. Zamir, J. Hirschberg // Plant Biotechnol J. –2020. – № 18. – Р. 2292–2303. DOI: 10.1111/pbi.13387
- Hermanns, A. S. Carotenoid Pigment Accumulation in Horticultural Plants / A. S. Hermanns, X. Zhou, Q. Xu, Ya. Tadmor, L. Li // Horticultural Plant Journal. – 2020. – № 6 (6). – Р. 343–360. https://doi.org/10.1016/j.hpj.2020.10.002
- Georgiadou, E. C. Tissue-specific elucidation of lycopene metabolism in commercial tomato fruit cultivars during ripening / E. C. Georgiadou, Ch. Antoniou, I. Majak, V. Goulas, P. Filippou, B. Smolińska, Jo. Leszczyńska, V. Fotopoulos // Scientia Horticulturae. – 2021. – № 284. – 110144. https://doi.org/10.1016/j.scienta.2021.110144
- Quijano-Ortega, N. FTIR-ATR Spectroscopy Combined with Multivariate Regression Modeling as a Preliminary Approach for Carotenoids Determination in Cucurbita spp. / N. Quijano-Ortega, C.A. Fuenmayor, C. Zuluaga-Dominguez, C. Diaz-Moreno, S. Ortiz-Grisales, M. García-Mahecha, S. Grassi // Appl. Sci. – 2020. – № 10. – Р. 3722–3732. DOI:10.3390/app10113722
- Ellong,. E. N. Polyphenols, Carotenoids, Vitamin C Content in Tropical Fruits and Vegetables and Impact of Processing Methods / E. N. Ellong, C. Billard, S. Adenet, K. Rochefort // Food and Nutrition Sciences. – 2015. – № 6. – Р. 299–313. http://dx.doi.org/10.4236/fns.2015.63030
- Нилова, Л.П. Влияние режимов сушки на содержание каротиноидов в тыквенных полуфабрикатах / Л.П. Нилова, С.М. Малютенкова // XXI век: итоги прошлого и проблемы на-стоящего плюс. – 2021. – Т. 10, № 3 (55). – С. 125–128. DOI: 10.46548/21vek-2021-1055-0024
- de Carvalho, L.M.Ja. Total carotenoid content, α-carotene and β-carotene, of landrace pumpkins (Cucurbita moschata Duch): A preliminary study / L.M.Ja. de Carvalho, P.B. Gomes, R.L. de Oliveira Godoy, S. Pacheco, P.H.F. do Monte, J.L.V. de Carvalho, M.R. Nutti, A.C.L. Neves, A.C.R. Vieira, S.R.R. Ramos // Food Research International. – 2012. – № 47. – Р. 337–340. DOI: 10.1016/j.foodres.2011.07.040
- Raju, M. Carotenoid composition and vitamin A activity of medicinally important green leafy vegetables / M. Raju, S. Varakumar, R. Lakshminarayana, Th.P. Krishnakantha, V. Baskaran // Food Chemistry. – 2007. – № 101. – Р. 1598–1605. doi:10.1016/j.foodchem.2006.04.015
- Alam, M. Kh. Minerals, vitamin C, and effect of thermal processing on carotenoids composi-tion in nine varieties orange-fleshed sweet potato (Ipomoea batatas L.) / M.Kh. Alam, S. Samsa, Z.H. Rana, M. Akhtaruzzaman, Sh.N. Islam // Journal of Food Composition and Analysis. – 2020. – № 92. – 103582. https://doi.org/10.1016/j.jfca.2020.103582
- Kotíková, Z. Carotenoid profile and retention in yellow-, purple- and red-fleshed potatoes af-ter thermal processing / Z. Kotíková, M. Šulc, Ja. Lachman, V. Pivec, M. Orsák, K. Hamouz // Food Chemistry. – 2016. – № 197. – Р. 992–1001. http://dx.doi.org/10.1016/j.foodchem.2015.11.072
- Stinco, C. M. Multivariate analyses of a wide selection of orange varieties based on carote-noid contents, color and in vitro antioxidant capacity / C. M. Stinco, M. L. Escudero-Gilete, F. J. Heredia, I. M. Vicario, A. J. Meléndez-Martínez // Food Research International. – 2016. – № 90. – Р. 194–204. http://dx.doi.org/10.1016/j.foodres.2016.11.005
- Abliz, A. Effect of dynamic high pressure microfluidization treatment on physical stability, microstructure and carotenoids release of sea buckthorn juice / A. Abliz, Ji. Liu, L. Mao, F. Yuan, Ya. Gao // LWT – Food Science and Technology. – 2021. – №135. – 110277. https://doi.org/10.1016/ j.lwt.2020.110277
- Pop, R. M. Carotenoid composition of berries and leaves from six Romanian sea buckthorn (Hippophae rhamnoides L.) varieties / R.M. Pop, Ya. Weesepoel, C. Socaciu, A. Pintea, Je.-P. Vincken, H. Gruppen // Food Chemistry. – 2014. – № 147. – Р. 1–9. http://dx.doi.org/10.1016/j.food-chem.2013.09.083
- Нилова, Л.П. Антиоксидантные профили облепихи крушиновидной (Hippophaë rhamnoides L.) северо-запада России / Л.П. Нилова, С.М. Малютенкова // Вестник ВГУИТ. – 2021. – Т. 83, № 1. – С. 108–114. http://doi.org/10.20914/2310-1202-2021-1-108-114
- Al-Yafeai, A. Characterization of carotenoids and vitamin E in R. rugosa and R. canina: Comparative analysis / A. Al-Yafeai, A. Malarski, V. Böhm // Food Chemistry. – 2018. – № 242. – Р. 435–442. http://dx.doi.org/10.1016/j.foodchem.2017.09.070
- Andersson, S. C. Carotenoid content and composition in rose hips (Rosa spp.) during ripen-ing,determination of suitable maturity marker and implications for health promoting food products / S. C. Andersson, K. Rumpunen, E. Johansson, M. E. Olsson // Food Chemistry. – 2011. – № 128. – Р. 689–696. doi:10.1016/j.foodchem.2011.03.08
- Головко, Т.К. Содержание и состав желтых пигментов в плодах морошки и черники в условиях среднетаежной зоны европейской части России / Т.К. Головко, О.В. Дымова, Е.А. Лашманова, О.А. Кузиванова // Известия Самарского научного центра Российской академии наук, 2011. – Т. 13. № 1(4). – С. 813–816.
- Lashmanova, K.A. Northern berries as a source of carotenoids / K.A. Lashmanova, O.A. Kuzivanova, O.V. Dymova // Acta Biochimica Polonica. – 2012. – V. 59, № 1. – P. 133–134.


