Картирование эпитопа на белке Erbb-2, узнаваемого моноклональным антителом 4b8, с помощью технологии фагового дисплея
Автор: Боргоякова М.Б., Ильичев А.А.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 4 (58), 2013 года.
Бесплатный доступ
Представлены результаты идентификации и локализации эпитопа в составе белка Erbb-2, с которым связывается моноклональное антитело 4b8, предназначенное для использования при проведении иммуногистохимического анализа с целью оценки уровня продукции белка Erbb-2. Эпитоп был идентифицирован с помощью биопеннинга фаговой пептидной библиотеки на основе нитчатого фага, его локализация выявлена с помощью программы ClustalW, анализ специфичности произведен с помощью иммуноферментного анализа. Полученный эпитоп также оказался схож с последовательностью, расположенной в тирозинкиназном домене рецептора, что говорит о возможном взаимодействии данного участка с МКА 4b8.
Фаговый дисплей, картирование эпитопа
Короткий адрес: https://sciup.org/14056349
IDR: 14056349 | УДК: 616-006.66:557-29
Текст научной статьи Картирование эпитопа на белке Erbb-2, узнаваемого моноклональным антителом 4b8, с помощью технологии фагового дисплея
Белок ЕrbB-2 (НЕR-2, neu, p185) – член семейства тирозинкиназных рецепторов эпидермального фактора роста (ЭФР), которое включает ещё 3 рецептора (EGFR, ErbB-3 и -4) [5]. Они обладают сходной структурой, имеют общие лиганды и играют большую роль в процессах развития и дифференцировки тканей эпителиального, мезенхимального и нейрального происхождения [3]. Неактивные тирозинкиназные рецепторы ЭФР находятся в «закрытом» состоянии, после связывания с лигандом их конформация меняется, они димеризуются и в результате аутофосфорилирования запускают каскад реакций митогенного характера. ErbB-2 отличается от остальных членов семейства отсутствием необходимости в лиганде и, соответственно, находится в постоянно «открытой» конформации [4, 7].
За счёт спонтанной полисомии 17-й хромосомы или амплификации гена, кодирующего белок ErbB-2, происходит гиперпродукция последнего, что приводит к его спонтанной активации. Запускаемый неконтролируемый каскад реакций вызывает гиперплазию ткани с последующей ма-лигнизацией [1, 11].
Для эффективного иммунотерапевтического лечения рака молочной железы (РМЖ) необходимо предварительно оценить уровень продукции белка HER-2 (HER-2 статус) в каждом конкретном случае, так как принято считать, что гиперпродукция этого рецептора связана с более агрессивным течением заболевания. С этой целью в первую очередь проводят дешёвый иммуногистохимический анализ (ИГХ) опухолевой ткани с использованием поли- или моноклональных антител. Поскольку оценка зависит от выбранного антитела, метода фиксации и приготовления срезов, а также способа интерпретации полученной информации, результат получается довольно грубым [10]. В случае, когда ИГХ анализ не позволяет с достаточной точностью оценить HER-2-статус пациента, исследуют уровень амплификации гена c-Еrb-2 с помощью флуоресцентной гибридизации in situ . Соответственно полученной информации о наличии гиперпродукции белка ErbB-2 назначают определённые схемы терапии. Этот подход является более точным, но и более дорогостоящим и трудоёмким [9].
Как было указано выше, первичная оценка HER-2-статуса производится с использованием различных антител. Исследуемое моноклональное антитело (МКАТ) 4B8, используемое для ИГХ, связывается с N-концом белка ErbB-2. Технология фагового дисплея в настоящее время является наиболее простым подходом к изучению белок-белковых взаимодействий, в том числе взаимодействия антиген-антитело. Нитчатые бактериофаги не имеют тропности к тканям млекопитающих, поэтому взаимодействие мишени с фагами из комбинаторной библиотеки обеспечивается исключительно за счет пептидных встроек. Последовательность такой встройки легко определить секвенированием, поскольку у нитчатых фагов существует прямая физическая связь между генотипом и фенотипом.
Целью исследования являлись картирование эпитопа, к которому специфично моноклональное антитело 4B8, с помощью биопеннинга фаговой пептидной библиотеки и проверка специфичности связывания отобранных мимотопов в ИФА.
Материал и методы
Антитела. Моноклональные антитела производства фирмы Abnova, использованные в данной работе, были получены с помощью гибридомной технологии. Клон 4B8 был отобран после иммунизации мышей синтетическим пептидом, яв- ляющимся полным гомологом участка 22-122 а.о. человеческого ErbB-2. Для ИФА использовались анти-М13 антитела, конъюгированные с пероксидазой хрена (GE Healthcare).
Фаговая пептидная библиотека. В работе использовали штамм Escherichia coli ER2738 и фаговую пептидную библиотеку Ph.D.-7TM фирмы New England Biolabs, Inc. 7-мерная фаговая пептидная библиотека содержит все возможные варианты последовательностей пептидов, экспонированных на поверхности бактериофагов в составе минорного белка pIII. Каждый клон в библиотеке представлен ~1000 копий.
Среды и растворы. Использовали следующие среды: LB, 1,5 % агар, 0,6 % агар (на основе LB). Растворы: IPTG/Xgal, тетрациклина (методики приготовления описаны в инструкции к набору библиотеки), преципитирующий (20 % ПЭГ-6000, 2,5 М NaCl). Буферы: блокирующий (0,1 М NaH-CO3, pH 8,6, 0,5 % БСА, 0,02 % NaN3), TBS (50 мМ Трис-HCl, pH 7,5, 150 мМ NaCl), йодный (10 мМ Трис-HCl, pH 8,0, 1 мМ ЭДТА, 4 М NaI).
Аффинная селекция пептидов, специфически взаимодействующих с МКАТ 4B8, проводилась по схеме, указанной в инструкции, с модификациями. Для проведения всех трёх раундов селекции в лунки иммунологических планшетов вносили по 100 мкл раствора МКА 4B8 в концентрации 29 мкг/ мл в 0,1 М NaHCO3 (pH 8,6) и продолжали сорбцию в течение ночи при 4°С. Для первого раунда использовали 10 лунок, для второго и третьего – по 1 лунке. Тщательно удалив раствор антитела из лунок, в них вносили блокирующий буфер для предотвращения неспецифической сорбции фагов на пластик, инкубировали в течение 1 ч при 4°С. Затем проводили шестикратную отмывку в TBS, содержащем 0,1 % Твин-20 (для 2-го и 3-го раундов использовался 0,5 % Твин-20), и добавляли в лунки по 100 мкл разведённой в TBST фаговой пептидной библиотеки (~1011 БОЕ/мл). Инкубировали библиотеку в течение часа при комнатной температуре. Несвязавшиеся фаги удаляли, десятикратно промывая лунки TBS+Твин, а связавшиеся фаги элюировали по следующей методике: добавляли в каждую лунку по 100 мкл 0,2 М глицинового буфера с HCl (pH 2,2), 0,1 % БСА, через 10 мин нейтрализовали буфер 15 мкл 1 М Трис-HCl (pH 9,1). Для увеличения количества фагов элюат амплифицировали в 20 мл разведённой 1:100
ErbE-2 1-60 immunogen 10 12 11 15 21 01 29 23 27 19 09 33 17
HE LAAL CRUGL L LAL L P P GAASTQVCTGTDHKLRL PAS PETHLDHLRHLYQ GC QWQ GNL ---------------------STQVCTGTDHKLRLPAS PETHLDHLRHLYQ GC QWQ GNL ---------------------------TTDHKLR-------------------------- ---------------------------TTDTKLR-------------------------- ---------------------------ITDTKLR-------------------------- ---------------------------ATDSKLR-------------------------- ---------------------------YFDGKLR-------------------------- ---------------------------YLDHKVR-------------------------- ---------------------------GLDLKLR-------------------------- ---------------------------VQDPKLR-------------------------- ---------------------------HHDAKLR-------------------------- ---------------------------IADFKLR-------------------------- ---------------------------SPDAKHR-------------------------- ---------------------------TTDVKKR-------------------------- ---------------------------ITDYKHR--------------------------
Рис. 1. Часть выравнивания белка ErbB-2, иммуногена для наработки 4B8 и пептидов, отобранных в нашем исследовании с помощью фагового дисплея. Выравнивание осуществлялось на базе программы ClustalW ночной культуры ER2738 в течение 4,5 ч на термошейкере при 37°С. Амплифицированный элюат очищали и использовали для следующего раунда. Элюат третьего раунда не амплифицировали. Для изоляции отдельных фагов его титровали на чувствительной культуре и переносили индивидуальные негативные колонии фаговых клонов в пробирки с 1 мл среды LB, содержащей разведенную 1:100 ночную культуру ER2738. Проводили раздельную амплификацию фаговых клонов в течение 4,5 ч на термошейкере при 37°С. Дважды центрифугировали и переносили по 500 мкл супернатанта в новые пробирки. Очищали фаговую ДНК с использованием йодного буфера.
Таблица
|
№ клона |
Последовательность |
Количество клонов |
|
01 |
YLDMKVR |
1 |
|
09 |
SPDAKMR |
1 |
|
10 |
TTDMKLR |
1 |
|
11 |
ITDTKLR |
1 |
|
12 |
TTDTKLR |
1 |
|
15 |
ATDSKLR |
1 |
|
17 |
SVDWKLR |
7 |
|
19 |
IADFKLR |
1 |
|
21 |
YFDGKLR |
12 |
|
23 |
VQDPKLR |
1 |
|
27 |
HMDAKLR |
1 |
|
29 |
GLDLKLR |
1 |
|
33 |
TTDVKMR |
1 |
Секвенирование ДНК потомков одного фагового клона для определения последовательностей встроек проводили на автоматическом капиллярном секвенаторе в ЦКП СО РАН «Геномика». Обработка результатов секвенирования производилась в программах Seaview, ClustalW.
Иммуноферментный анализ для оценки специфичности связывания отобранных фагов с иммобилизованным МКА 4B8 был выполнен на 96-луночных планшетах, лунки которых были покрыты антигеном в концентрации 2 мкг/мл после ночной инкубации при 4°С (для разведения использовался 0,1М NaHCO3, pH 8,6). После инкубации с блокирующим буфером для уменьшения возможности неспецифического связывания и 6-кратной отмывки в TBST в лунки были добавлены фаговые клоны в концентрации 1010 БОЕ/мл, инкубация проводилась 1 ч при комнатной температуре. После отмывки были добавлены конъюгированные с пероксидазой анти-М13 антитела, разведенные 1:5000. Результат проявляли хромогеном TMB, регистрация сигнала проводилась при длине волны 450 нм. Было проведено четыре независимых ИФА.
Результаты и обсуждение
После трёх раундов аффинной селекции из не-амплифицированного элюата последнего раунда были отобраны 30 фаговых клонов, в которых была определена последовательность встройки (таблица).
Все пептиды выравниваются, обнаруживая три консенсусных аминокислотных остатка (а.о.): D – аспарагиновая кислота, K – лизин, R – аргинин.
ErbB-2 951-1010 VYMIHVKCWMIDSECRPRERELVSEFSRMARDPQRFWIUHEDLGPASPLDSTFYRSLLE
10 TTDHKLR------------------------------------------
12 TTDTKLR------------------------------------------
И ITDTKLR------------------------------------------
19 IADFKLR------------------------------------------
23 VQDPKLR------------------------------------------
27 HMDAKLR------------------------------------------
33 TIDVKMR------------------------------------------
17 ITDYKMR------------------------------------------
09 5PDAKMR------------------------------------------
21 YFDGKLR------------------------------------------
01 YLDMKVR------------------------------------------
29 GLDLKLR------------------------------------------
15 ATDSKLR------------------------------------------
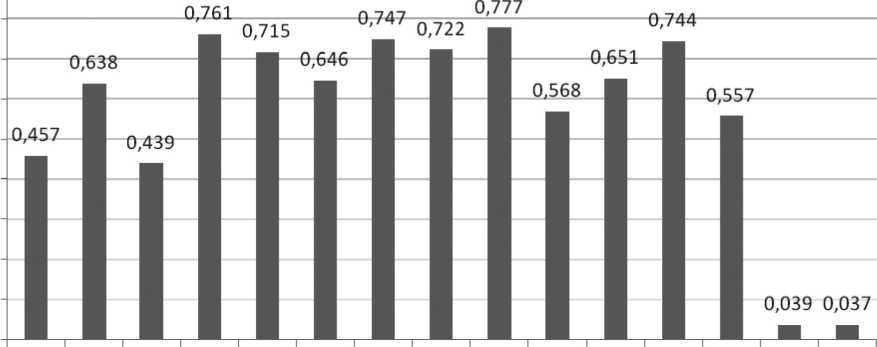
Рис. 2. Взаимодействие отобранных фаговых клонов и фага mp9 на фоне бесфагового контроля (к). На оси ординат указаны значения оптической плотности (OD 450)
0,900
0,800
0,700
0,600
0,500
0,400
0,300
0,200
0,100
0,000
1 9 10 11 12 15 17 19 21 23 27 29 33 mp9 к
Рис. 3. Выравнивание участка тирозинкиназного домена и пептидов, отобранных в нашем исследовании, осуществлялось на базе программы ClustalW
Считается, что именно заряженные а.о. оказывают наибольшее влияние на связывание антител [6], поэтому кажется понятным, почему именно эти аминокислоты оказались в составе консенсусного мотива.
От производителя известно, что иммуноген, который использовали для наработки антитела 4B8, являлся синтетическим полипептидом, идентичным по аминокислотной последовательности участку 22–122 а.о. белка ErbB-2. Выравнивание полученных пептидов с иммуногеном и N-концом ErbB-2 позволило выявить локализацию указанных а.о. (рис. 1). Основываясь на этих результатах, с большой вероятностью мы можем предположить, что Asp-30, Lys-32, Arg-34 составляют линейный эпитоп, с которым связывается МКАТ 4B8. Стоит отметить также значимость а.о. в 33-й позиции: во всех клонах на этом месте расположены али- фатические а.о., имеющие примерно одинаковый размер бокового радикала (Leu, Met, Val). По всей видимости, эта позиция также важна для связывания антитела.
Известно, что обнаруженный мотив в нативном ErbB-2 находится между β-складкой (25–27 а.о.) и α-спиралью (39–50 а.о.), то есть участок 30–34 а.о. имеет свободную конформацию и подходит для формирования эпитопа и взаимодействия с антителом (база данных Pubmed).
Результаты иммуноферментного анализа при наличии отрицательного контроля в виде фага mp9, не имеющего встроек, показывают высокую специфичность связывания отобранных фагов с исследуемым антителом (рис. 2).
Интересно, что полученный мотив в некоторой степени гомологичен участку, расположенному в тирозинкиназном домене ErbB-2 в позиции
964–968 а.о. (ECRPR). Аспарагиновая кислота на этом участке заменена на глутаминовую, а лизин – на аргинин (рис. 3).
Поскольку считается, что в этих парах (D-E, K-R) аминокислоты иммунологически тождественны в значительной степени, а аминокислота пролин (P) является алифатической с небольшим боковым радикалом, есть вероятность, что МКАТ 4B8 связывается также и с указанным участком, то есть, возможно, позволяет выявить гиперпродукцию С-концевого фрагмента ErbB-2 (C-terminal fragment, CTF) [8]. Существуют данные, указывающие на значимость увеличения количества тирозинкиназного домена внутри клетки в развитии опухоли. Новообразования, характеризующиеся повышенной продукцией CTF, оказываются устойчивы к определённым видам терапии, поэтому важно во время анализа ткани РМЖ также выявить наличие в цитоплазме и/или ядре CTF [2]. Исследуемое нами антитело 4B8, вероятно, может позволить в некоторой степени оценить наличие данной аномалии в ходе первичного анализа HER-2 статуса.
Таким образом, впервые нами был идентифицирован и локализован линейный эпитоп рецептора HER-2, с которым связывается МКА 4B8. Он представляет собой последовательность DMKLR, в которой ключевые позиции для связывания антитела занимают заряженные аминокислотные остатки: аспарагиновая кислота, лизин и аргинин. Также была выявлена последовательность в составе тирозинкиназного домена, которая, вероятно, может связывать МКА 4B8, поскольку содержит иммунологически тождественные указанным аминокислотные остатки. Следует отметить, что полученные данные подтверждают возможность использования МКА 4B8 для оценки HER-2 ста- туса, а также дают возможность предположить, что оно может быть использовано для оценки продукции CTF. Результаты данного исследования могут быть интересны разработчикам различных методов диагностики (ИФА, ИГХ и др.), а также могут быть использованы при разработке вакцин нового поколения, например полиэпитопных вакцин или вакцин на основе дендритных клеток, нагруженных антигенами.


