Каталитические свойства продуктов гидролиза бромида иттрия
Автор: Буланова Александра Владимировна, Авдин Вячеслав Викторович, Головин Михаил Сергеевич, Задорина Ольга Александровна
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Физическая химия
Статья в выпуске: 3 т.13, 2021 года.
Бесплатный доступ
В работе изучено влияние на формирование оксигидроксидов иттрия, полученных щелочным гидролизом бромида иттрия, времени гидролиза, конечного рН синтеза и гидротермальной обработки. Гидролиз осуществлен при различном времени введения гидролитического агента: 5 минут, 1 и 24 часа, а также при различных конечных рН: 8, 9 и 10. Для характеризации полученных образцов применены такие методы как термогравиметрия, совмещенная с дифференциальной сканирующей калориметрией и масс-спектрометрией газообразных продуктов термолиза, рентгенофазовый анализ, сканирующая электронная микроскопия высокого разрешения, рентгеновская энерго-дисперсионная спектрометрия. Кроме того, выполнен фотокаталитический тест полученных образцов в реакции разложения метиленового голубого под действием ультрафиолетового излучения. Установлено, что при гидролизе бромида иттрия происходит захват значительного количества примесей бромид- и карбонат-ионов, которые находятся в структуре образцов. Физико-химические характеристики продуктов гидролиза бромида иттрия зависят как от рН и времени гидролиза, так и от гидротермальной обработки. Последняя значительно повышает кристалличность образцов и их фотокаталитические свойства в реакции деструкции метиленового голубого.
Золь-гель метод, гидротермальная обработка гидрогелей, оксигидроксид иттрия, фотокаталитическое разложение метиленового голубого
Короткий адрес: https://sciup.org/147235329
IDR: 147235329 | УДК: 544.016.5 | DOI: 10.14529/chem210311
Текст научной статьи Каталитические свойства продуктов гидролиза бромида иттрия
Продукты гидролиза неорганических солей редкоземельных элементов (РЗЭ) представляют собой соответствующие оксигидроксиды, содержащие включения в виде ионов исходных солей и гидролитических агентов. Это происходит, в частности, из-за того, что они имеют слоистое строение и межслоевое пространство является емкостью, заполняемой противоионами и коионами [1]. Различные синтетические процедуры обычно направлены на то, чтобы уменьшить количество примесей, но некоторые примеси могут оказывать положительное значение на свойствах получаемых материалов. К таким примесям относятся допанты в виде катионов европия, неодима и др., а также ионы, формирующие на поверхности оксигидроксида различные функциональные группы.
Широкое применение оксигидроксиды РЗЭ находят в качестве люминофоров. В литературе представлены результаты исследований, в которых показано, что люминофоры с наноразмерны-ми частицами могут проявлять более высокую люминесцентную эффективность, улучшать разрешение изображений при освещении и отображении [2, 3]. Иттрий и его соединения используются также в качестве добавки к катализаторам для нейтрализации автомобильных выхлопных газов и для переработки углеводородов [4], разложения трудноокисляемых органических соединений [5]. Одним из перспективных катализаторов является хлорид иттрия, применяемый как катализатор в реакциях получения безатиозола [6], в-аминокарбонильных соединений [7], в реакции полимеризации лактона [8] для получения биоразлагаемых полимеров.
В литературе описано большое количество методов получения оксигидроксидов иттрия: твердофазные реакции разложения [9], гомогенное осаждение [10], гидротермальная обработка [11-14], золь-гель метод Печини [15, 16], метод электроспининга [17]. В данной работе представлены исследования оксигидроксидов иттрия, полученных гидролизом бромида иттрия. Исследовано влияние различных воздействий на физико-химические свойства полученных материалов. Исследованы их фотокаталитические свойства.
Экспериментальная часть
Для получения раствора бромида иттрия оксид иттрия растворяли в бромоводородной кислоте (0,86 М). Гидролизом раствора бромида иттрия по золь-гель технологии получали оксигидроксид иттрия. В качестве гидролитического агента использовали раствор гидроксида натрия с концентрацией 1,0 моль/л. Все реактивы имели квалификацию ХЧ и не подвергались дополнительной очистке перед применением. Раствор NaOH вводили по каплям до достижения рН 8, 9 и 10 при комнатной температуре. Длительность введения гидролитического агента составила 5 мин, 1 и 24 ч. Полученный гель подвергался созреванию в течение 24 ч. После созревания гель разделяли на две части и одну из них декантировали и пятикратно отмывали – заливали дистиллированной водой, интенсивно встряхивали в течение минуты, затем центрифугировали при скорости 9000 об/мин. в течение 2 мин. В предварительных экспериментах установили, что пятикратное повторение отмывки гарантирует получение отрицательной реакции на противоионы в фугате. Другую часть гидрогеля подвергали гидротермальной обработке, которую проводили в маточном растворе в автоклаве с саморегулирущимся давлением с заполнением 70 % при температуре 180 °С в течение 24 ч. Все полученные образцы (без и с гидротермальной обработкой) высушивали в вакуумном шкафу при давлении 8 мБар и температуре 50 °С.
Рентгенофазовый анализ (РФА) проведен при помощи порошкового рентгеновского дифрактометра Rigaku Ultima IV с использованием излучения Cu-K a (1,541874 А) в диапазоне 2 0 5...90 ° с дискретностью 0,02 ° , скорость сканирования - 2 ° /мин. Для поиска кристаллических фаз использовали библиотеку рентгеновских спектров ICDD-COD-Inorg Rev218120 2019.09.10 и программу Portable Crystal Impact Match. Исследования морфологии и определение элементного состава выполняли на сканирующем электронном микроскопе Jeol JSM-7001F с приставкой EDS Oxford INCA X-max 80.
Термический анализ ТГ-ДСК выполнили на термическом анализаторе Netzsch STA 449 F1 Jupiter, а ТГ-ДСК-МС – на термическом анализаторе Netzsch STA 449 С Jupiter, совмещенным с квадрупольным масс-спектрометром газообразных продуктов термолиза QMS 403C Aëolos. В обоих исследованиях нагревание проводили в платиновых микротиглях (50 мкл) в атмосфере аргона со скоростью 10 K/мин, в интервале температур 30^1200 ° С, держатель типа S. Масса навески образцов составляла около 5 мг (зависимости строили для относительного изменения массы, %). Для каждого образца проводили не менее трех ТГ-ДСК-исследований и усреднили полученные результаты. Масс-спектры записаны в режиме мониторинга трех массовых чисел: 18 (H 2 O), 30 (NO) и 44 (СО 2 ) и 81 (HBr) – газов, выделяющихся при термолизе продуктов гидролиза бромида иттрия, установленных в предварительных ТГ-ДСК-МС-исследованиях, в которых масс-спектры записывали в режиме сканирования.
Для определения фотокаталитической активности навеску образца оксигидроксида иттрия массой 25 мг помещали в кварцевый реактор, содержащий 50 мл водного раствора метиленового голубого с концентрацией 10 мг/л. Суспензию перемешивали на магнитной мешалке в темноте в течение 30 мин до достижения адсорбционного равновесия. Время адсорбции установили в предварительных экспериментах. Адсорбцию определяли фотометрически по пику 664 нм. После измерения адсорбции суспензию облучали ультрафиолетом в течение 120 мин. Источник ультрафиолета – 3 кварцевые ртутные лампы ДБК 30, расположенные в закрытом цилиндрическом боксе из алюминиевых листов. Методом актинометрии [18,19] определили, что мощность светового потока в спектральном диапазоне длин волн менее 410 нм имеет значение 45 Вт/м2. Каждые 30 мин из реактора отбирали аликвоту 5 мл, раствор отделяли от катализатора центрифугированием при 8000 об/мин и измеряли оптическую плотность. После измерения катализатор и раствор возвращали обратно в реактор и продолжали облучение. Фотолиз красителя проводили в тех же экспериментальных условиях, но в отсутствие катализатора. Изменение концентраций красителей при УФ-облучении без катализатора находится в пределах ошибки определения, которая составляет менее 3 %. Спектрофотометрические исследования проводили на спектрофотометре ультрафиолетового и видимого диапазона Shimadzu UV-2700.
Навески реагентов брали на весах Sartorius серии СРА, 5 знак точности (0,01 мг). рН контролировали при помощи рН-метра Sartorius РР-25. Синтез проводили при помощи магнитной мешалки BIOSAN MSH-300, вакуумного сушильного шкафа Binder VD 115 и центрифуги Hermle LaborTechnic Z383.
Исследования проведены на оборудовании научно-образовательного центра «Нанотехнологии» Южно-Уральского государственного университета.
Обсуждение результатов
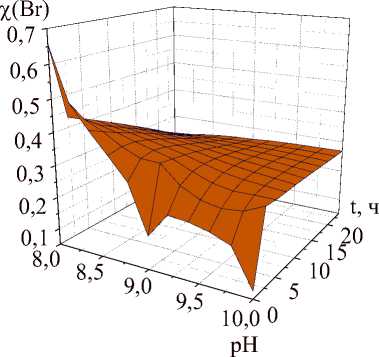
Продукты щелочного гидролиза бромида иттрия содержат значительные примеси исходных бромид-ионов, не удаляющихся отмывкой. Количество примесных бромидов сопоставимо с количеством ионов Cl– и NO 3 –, захватываемых при щелочном гидролизе хлоридов и нитратов иттрия [20], и в среднем составляет около 0,3 атомов брома в расчете на 1 атом иттрия. После гидротермальной обработки содержание примесных ионов брома в среднем возрастает до 0,36 на 1 атом иттрия. В таблице приведены значения мольных долей ( χ ) примесных бромидов, определенных методом EDS, а на рис. 1 показано изменение содержания примесных бромидов при варьировании рН, времени синтеза для образцов, полученных золь-гель методом до гидротермальной обработки и после нее. Как видно из приведенных данных, изменения содержания бромидов в наибольшей степени наблюдаются для образцов, полученных при времени гидролиза 5 мин, и в основном зависят от рН синтеза. При рН 8 содержание бромидов резко падает после выдержки в автоклаве, при рН 9 – остается примерно постоянным, а при рН 10 – резко возрастает. При времени синтеза 1 ч после гидротермальной обработки содержание бромидов незначительно снижается, а при длительности гидролиза 24 ч также незначительно возрастает.
а)
χ (Br) 0.7
0.6
0.5
0.4
0.3
0.2
8.0
8.5 9.0
t, ч
9.5 5
10.0 0
pH
б)
Рис. 1. Изменение содержания бромид-ионов в образцах до (а) и после (б) гидротермальной обработки
Мольное содержание бромид-ионов в исходных образцах (исх.) и после гидротермальной обработки (гидр.)
|
Время синтеза и рН |
χ (Br) исх. |
χ (Br) гидр. |
|
5 мин, pH 8 |
0,672 |
0,392 |
|
5 мин, pH 9 |
0,140 |
0,220 |
|
5 мин, pH 10 |
0,061 |
0,685 |
|
1 час, pH 8 |
0,420 |
0,373 |
|
1 час, pH 9 |
0,371 |
0,240 |
|
1 час, pH 10 |
0,317 |
0,280 |
|
24 часа, pH 8 |
0,225 |
0,395 |
|
24 часа, pH 9 |
0,260 |
0,389 |
|
24 часа, pH 10 |
0,269 |
0,268 |
Примечание. Расчет сделан по отношению к содержанию иттрия.
По данным ТГ-ДСК-МС кроме бромид-ионов образцы содержат значительные количества карбонат-ионов, аналогично продуктам гидролиза нитрата и хлорида иттрия [20]. При термолизе бромид-ионы отщепляются в виде HBr (M/Z = 81 Да), аналогично оксигидроксидам, полученным гидролизом хлорида иттрия, при термолизе которых хлориды удаляются в виде HCl
(M/Z = 36,5 Да). В основном деструкция протекает с отщеплением воды и углекислого газа до температуры около 650 ° С с последующим удалением бромидов (рис. 2а), но при рН 10 углекислый газ частично удаляется вплоть до 900 °С, что особенно характерно для образцов, подвергнутых гидротермальной обработке. А при рН синтеза 10 и времени гидролиза 5 мин, при котором образец имеет минимальное содержание примесных бромидов, все данные примеси удаляются в узком интервале 350…400 °С (рис. 2б).
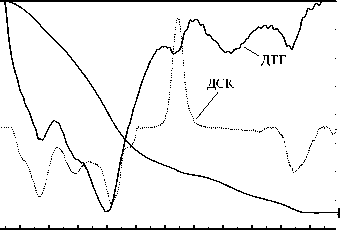
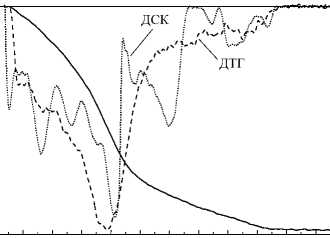
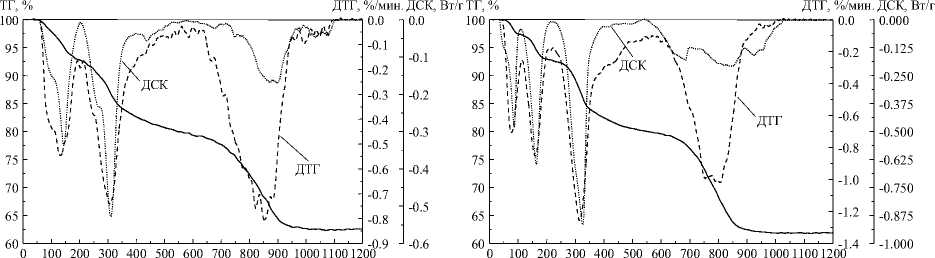
Температурные интервалы дегидратации образцов, полученных из бромида иттрия совпадают с теми, которые наблюдаются для оксигидроксидов иттрия, полученных из растворов нитратов и хлоридов [20]: от комн. до 200 ° С удаляется адсорбированная и поровая вода, в интервале 200^350 °С -вода от концевых поверхностных групп, 350^550 ° С - вода от мостиковых ОН-групп. Характерным отличием образцов, обработанных гидротермально, от необработанных, является уменьшение ширины пиков на кривых ДСК и ДТГ, исчезновение дополнительных пиков небольшой амплитуды и/или плечей, а также увеличение в среднем в два раза амплитуды изменения потери массы и поглощения тепла при протекании дегидратации. На рис. 3 представлено сравнение характерных термоаналитических кривых исходных и обработанных гидротермально образцов.
ТГ, % 100
ДТГ, %/мин. ДСК, Вт/г ТГ, %
-0.125 0.20
-0.875 -0.15
-0.250 0.15
0.10 -0.375 .
0.05
-0.500
0.00
-0.625
- . -0.05
-0.750 -0.10
100 200 300 400 500 600 700 800 900 1000 1100 1200
Т, ° С
0.000 0.25
-1.000 -0.20
-0.125 -0.025
-1.000 -0.225
-0.250 -0.050
-0.375 -0.075
-0.100
-0.500
-0.125
-0.625
-0.150
-0.750 -0.175
-0.875 -0.200
100 200 300 400 500 600 700 800 900 1000 1100 1200
Т, ° С
ДТГ, %/мин. ДСК, Вт/г 0.000 0.000
-1.125 -0.250
18 Да
44 Да
81 Да
а)
0 100 200 300 400 500 600 700 800 900 1000 1100 1200
Т, ° С
18 Да
44 Да
81 Да
0 100 200 300 400 500 600 700 800 900 1000 1100 1200
Т, ° С
б)
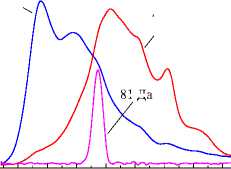
Рис. 2. Характерный вид термоаналитических и масс-спектрометрических кривых (а) и аномальное удаление примесных бромидов (б): 18, 44 и 81 Да – МС-кривые, записанные в режиме мониторинга, а) 5 мин, pH 9, исходный ксерогель, б) 5 мин, pH 10, гидротермально обработанный образец
Т, ° С Т, ° С
а) б)
Рис. 3. Характерный вид термоаналитических кривых исходного (а) и гидротермально обработанного (б) образцов: условия синтеза: 1 ч, pH 9
Рентгенофазовый анализ показал, что почти все полученные образцы имеют некоторую кристаллическую упорядоченность. Рентгеноаморфными являются только ксерогели, полученные при времени гидролиза 5 мин и рН синтеза 9 и 10. Оксигидроксиды иттрия, полученные из бромидных растворов не содержат фазу ни чистого оксида, ни чистого гидроксида иттрия. При помощи имеющейся базы данных идентифицировать кристаллические фазы не удалось.
Кристалличность ожидаемо растет у образцов после гидротермальной обработки. При варьировании времени синтеза наибольшая кристалличность наблюдается у образцов, полученных при длительности гидролиза 1 ч (рис. 4), а при варьировании рН синтеза – при рН 8 (рис. 5).
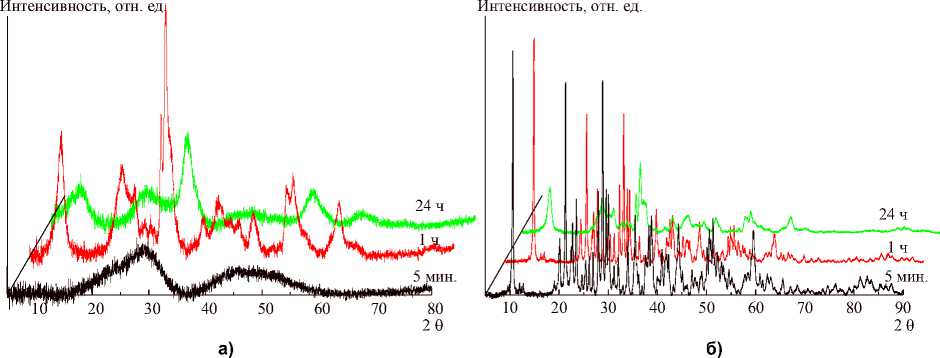
Рис. 4. Изменение дифрактограмм при возрастании времени синтеза исходных (а)
и гидротермально обработанных (б) образцов
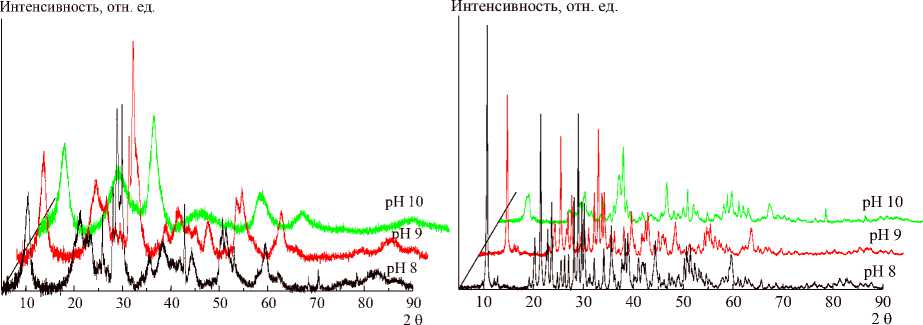
а) б)
Рис. 5. Изменение дифрактограмм при возрастании pH синтеза исходных (а) и гидротермально обработанных (б) образцов
Морфология образцов существенно зависит и от условий синтеза и от гидротермальной обработки. При времени гидролиза 5 мин все образцы независимо от рН синтеза представляют собой крупные агрегаты размером от 200 до 1000 нм. Агрегаты представляют собой частицы размером 100…200 нм, соединенные между собой при помощи небольших образований размеров в несколько нм. После гидротермального воздействия частицы небольшого размера переходят в маточный раствор и агрегаты распадаются на отдельные частицы, возможно с некоторой перестройкой структуры. Так, образцы, полученные при рН 8, после гидротермального воздействия состоят из отдельных сфероидальных частиц размером около 100 нм. Образцы, синтезированные при рН 10 распадаются на частицы неправильной формы размером 100…300 нм. Оксигидроксиды, полученные при рН 9, формируют слоистые частицы, размеры которых от сотен нанометров до 1,5 мкм, а толщина – около 5 нм.
Похожие изменения морфологии наблюдаются для образцов, полученных при времени гидролиза 1 ч, с той лишь разницей, что еще до гидротермальной обработки большая часть образцов состоит из отдельных агрегатов, а после обработки агрегированных частиц почти не остается и форма различных частиц становится близкой. При рН синтеза 9 и 10 образуются палочкообразные частицы диаметром 200…300 нм, длиной 1…2 мкм, при рН 8 – сфероидальные диаметром около 150…200 нм. Такая же картина наблюдается при времени синтеза 24 ч, но сферические частицы образуются при рН синтеза 9, а палочкообразные – при рН 8 и 10. В качестве примера на рис. 6 показано изменение морфологии в образцах, синтезированных при рН 8 в течение 5 мин.
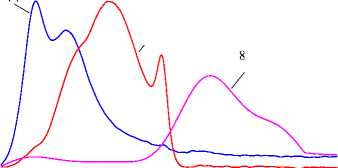
Образцы были испытаны в реакции фотокаталитической деструкции метиленового голубого. Для полученных кинетических зависимостей определили, что они с коэффициентом корреляции выше 0,95 хорошо описываются уравнением псевдопервого порядка (линейная регрессия для уравнения ln(C) = a + bx, где С – концентрация, моль/л, а – свободный член, b – константа реакции). Образцы, полученные при времени гидролиза 24 ч проявляют очень слабые фотокаталитические свойства; константа реакции менее 10–4. Такой же порядок имеют константы у образцов, не подвергнуных гидротермальной обработке. Наибольшей активностью обладают образцы, полученные при рН 9 и времени гидролиза 1 ч. Константа реакции фотодеструкции для них возрастает почти на два порядка. На рис. 7 приведены некоторые кинетические зависимости, полученные в данном каталитическом тесте. Некоторые кривые показаны в более крупном масштабе на врезке. Верхняя кривая иллюстрирует фотодеструкцию в тех же условиях метиленового голубого без фотокатализатора.


а) б)
Рис. 6. Изменение морфологии после гидротермальной обработки: а – исходные ксерогели, б – гидротермально обработанные
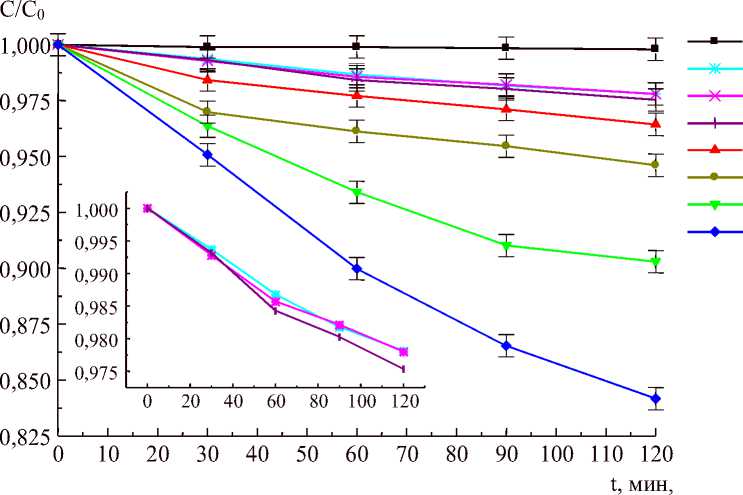
Фотолиз
-
1 ч, рН 10, ГТ
-
1 ч, рН 8
-
1 ч, рН 10
-
5 мин., рН 9, ГТ
-
5 мин., рН 8, ГТ
-
1 ч, рН 8, ГТ
-
1 ч, рН 9, ГТ
Рис. 7. Кинетика фотокаталитического разложения метиленового голубого с участием образцов оксигидроксида иттрия, полученного в разных условиях
Заключение
Гидролиз бромида иттрия приводит к формированию оксигидроксидов, содержащих в своем составе значительное количество примесей бромид- и карбонат ионов. Примеси находятся внутри структуры и обычной отмывкой не удаляются. При нагревании бромид-ионы удаляются только после полной дегидратации оксигидроксида. Высушенные ксерогели имеют низкую кристалличность. Гидротермальная обработка гидрогелей приводит к значительным изменениям, связанным с растворением ряда аморфных и дефектных кристаллов. В результате кристалличность значительно возрастает, но размер образующихся частиц значительно не изменяется. Наибольшую кристалличность имеют образцы, полученные при времени гидролиза 1 ч и рН 8 и 9. При помощи имеющейся базы данных идентифицировать кристаллические фазы не удалось. В зависимости от условий синтеза (время гидролиза и конечный рН) формируются палочкообразные наночастицы, слоистые, а также частицы неправильной формы. Последнее наблюдается при рН синтеза 10. Оксигидроксиды иттрия, полученные из бромида иттрия, обладают некоторой фотокаталитической активностью в реакции разложения метиленового голубого. Гидротермальная обработка почти на два порядка повышает данное свойство. Наибольшую активность проявили образцы, имеющие плоскостное строение и высокую степень кристалличности (гидролиз в течение 1 ч при рН 9).
Список литературы Каталитические свойства продуктов гидролиза бромида иттрия
- Xi Y., Davis R.J. Intercalation of Ethylene Glycol into Yttrium Hydroxide Layered Materials. Inorg. Chem., 2010, vol.49, pp. 3888–3895. DOI: 10.1021/ic1000478
- Hong, K.S., Meltzer R.S., Bihari B., Williams D.K., Tissue B.M. Spectral Hole Burning in Crystalline Eu2O3 and Y2O3:Eu3+ Nanoparticles. J Lumin., 1998, vol. 76–77, pp. 234–237. DOI: 10.1016/S0022-2313(97)89949-8.
- Bhargara R.N., Gallaghar D., Hong X., Nurmikko A. Optical Properties of Manganese-Doped Nanocrystals of ZnS. Phys. ReV. Lett., 1994, vol. 72, pp. 416–419.
- Брыкин А.В., Артемов А.В., Колегов К.А. Анализ рынка редкоземельных элементов (РЗЭ) и РЗЭ-катализаторов. Общие вопросы катализа. Катализ в промышленности. 2013. № 4. С. 7–15. [Brykin A.V., Artemov A.V., Kolegov K.A. Analysis of the Market for Rare Earth Elements (REE) and REE Catalysts. General Questions of Catalysis. Catalysis in Industry, 2013, vol. 4, pp. 7–15. (in Russ.)]
- Maria Magdalane C., Kaviyarasu K., Judith Vijaya J., Siddhardha B., Jeyaraj B. Facile Synthesis of Heterostructured Cerium Oxide/Yttrium Oxide Nanocomposite in UV Light Induced Photocatalytic Degradation and Catalytic Reduction: Synergistic Effect of Antimicrobial Studies. Journal of Photochemistry & Photobiology, B: Biology, 2017. DOI: 10.1016/j.jphotobiol.2017.05.024
- Li-Yan Fan , Ying-Hui Shang, Xiang-Xiong Li, Wen-Jun Hua. Yttrium-Catalyzed Heterocyclic Formation via Aerobic Oxygenation: A Green Approach to Benzothiazoles. J. Chinese Chemical Letters, 2014, vol. 26 (1), pp. 77–80. DOI: 10.1016/j.cclet.2014.10.017
- Venkateswarlu Yekkirala, Ramesh Kumar Sudhagani,Leelavathi Panuganti. Yttrium (III) Chloride Catalyzed Mannich Reaction: An Efficient Procedure for the Synthesis of β-amino Carbonyl Compounds. J. Org. Commun., 2014, vol. 7, pp. 123–129.
- Patent 5028667 United States Yttrium and rare earth compounds catalyzed lactone polymerization / Stephan J- McLam. , Neville E. Drysdale, Jul. 2, 1991
- D'Assunção L.M., Giolito I., Ionashiro M. Thermal Decomposition of the Hydrated Basic Carbonates of Lanthanides and Yttrium. Thermochim. Acta, 1989, vol. 137, no. 2, pp. 319–330. DOI: 10.1016/0040-6031(89)87224-7.
- Vila L.D., Stucchi E.B., Davolos M.R. Preparation and Characterization of Uniform, Spherical Particles of Y2O2S and Y2O2S:Eu. J. Mater. Chem., 1997, vol. 7, pp. 2113–2216. DOI: 10.1039/A701540B.
- Simoneti J.A., Davolos M.R., Jafelicci Jr. M. Hydrothermal Treatment of Gadolinium Oxide in Presence of Silica. High Pressure Res., 1994, vol. 12, pp. 353–360.
- Holsa J., Leskela T., Leskela M., Luminescence Properties of Europium(3+)-Doped Rare-Earth Oxyhydroxides. Inorg. Chem., 1985, vol. 24, no. 10, pp. 1539–1542. DOI: 10.1021/ic00204a026.
- Davolos M. R., Feliciano S., Pires A.M., Marques R., Jafelicci M. Jr, Solvothermal Method to Obtain Europium-Doped Yttrium Oxide, Sol. St. Chem., 2003, vol. 171 pp. 268–272. DOI: 10.1016/S0022-4596(02)00174-3
- Holsa J., Turkki T. Preparation, Thermal Stability and Luminescence Properties of Selected Rare Earth Oxycarbonates. Thermochim. Acta, 1991, vol. 190, no. 2, pp. 335–343. DOI: 10.1016/0040-6031(91)85261-F.
- Hassanzadeh-Tabrizi S.A. Synthesis and Luminescence Properties of YAG:Ce Nanopowder Prepared by the Pechini Method. Adv Powder Technol., 2012, vol. 23, pp. 324–327. DOI: 10.1016/j.apt.2011.04.006.
- Szczeszak A., Kubasiewicz K., Grzyb T., Lis S. Spectroscopic Properties of Y1-xEuxBO3 and Y1-xTbxBO3 Nanopowders Obtained by the Sol-Gel Pechini Method. J. Luminescence, 2014, vol. 155, pp. 374–383. DOI: 10.1016/j.jlumin.2014.07.006
- Song L., Shao X., Du P., Cao H., Hui Q., Xing T., Xiong J. A Facile Preparation and the Lumi-nescent Properties of Eu3+-Doped Y2O2SO4 Nanopieces. Mater. Res. Bull., 2013, vol. 48, no. 11, pp. 4896–4900. DOI: 10.1016/j.materresbull.2013.07.017.
- Galbavy, Edward S, Keren Ram, Cort Anastasio. 2-Nitrobenzaldehyde as a Chemical Actinome-ter for Solution and Ice Photochemistry. Journal of Photochemistry and Photobiology A: Chemistry, 2010, vol. 209, pp. 186–192. DOI: 10.1016/j.jphotochem.2009.11.013
- Willett, Kristine L., Hites Ronald A. Chemical Actinometry: Using o-Nitrobenzaldehyde to Measure Light Intensity in Photochemical Experiments. Journal of Chemical Education, 2000, vol. 77, no. 7, pp. 900–902. DOI: 10.1021/ed077p900
- Yudina E.P., Frolova A.V., Krivtsov I.V., Avdin V.V. Analysis of Products Formed in Hydro-thermal Processing of Yttrium Nitrate and Yttrium Chloride. Bulletin of the South Ural State University. Ser. Chemistry, 2015, vol. 7, no. 1, pp. 51–54.


