Каталитический пиролиз легких алканов в присутствии соединений металлов шестой группы
Автор: Цыганова Елена Ивановна, Шекунова Валентина Михайловна, Александров Юрий Арсентьевич, Филофеев Сергей Васильевич, Лелеков Валерий Евгеньевич
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Физическая химия
Статья в выпуске: 3 т.8, 2016 года.
Бесплатный доступ
Изучен каталитический пиролиз легких углеводородов С1-С4 в проточном трубчатом реакторе в присутствии комплексных катализаторов, содержащих металлы шестой группы Cr, Mo, W, нанесенных в виде неорганических солей или кислот на керамический носитель с последующей термической обработкой. Исследования проведены в интервале температур 500-850 °С, скорости пропускания газовой смеси 25-100 мл/мин, времени контакта 0,65-2,7 с, значениях гетерогенного фактора S/V 5,6∙105 см-1. Проведено сравнение каталитической активности металлсодержащих композиций в сопоставимых условиях, изучено влияние природы металлов на выход этилена и пропилена, оценено сажеобразование. Рассчитаны кинетические и активационные параметры распада углеводородной смеси и накопления продуктов. Лучшие результаты при нанесении на керамический носитель показал Cr-содержащий катализатор.
Пиролиз, легкие алканы, катализаторы, этилен, сажеобразование, высокодисперсные материалы
Короткий адрес: https://sciup.org/147160359
IDR: 147160359 | УДК: 665.644.097.3+546.75 | DOI: 10.14529/chem160303
Текст научной статьи Каталитический пиролиз легких алканов в присутствии соединений металлов шестой группы
Нарастающее внимание к исследованиям в области каталитических технологий нефтепереработки наблюдается как в России, так и за рубежом, не только из-за интенсивного развития процессов полимеризации, но, прежде всего, из-за возможности получения дефицитных низкомолекулярных алкенов, используемых в процессах алкилирования и этерификации [1 - 4]. Возрастают перспективы применения в качестве сырья пиролиза малоиспользуемых ранее ресурсов природных и попутных нефтяных газов, а также других альтернативных низкомолекулярных углеводородных источников. На основании результатов термодинамического анализа было установлено, что наиболее эффективным сырьем для образования низкомолекулярных алкенов являются легкие углеводороды [5].
Ранее нами было показано, что ультрадисперсные металлические катализаторы W, Fe и Mo, полученные методом электровзрывного диспергирования металлических проводников на поверхности кварцевых носителей позволяют снизить температуру пиролиза легких алканов на 50– 70 °С [6] и по основным параметрам (выходу этилена и пропилена, селективности по этилену и коксообразованию) превосходят пленочные полифосфатные покрытия и композиционные керамические материалы, прошедшие модифицирующую обработку цинк-, фосфор-, кремний- и кадмийорганическими соединениями [7] или соединениями металлов восьмой группы Fe, Co, Ni, Pd [8] в проточных системах. Однако катализаторы, полученные электровзрывным диспергированием металлических проводников, частично теряют каталитическую активность со временем, что вызывает необходимость в их быстром использовании после нанесения, в отличие от более устойчивых катализаторов, полученных традиционными методами. Известно, что модифицирование цеолитов катионами цинка, кадмия, кобальта и др. не только увеличивают конверсию углеводородов, но и существенно меняют селективность реакций [9]. Включение в состав катализаторов катионов переходных металлов может приводить к появлению, наряду с кислотными, новых активных центров, способных непосредственно взаимодействовать с углеводородами и при- давать катализатору бифункциональный характер [10]. В работе [4] показано возрастание селективности алюмохромового катализатора дегидрирования н-бутана после его прокаливания при 800-900 °С, улучшение свойств которого объясняется формированием кластеров Cr2O3 и снижением поверхностной кислотности катализатора в результате дегидроксилирования и фазовых превращений алюмооксидного носителя.
Данная работа направлена на выявление наиболее активного катализатора подгруппы хрома (Cr, Mo, W), нанесенного в виде неорганических солей или кислот на керамический носитель, являющийся композицией минеральных и органических веществ, в процессе прямого превращения углеводородов С 1 - С 4 в этилен и пропилен.
Экспериментальная часть
В работе использовалась углеводородная смесь (технический продукт ОАО «Сибур-Нефтехим») следующего состава, мас. %: метан 0,3; этан 0,2; пропан 65,5; бутан 18,8; i -бутан 15,2.
Исследование процесса пиролиза легких углеводородов проводили на установке проточного типа, созданной на основе газового хроматографа «Цвет-500» с использованием программного обеспечения TWS - Maxichrom, при давлении близком к атмосферному, в стальных реакторах (сталь марки 12Х18Н10Т), диаметром 0,6 см в интервале температур 500 - 850 ° С, скорости пропускания углеводородной смеси 25 - 100 мл/мин, времени контакта (т) реагирующей смеси с катализатором 0,65 - 2,7 с, значении гетерогенного фактора S/V (где S - поверхность катализатора, V – свободный объем) 5,6∙105 см–1. Количество углеродистых отложений, образующихся в процессе пиролиза, рассчитывали по привесу реактора, их анализ проводили на ИК-спектрометре (IR - Prestige-21) c преобразованием Фурье фирмы «Shimadzu» и на сканирующем зондовом микроскопе СЗМ Solver PRO.
Для получения катализаторов в качестве носителя использовался синтетический пенокерамический материал, являющийся композицией минеральных и органических веществ [7], характеризующийся высокой термостабильностью до 1000 ° С, пористостью 70 - 80 % и высокой прочностью на сжатие до 300 н/см2. Керамический материал использовался в раздробленном состоянии (фракция 0,3 - 0,5 мм), обрабатывался соответствующими растворами солей с последующей термической обработкой 2 часа при 200 ° С, затем 2 - 2,5 часа при 600 ° С. Молибденовая и вольфрамовая кислоты перед нанесением на керамический носитель растворялись в смеси 20 мл H3PO4, 10 мл C 2 H 5 OH и 1 мл HCl.
Конверсия углеводородов рассчитывалась по отношению суммарного количества прореагировавшего сырья к суммарному количеству сырья, поступившего в установку. Выход продуктов реакции определялся как отношение количества образовавшегося продукта при данной температуре, к общему количеству углеводородного сырья, поступившего в установку. Селективность по этилену рассчитывалась как отношение количества этилена к суммарному количеству продуктов. Расчет констант скорости проводился по кинетическому уравнению реакции первого порядка, расчет активационных параметров - методом наименьших квадратов по значениям констант скорости при пяти температурах.
Обсуждение результатов
Результаты каталитического превращения углеводородов С 1 - С 4 в реакторах, заполненных керамическим носителем в виде гранул, прошедших обработку соединениями металлов VI группы (Cr, Mo, W), приведены в табл. 1. Как и для ранее изученных нами катализаторов [7, 8], продуктами пиролиза легких углеводородов были: метан, этан, этилен, пропилен, водород и твердые продукты конденсации углеводородов, образующиеся в виде кокса в процессе превращения углеводородов. Наблюдалось увеличение содержания метана, этана, этилена и пропилена с температурой за исключением катализаторов II, IX, X (табл. 1), для которых количество пропилена сначала росло с увеличением температуры, затем уменьшалось, что связано с его участием во вторичных процессах с образованием продуктов уплотнения [11]. В интервале температур 710 - 830 ° С образуется водород в количестве не превышающем 5 - 10 мас. %, что свидетельствует о незначительном вкладе реакции дегидрирования в процесс каталитического пиролиза.
При получении катализаторов на основе термического разложения нитрата хрома (II, III, IV, табл. 1) на керамическом носителе формируется фаза Cr2O3, для которой известны три модифи- кации: ромбоэдрическая α-Cr2O3, структура типа α-Al2O3; кубическая, изоморфная γ-Fe2O3 и высокотемпературная тетрагональная форма. В данных экспериментальных условиях устойчива ромбоэдрическая модификация. Из данных табл. 1 видно, что каталитическая активность Cr-содержащих систем зависит от содержания хрома на поверхности носителя. Уменьшение его содержания от 5 до 0,5 мас. % при 710 °С увеличивало конверсию углеводородной смеси в 2,6; выход этилена в 3,9; выход пропилена в 1,6; селективность по этилену в 1,5 раза. При этом катализатор с содержанием хрома 0,5 мас. % превосходил керамический носитель без обработки по суммарному выходу алкенов в интервале 710-800 °С в 1,4 раза. В продуктах пиролиза в присутствии Cr-содержащих катализаторов практически отсутствовала сажа, выделение которой наблюдалось на керамическом носителе без обработки.
Таблица 1
Характеристики пиролиза углеводородной смеси С 1 –С 4 в реакторе с керамическим носителема
|
№ образца |
Обработка носителя |
М б |
Т, ° С |
Конверсия, % |
Выход на пропущенное сырьё, мас. % |
Селективность по С 2 Н 4, % |
Кокс, мас. % |
|||
|
СН 4 |
С 2 Н 6 |
С 2 Н 4 |
С 3 Н 6 |
|||||||
|
I |
Без |
710 |
8,4 |
1,5 |
— |
4,3 |
2,6 |
51,2 |
0,1 |
|
|
обработки |
750 |
25,8 |
4,8 |
— |
9,8 |
11,2 |
38,0 |
|||
|
800 |
40,2 |
9,4 |
19,9 |
10,9 |
49,5 |
|||||
|
850 |
74,2 |
19,6 |
1,9 |
39,1 |
13,6 |
52,7 |
||||
|
II |
Cr(NO 3 ) 3 |
0,5 |
710 |
11,0 |
0,13 |
1 , ,0 |
5,8 |
4,1 |
52,7 |
0 |
|
740 |
22,2 |
4,3 |
1,7 |
8,0 |
8,2 |
36,0 |
||||
|
800 |
56,8 |
13,7 |
3,7 |
20,4 |
19,1 |
35,9 |
||||
|
830 |
73,5 |
19,6 |
6,0 |
32,4 |
15,5 |
44,1 |
||||
|
III |
Cr(NO 3 ) 3 |
1,0 |
710 |
7,2 |
1,1 |
3,8 |
2,3 |
52,3 |
0 |
|
|
740 |
15,1 |
2,3 |
1,0 |
6,9 |
5,0 |
45,3 |
||||
|
800 |
43,7 |
9,2 |
3,0 |
17,5 |
14,0 |
40,2 |
||||
|
830 |
65,3 |
17,0 |
4,0 |
29,3 |
15,0 |
44,9 |
||||
|
IV |
Cr(NO 3 ) 3 |
5,0 |
710 |
4,2 |
0,1 |
1,5 |
2,5 |
35,7 |
0 |
|
|
740 |
9,5 |
1,9 |
0,2 |
3,7 |
3,7 |
38,6 |
||||
|
800 |
40,7 |
8,0 |
1 , ,2 |
14,4 |
17,3 |
35,3 |
||||
|
830 |
56,2 |
14,1 |
2,0 |
20,5 |
19,6 |
36,5 |
||||
|
V |
(NH 4 ) 6 Mo 7 O 24 |
0,5 |
710 |
1,1 |
— |
— |
1,1 |
- |
0 |
|
|
740 |
5,2 |
0,3 |
0,4 |
0,9 |
3,7 |
16,4 |
||||
|
800 |
29,6 |
6,2 |
1,3 2,3 0,4 0,4 |
8,6 |
13,5 |
29,1 |
||||
|
830 |
51,0 |
11,9 |
20,5 |
16,3 |
40,2 |
|||||
|
VI |
(NH 4 ) 6 Mo 7 O 24 |
1,0 |
710 |
5,7 |
0,3 |
0,4 |
4,6 |
7,0 |
0 |
|
|
740 |
8,5 |
0,4 |
0,7 |
7,0 |
7,8 |
|||||
|
800 |
36,0 |
7,0 |
1,1 2,4 0,4 0,5 1,8 2,7 0,4 1,5 0,8 1,6 0,4 0,4 |
12,4 |
15,3 |
34,6 |
||||
|
830 |
56,2 |
13,2 |
21,6 |
19,0 |
38,5 |
|||||
|
VII |
(NH 4 ) 6 Mo 7 O 24 |
5,0 |
710 |
3,5 |
0,3 |
0,4 |
2,4 |
11,1 |
0 |
|
|
740 |
8,9 |
0,3 |
1,2 |
6,9 |
13,2 |
|||||
|
800 |
31,7 |
8,8 |
7,7 |
13,4 |
23,3 |
|||||
|
830 |
55,9 |
15,7 |
20,7 |
16,9 |
37,0 |
|||||
|
VIII |
H 2 MoO 4 |
5,0 |
710 |
7,3 |
0,3 |
0,4 |
6,3 |
5,2 |
0 |
|
|
740 |
11,4 |
0,5 |
1,2 |
8,2 |
10,7 |
|||||
|
800 |
30,4 |
4,2 |
9,9 |
15,6 |
32,4 |
|||||
|
830 |
55,8 |
10,1 |
21,3 |
22,8 |
38,3 |
|||||
|
IX |
H 2 WO 4 |
5,0 |
710 |
5,5 |
0,8 |
0,5 |
3,9 |
8,4 |
0,1 |
|
|
740 |
9,5 |
0,5 |
0,8 |
7,7 |
8,8 |
|||||
|
800 |
38,7 |
8,9 |
0,8 1,4 0,4 |
12,6 |
16,4 |
32,4 |
||||
|
830 |
56,5 |
16,6 |
25,5 |
13,1 |
45,7 |
|||||
|
X |
W в составе |
10 |
690 |
5,5 |
0,8 |
1,2 |
3,1 |
21,8 |
1,1 |
|
|
керамики |
730 |
26,9 |
4,1 |
1,1 |
7,3 |
14,4 |
27,1 |
|||
|
800 |
69,6 |
18,9 |
0,5 2,0 |
30,2 |
20,0 |
43,4 |
||||
|
820 |
79,9 |
29,4 |
37,9 |
15,1 |
47,4 |
|||||
Примечания: а V смеси = 50 мл/мин; τ = 1,34 с; d = 0,6 см; S/V = 5,6∙10 5 см б содержание металла в покрытии, мас. %.
Нанесение молибдата аммония (NH4)6Mo7O24 и молибденовой кислоты H2MoO4 на керамический носитель с последующей термической обработкой при 600 ° С приводит к образованию MoO 3 , частичное восстановление которого продуктами пиролиза, содержащими водород, ведет к образованию оксидов промежуточного состава между MoO 3 и Mo 2 O 5 . Mo-содержащие катализаторы увеличивали выход пропилена при 800 ° С по сравнению с керамическим носителем без обработки в 1,2–1,4 раза, но уступали по выходу этилена, суммарному выходу алкенов и селективности по этилену. При проведении пиролиза в присутствии Mo-содержащих катализаторов практически отсутствовала сажа. Лучшие результаты по выходу пропилена показал Mo-содержащий катализатор (VIII, табл. 1), полученный при обработке керамического носителя H 2 MoO 4 .
Нанесение вольфрамовой кислоты H 2 WO 4 на керамический носитель с последующей термической обработкой при 600 ° С приводит к образованию WO 3 . Как и в случае с Mo-содержащим катализатором, наблюдалось увеличение содержания пропилена в продуктах пиролиза по сравнению с необработанным керамическим носителем (при 800 ° С в 1,5 раза), снижение выход этилена, суммарного выхода алкенов и селективности пиролиза по этилену. При этом количество образующейся сажи было таким же, как и в случае необработанного носителя. Введение металлического вольфрама в состав керамики в количестве 10 мас. % увеличивало при 800 ° С выход этилена в 1,5 раза, выход пропилена в 2 раза, суммарный выход алкенов в 1,6 раза. Однако введение в состав носителя металлического вольфрама приводило к увеличению сажеобразования в 7,6 раза по сравнению с исходным носителем.
Таким образом, проведенные исследования показали, что по выходу этилена изученные катализаторы (табл. 1) при 710 ° С располагаются в следующий ряд: II > I > III > IV > IX > VI > VII ~ VIII > V. При 800 ° С ряд имел следующий вид: II > I > III > IV > IX ~ VI > VIII > V > VII. Из приведенных данных видно, что лучшим по выходу этилена в интервале температур 710 - 830 ° С был Cr-содержащий катализатор, с содержанием хрома 0,5 мас. %. Достаточно высокая каталитическая активность керамического носителя без обработки (I, табл. 1) связана с содержанием в нем оксидов железа (1 - 3 мас.%), характеризующихся значительной активностью в процессе превращения углеводородов [8].
По выходу пропилена изученные катализаторы при 710-730 ° С располагаются в следующий ряд: VIII > VI ≥ II > IX > I > IV ≥ VII ≥ III > V. Лучший результат наблюдался у Mo-содержащего покрытия, полученного из H 2 MoO 4 . Последний превосходит Cr-содержащий катализатор (II, табл. 1) в 1,5 раза. При 800 - 830 ° С этот ряд имел следующий вид: IX > II > IV > VIII > VI > III > V ~ VII > I и лучший результат по выходу пропилена наблюдался у W- и Cr-содержащих катализаторов. По суммарному выходу алкенов в интервале температур 710 - 830 ° С лучшие результаты были у Cr-содержащего катализатора с 0,5 мас. % хрома. Наибольшая конверсия углеводородов в интервале 710 - 800 ° С наблюдалась в присутствии катализатора, содержащего 0,5 мас. % хрома, а наименьшая – у катализатора с содержанием 0,5 мас. % молибдена (V, табл. 1).
Из данных табл.1 видно, что в присутствии Cr- и Mo-содержащих катализаторов практически отсутствует коксообразование в отличие от W- катализатора и керамического носителя, на которых количество образующейся сажи было в 14 раз больше.
Таким образом, по величине конверсии, выходу этилена и пропилена лучшие результаты показал Cr-содержащий катализатор, имеющий в своем составе 0,5 мас. % хрома. По выходу этилена и низкому сажеобразованию данная каталитическая система превосходит ранее изученный нами Fe-содержащий катализатор на аналогичном керамическом носителе [8].
Методом ИК-спектроскопии исследован керамический носитель до и после пиролиза углеводородной смеси. ИК-спектры подтвердили наличие фосфатных и силикатных групп при 580–530 и 1200-1050 см - 1, интенсивность которых снижается после пиролиза, что указывает на количественные изменения содержания фаз оксидов и происходящие процессы конденсации.
В ИК-спектрах исходных образцов керамики, обработанных нитратом хрома наблюдались интенсивные полосы в области 800 и 1380 см - 1, характерные для NO 3 - -группы, которые практически отсутствовали после пиролиза, но появлялась полоса при 95 - 0900 см - 1, характерная для асимметричных колебаний Cr - O - Cr. Полосы при 500 - 400 см - 1 и 700 см - 1, характерные для Al - O, наблюдались на всех ИК-спектрах образцов, интенсивность которых не изменялась после превращения углеводородов, что указывает на отсутствие количественных изменений содержания фаз оксидов алюминия в составе керамического носителя.
В табл. 2 приведены кинетические и активационные параметры разложения пропана и образования продуктов пиролиза (метана и этилена) в реакторе, заполненном керамическим носителем, обработанным соединениями Cr, Mo и W.
Таблица 2
Кинетические и активационные параметры превращения пропана и накопления продуктов при пиролизе углеводородной смеси С 1 - С 4 в реакторе с керамическим носителема
|
№ образца |
Соединение |
Т, °С |
k·10 2 , с - 1 |
Е а , кДж/моль |
ln k 0 |
|
I |
СH 4 |
710 |
3,7 |
150,2±3,6 |
15,1±0,4 |
|
800 |
17,9 |
||||
|
С 2 Н 4 |
710 |
5,1 |
124,4±7,1 |
12,2±0,8 |
|
|
800 |
18,3 |
||||
|
С 3 H 8 |
710 |
6,1 |
234,1±8,5 |
25,8±1,0 |
|
|
800 |
64,7 |
||||
|
II |
СH 4 |
710 |
4,6 |
103,4 ± 4,8 |
10,1±0,5 |
|
800 |
23,6 |
||||
|
С 2 Н 4 |
710 |
6,7 |
112,4±5,9 |
11,1±0,7 |
|
|
800 |
19,4 |
||||
|
С 3 H 8 |
710 |
23,6 |
147,1±7,1 |
16,6±0,8 |
|
|
800 |
112,0 |
||||
|
III |
СH 4 |
710 |
3,3 |
145,8±9,6 |
14,5±1,1 |
|
800 |
14,4 |
||||
|
С 2 Н 4 |
710 |
3,9 |
167,6±4,9 |
17,2±0,6 |
|
|
800 |
21,5 |
||||
|
С 3 H 8 |
710 |
14,8 |
164,3±1,0 |
18,2±0,1 |
|
|
800 |
79,7 |
||||
|
IV |
СH 4 |
710 |
2,0 |
190,3±5,8 |
19,4±0,7 |
|
800 |
14,6 |
||||
|
С 2 Н 4 |
710 |
1,8 |
184,8±15,2 |
18,7±1,8 |
|
|
800 |
15,0 |
||||
|
С 3 H 8 |
710 |
10,0 |
182,0±9,1 |
20,0±1,0 |
|
|
800 |
74,6 |
||||
|
V |
СH 4 |
710 |
0,6 |
279,1±13,9 |
29,1±1,5 |
|
800 |
12,8 |
||||
|
С 2 Н 4 |
710 |
0,4 |
308,4±9,9 |
32,1±1,1 |
|
|
800 |
8,5 |
||||
|
С 3 H 8 |
710 |
9,9 |
198,5±16,4 |
23,1±1,9 |
|
|
800 |
86,3 |
||||
|
VI |
СH 4 |
710 |
0,8 |
261,7 ± 12,4 |
27,1±1,7 |
|
800 |
10,4 |
||||
|
С 2 Н 4 |
710 |
0,7 |
270,3±13,5 |
28,1±1,4 |
|
|
800 |
14,2 |
||||
|
С 3 H 8 |
710 |
12,7 |
184,2 ± 10,8 |
20,5 ± 1,2 |
|
|
800 |
77,1 |
||||
|
VII |
СH 4 |
710 |
1,7 |
217,9±10,8 |
22,6±1,1 |
|
800 |
18,1 |
||||
|
С 2 Н 4 |
710 |
0,5 |
251,3±12,6 |
25,4±1,3 |
|
|
800 |
8,5 |
||||
|
С 3 H 8 |
710 |
12,3 |
194,8 ± 9,9 |
21,7 ± 1,2 |
|
|
800 |
95,1 |
||||
|
VIII |
СH 4 |
710 |
0,7 |
168,5±8,4 |
15,6±0,8 |
|
800 |
3,5 |
||||
|
С 2 Н 4 |
710 |
0,5 |
285,1 ± 8,0 |
29,6 ± 1,0 |
|
|
800 |
9,4 |
||||
|
С 3 H 8 |
710 |
17,5 |
138,8 ± 8,0 |
15,2 ± 0,9 |
|
|
800 |
76,9 |
||||
|
IX |
СH 4 |
710 |
2,4 |
190.2 ± 8.0 |
19,5 ± 0,9 |
|
800 |
17,1 |
||||
|
С 2 Н 4 |
710 |
1,5 |
210,4 ± 3,7 |
21,6 ± 0,4 |
|
|
800 |
13,5 |
||||
|
С 3 H 8 |
710 |
16,2 |
165,2 ± 9,5 |
18,3 ± 1,1 |
|
|
800 |
77,0 |
Примечание . аVсмеси = 50 мл/мин; τ = 1,34 с; d = 0,6 см; S/V = 5,6∙105 см–1.
Р ас че т к он с т а н т с к оро с ти проводился по уравнению реакции первого порядка, который подтв е рж д ае тс я п рямо ли н е йн ой за в иси м ост ь ю в коорди н а та х ln 1/1-а (где а - степень превращения) от времени контакта (τ) (см. р исунок).
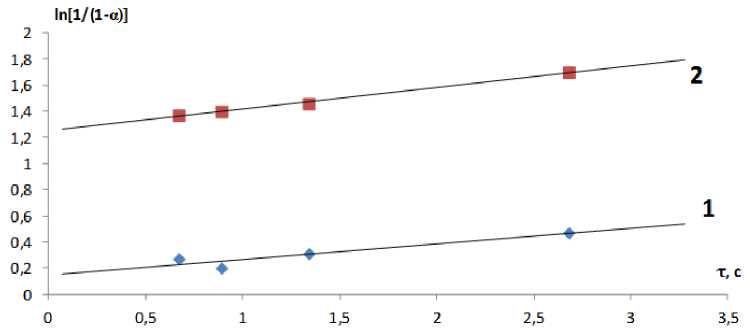
Зависимость ln[1/(1 - α)] от времени контакта при пиролизе пропана в реакторе с керамическим носителем, обработанным Cr(NO 3 ) 3 с содержанием 5 мас. % хрома: 1 - 710 °С; 2 - 800 °С
По в е л и чи не к он с та н т ы ск орости образования метана изученные катали за т оры рас п олага ю тся в ряды: II > I > III > IX > IV > VII > VI > VIII ~ V (при 710 ° С); II > VII > I > IX > IV > III > V > > VI > VIII ( при 800 ° С ). Э ти ряды находятся в хорошем соответствии с данн ыми по в ы ход у CH 4 .
По в е л и чин е к он с та н т ы скорости образования этилена ряды активност и к а тализаторов имеют следующий вид: II > I > III > IV > IX > VI > VII > VIII > V (при 710 ° С); II > I > III > IV > IX ~ « VI > VIII > V > VII (п р и 800 ° С). Таким образом, самую высокую константу скорости образования этилена имеет Cr-с од е рж а щ и й к а т а ли за тор, с содержанием металла 0,5 мас. %. На данном ка та ли за то ре э н е р ги я ак т и в а ц и и образования этилена равна 112,4 кДж/моль , что п очти в 3 р а за н и же э н е рги и ак т и в а ц и и об раз ов а н и я э ти ле н а н а Mo-содержащих катализаторах, показавших н и зк и й в ыход э ти лена и ни зк у ю с елек тивность процесса по этилену.
По вели чи н е кон с та н ты с корости распада пропана ряды имеют следую щ ий в и д : II > VIII > >IX > III > VI ~ VII > IV > V > I (при 710 ° С); II > VII > V > III > IV > VI ~ IX > VIII > I (при 800 ° С). Т а к и м об ра зо м, с ама я в ысо к а я к онв е рс ия н а б лю д а лас ь н а Cr-содержащем катализаторе (II, табл. 1).
По вели чи не отн ош е н и я к о нстанты скорости образования метана к конс т а нте с к оро с ти об разования этилена (k CH4 / k C2H4 ) изученные катализаторы располагаются в ряд: VII (3,4) > IX (1,6) > V (1,5) > VIII (1,4) > VI (1,1) ~ IV (1,1) > III (0,85) > I (0,73) > II (0,7) (710 ° С); VII (2,1) > V (1,5) > IX (1,3) > II (1,2) > IV (0,97) > I (1,0) > VI (0,7) > III (0,7) > VIII (0,4) (800 ° С). Эти данные говорят о том, что на Mo-с од е р жа щ и х катализаторах, полученных на основе мол и б д а та а ммон и я, ск орость образования CH 4 при 710 ° С в два-три раза выше скорости образования C 2 H 4 , тогда как на Cr- сод е ржа ще м к а тали за т оре и керамическом носителе скорость образован ия CH 4 ниже скорости образования C 2 H 4 . П ри б о л е е высоких температурах эти скорости практичес к и ра в н ы.
Данны е по со ст аву пр о д у ктов и значения кинетических и активационных па р ам ет р о в по казывают , ч т о пр о цесс кат ал и т ич еско г о п ир о л из а уг л ев о до р о до в С 1 - С 4 на катализаторах, содержащих металлы VI г руппы , пр от екает по го м о г енно -гетерогенному радикально-цепному механизму [5].
Заключение
В ре зу льтате п ровед е н ных исследований показано, что по основным па р а ме тра м п и рол и з а легких углеводородов С 1 - С 4 в при сутс тв и и комплексных катализаторов, содержащих металлы шестой группы (Cr, Mo, W), нанесенных в виде неорганических солей или к и слот н а к е р а ми ческ и й носитель ( к он в е р с ии , в ыходу низших алкенов и понижению сажеобразов а н и я), лучшие результаты получены на Cr- сод е р жащ е м катализаторе с 0,5 мас. % хрома в покрытии.
Работа выполн е н а при фи нансовой поддержке Министерства образован ия и нау ки Рос си йск ой Фед ерации ( к о нтракт № 3. 640. 2 014/ К ).
Список литературы Каталитический пиролиз легких алканов в присутствии соединений металлов шестой группы
- Васильева, Н.А. Генерация радикалов при пиролизе н-ундекана на BaCl2 и дефектных оксидах магния/Н.А. Васильева, Р.А. Буянов//Химия в интересах устойчивого развития. -2004. -Т. 12, № 6. -С. 661-668.
- Sanfilippo, D. Dehydrogenation of Paraffins: Synergies between Catalyst Design and Reactor engineering/D. Sanfilippo, I. Miracca//Catalysis Today. -2006. -V. 111, № 1-2. -P. 133-139.
- Light Alkane Dehydrogenation over Mesoporous Cr2O3/Al2O3 Catalyst/L. Shee, A. Sayari//Applied Catalysis A: General. -2010. -V. 389, № 1-2. -P. 155-164.
- Егорова, С.Р. Влияние высокотемпературной обработки на свойства алюмохромового катализатора дегидрирования низших парафинов/С.Р. Егорова, Г.Э. Бекмухамедов, А.А. Ламберов//Кинетика и катализ. -2013. -Т. 54, № 1. -С. 51-57 DOI: 10.7868/S0453881113010073
- Галикеев, А.Р. Детерминированная кинетическая модель каталитического пиролиза/А.Р. Галикеев//Нефтехимия. -2007. -Т. 47, № 5. -С. 389-397.
- Каталитический пиролиз легких углеводородов в присутствии ультрадисперсных частиц, сформированных электровзрывным диспергированием металлических проводников/В.М. Шекунова, Ю.Т. Синяпкин, И.И. Диденкулова и др.//Нефтехимия. -2013. -Т. 53, № 2. -С. 107-111 DOI: 10.7868/S0028242113020111
- О каталитическом пиролизе пропан -бутанового углеводородного сырья/Ю.А. Александров, В.М. Шекунова, И.А. Пищурова и др.//Журнал общей химии. -2009. -Т. 79, № 6. -С. 945-949.
- Влияние металлов восьмой группы на каталитический пиролиз низших алканов/Е.И. Цыганова, В.М. Шекунова, Ю.А. Александров и др.//Журнал общей химии. -2015. -Т. 85, № 1. -С. 24-33.
- Hagen, A. Ethane to Aromatic Hydrocarbons: Past, Present, Future/A. Hagen, F. Roessner//Catalysis Reviews: Science and Engineering. -2000. -V. 42, № 4. -Р. 403-437.
- Kazansky, V.B. Intensities of IR Stretching Bands as a Criterion of Polarization and Initial Chemical Activation of Adsorbed Molecules in Acid Catalysis. Ethane Adsorption and Dehydrogenation by Zinc Ions in ZnZSM-5 Zeolite/V.B. Kazansky, E.A. Pidko//Journal Physical Chemistry. B. -2005. -V. 109. -Р. 2103-2108.
- Гашимов, Ф.А. Продукты уплотнения в процессе превращения этилена на высококремнеземном цеолитном катализаторе/Ф.А. Гашимов//Журнал прикладной химии. -2009. -Т. 82, вып. 5. -С. 850-855.


