Каталитическое окисление серосодержащих соединений
Автор: Батоева Агния Александровна, Цыбикова Бэлэгма Амоголоновна, Будаев Саян Львович
Журнал: Вестник Бурятского государственного университета. Философия @vestnik-bsu
Рубрика: Химия
Статья в выпуске: 3, 2011 года.
Бесплатный доступ
Изучены основные закономерности каталитического окисления тиоцианатов и тиосульфатов пероксидом водорода в присутствии ионов Fe3+ и Cu2+. Представлены результаты по обезвреживанию реальных технологических растворов од- ной из золотоизвлекательных фабрик.
Цианиды, тиоцианаты, тиосульфаты, окисление
Короткий адрес: https://sciup.org/148180227
IDR: 148180227 | УДК: 66.074.3:
Текст научной статьи Каталитическое окисление серосодержащих соединений
Высокие концентрации тиоцианатов, как правило, наблюдаются при цианидном выщелачивании упорных золотосодержащих сульфидных руд или флотоконцентратов [1]. Тиоцианаты (SCN-) образуются при проведении процессов цианидного выщелачивания золота как продукт реакции между цианид-ионами (CN-) и соединениями серы, включая элементарную серу [2]:
S0 + CN- → SCN- (1)
-
S2- + CN- + H 2 O + ½ O 2 → SCN- + 2OH- (2) S 2 O 3 2- + CN- → SO 3 2- + SCN- (3)
В зависимости от содержания серы и количества оборотных циклов концентрация тиоцианатов в технологических растворах (сточных или оборотных водах) может составлять от нескольких миллиграммов до нескольких граммов на 1 л. Образование тиоцианатов приводит к увеличению расхода NaCN при цианировании и негативно влияет на процессы сорбционного выщелачивания золота [3]. Для обезвреживания цианидсодержащих технологических растворов золотоизвлекающих фабрик (ЗИФ) широко применяются: обработка активным хлором, кислородом в присутствии солей меди, так называемый INKO-процесс, озонирование, обработка солями железа с целью перевода токсичных цианидов в устойчивые нерастворимые соединения, а также их различные комбинации [4-9]. Особенностью тиоцианатов является их токсичность для аквасистем и устойчивость к разложению большинством методов, применяемых для обезвреживания цианидов. Поэтому проблема глубокой доочистки сточных или оборотных растворов от тиоцианатов является актуальной.
В последние годы определилось принципиально новое направление в практике очистки сточных вод комбинированными окислительными методами «Advanced Oxidation Processes», получившее название АОР–методы [10], суть которых заключается в жидкофазном окислении примесей высокореакционными частицами – формами активного кислорода, в первую очередь ОН–радикалами. Из комбинированных методов для практической реализации весьма привлекательной и перспективной является окислительная деструкция пероксидом водорода, поскольку при его восстановлении получаются кислород и вода, а в присутствии катализаторов – металлов переменной валентности (Fe3+, Cu2+) – реализуются условия для проведения редокс-каталитических процессов окисления тиоцианатов [11]. С учетом того, что примерно 50% цианида безвозвратно теряется за счет образования тиоцианатов, проблема регенерации цианида из тиоцианатных растворов носит не только экологический, но и экономический характер [12].
При взаимодействии тиоцианатов с пероксидом водорода в зависимости от рН среды и концентрации пероксида водорода возможно их окисление как до цианид-, так и до цианат-ионов [13-15]. Известно, что при рН>4 разложение тиоцианат ионов SCN- идет с получением цианид- и сульфат-ионов [16]. При дальнейшем окислении образующийся цианат-ион постепенно гидролизуется по уравнению:
CNO- + 2H 2 O → CO 3 2- + NH 4 +, (4)
либо может быть окислен далее до элементарного азота и диоксида углерода [13]. При низких же значениях рН<4 окисление SCN- идет c образованием цианистоводородой кислоты, которая в значительно меньшей степени подвергается дальнейшему гидролизу до цианат-иона:
SCN- + 3H 2 O 2 → HSO 4 2- + HCN + + 2H 2 O. (5)
Ранее на модельных и реальных тиоцианатсодержащих технологических растворах было показано, что окислительная деструкция SCN- наиболее эффективна при рН<3 и позволяет вернуть в производство дополнительное количество цианида [17-19].
Целью настоящей работы являлось исследование влияния серосодержащих соединений, поскольку они являются продуктом окисления сульфидов и сопутствующим поллютантом сточных и оборотных вод ЗИФ при добыче драгметаллов из упорных сульфидных руд, в частности тиосульфатов, на окисление тиоцианатов пероксидом водорода с использованием катализаторов (Fe3+, Cu2+) и обезвреживание реальных технологических растворов одной из золотоизвлекательных фабрик.
Экспериментальная часть
Для экспериментов с модельными растворами использовали реактивы марки «хч». Окисление тиоцианатов проводили при начальных концентрациях [SCN-]=17 ммоль ⋅ л-1 (1000 мг/л) и [S2O32-]=4.5 ммоль ⋅ л-1 (500 мг/л) при стехиометрически необходимой концентрации окислителя [H 2 O 2 ] 0 =51 ммоль ⋅ л-1. Состав реальной оборотной воды ЗИФ из наливного хвостохранилища ОАО «Березитовый рудник» представлен в таблице 1.
Концентрации тиоцианатов определяли фотометрированием соответствующего комплекса [20], цианидов – фотометрическим методом с пиридином и барбитуровой кислотой [21], а тиосульфатов – йодометрическим методом [22]. Атомно-абсорбционное определение ионов тяжелых металлов проводили на приборе ААS Perkin Elmer 3110. Для контроля значений рН и температуры использовали иономер рН 150-М. Для исследования полноты улавливания образующихся цианидов проводили количественный анализ на массовое содержание цианидов в поглотительном растворе [21]. Каталити- ческое окисление тиоцианатов проводили в стеклянном реакторе в статических условиях с непрерывным барботажем воздуха. В качестве катализаторов использовали растворы соответствующих солей Fe3+ и Cu2+ .
Таблица 1
Состав оборотной воды ЗИФ
|
№ п/п |
Параметры |
С, мг/л |
|
1 |
рН |
11.3 ± 0.2 |
|
2 |
Тиоцианаты |
752.0 ± 97.8 |
|
3 |
Цианиды |
272.6 ± 43.6 |
|
4 |
Тиосульфаты |
655.2 ± 98.3 |
|
5 |
Железо |
33.4 ± 7.7 |
|
6 |
Медь |
262 ± 65 |
|
7 |
Цинк |
48.3 ± 9.7 |
|
8 |
Никель |
0.620 ± 0.105 |
|
9 |
Свинец |
не обн. |
|
10 |
Хром |
0.034 ± 0.009 |
|
11 |
Кобальт |
0.628 ± 0.126 |
|
12 |
Кадмий |
0.043 ± 0.011 |
|
13 |
Кальций |
133 ± 13 |
Результаты и обсуждение
Механизм превращения SCN- достаточно сложен. Прямое окисление SCN- пероксидом водорода протекает довольно медленно, и чтобы ускорить процесс получения HCN, требуется введение в систему катализатора [23]. Изменение концентрации катализатора существенным образом сказывается на глубине и скорости реакции окисления тиоцианатов (рис. 1, табл. 2). Ранее были установлены оптимальные условия полной конверсии тиоцианатов до стадии образования цианистоводородой кислоты в присутствии ионов Fe3+: рН 2.8, мольные соотношения [H 2 O 2 ]: [SCN-]:[Fe3+]=3:1:0.2 [24]. Полная конверсия тиоцианатов наблюдается при концентрации [Fe3+]=3.6 ммоль/л. Однако аналогичного результата можно добиться при меньшей концентрации железа с использованием каталитической системы {Fe3+ + Cu2+} (рис. 1, табл. 2).
Подобный эффект можно объяснить тем, что при каталитическом окислении тиоцианатов в присутствии ионов железа небольшие добавки ионов меди генерируют гидроксильные и супероксидные радикалы по дополнительным маршрутам. В присутствии же тиосульфатов скорость и полнота реакции значительно изменяются (рис. 2): тиосульфат–ионы оказывают негативное влияние на процесс деструкции тиоцианатов, которое проявляется как за счет расходования окислителя, так и нецелевого расходования катализатора. При подкислении до рН≤3 раствора, содержащего тиоцианаты и тиосульфаты, появляется небольшое количество белого осадка. Тиосульфаты медленно разлагаются с образованием элементарной серы и сульфитов в соответствии с реакцией диспропорционирования [25]:
S2O32- + H+ = S0 + HSO3-(6)
При добавлении в раствор ионов металлов (Cu2+ или Fe3+) имеет место более быстрое, конкурирующее с тиоцианатами, окисление тиосульфатов по реакциям:
Cu2+ + S2O32- → CuS2O3 + S2O32- = S4O62-+ Cu+(7)
2Fe3+ + 2 S2O32- → 2FeS2O3+ = S4O62- + 2Fe2+(8)
и практически на 100% продуктом окисления S 2 O 3 2- являются тетратионаты S 4 O 6 2- [11, 25-26]. При этом эффективность деструкции SCN- не превышает 80% даже через 60 мин обработки, в то время как степень конверсии самих тиосульфатов достигает 93% уже в течение первых пяти минут.
Поскольку тиосульфаты в присутствии ионов Fe3+ и Cu2+ окисляются с высокой скоростью и достаточно полно, можно утверждать, что лимитирующей стадией в данной системе{(SCN- + S 2 O 3 2-) + H 2 O 2 }, как было определено и в ранее рассмотренной цианидсодержащей – {(SCN- + CN-) + H 2 O 2 } [17], является реакция окисления тиоцианатов. Полного и достаточно быстрого окисления SCN- в растворе, содержащем S2O32-, можно добиться, увеличивая концентрацию ионов Fe3+ в реакционной смеси (табл. 3).
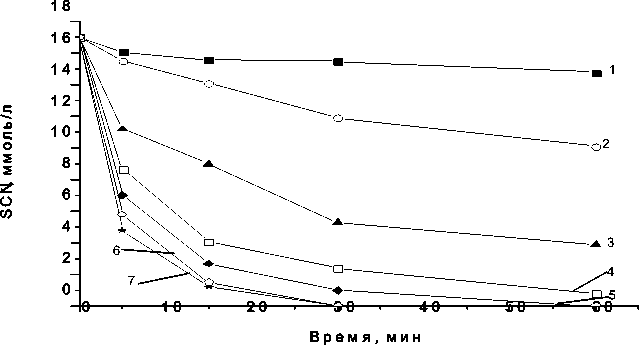
Рис. 1. Влияние концентрации ионов Fe3+ на процесс окисления SCN- пероксидом водорода: рH 2.8, [SCN-] 0 =17.2 ммоль ⋅ л-1, [H 2 O 2 ] 0 =51 ммоль ⋅ л-1, [Fe3+], ммоль ⋅ л-1 соответственно: 1 – 0.0, 2 – 0.45, 3 – 0.9, 4 – 1.8, 5 – 2.7, 6 – 2.7 (в присутствии [Cu2+]=0.78 ммоль ⋅ л-1), 7 – 3.6
Таблица 2
Зависимость начальной скорости реакции и эффективности окисления SCN- от концентрации Fe3+
|
Условия |
Fe3+, ммоль ⋅ л-1 |
W0,ммоль ⋅ л-1 ⋅ мин-1 |
Эффективность окисления, % |
|
[SCN-] o = 17.2ммоль ⋅ л-1 |
0 |
0.2 |
9.5 |
|
pH = 2.8 |
0.9 |
1.2 |
69.1 |
|
1.8 |
1.7 |
85.9 |
|
|
2.7 |
1.8 |
94.5 |
|
|
*[Cu2+]= 0.78 ммоль·л-1 |
3.6 |
2.4 |
100 |
|
2.7* |
2.2 |
100 |
* эффективность процесса рассчитана через 30 мин обработки
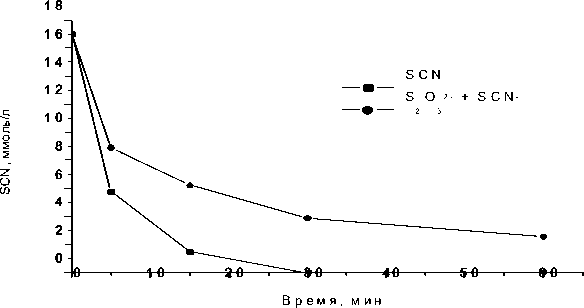
Рис. 2. Влияние S2O32- на процесс окисления SCN- пероксидом водорода в присутствии {Fe3++ Cu2+}: рH 2.8, [SCN-] 0 =17.2 ммоль ⋅ л-1, [S 2 O 3 2-] 0 =4.5 ммоль ⋅ л-1, [H 2 O 2 ] 0 =51 ммоль ⋅ л-1, [Fe3+]=2.7 ммоль ⋅ л-1, [Cu2+]=0.78 ммоль ⋅ л-1
Полученные данные свидетельствуют о том, что при [S2O32-] ≤ 4.5 ммоль/л и [Fe3+] ≥ 3.6 ммоль/л весь пероксид водорода расходуется на окисление тиоцианатов, а тиосульфаты окисляются по реакциям (7) и (8). Увеличение начальной концентрации тиосульфатов до 9.0 ммоль/л приводит к снижению W0 до 1.6 ммоль/л ⋅ мин и степени конверсии тиоцианатов до 88% за 30 мин. Очевидно, что в этом случае Н 2 О 2 расходуется и на окисление тиосульфатов по реакции:
2S 2 O 3 2- + H 2 O 2 + 2H+ = S 4 O 6 2- + 2H 2 O (9)
Таблица 3
Зависимость начальной скорости реакции и эффективности окисления SCN- в присутствии [S2O32-] от концентрации Fe +
|
Условия |
[Fe3+], ммоль - л |
W 0 , ммоль - л-1 - мин-1 |
[S 2 O 3 2-], моль - л |
Эффективность окисления, % |
|
|
SCN- |
S 2 O 3 2- |
||||
|
[SCN-] o = 17.2 ммоль - л [Cu2+]= 0.78 ммоль·л pH = 2.8 |
0 |
0.2 |
4.5 |
9.5 |
|
|
2.7 |
1.8 |
94.0 |
95.5 |
||
|
3.6 |
2.4 |
100 |
100 |
||
|
4.5 |
2.6 |
100 |
100 |
||
|
3.6 |
1.6 |
9.0 |
88 |
85.9 |
|
Примечание : эффективность процесса рассчитана через 30 мин обработки
Согласно полученным данным, оптимальными условиями можно считать: рН<3, мольные соотношения [H 2 O 2 ]:[SCN-]=3:1, [SCN-]:[Fe3+]: [Cu2+]=5:1:0.2 [27]. Сравнение процессов окисления серосодержащих соединений SCN- + S2O32- при их совместном присутствии пероксидом водорода с использованием катализаторов Fe3+, Cu2+ и каталитической системы {Fe3++ Cu2+}, а также расчет синергического индекса свидетельствуют о взаимном положительном влиянии ионов железа и меди. Так, значение синергического индекса, рассчитанного по формуле, равно 1.5÷1.7 (рис. 3):
r rf ( ПВ + Fe ( III ) + Cu ( II ))
f(Fe (III )Cu (II )) = ;---------------—-------------, rf (ПВ + Fe (III )) + rf (ПВ + Cu (II ))
где f (Fe(II)+Cu(II)) – синергические индексы; r f – конверсия тиоцианатов или тиосульфатов через 5 мин; f = 1 – аддитивность; f > 1- синергизм
В таблице 4 представлены результаты экспериментов на реальной воде ЗИФ из наливного хвосто-хранилища ОАО «Березитовый рудник» (Амурская область) (табл. 1). Отработанная технологическая вода предварительно обрабатывалась по AVR-методу (регенерационный метод), т.е. воду подкисляли до рН < 3.0, далее подвергали барботажу кислородом воздуха с целью отдувки образующейся HCN и поглощения ее раствором щелочи. Подробное описание технологии извлечения цианидов из отработанных растворов цианирования сульфидных флотоконцентратов представлено в работах [18-19, 28]. После проведения AVR-процесса вода подвергалась обработке пероксидом водорода в присутствии катализаторов.
Таблица 4
Результаты очистки модельных растворов и реальных оборотных вод ЗИФ
|
Показатели |
Модельный раствор |
Производственная вода |
||||||
|
AVR |
*Окисление H 2 O 2 |
|||||||
|
S 2 O 3 2- |
SCN" |
CN- |
S 2 O 3 2- |
SCN" |
S 2 O 3 2- |
SCN" |
||
|
Сисх, мг/л |
500 |
1000 |
272.6 |
655.2 |
752.0 |
649.4 |
735.2 |
|
|
Сост, мг/дм3 через t, мин. |
5 |
39.0 |
339.7 |
- |
- |
- |
57.4 |
373.2 |
|
15 |
37.4 |
89.12 |
- |
- |
- |
45.9 |
252.3 |
|
|
30 |
36.7 |
отс. |
- |
- |
- |
40.2 |
116.9 |
|
|
60 |
36.7 |
отс |
отс. |
649.4 |
735.2 |
40.2 |
26.7 |
|
|
Эффективность, % |
94.2 |
100 |
96 |
1.2 |
3.4 |
93.8 |
92.4 |
|
*мольные соотношения [H2O2]:[SCN-]=3:1, [SCN-]:[Fe3+]: [Cu2+]=5:1:0.2
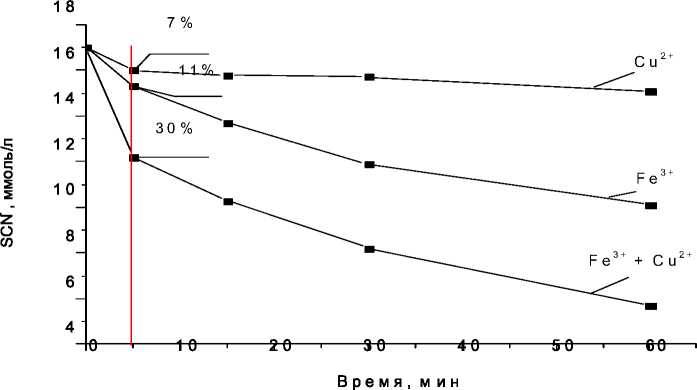
Рис. 3. Влияние ионов Fe3+ и Cu2+ на процесс окисления SCN- пероксидом водорода: рH 2.8, [SCN-]0=17.2 ммоль ⋅ л-1, [S 2 O 3 2-] 0 =4.5 ммоль ⋅ л-1, [H 2 O 2 ] 0 =51 ммоль ⋅ л-1. 1 – [Cu2+]=0.38 ммоль ⋅ л-1, 2 – [Fe3+]=0.44 ммоль ⋅ л-1, 3 – [Cu2+] + [Fe3+]
Выводы
Изучены основные закономерности каталитического окисления тиоцианатов и тиосульфатов пероксидом водорода в присутствии ионов Fe3+ и Cu2+. Лимитирующей стадией является реакция окисления тиоцианатов. Определены оптимальные мольные соотношения ионов металлов в используемой каталитической системе: [SCN-]:[Fe3+]: [Cu2+]=5:1:0.2. Выявлен синергизм совместного действия ионов металлов в каталитической системе {Fe3+ и Cu2+} при окислении тиоцианатов и тиосульфатов пероксидом водорода. Полученные результаты подтверждают перспективность применения комбинированного окислительного метода, заключающегося в обработке воды пероксидом водорода в присутствии ионов железа (III) и меди (II) для обезвреживания серосодержащих соединений сточных или оборотных вод ЗИФ.