Кинетическая модель деактивации О2 ( а 1D)
Автор: Торбин Алексей Петрович, Першин Андрей Александрович, Азязов Валерий Николаевич
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Физика и электроника
Статья в выпуске: 2-1 т.17, 2015 года.
Бесплатный доступ
Для повышения производительности электроразрядного кислородно-йодного лазера необходимо увеличивать давление О 2 на выходе электроразрядного генератора синглетного кислорода O 2( a 1D). Механизм деактивации O 2( a 1D) при повышенных давлениях кислорода до конца не изучен. В данной работе показано, что колебательно-возбужденный озон O 3( υ ), образованный в трехчастичном процессе рекомбинации O + O 2 + M ® O 3( υ ) + M, играет важную роль в деактивации синглетного кислорода в смесях O-O 2-O 3. В послеразрядной зоне главным каналом деактивации O 2( a 1D) является процесс O 3( υ ³2) + O 2( a 1D) ® 2O 2 + O. Если не принимать никаких мер по снижению концентрации атомов кислорода, то вклад этого процесса в общую скорость удаления синглетного кислорода будет значительным даже в разрядной зоне.
Синглетный кислород, атомы кислорода, лазерный фотолиз, деактивация, колебательно-возбужденный озон
Короткий адрес: https://sciup.org/148203601
IDR: 148203601 | УДК: 621.373.826
Текст научной статьи Кинетическая модель деактивации О2 ( а 1D)
Низкий коэффициент усиления активной среды электроразрядного кислородно-йодного лазера (ЭКИЛ) [1] не позволяет осуществлять эффективный съем запасенной в синглетном кислороде О2( а 1∆) энергии [2]. Для повышения коэффициента усиления необходимо увеличивать концентрации как атомов йода, так и молекул О2( а 1∆). Обнаружено [3], что скорость деактивации О2( а 1∆) на выходе электроразрядного генератора синглетного кислорода (ЭГСК) растет с увеличением концентраций атомов кислорода [О], молекул кислорода [О2], а также буферного газа [M]. Темп убыли О2( а 1∆) на выходе ЭГСК удовлетворительно объясняется феноменологическим трехчастичным механизмом деактивации [3]
О + О2( а 1∆) + М → О + О2+ М. (1)
В [4-6] также наблюдали аномально высокую скорость деактивации О2( а 1∆) в смесях О-О2-Ar-He-CO2 в послефотолизной зоне. При этом добавление Ar не сказывалось на скорости деактивации, а добавление He и CO2 даже уменьшало темп деактивации О2( а 1∆) [6], что находится в противоречии с механизмом (1). Темп убыли O2( a 1D) в послефотолизной зоне хорошо объясняется химическим процессом [5, 6]
O2( a 1D) + O3( υ ) → 2O2+ O, (2)
где колебательно-возбужденная молекула озона O3( υ ) образуется в процессе трехчастичной рекомбинации [7]
О + О2+ М → О3( υ ) + М. (3)
Здесь υ = υ 1 + υ 2 + υ 3 – суммарное число квантов на деформационной υ 2 =701 см-1 , симметричной υ 1 =1103 см-1 и антисимметричной υ 3 =1042 см-1 валентных модах молекулы озона [7]. В ряде работ [7-10] также отмечается, что О3( υ ) эффективно реагирует с O2( a 1D). Несмотря на это, процесс (2) ранее не привлекался для объяснения высокого темпа убыли O2( a 1 Δ ) на выходе ЭГСК. Целью данной работы является определение влияния процесса (2) на динамику O2( a 1 Δ ) в ЭКИЛ.
РЕЗУЛЬТАТЫ И АНАЛИЗ
Кинетическая схема процессов с участием колебательно-возбужденного озона приведена в [6]. Отсутствие измеренных значений вероятностей возбуждения колебательных мод молекулы О3 в процессе (3) и констант скоростей процесса (2) для конкретных наборов значений υ 1 , υ 2 и υ 3 осложняет моделирование колебательной кинетики озона. В [5] показано, что упрощенная модель колебательной кинетики озона с объединенной модой υ , адекватно описывает экспериментальные результаты, полученные в [4-6]. В процессе (3) образуется молекула озона с υ ≥2 [5, 7]. В столкновениях с частицами среды колебательные кванты перераспределяются между тремя модами
O3( υ 1, υ 2, υ 3) + M ↔ O3( υ 1+1, υ 2, υ 3-1) + M
O3( υ 1, υ 2, υ 3) + M ↔ O3( υ 1, υ 2+1, υ 3-1) + M.
O3( υ 1, υ 2, υ 3) + M ↔ O3( υ 1-1, υ 2+1, υ 3) + M
O3( υ ) деактивируется в VT процессе [7]
О3( υ ) + М → О3( υ -1) + М, (4)
или удаляется в химических реакциях (2) и
O3( υ ) + О → O2 + O2. (5)
Скорости реакций (2) и (5) с υ <2 медленные и не оказывают существенного влияния на кинети-
Известия Самарского научного центра Российской академии наук, т.17, №2, 2015
ку O3( u ) [5]. Для и > 2 в [5] приводятся следующие значения констант скоростей реакций: к 2 = 4,1 х 1011 см 3 с -1 и к 5 = 1,2 х 1011 см 3 с -1.
Квазистационарная концентрация O3( u > 2) может быть найдена из баланса его образования в процессе (3) и убыли в процессах (2), (4) и (5):
1 k зМ [О][О 2 ][М]
М
Рз Ф > 2)] =
k 2 [O 2 ( a )] + 1 k 4M [M] + k 5[O] M . (6)
Покажем, что процесс (2) обеспечивает такие же скорости убыли О2(а1∆) как и процесс (1) для условий экспериментов работы [3], где впервые был предложен трехчастичный процесс деактивации. Для этого рассмотрим отношение скоростей этих процессов с учетом (6):
Q = k 2 [O 3 ( u> 2)][O 2 ( a )] 2/1 1 k ,M [O][O 2 ( a )][M]
M k 2[O2]1 k 3M[M] M
1 k M I k 2 [O 2 ( a )] + 1 k M [M] + к 5[О] M V M
Для условий экспериментов [3]: Ar:O2=99:1, давление смеси 100 Торр, концентрация молекул синглетного кислорода [O2( а )]=1,5 х 1015 см3, [O]=2 х 1015 см3, температура смеси T =300 K при к 1A =0,62 х 10-32 см6 с-1 [3], к 1 O2=1 х 10-32 см6 с-1 [3], к 3O2=6 х 10-34 см6 с-1 [3], к 3Ar=0,62 х к 3 02 [3], к 4 O2=3 х 10 —14 см3с-1 [7], к 4 Ar=5,9 х 10-15 см3 с-1 [7] отношение Q 2/1 близко к единице. Следовательно, процесс (2) обеспечивает темпы убыли О2(а1∆) на выходе ЭГСК.
Скорость процесса (2) с учетом (6) может быть представлена в виде:
k 2 [O 2 ( a )] 1 k 3M [O][O 2 ][M]
R = k 2 [O3 ( u > 2)][O 2 ( a )] =----------------------
-
2 2L л Л J k 2[O2( a )] + 1 k 4 M [M] + k 5[O].
M
Для типичных условий в послеразрядной зоне ЭГСК [1]: [He]= 9*1017 см3, [02]= 2,5 х 1017 см3, [0]=5 х 1015 см3, [O2( а )]=3*1016 см3, T =550 K слагаемые в знаменателе удовлетворяют условию k 2 [O 2 ( a )] >> 1 k 4M[M] + k 5[O] . В этом случае M
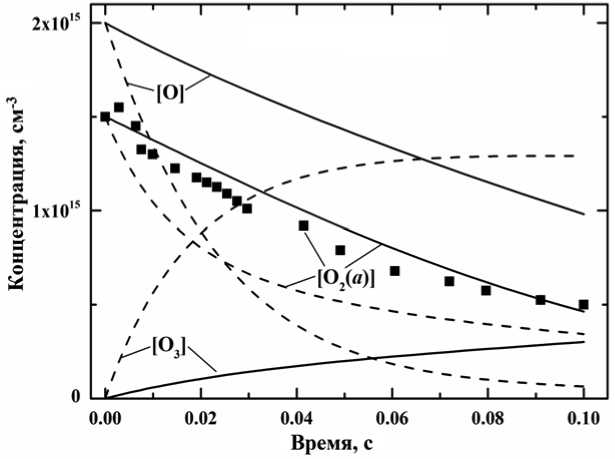
Рис. 1. Временные профили концентраций O, O2( а 1 Д ) и O 3 в послеразрядной зоне
R 2 « 1 k 3M [O][O2][M] и скорость процесса M
-
( 2) лимитируется скоростью образования O3( υ ) в процессе трехчастичной рекомбинации (3). Это явилось причиной, почему в [3] склонились в пользу трехчастичной деактивации O2( a 1 Δ ).
На рис. 1 представлены временные профили концентраций O, O2( a 1 Δ ) и O3 на выходе несамостоятельного разряда для условий эксперимента из [3]: состав газовой смеси Ar:O2 = 99:1, общее давление P = 100 Торр. Символами обозначены экспериментальные значения концентрации O2( a 1 Δ ) из [3]. Сплошными линиями на рисунке показаны расчетные значения концентраций согласно двухчастичному (процесс (2)), а пунктирными – трехчастичному (процесс (1)) механизму деактивации синглетного кислорода.
Из рис. 1 очевидно, что предложенная кинетическая модель двухчастичной деактивации синглетного кислорода обеспечивает лучшее согласование с экспериментально полученными значениями концентрации O2( a 1 Δ ), чем трехчастичная. Более того, предложенная модель предсказывает более низкие скорости удаления атомарного кислорода и наработки O3 вследствие регенерации атомов O в процессе (2). В результате согласно двухчастичному механизму деактивации O2( a 1 Δ ) концентрация атомов кислорода падает всего в два раза за 0,1 с , в то же время как в трехчастичной кинетической модели она снижается практически до нуля за такой же промежуток времени.
Реакция (2) может вносить заметный вклад в скорость убыли О2( а 1∆) также в разрядной зоне ЭГСК. Рассмотрим отношение скорости данной реакции к скорости самого быстрого процесса в разрядной зоне - деактивации О2( а 1∆) электронным ударом
О2( а 1 А) + е ^ О2 + е, (7) константа скорости которой к 7 = 1,02 х 10 -9 см 3 с -1[11].
Отношение скоростей процессов (2) и (7) определяется по формуле:
Q 2/7 = k JO,№ 2>][O ; ( a )] = k .- tO«Q .« Ml
k [e '°/ a >1 k j,/ k 7[O _( a >] , y k M[M] + k , [O]1 .
V M
Для экспериментальных условий [12] отношение скоростей процессов (2) и (7) составляет Q 2/7 « 0,2, в случае когда атомы О не удалялись из системы. В экспериментах с уменьшенной концентрации атомов О за счет добавления NO и покрытия стенок камеры окисью ртути отношение намного меньше Q 2/7 « 0,03. Следовательно, процесс (2) дает заметный вклад в скорость убыли O2( a 1 Δ ) также в разрядной зоне ЭГСК в случаях когда имеется избыток атомов О. В [12] за счет удаления избытка атомов О получена рекордная плотность О2( а 1∆) в ЭГСК.
ЗАКЛЮЧЕНИЕ
Таким образом, процесс (2) предсказывает наблюдаемые скорости деактивации O2( a 1 Δ ) как в послеразрядной [3], так и в послефотолизной [5] зонах. Процессы (2)-(5) также необходимо включать в кинетическую схему процессов разрядной зоны ЭГСК. В ряде работ [4-9] приведены экспериментальные факты в пользу процесса (2), тогда как процесс (1) феноменологический и он не объясняет темпы убыли O2( a 1 Δ ) в послефото-лизной зоне [4, 5]. Скорость деактивации O2( a 1 Δ ) может быть уменьшена удалением избытка атомов O, например, добавлением в смесь NO [1] или покрытием стенок камеры окисью ртути [12], а также добавлением в смесь на выходе ЭГСК тушителей O3( υ ), таких как СО2, SF6, SiF4 и т.д.
Работы в СГАУ поддержаны Минобрнауки РФ в рамках программы повышения конкурентоспособности СГАУ на 2013-2020 гг. и Государственного задания вузам и научным организациям в сфере научной деятельности, (гос. задание № 3.161.2014/K), а в СФ ФИАН поддержаны РФФИ (грант № 14-05-97013).
Список литературы Кинетическая модель деактивации О2 ( а 1D)
- Benavides G.F., Woodard B.S., Zimmerman J.W., Palla A.D., Day M.T., King D.M., Carroll D.L., Verdeyen J.T., Solomon W.C. IEEE J. Quantum Electr. 48, 741 (2012).
- Mezhenin А.V., Azyazov V.N., IEEE J. Quantum Electr., 49, 739 (2013).
- Vasiljeva A.N., Klopovskiy K.S., Kovalev A.S., Lopaev D.V., Mankelevich Y.A., Popov N.A., Rakhimov A.T., Rakhimova T.V. J. Phys. D: Appl. Phys. 37, 2455 (2004).
- Azyazov V.N., Mikheyev P.A., Postell D., Heaven M.C. Chem. Phys. Lett. 482, 56 (2009).
- Azyazov V.N., Heaven M.C. Int. Jour. Chem. Kinet. (2014) в печати.
- Azyazov V.N., Mikheyev P.A., Heaven M.C. Proc. SPIE 7751, 77510E (2010).
- Steinfield J.I., Adler-Golden S.M., Gallagher J.W. J. Phys. Chem. Ref. Data 16, 911 (1987).
- Kurylo M.J., Braun W., Kaldor A., Freund S.M., Wayne R.P. J. Photochem. 3, 71 (1974).
- Rawlins W.T., Caledonia G.E., Armstrong R.A. J. Chem. Phys. 87, 5209 (1987).
- Клоповский К.С., Ковалев А.С., Лопаев Д.В., Рахимов А.Т., Рахимова Т.В. Физика плазмы 18, 1606 (1992).
- Zimmerman, J.W., Dissertation, University of Illinois at Urbana-Champaign
- Braginsky O.V., Kovalev A.S., Lopaev D.V., Proshina O.V., Rakhimova T.V., Rakhimov A.T., Vasilieva A.N. J. Phys. D: Appl. Phys. 40, 6571 (2008).


