Кинетические аспекты бромирования пластификатора фталатного типа
Автор: Плотникова Р.Н.
Журнал: Вестник Воронежского государственного университета инженерных технологий @vestnik-vsuet
Рубрика: Химическая технология
Статья в выпуске: 1 (91), 2022 года.
Бесплатный доступ
Рассмотрены основные характеристики сложной системы непредельный пластификатор-бром с использованием основных «рабочих компонентов» - изомеров 2-этилгексил-2-этилгексенфталата. Принято во внимание, что сложноэфирный пластификатор фталатного типа является полярным соединением с дипольным моментом на уровне диоктилфталата, входящего в его состав. Показано, что в процессе бромирования молекулярный бром вступает в физическое взаимодействие со всеми компонентами пластификатора. Дозированное введение брома в систему при высоких скоростях перемешивания приводит к образованию гомогенной термодинамически устойчивой системы, так как параметры растворимости компонентов практически одинаковы. С использованием модельной смеси бром-диоктилфталат-дибутилфталат показано, что смешение брома с пластификаторами в любых исследованных соотношениях не приводит к появлению границы «бром в пластификаторе» или «пластификатор в броме». Тем самым установлена неограниченная растворимость брома в пластификаторе при условиях его бромирования. С использованием метода УФ-спектроскопии на модельных смесях уксусная кислота-бром-вода; уксусная кислота-бром-гексан доказано, что в реальной системе непредельный пластификатор-бром бромирование наиболее вероятно осуществляется только молекулярным бромом без образования димеров брома. Показан механизм бромирования непредельных фталатов, входящих в состав пластификатора. Предложена система кинетических уравнений в безразмерных переменных. Выявлено, что характер теоретических кривых существенно зависит от скорости введения брома при неизменном механизме реакции. Отмечено изменение лимитирующих стадий процесса бромирования в зависимости от скорости введения брома в систему.
Кинетика бромирования, фталатные пластификаторы, уф-спектроскопия, молекулярный бром, кинетическая модель
Короткий адрес: https://sciup.org/140293763
IDR: 140293763 | УДК: 360
Текст научной статьи Кинетические аспекты бромирования пластификатора фталатного типа
Исследование скорости реакций в зависимости от различных факторов представляет собой не только теоретический, но и практический интерес. От кинетических особенностей зависит как производительность применяемой аппаратуры, обеспечивающий необходимое количество продукции, так и характеристики данного оборудования. Подобное исследование позволяет выявить методы подавления нежелательных процессов и интенсификации целевых реакций [1–5].
Для построения кинетической модели необходимо знать характеристики реакционной среды, установить механизм протекания процесса, наличие промежуточных продуктов и термодинамику процесса. Для многокомпонентных систем, созданных на основе отходов производства, определение подобных характеристик затруднено.
Исследуемый объект – сложная многокомпонентная система, предоставленная непредельным пластификатором, при кинетическом исследовании, порождает большие трудности для химического и математического описания [6]. Поэтому сложная система в рассматриваемом случае [7] смоделирована «рабочими компонентами» – изомерами 2-этилгексил-2-этилгексен-
This is an open access article distributed under the terms of the Creative Commons Attribution 4.0 International License
Плотникова Р.Н.Вестник ВГУИТ, 2022, Т. 84, №. 1, С. 226-231 фталата. Ди-2-этилгексилфталат, дибутилфталат и примеси являются растворителем.
Методы
Сложные эфиры карбоновых кислот являются полярными соединениями. Дипольный момент ди–н-бутил-о-фталата, входящего в состав пластификатора, равен 2,82 D; диэлектрическая проницаемость самого пластификатора находится на уровне диэлектрической проницаемости уксусной кислоты [8], дипольный момент которой составляет 1,74 D. Молекулярный бром, обладая одной из самых высоких величин поляризунемости α = 6,43×103 м3 на одну молекулу, вступает в физическое взаимодействие со всеми компонентами пластификатора, что ведет к образованию гомогенной термодинамически устойчивой системы, так как параметры растворимости компонентов практически одинаковы [7].
С целью определения растворимости брома в пластификаторе исследовали модельную смесь бром-диоктилфталат-дибутилфталат (Вr 2 -ДОФ-ДБФ), поскольку бром вступает в реакцию с непредельными эфирами изучаемого пластификатора в исследованном интервале температур от 273 до 333 К.
Указанная модельная смесь выбрана в соответствии с литературными данными, свидетельствующими, что ДОФ и ДБФ при соблюдении обоснованных в [8, 9] оптимальных условиях реакции бромирования не вступают во взаимодействие с бромом.
В ходе исследования указанной модельной смеси приливали к смеси эфиров ДОФ и ДБФ, взятых в соотношении 9:1, молекулярный бром в количестве 1÷200 мас. % на 10 мас. % эфиров, и определяли наличие границы пла-стификатор-бром. Проведенное исследование позволило сделать вывод о неограниченной растворимости брома в пластификаторе при условиях его бромирования, поскольку смешение брома с пластификаторами в любых указанных соотношениях не приводило к появлению границы «бром в пластификаторе» или «пластификатор в броме».
Результаты и обсуждение
Попытка построить диаграммы, характеризующие зависимости температуры кипения раствора от состава, не дала желаемого результата, поскольку было отмечено повышение реакционной способности о-фталатов с образованием бромированных в ядро или бромзамещенных в алифатическом радикале фталатов. Кроме того известно, что температура кипения брома 332,2 К, в то время как ДБФ кипит при 613 К, а ДОФ – при 404 К (при 666,5 кПа) Давление паров ДБФ при 423 К составляет 6,7–21,0 Па.
Следовательно бром, не вступивший в реакцию, удаляется из жидкой фазы раньше, чем она закипает. Удельная мольная теплота испарения для брома ΔНисп = 29,5 кДж/моль, для ДБФ ΔНисп = 100 кДж/моль.
При растворении 28 мл брома в 100 мл ДОФ в течении 6 мин при скорости подачи брома 4,7 моль/мин наблюдали повышение температуры смеси с 296,9 до 303,2 К. То есть температура поднялась на 5,3 градуса, что свидетельствует об отрицательном изменении энтальпии при смешении с образованием термодинамически устойчивой гомогенной системы [10].
Большинство схем бромироавния непредельных органических соединений, предлагаемых в литературе, предполагают образование активированного комплекса, представленного в виде циклического катиона бромония.
Переходное состояние в электрофильных реакциях присоединения брома, характеризуемое образованием катиона бромония, вклюает две стадии: стадию образования циклического переходного комплекса бром-олефин, считающуюся лимитирующей, и стадию, завершающую присоединение брома [11, 12].
Ряд авторов предполагает, что при бромировании непредельных органических соединений атака олефина на первой стадии производится димерными молекулами брома [13, 14]. Образование последних требует специального доказательства. С этой целью проведены исследования модельных смесей уксусная кислота-бром-вода; уксусная кислота-бром-гексан методом ультрафиолетовой спектроскопии на спектрометре SPECORD-UVVIS в области 30000–12800 см-1 с лампой накаливания. Спектрограммы приведены на рисунках 1, 2.
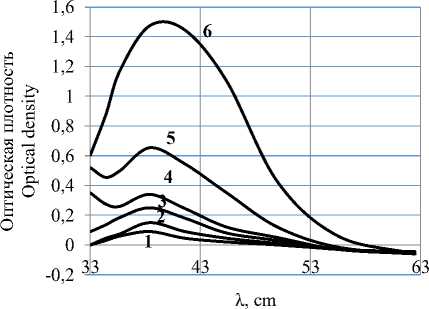
Рисунок 1. УК-спектр модельной смеси бромуксусная кислота-вода с концентрацией брома в уксусной кислоте, моль/л: 1 – 0,039; 2 – 0,39; 3 – 0,68; 4 – 0,97; 5 – 1,4; 6 – 3,9
Figure 1. UK-spectrum of a model mixture of bromineacetic acid-water with bromine concentration in acetic acid, mol / l: 1 – 0,039; 2 – 0,39; 3 – 0,68; 4 – 0,97; 5 – 1,4; 6 – 3,9
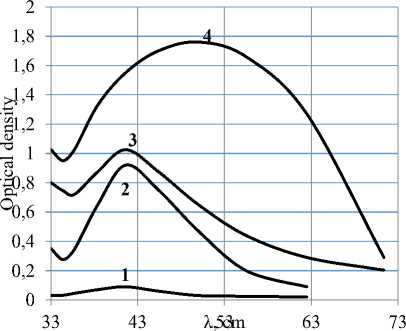
Рисунок 2. УК-спектр модельной смеси бромуксусная кислота-гексан с концентрацией брома в уксусной кислоте, моль/л: 1 – 0,036; 2 – 1,4; 3 – 1,7; 4 – 4,0
Figure 2. UK-spectrum of a model mixture of bromineacetic acid-hexane with bromine concentration in acetic acid, mol/l: 1 – 0,036; 2 – 1,4; 3 – 1,7; 4 – 4,0
Указанные модельные смеси выбраны с целью выявления полос поглощения за счет образования димеров брома. Известно, что при образовании ассоциатов наряду с полосой поглощения молекулярного соединения появляются полосы поглощения ассоциатов. Увеличение концентрации ассоциатов приводит к усилению полосы их поглощения за счет ослабления полосы поглощения, характеризующей молекулярное состояние [15–19]. Повышение температуры и введение полярных растворителей приводит также к ослаблению или полному исчезновению полосы поглощения ассоциатов и усилению полосы поглощения, характерной для молекулярного состояния.
Как следует из приведенной структуры модельных систем, уксусная кислота использована взамен непредельного пластификатора. Подобная замена была произведена на основании выводов, сделанных [8] относительно близости характеристик диэлектрической проницаемости непредельного пластификатора и уксусной кислоты.
Полярный растворитель – вода в первом случае использован с целью разрушения возможно присутствующих в системе димеров брома и получения чистой полосы поглощения молекулярного брома, которая могла бы быть использована для сравнения со спектром поглощения в неполярном растворителе. В данном случае высокая полярность воды и низкая концентрация брома исключает образование в этой системе ассоциатов брома.
Выбор системы уксусная кислота-бром-гексан обоснован тем, что гексан является неполярным растворителем, и поэтому никакого дополнительного воздействия на модельную систему при соотношении уксусная кислота – ром 5:1 не оказывает. Указанное соотношение компонентов имеет место в реальной системе непредельный пластификатор-бром.
Спектры системы, снятой в неполярном гексане, могли бы отразить полосу поглощения, свидетельствующую об образовании ассоциированных молекул брома. Однако, как видно из рисунков 1–2, спектры модельных систем имеют только одну полосу поглощения, соответствующую молекулярному брому при любых приведенных концентрациях брома в модельной смеси.
Таким образом в реальной системе непредельный пластификатор-бром бромирование наиболее вероятно осуществляется только молекулярным бромом.
В таком случае механизм бромирования возможно представить следующим образом [20, 21]:
k 1
НП + Bq ^ А k2
А ^ Б + Br - k3
Б + Br - ^ П или k1'
НП + Bq ^ А'
k 2'
А + Bq ^ Б' + Bq- k3'
Б' + Bq ^ П + Bq , где НП – непредельный пластификатор; П – продукт реакции; А и А’, Б и Б’ – промежуточные комплексы.
Классическая модель бромирования од- новременно двух непредельных компонентов, входящих в состав пластификатора, с непрерывной подачей брома в безразмерных переменных приобретает вид:
12 22
dX B 2 . d r
S 1 aS 2 aS
Если принять a = ( C нп oi + C нп 02 )-1 = C нп о-1 , откуда 6 = kJ a = kC ^ 0, тогда
НП 1 НП 2
НП 1 ; X НП 2 ;
CНП 0 CНП 0
X Br 2
CBr 2
CНП 0
T k i С нп 0 t .
Плотникова Р.Н.Вестник ВГУИТ, 2022, Т. 84, №. 1, С. 226-231
Окончательно для кинетической модели имеем:
dX НП 1
dT dX НП2
dT dX
—^rL = p — x
dT
НП 1 Br 2
= T X НП 2 X Br 2
Br 2
—
Br 2
где 0 = U 0 C HП k 1 ;; у = k ! (к 2 .
Решение системы в графическом виде для
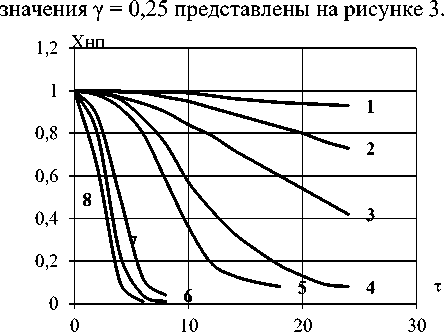
Рисунок 3. Зависимость X НП от τ при γ = 0,25
для различных значений β
Figure 3. Dependence of X NР on τ at γ = 0.25 for different values of β
При анализе полученных графических зависимостей выявлено, что характер теоретических кривых существенно зависит от значений коэффициента β при неизменном механизме
постепенно исчезает (кривые 2–4). И, наконец, зависимость X^ = X^ ( t ) становится практически линейной (прямая 1).
Основные причины отмеченного поведения кинетических зависимостей состоят в том, что изменяются лимитирующие стадии процесса бромирования. При больших β скорость подачи брома превосходит кинетическую константу, и, следовательно, основные сопротивления сосредотачиваются в кинетической области. При малых β процесс лимитируется скоростью подачи брома. Естественно, что при промежуточных значениях β наблюдается смешанная область.
Заключение
Бромирование непредельного пластификатора из отходов производства, содержащего в своем составе изомеры 2-этилгексил-2-этил-гексенфталата, идет с образованием гомогенной термодинамически устойчивой системы молекулярным бромом без образования его димеров.
Построенная кинетическая модель бромирования непредельного фталатного пластификатора в безразмерных переменных позволила определить, что основным лимитирующим фактором процесса является скорость введения брома в систему. Получены параметры безразмерной переменной, определяющей переход процесса бромирования из кинетической в диффузионную область.
Список литературы Кинетические аспекты бромирования пластификатора фталатного типа
- Федотов В.Х., Кольцов Н.И., Косьянов П.М. Влияние автокаталитических стадий на динамику сопряженных химических реакций // Известия высших учебных заведений. Химия и химическая технология. 2020. Т. 63. №. 2. С. 14-20. doi: 10.6060/ivkkt.20206302.6053
- Fedotov V. Kh., Kol'tsov N.I. Kinetics of redused models of catalytic reactions // Rus. Journ. Phys. Chem. B. 2015. V. 10. № 6. P. 875-883.
- Федотов В.Х., Кольцов Н.И. Кинетические квазиинварианты химических реакций в закрытых системах // Известия высших учебных заведений. Химия и химическая технология. 2019. V. 62. №. 6. P. 47-52.
- Кольцов Н.И. Квазиинварианты химических реакций в распределенных системах с диффузией // Известия высших учебных заведений. Химия и химическая технология. 2021. V. 64. №. 1.
- Федотов В. Х., Кольцов Н. И. Кинетические квазиинварианты химических реакций в закрытых системах // Известия высших учебных заведений. Химия и химическая технология. 2019. V. 62. №. 6. P. 47-52.
- Lee B., Yoo J., Kang K. Predicting the chemical reactivity of organic materials using a machine-learning approach // Chemical science. 2020. V. 11. №. 30. P. 7813-7822. doi: 10.1039/d0sc01328e
- Плотникова Р.Н. Исследование свойств бромированнойфталатсодержащей системы и определение областей ее применения // Вестник ВГУИТ. 2021. Т. 83. № 1. С. 290-296. doi: 10.20914/2310-1202-2021-1-290-296
- Плотникова Р.Н., Корчагин В.И., Попова Л.В. Бромирование фталатсодержащих систем, полученных из отходов производства // Известия высших учебных заведений. Химия и химическая технология. 2021. Т. 64. №. 11. С. 112-116. doi: 10.6060/ivkkt.20216411.6429
- Плотникова Р.Н. Исследование процесса нейтрализации бромсодержащих систем фталатного типа // Вестник ВГУИТ. 2020. Т. 82. № 4. С. 236-241. doi: 10.20914/2310-1202-2020-4-236-241
- Бондарчук И.С., Бондарчук С.С. Кинетика гомогенных реакций. 2019.
- Kol'tsov N.I. Chaotic oscillation in for-step chemical reaction // Rus. Journ. Phys. Chem. B. 2017. V. 11. № 6. P. 1047-1048.
- Кольцов Н.И., Федотов В.Х. Хаотические колебания в простой гетерогенной каталитической реакции // Бутлеровские сообщения. 2017. Т. 50. №. 6. С. 30-33.
- Быков В.И. Моделирование критических явлений в химической кинетике. URSS, 2006.
- Bykov V.I., Tsybenova S.B., Yablonsky G.S. Chemical complexity via simple models. Berlin. New York: Germany. De Gruyter. 2018. 364 p.
- Ouhaddouch H., Cheikh A., Idrissi M.O.B., Draoui M. et al FT-IR spectroscopy applied for identification of a mineral drug substance in drug products: Application to bentonite // Journal of Spectroscopy. 2019. doi: 10.1155/2019/2960845
- Segneanu A.E., Gozescu I., Dabici A., Sfirloaga P. et al. Organic compounds FT-IR spectroscopy. Rijeka, Croatia: InTech, 2012. V. 145. doi: 10.5772/50183
- Казицина Л.А., Куплетская Н.Б. Применение УФ-, ИК-, ЯМР-спектроскопии в органической химии. М.: Книга по Требованию, 2012. 262 с.
- Хрипач Н., Барановский А. Применение спектроскопии в органической химии // Наука и инновации. 2013. № 3 (121). С. 6-9.
- Boughendjioua H., Boughendjioua Z. Fourier transformed infrared spectroscopy analysis of constituents of Rosmarinus officinalis L. essential oil from Algeria // Inorganic materials. 2017. V. 14. P. 15. doi: 10.11648/j.ajop.20170503.12
- Плотникова Р.Н. Моделирование процесса бромирования ненасыщенных фталатсодержащих систем // Моделирование энергоинформационных процессов: сборник статей IX Национальной научно - практической конференции с международным участием. Воронеж: 2021. С. 165-169.
- Tsai Y. T., Lin H., Lee M. J. Kinetics of heterogeneous esterification of glutaric acid with methanol over Amberlyst 35 // Journal of the Taiwan Institute of Chemical Engineers. 2011. V. 42. №. 2. P. 271-277. doi: 10.1016/j.jtice.2010.07.010


